P-29 - EFECTIVIDAD DE UPADACITINIB EN LA ENFERMEDAD DE CROHN: EXPERIENCIA INICIAL EN VIDA REAL DESDE LA BASE DE DATOS ENEIDA
1Hospital Universitario y Politécnico La Fe, Valencia. 2Hospital Universitario Puerta de Hierro, Madrid. 3Hospital Universitario La Paz, Madrid. 4Hospital Universitario Dr. Negrín, Las Palmas de Gran Canaria. 5Hospital Clínico Universitario Virgen de La Arrixaca, Murcia. 6Hospital Universitario de Cabueñes, Gijón. 7Hospital Río Hortega, Valladolid. 8Hospital Universitario Parc Taulí, Sabadell. 9Hospital Universitario 12 de Octubre, Madrid. 10Hospital Nuestra Señora de la Candelaria, Santa Cruz de Tenerife. 11Complejo Hospitalario de Navarra, Pamplona. 12Hospital Universitario de La Princesa, Madrid. 13Hospital Clínic de Barcelona. 14Hospital Universitario Virgen Macarena, Sevilla. 15Hospital Clínico de Valencia. 16Hospital Universitario Miguel Servet, Zaragoza. 17Complejo Asistencial Universitario de León. 18Hospital Galdakao. 19Hospital Universitario Infanta Cristina, Madrid. 20Hospital Dr. Peset, Valencia. 21Hospital Universitario de Burgos. 22Hospital Ramón y Cajal, Madrid. 23Hospital General Universitario de Elche. 24Hospital Universitario de Santiago de Compostela. 25Hospital San Jorge, Huesca. 26Hospital de Manises. 27Hospital Sierrallana, Torrelavega. 28Hospital General Universitario de Valencia. 29Hospital Universitari de Bellvitge, Barcelona. 30Hospital Universitario Marqués de Valdecilla, Santander. 31Hospital General de Alicante. 32Hospital Universitario Infanta Leonor, Madrid. 33Hospital Universitario de Canarias, Santa Cruz de Tenerife. 34Hospital Universitari Germans Trias i Pujol, Badalona.
Introducción: Upadacitinib (UPA) es el primer inhibidor de JAK oral aprobado para el tratamiento de la enfermedad de Crohn (EC). Su efectividad y seguridad se ha demostrado en ensayos, pero los datos en vida real son limitados.
Objetivos: Evaluar la eficacia y seguridad de UPA, a corto y largo plazo, en pacientes con EC.
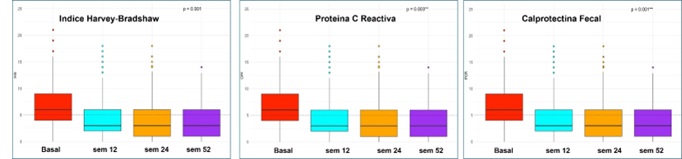
Métodos: Estudio multicéntrico, prospectivo y observacional. Se recopilaron variables epidemiológicas, clínicas, factores de riesgo cardiovascular (FRCV) y tratamientos previos. La actividad de la enfermedad se evaluó con Índice de Harvey-Bradshaw (HBI) y evaluación endoscópica/radiológica (E/R), proteína C reactiva (PCR) y calprotectina fecal (CF) en semanas 0, 12, 24 y 52. Se registraron eventos adversos (EA) y discontinuaciones.
Resultados: Incluimos 300 EC tratados con UPA: 83% por EC luminal, 8% por manifestaciones extraintestinales (MEI) sin luminal y 9% combinado con biológico. El 15% había recibido una terapia avanzada, 26% dos, 29% tres y 29% >= 4. El 45% tenía actividad E/R moderada y 37% grave. La remisión clínica se alcanzó en 62%, 65% y 67% en semana 12, 24 y 52. La CF se normalizó (< 250 μg/g) en 50%, 55% y 62%, y la PCR (< 3 mg/L) en 60%, 64% y 65% en semana 12, 24 y 52, respectivamente (evolución de parámetros mostrada en la figura). En el seguimiento, 16% estaban inactivos en E/R y 32% actividad leve. El mayor número de terapias avanzadas previas se asoció con menor persistencia de UPA, pero no los FRCV ni la localización o comportamiento de la EC. Con terapia combinada mejoró el HBI, pero la reducción en PCR y CF no fue estadísticamente significativa. Los tratados por MEI, mantuvieron HBI y CF y la PCR disminuyó significativamente. Hubo EA en 23%, hospitalizaciones 19% y cirugías 9%. Se discontinuó el tratamiento en 30%: no respuesta primaria (51%), pérdida de respuesta (13%), EA (32%) y otras razones (4%).
Conclusiones: En este estudio, UPA demuestra eficacia y seguridad en vida real, especialmente en EC agresiva y con MEI y usado en líneas precoces.








