La esteatosis hepática metabólica (EHmet) es una enfermedad clínicamente heterogénea, multisistémica, dinámica y compleja, cuyo progreso es una de las causas principales de cirrosis y hepatocarcinoma. La presente guía de práctica clínica pretende dar respuesta a los principales desafíos que presenta, tanto en su carga de enfermedad como en su complejidad. Para ello se han propuesto una serie de recomendaciones consensuadas mediante el método Delphi. El consenso resultó óptimo en las recomendaciones relativas a la diabetes mellitus tipo 2 (DM2) como factor de riesgo (1.5.1, 4.5.1), en cuyos casos se debe llevar a cabo una detección precoz de EHmet (4.5.2). Destaca la importancia del uso de pruebas no invasivas (FIB-4, NFS, HFS) para la exclusión de fibrosis significativa en pacientes con sospecha de EHmet (2.3.1, 2.3.3). El diagnóstico debe ser llevado a cabo a través de la combinación secuencial de índices no invasivos y elastografía transitoria (ET) mediante FibroScan® para una correcta estratificación del riesgo (2.3.3). Se ha alcanzado un consenso casi unánime en el papel de la prevención precoz en el impacto en la calidad de vida y supervivencia de los pacientes (5.1.2), así como en la efectividad de la dieta mediterránea y el ejercicio físico en relación con la mejoría de la esteatosis, la esteatohepatitis y la fibrosis en pacientes con EHmet (5.2.2) y en los resultados positivos ofrecidos por resmiterom y semaglutida para promover la regresión de la fibrosis (5.4.1). Finalmente, se ha alcanzado un gran consenso en la importancia del manejo multidisciplinar de EHmet, para el cual es esencial consensuar protocolos multidisciplinares de derivación entre niveles en cada área sanitaria (6.2.1), así como que las derivaciones a los servicios de hepatología/digestivo y endocrinología o medicina interna resulten efectivas y beneficiosas para prevenir el riesgo de progresión de la enfermedad (6.2.3, 6.3.1).
Metabolic hepatic steatosis (MetHS) is a clinically heterogeneous, multisystemic, dynamic, and complex disease, whose progression is one of the main causes of cirrhosis and hepatocarcinoma. This clinical practice guideline aims to respond to its main challenges, both in terms of disease burden and complexity. To this end, recommendations have been proposed to experts through the Delphi method. The consensus was optimal in recommendations regarding type 2 diabetes as a risk factor (1.5.1, 4.5.1), in which cases early detection of MetHS should be carried out (4.5.2). Its results also emphasize the importance of the use of non-invasive tests (FIB-4, NFS, HFS) for the exclusion of significant fibrosis in patients with suspected MetHS (2.3.1, 2.3.3). Diagnosis should be carried out through the sequential combination of non-invasive indices and transient elastography by FibroScan® for its risk stratification (2.3.3). A nearly unanimous consensus was reached regarding the role of early prevention in the impact on the quality of life and survival of patients (5.1.2), as well as on the effectiveness of the Mediterranean diet and physical exercise in relation to the improvement of steatosis, steatohepatitis and fibrosis in MetHS patients (5.2.2) and on the positive results offered by resmiterom and semaglutide in promoting fibrosis regression (5.4.1). Finally, a great consensus has been
reached regarding the importance of multidisciplinary management in MetHS, for which it is essential to agree on multidisciplinary protocols for referral between levels in each health area (6.2.1), as well as ensuring that referrals to Hepatology/Digestive and Endocrinology or Internal Medicine services are effective and beneficial to prevent the risk of disease progression (6.2.3, 6.3.1).
La esteatosis hepática metabólica (EHmet) es una enfermedad biológica y clínicamente heterogénea que se define a través de la acumulación de grasa en el hígado. Es considerada el componente hepático de un grupo de enfermedades asociadas con la disfunción metabólica1 en ausencia de consumo de alcohol.
Desde un punto de vista histológico, la EHmet abarca desde la esteatosis hepática simple (esteatosis sin inflamación) y la esteatohepatitis (esteatosis, inflamación y balonización con grados variables de fibrosis) hasta la cirrosis y el carcinoma hepatocelular (CHC). Aproximadamente el 80% de los pacientes con EHmet padecen de esteatosis hepática simple, la cual progresa hacia formas más avanzadas de la enfermedad en cerca del 20% de los pacientes. Es, por tanto, una de las causas más frecuentes de cirrosis y hepatocarcinoma2.
La EHmet es una enfermedad multisistémica: en los pacientes que han desarrollado una enfermedad hepática significativa, y particularmente en aquellos con cirrosis hepática, la mortalidad se encuentra relacionada con la enfermedad hepática, pero en el resto de los pacientes diagnosticados de EHmet la mortalidad se relaciona con eventos cardiovasculares y cáncer, tanto hepático como extrahepático3.
Esta guía de práctica clínica pretende dar respuesta a los principales desafíos que presenta esta enfermedad: su enorme carga y su complejidad, así como su dinamismo y heterogeneidad. Por ello, es necesario desarrollar herramientas no invasivas para el manejo diagnóstico y la estratificación del riesgo, y al mismo tiempo crear equipos multidisciplinares que permitan abordar la enfermedad en su totalidad.
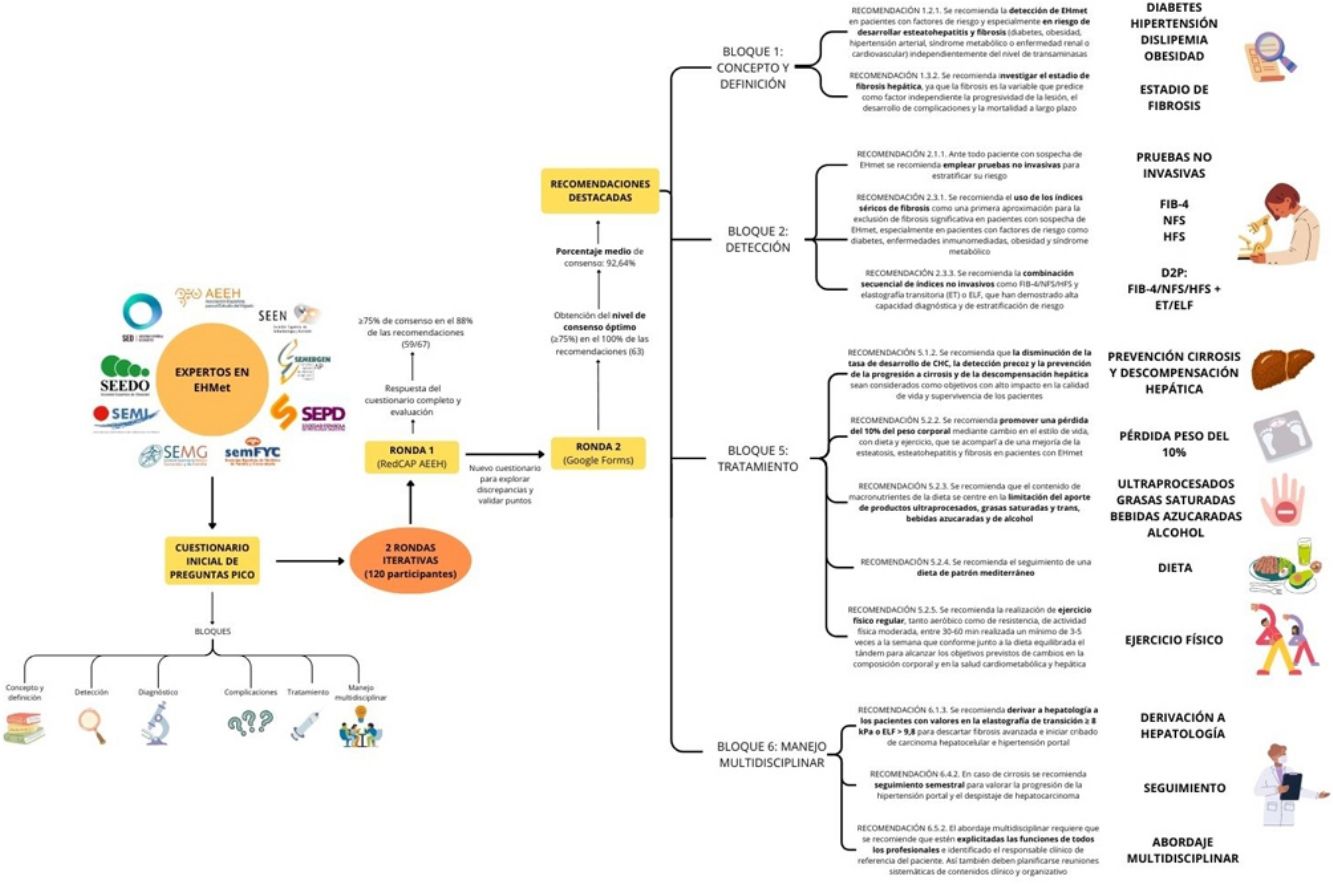
MetodologíaA lo largo del desarrollo del presente consenso hemos seguido el método Delphi, mediante la selección de expertos en EHmet pertenecientes a las nueve sociedades científicas implicadas en el manejo de esta enfermedad: AEEH, SEEN, SEMFYC, SEMI, SEPD, SEMERGEN, SEEDO, SED y SEMG. Diseñamos un cuestionario inicial de preguntas PICO (del inglés, población, intervención, comparador y resultados) que se respondieron teniendo en cuenta la evidencia científica disponible en cada uno de los cuatro ítems. Dicho cuestionario se sometió a dos rondas iterativas: en la primera los expertos respondieron al cuestionario inicial al completo, y el equipo organizador recopiló, analizó y resumió las respuestas, identificando patrones, consensos y áreas de desacuerdo. A partir de dichos desacuerdos se generó un nuevo cuestionario que se completó en una segunda ronda: dicho cuestionario contenía una reformulación de las preguntas que permitió explorar las discrepancias y validar los puntos de consenso. De esta forma, se alcanzó un nivel de consenso óptimo entre los participantes. Es importante señalar que el alcance de un consenso no significa obtener respuestas unánimes, sino más bien que los organizadores perciban la existencia de un acuerdo general sobre los puntos clave relativos al consenso.
La primera ronda se realizó en RedCAP de la AEEH y la segunda ronda en Google Forms®, dado el menor volumen de recomendaciones a evaluar.
Una vez obtenidas las respuestas del grupo de trabajo se realizó un análisis cualitativo y cuantitativo del nivel de acuerdo. Establecimos, de forma arbitraria, que un nivel excelente sería entre 90% y 100% y un nivel óptimo entre 75% y 90%. Las recomendaciones con acuerdos inferiores al 75% se evaluaron en la segunda ronda (tabla 1).
Relación de nivel de consenso, grado de recomendación y nivel de evidencia de cada una de las recomendaciones propuestas
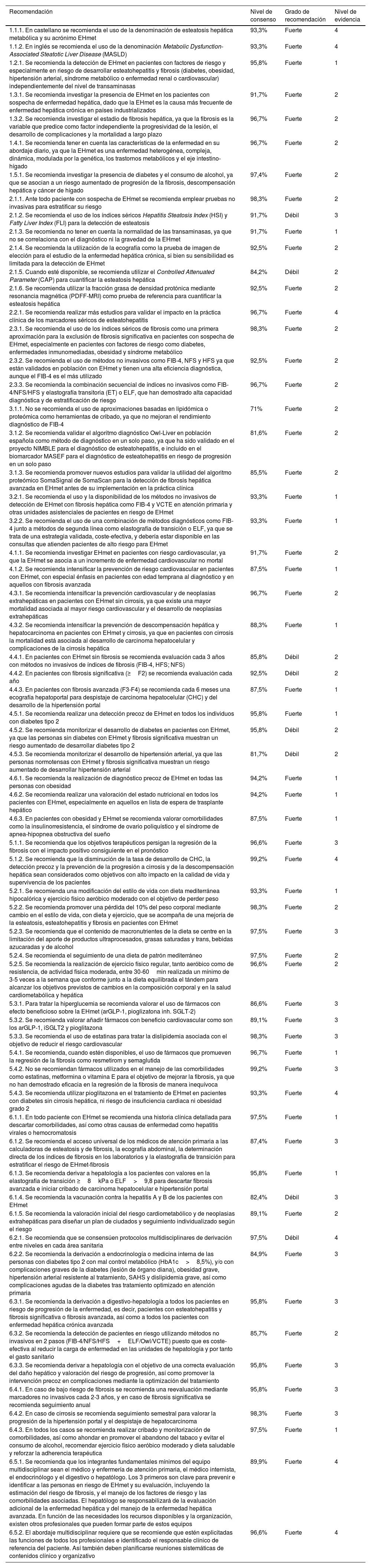
| Recomendación | Nivel de consenso | Grado de recomendación | Nivel de evidencia |
|---|---|---|---|
| 1.1.1. En castellano se recomienda el uso de la denominación de esteatosis hepática metabólica y su acrónimo EHmet | 93,3% | Fuerte | 4 |
| 1.1.2. En inglés se recomienda el uso de la denominación Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD) | 93,3% | Fuerte | 4 |
| 1.2.1. Se recomienda la detección de EHmet en pacientes con factores de riesgo y especialmente en riesgo de desarrollar esteatohepatitis y fibrosis (diabetes, obesidad, hipertensión arterial, síndrome metabólico o enfermedad renal o cardiovascular) independientemente del nivel de transaminasas | 95,8% | Fuerte | 1 |
| 1.3.1. Se recomienda investigar la presencia de EHmet en los pacientes con sospecha de enfermedad hepática, dado que la EHmet es la causa más frecuente de enfermedad hepática crónica en países industrializados | 91,7% | Fuerte | 2 |
| 1.3.2. Se recomienda investigar el estadio de fibrosis hepática, ya que la fibrosis es la variable que predice como factor independiente la progresividad de la lesión, el desarrollo de complicaciones y la mortalidad a largo plazo | 96,7% | Fuerte | 2 |
| 1.4.1. Se recomienda tener en cuenta las características de la enfermedad en su abordaje diario, ya que la EHmet es una enfermedad heterogénea, compleja, dinámica, modulada por la genética, los trastornos metabólicos y el eje intestino-hígado | 96,7% | Fuerte | 2 |
| 1.5.1. Se recomienda investigar la presencia de diabetes y el consumo de alcohol, ya que se asocian a un riesgo aumentado de progresión de la fibrosis, descompensación hepática y cáncer de hígado | 97,4% | Fuerte | 2 |
| 2.1.1. Ante todo paciente con sospecha de EHmet se recomienda emplear pruebas no invasivas para estratificar su riesgo | 98,3% | Fuerte | 2 |
| 2.1.2. Se recomienda el uso de los índices séricos Hepatitis Steatosis Index (HSI) y Fatty Liver Index (FLI) para la detección de esteatosis | 91,7% | Débil | 3 |
| 2.1.3. Se recomienda no tener en cuenta la normalidad de las transaminasas, ya que no se correlaciona con el diagnóstico ni la gravedad de la EHmet | 91,7% | Fuerte | 1 |
| 2.1.4. Se recomienda la utilización de la ecografía como la prueba de imagen de elección para el estudio de la enfermedad hepática crónica, si bien su sensibilidad es limitada para la detección de EHmet | 92,5% | Fuerte | 2 |
| 2.1.5. Cuando esté disponible, se recomienda utilizar el Controlled Attenuated Parameter (CAP) para cuantificar la esteatosis hepática | 84,2% | Débil | 2 |
| 2.1.6. Se recomienda utilizar la fracción grasa de densidad protónica mediante resonancia magnética (PDFF-MRI) como prueba de referencia para cuantificar la esteatosis hepática | 92,5% | Fuerte | 2 |
| 2.2.1. Se recomienda realizar más estudios para validar el impacto en la práctica clínica de los marcadores séricos de esteatohepatitis | 96,7% | Fuerte | 4 |
| 2.3.1. Se recomienda el uso de los índices séricos de fibrosis como una primera aproximación para la exclusión de fibrosis significativa en pacientes con sospecha de EHmet, especialmente en pacientes con factores de riesgo como diabetes, enfermedades inmunomediadas, obesidad y síndrome metabólico | 98,3% | Fuerte | 2 |
| 2.3.2. Se recomienda el uso de métodos no invasivos como FIB-4, NFS y HFS ya que están validados en población con EHmet y tienen una alta eficiencia diagnóstica, aunque el FIB-4 es el más utilizado | 92,5% | Fuerte | 2 |
| 2.3.3. Se recomienda la combinación secuencial de índices no invasivos como FIB-4/NFS/HFS y elastografía transitoria (ET) o ELF, que han demostrado alta capacidad diagnóstica y de estratificación de riesgo | 96,7% | Fuerte | 2 |
| 3.1.1. No se recomienda el uso de aproximaciones basadas en lipidómica o proteómica como herramientas de cribado, ya que no mejoran el rendimiento diagnóstico de FIB-4 | 71% | Fuerte | 2 |
| 3.1.2. Se recomienda validar el algoritmo diagnóstico Owl-Liver en población española como método de diagnóstico en un solo paso, ya que ha sido validado en el proyecto NIMBLE para el diagnóstico de esteatohepatitis, e incluido en el biomarcador MASEF para el diagnóstico de esteatohepatitis en riesgo de progresión en un solo paso | 81,6% | Fuerte | 2 |
| 3.1.3. Se recomienda promover nuevos estudios para validar la utilidad del algoritmo proteómico SomaSignal de SomaScan para la detección de fibrosis hepática avanzada en EHmet antes de su implementación en la práctica clínica | 85,5% | Fuerte | 2 |
| 3.2.1. Se recomienda el uso y la disponibilidad de los métodos no invasivos de detección de EHmet con fibrosis hepática como FIB-4 y VCTE en atención primaria y otras unidades asistenciales de pacientes en riesgo de EHmet | 93,3% | Fuerte | 1 |
| 3.2.2. Se recomienda el uso de una combinación de métodos diagnósticos como FIB-4 junto a métodos de segunda línea como elastografía de transición o ELF, ya que se trata de una estrategia validada, coste-efectiva, y debería estar disponible en las consultas que atienden pacientes de alto riesgo para EHmet | 93,3% | Fuerte | 1 |
| 4.1.1. Se recomienda investigar EHmet en pacientes con riesgo cardiovascular, ya que la EHmet se asocia a un incremento de enfermedad cardiovascular no mortal | 91,7% | Fuerte | 2 |
| 4.1.2. Se recomienda intensificar la prevención de riesgo cardiovascular en pacientes con EHmet, con especial énfasis en pacientes con edad temprana al diagnóstico y en aquellos con fibrosis avanzada | 87,5% | Fuerte | 1 |
| 4.3.1. Se recomienda intensificar la prevención cardiovascular y de neoplasias extrahepáticas en pacientes con EHmet sin cirrosis, ya que existe una mayor mortalidad asociada al mayor riesgo cardiovascular y el desarrollo de neoplasias extrahepáticas | 96,7% | Fuerte | 2 |
| 4.3.2. Se recomienda intensificar la prevención de descompensación hepática y hepatocarcinoma en pacientes con EHmet y cirrosis, ya que en pacientes con cirrosis la mortalidad está asociada al desarrollo de carcinoma hepatocelular y complicaciones de la cirrosis hepática | 88,3% | Fuerte | 1 |
| 4.4.1. En pacientes con EHmet sin fibrosis se recomienda evaluación cada 3 años con métodos no invasivos de índices de fibrosis (FIB-4, HFS; NFS) | 85,8% | Débil | 2 |
| 4.4.2. En pacientes con fibrosis significativa (≥F2) se recomienda evaluación cada año | 92,5% | Débil | 2 |
| 4.4.3. En pacientes con fibrosis avanzada (F3-F4) se recomienda cada 6 meses una ecografía hepatoportal para despistaje de carcinoma hepatocelular (CHC) y del desarrollo de la hipertensión portal | 87,5% | Fuerte | 1 |
| 4.5.1. Se recomienda realizar una detección precoz de EHmet en todos los individuos con diabetes tipo 2 | 95,8% | Fuerte | 1 |
| 4.5.2. Se recomienda monitorizar el desarrollo de diabetes en pacientes con EHmet, ya que las personas sin diabetes con EHmet y fibrosis significativa muestran un riesgo aumentado de desarrollar diabetes tipo 2 | 95,8% | Débil | 2 |
| 4.5.3. Se recomienda monitorizar el desarrollo de hipertensión arterial, ya que las personas normotensas con EHmet y fibrosis significativa muestran un riesgo aumentado de desarrollar hipertensión arterial | 81,7% | Débil | 2 |
| 4.6.1. Se recomienda la realización de diagnóstico precoz de EHmet en todas las personas con obesidad | 94,2% | Fuerte | 1 |
| 4.6.2. Se recomienda realizar una valoración del estado nutricional en todos los pacientes con EHmet, especialmente en aquellos en lista de espera de trasplante hepático | 94,2% | Fuerte | 1 |
| 4.6.3. En pacientes con obesidad y EHmet se recomienda valorar comorbilidades como la insulinorresistencia, el síndrome de ovario poliquístico y el síndrome de apnea-hipopnea obstructiva del sueño | 87,5% | Fuerte | 1 |
| 5.1.1. Se recomienda que los objetivos terapéuticos persigan la regresión de la fibrosis con el impacto positivo consiguiente en el pronóstico | 96,6% | Fuerte | 3 |
| 5.1.2. Se recomienda que la disminución de la tasa de desarrollo de CHC, la detección precoz y la prevención de la progresión a cirrosis y de la descompensación hepática sean considerados como objetivos con alto impacto en la calidad de vida y supervivencia de los pacientes | 99,2% | Fuerte | 4 |
| 5.2.1. Se recomienda una modificación del estilo de vida con dieta mediterránea hipocalórica y ejercicio físico aeróbico moderado con el objetivo de perder peso | 93,3% | Fuerte | 1 |
| 5.2.2. Se recomienda promover una pérdida del 10% del peso corporal mediante cambio en el estilo de vida, con dieta y ejercicio, que se acompaña de una mejoría de la esteatosis, esteatohepatitis y fibrosis en pacientes con EHmet | 98,3% | Fuerte | 2 |
| 5.2.3. Se recomienda que el contenido de macronutrientes de la dieta se centre en la limitación del aporte de productos ultraprocesados, grasas saturadas y trans, bebidas azucaradas y de alcohol | 97,5% | Fuerte | 3 |
| 5.2.4. Se recomienda el seguimiento de una dieta de patrón mediterráneo | 97,5% | Fuerte | 2 |
| 5.2.5. Se recomienda la realización de ejercicio físico regular, tanto aeróbico como de resistencia, de actividad física moderada, entre 30-60min realizada un mínimo de 3-5 veces a la semana que conforme junto a la dieta equilibrada el tándem para alcanzar los objetivos previstos de cambios en la composición corporal y en la salud cardiometabólica y hepática | 96,6% | Fuerte | 2 |
| 5.3.1. Para tratar la hiperglucemia se recomienda valorar el uso de fármacos con efecto beneficioso sobre la EHmet (arGLP-1, pioglizatona inh. SGLT-2) | 86,6% | Fuerte | 3 |
| 5.3.2. Se recomienda valorar añadir fármacos con beneficio cardiovascular como son los arGLP-1, iSGLT2 y pioglitazona | 89,1% | Fuerte | 3 |
| 5.3.3. Se recomienda el uso de estatinas para tratar la dislipidemia asociada con el objetivo de reducir el riesgo cardiovascular | 98,3% | Fuerte | 3 |
| 5.4.1. Se recomienda, cuando estén disponibles, el uso de fármacos que promueven la regresión de la fibrosis como resmetirom y semaglutida | 96,7% | Fuerte | 1 |
| 5.4.2. No se recomiendan fármacos utilizados en el manejo de las comorbilidades como estatinas, metformina o vitamina E para el objetivo de mejorar la fibrosis, ya que no han demostrado eficacia en la regresión de la fibrosis de manera inequívoca | 99,2% | Fuerte | 3 |
| 5.4.3. Se recomienda utilizar pioglitazona en el tratamiento de EHmet en pacientes con diabetes sin cirrosis hepática, ni riesgo de insuficiencia cardiaca ni obesidad grado 2 | 93,3% | Fuerte | 4 |
| 6.1.1. En todo paciente con EHmet se recomienda una historia clínica detallada para descartar comorbilidades, así como otras causas de enfermedad como hepatitis virales o hemocromatosis | 97,5% | Fuerte | 1 |
| 6.1.2. Se recomienda el acceso universal de los médicos de atención primaria a las calculadoras de esteatosis y de fibrosis, la ecografía abdominal, la determinación directa de los índices de fibrosis en los laboratorios y la elastografía de transición para estratificar el riesgo de EHmet-fibrosis | 87,4% | Fuerte | 3 |
| 6.1.3. Se recomienda derivar a hepatología a los pacientes con valores en la elastografía de transición ≥8kPa o ELF>9,8 para descartar fibrosis avanzada e iniciar cribado de carcinoma hepatocelular e hipertensión portal | 95,8% | Fuerte | 1 |
| 6.1.4. Se recomienda la vacunación contra la hepatitis A y B de los pacientes con EHmet | 82,4% | Débil | 3 |
| 6.1.5. Se recomienda la valoración inicial del riesgo cardiometabólico y de neoplasias extrahepáticas para diseñar un plan de ciudados y seguimiento individualizado según el riesgo | 89,1% | Fuerte | 2 |
| 6.2.1. Se recomienda que se consensúen protocolos multidisciplinares de derivación entre niveles en cada área sanitaria | 97,5% | Débil | 4 |
| 6.2.2. Se recomienda la derivación a endocrinología o medicina interna de las personas con diabetes tipo 2 con mal control metabólico (HbA1c>8,5%), y/o con complicaciones graves de la diabetes (lesión de órgano diana), obesidad grave, hipertensión arterial resistente al tratamiento, SAHS y dislipidemia grave, así como complicaciones agudas de la diabetes tras tratamiento optimizado en atención primaria | 84,9% | Fuerte | 3 |
| 6.3.1. Se recomienda la derivación a digestivo-hepatología a todos los pacientes en riesgo de progresión de la enfermedad, es decir, pacientes con esteatohepatitis y fibrosis significativa o fibrosis avanzada, así como a todos los pacientes con enfermedad hepática crónica avanzada | 95,8% | Fuerte | 3 |
| 6.3.2. Se recomienda la detección de pacientes en riesgo utilizando métodos no invasivos en 2 pasos (FIB-4/NFS/HFS+ELF/Owl/VCTE) puesto que es coste-efectiva al reducir la carga de enfermedad en las unidades de hepatología y por tanto el gasto sanitario | 85,7% | Fuerte | 2 |
| 6.3.3. Se recomienda derivar a hepatología con el objetivo de una correcta evaluación del daño hepático y valoración del riesgo de progresión, así como promover la intervención precoz en complicaciones mediante la optimización del tratamiento | 95,8% | Fuerte | 3 |
| 6.4.1. En caso de bajo riesgo de fibrosis se recomienda una reevaluación mediante marcadores no invasivos cada 2-3 años, y en caso de fibrosis significativa se recomienda seguimiento anual | 95,8% | Fuerte | 3 |
| 6.4.2. En caso de cirrosis se recomienda seguimiento semestral para valorar la progresión de la hipertensión portal y el despistaje de hepatocarcinoma | 98,3% | Fuerte | 3 |
| 6.4.3. En todos los casos se recomienda realizar cribado y monitorización de comorbilidades, así como ahondar en promover el abandono del tabaco y evitar el consumo de alcohol, recomendar ejercicio físico aeróbico moderado y dieta saludable y reforzar la adherencia terapéutica | 97,5% | Fuerte | 1 |
| 6.5.1. Se recomienda que los integrantes fundamentales mínimos del equipo multidisciplinar sean el médico y enfermería de atención primaria, el médico internista, el endocrinólogo y el digestivo o hepatólogo. Los 3 primeros son clave para prevenir e identificar a las personas en riesgo de EHmet y su evaluación, incluyendo la estimación del riesgo de fibrosis, y el manejo de los factores de riesgo y las comorbilidades asociadas. El hepatólogo se responsabilizará de la evaluación adicional de la enfermedad hepática y del manejo de la enfermedad hepática avanzada. En función de las necesidades los recursos disponibles y la organización, existen otros profesionales que pueden formar parte de estos equipos | 89,9% | Fuerte | 4 |
| 6.5.2. El abordaje multidisciplinar requiere que se recomiende que estén explicitadas las funciones de todos los profesionales e identificado el responsable clínico de referencia del paciente. Así también deben planificarse reuniones sistemáticas de contenidos clínico y organizativo | 96,6% | Fuerte | 4 |
Desde principios de la década de los 2000 se han realizado varias propuestas para cambiar el nombre internacional de esta enfermedad. Hasta el año 2020, y en ausencia de un consenso generalizado, NAFLD fue el nombre de uso común. En los últimos años, el término «enfermedad del hígado graso asociado a disfunción metabólica» (MASLD) ha ganado terreno para resaltar la importancia de los factores de riesgo metabólicos en el desarrollo y progresión de la enfermedad hepática, incluso entre pacientes con otras enfermedades hepáticas4. La propuesta de esta nueva denominación fue motivada por la necesidad de una definición no excluyente, ya que el término «no alcohólico» enfatiza demasiado la ausencia de consumo de alcohol. De la misma forma, se pretende evitar el estigma de la palabra fatty («gordo» en español) y, finalmente, dar relevancia a la disfunción metabólica como parte central de su patogenia, la cual se encuentra subestimada dentro de la actual definición5. El nombre propuesto en castellano, esteatosis hepática metabólica, se definió en una conferencia de consenso de la Asociación Española para el Estudio del Hígado6. El término Steatotic Liver Disease (SLD) se traduciría al español como «esteatosis hepática» o «hígado graso», que contemplaría todo el espectro de enfermedad desde MASLD hasta la enfermedad hepática alcohólica (ALD). A partir de esto se acuñó el término Met-ALD, que combina ambas etiologías7.
Recomendación 1.1.1: en castellano se recomienda el uso de la denominación de esteatosis hepática metabólica y su acrónimo EHmet (NdE: 4; grado de recomendación: fuerte; nivel de consenso: 93,3%).
Recomendación 1.1.2: en inglés se recomienda el uso de la denominación Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD) (NdE: 4; grado de recomendación: fuerte; nivel de consenso: 93,3%).
¿Cuál es la prevalencia de la esteatosis hepática metabólica y qué poblaciones tienen un riesgo más elevado?Se estima que entre el 17% y el 46% de los adultos europeos sufren de EHmet, con un promedio del 25-30%. La EHmet afecta a personas de todas las edades, incluidos los niños8. Esta condición se encuentra directamente relacionada con la ingesta calórica, la falta de actividad física y la obesidad. Por ello, la prevalencia de EHmet es muy alta en personas que presentan dichos factores de riesgo. La esteatohepatitis ocurre en el 20-25% de las personas con EHmet (1,5-6,5% de la población general). La fibrosis avanzada tiene lugar en el 1,5% de la población adulta general y hasta en el 15% de las personas con diabetes mellitus tipo 2 (DM2). La prevalencia en pacientes que viven con DM2 es del 70%, con obesidad grado 3 alcanza el 90%, en pacientes que viven con obesidad grado 2 es de un 60-70% y en personas que viven con hipertensión arterial o hiperlipidemia es de un 50-60%9. De las personas con EHmet un 20-25% tienen un peso corporal estándar, y su distribución geográfica mundial sitúa en Malasia o Pakistán alrededor de un 25% y a más del 50% en Austria, México o Suecia. La prevalencia de EHmet aumenta con la edad, y se ha señalado su asociación con variantes genéticas y la etnia, ya que tiende a afectar más a individuos portadores del genotipo GG del gen PNPLA3 y aquellos de origen asiático e hispano; por otro lado, es mucho menor en individuos de origen africano. Por todo ello, en el momento actual se recomienda la detección temprana de EHmet en pacientes de riesgo, y más concretamente en aquellos con riesgo de desarrollar esteatohepatitis y/o fibrosis10. Estas categorías de riesgo incluyen dos grandes grupos: 1) personas con alteración en la bioquímica hepática de forma crónica (más de seis meses); y 2) personas con DM2, individuos con sobrepeso/obesidad, sujetos con síndrome metabólico y aquellos que presentan enfermedad cardiovascular (ECV), incluso con bioquímica hepática normal11. Los pacientes con diabetes mellitus tipo 1 (DM1) podría ser otra población objetivo, pero es demasiado pronto para formular una recomendación clara, salvo si se asocia a la obesidad u otros factores de riesgo como los anteriormente enumerados.
Recomendación 1.2.1: se recomienda la detección de EHmet en pacientes con factores de riesgo y especialmente en riesgo de desarrollar esteatohepatitis y fibrosis (diabetes, obesidad, hipertensión arterial, síndrome metabólico o enfermedad renal o cardiovascular) independientemente del nivel de transaminasas (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 95,8%).
Conceptos de enfermedad hepática crónica prevalente y de fibrosis hepática significativaLa EHmet se ha convertido en un importante problema de salud pública en todo el mundo, y en concreto también en España, donde se estima que afecta al 25% de la población12,13. La importancia de evaluar el grado de fibrosis radica en su percepción como variable con un mayor impacto en la progresión de la lesión, el desarrollo de complicaciones y en la mortalidad a largo plazo. Se entiende por fibrosis significativa aquella igual o superior a F2 en la biopsia hepática y/o superior a 8Kpa en la elastografía hepática mediante Fibroscan®.
Aunque no se conoce con exactitud la prevalencia de fibrosis en la población general, un estudio muy reciente que combina datos de un gran conjunto poblacional y una cohorte de pacientes diagnosticados de EHmet mediante biopsia hepática, estima que la prevalencia de EHmet con fibrosis significativa y cirrosis en la población adulta española es del 2,03% (IC 95%: 0,29-5,98) y del 0,70% (IC 95%: 0,10-4,95), respectivamente10. El sexo masculino, la obesidad central, la presencia de DM2, los niveles elevados de triglicéridos, el colesterol-HDL bajo y el cociente aspartato aminotransferasa/alanina aminotransferasa (AST/ALT) elevado se asocian de forma independiente a una mayor rigidez hepática. Asimismo, se ha concluido que los varones mayores de 50 años, las mujeres posmenopáusicas y las personas con múltiples factores de riesgo cardiometabólico constituyen la población con mayor riesgo de fibrosis progresiva y de desarrollo de cirrosis y sus complicaciones.
Recomendación 1.3.1: se recomienda investigar la presencia de EHmet en los pacientes con sospecha de enfermedad hepática, dado que la EHmet es la causa más frecuente de enfermedad hepática crónica en países industrializados (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 91,7%).
Recomendación 1.3.2: se recomienda investigar el estadio de fibrosis hepática, ya que la fibrosis es la variable que predice como factor independiente la progresividad de la lesión, el desarrollo de complicaciones y la mortalidad a largo plazo (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 96,7%).
Patogenia de la esteatosis hepática metabólica. ¿Por qué se produce la acumulación de grasa en el hígado? ¿Por qué se produce la fibrosis?La EHmet es una enfermedad heterogénea, compleja, dinámica y modulada por la genética, los trastornos metabólicos y el eje intestino-hígado. Comprende un grupo heterogéneo de procesos caracterizados por la acumulación de grasa en el hígado. La esteatosis hepática simple se define por la presencia de un exceso de grasa, típicamente macrovesicular en al menos el 5% de los hepatocitos. La esteatosis hepática está estrechamente relacionada con el sobrepeso, la obesidad, el síndrome metabólico y la resistencia a la insulina. Por lo tanto, la EHmet puede considerarse la expresión hepática del síndrome metabólico14,15.
En los estados de resistencia a la insulina se produce un depósito de grasa ectópica (adiposidad visceral) con una acumulación progresiva de triglicéridos en los hepatocitos. Los triglicéridos no son hepatotóxicos por sí solos, pero en algunos pacientes este exceso de grasa hepática evoluciona a esteatohepatitis (MASH), que se caracteriza por la presencia de daño hepatocelular en forma de hepatocitos balonizados (necrosis), inflamación de predominio lobular y fibrosis. La fibrosis, que inicialmente es pericelular, puede progresar a fibrosis en puente y cirrosis, la cual es un factor de riesgo para el desarrollo de hepatocarcinoma. La acumulación de grasa en los hepatocitos puede inducir estrés metabólico, estrés oxidativo y estrés del retículo endoplásmico (lipotoxicidad). La lipotoxicidad de los triglicéridos acumulados en los hepatocitos, junto con la activación del sistema inmune innato, son los principales mecanismos patogénicos de la EHmet, a partir de los cuales se produce un reclutamiento de macrófagos, células dendríticas y linfocitos que contribuyen a perpetuar un estado inflamatorio y profibrótico crónico. A su vez, la lesión o muerte de los hepatocitos libera señales celulares para intentar reparar el daño hepático, lo cual conduce a la inflamación, remodelación vascular, fibrogénesis y a la acumulación de células epiteliales hepáticas16.
Se han descrito factores genéticos, epigenéticos y ambientales que pueden generar una predisposición al desarrollo de EHmet. Estudios realizados en gemelos sugieren que los factores hereditarios explican hasta la mitad de las diferencias interindividuales en la prevalencia de esteatohepatitis y cirrosis17. Algunos polimorfismos en genes que regulan el contenido lipídico de los adipocitos (PNPLA3 I148M, TM6SF2) promueven el daño hepático18. Los factores epigenéticos, como la sobrealimentación o la infraalimentación durante el embarazo, pueden originar una sobreexpresión de genes relacionados con el metabolismo energético que predispone a la obesidad, al síndrome metabólico y a la enfermedad hepática metabólica. Estos mismos factores pueden alterar el microbioma y derivar en un estado proinflamatorio por una mayor permeabilidad intestinal, así como la producción de lipopolisacáridos y otras citoquinas y factores hepatotóxicos19.
Recomendación 1.4.1: se recomienda tener en cuenta las características de la enfermedad en su abordaje diario, ya que la EHmet es una enfermedad heterogénea, compleja y dinámica, modulada por la genética, los trastornos metabólicos y el eje intestino-hígado (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 96,7%).
¿Qué factores influyen en las tasas de progresión de la fibrosis y descompensación hepática?Las tasas de progresión de la fibrosis y de descompensación hepática varían según la gravedad basal de la enfermedad, así como por determinantes genéticos, ambientales, individuales y las comorbilidades asociadas20. En un estudio de Vilar-Gómez se constató que en pacientes con fibrosis avanzada el riesgo de progresión a descompensación se vio aumentado en el caso de los que padecen diabetes, así como en aquellos con consumo moderado de alcohol y de forma inversa con la infiltración grasa en el hígado21. Un estudio recientemente realizado en 2.227 individuos con EHmet, de los cuales el 9% reportó un consumo bajo de alcohol y el 14% un consumo moderado de alcohol (por debajo de los 30g de alcohol al día en hombres y los 20g de alcohol al día en mujeres), demostró que el consumo moderado de alcohol se asocia de forma independiente con la fibrosis significativa y la esteatohepatitis en riesgo de progresión22.
Recomendación 1.5.1: se recomienda investigar la presencia de diabetes y el consumo de alcohol, ya que se asocian a un riesgo aumentado de progresión de la fibrosis, descompensación hepática y cáncer de hígado (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 97,4%).
Detección de la esteatosis hepática metabólica¿Cómo detectar la presencia de esteatosis hepática metabólica?Los niveles normales de transaminasas no se relacionan, de forma aislada, con el estadio de la EHmet. Un estudio reciente demostró que el 90% de los pacientes con cirrosis no habrían sido diagnosticados a través de las pruebas habituales de perfil hepático23.
La ecografía es la prueba de imagen de elección para la detección de EHmet debido a su amplia disponibilidad, bajo coste y seguridad; sin embargo, sus principales limitaciones son su sensibilidad limitada para la detección de esteatosis leve (no detecta esteatosis si es<30%) o en individuos con mala ventana acústica por obesidad, y su incapacidad para diferenciar entre esteatosis simple y esteatohepatitis. Aun así, forma parte de la evaluación de todo paciente con sospecha de enfermedad hepática. Su especificidad es excelente (>90%) en presencia de signos de hipertensión portal (circulación colateral intraabdominal y esplenomegalia) y/o de nodularidad de la superficie hepática, incluso en pacientes compensados24.
Se han desarrollado varios índices serológicos para predecir la existencia de esteatosis hepática: Fatty liver index (FLI), índice triglicéridos glucosa, NAFLD-Liver Fat Score, Hepatic Steatosis Index (HSI) y SteatoTest, entre otros (estos cuatro se pueden calcular en https://www.mdapp.co/hepatology/). Los más extendidos y mejor validados son el HSI y el FLI25. Los valores de FLI por debajo de 30 permiten descartar la presencia de esteatosis con una razón de verosimilitud (likelihood ratio) de 0,2, mientras que los valores de FLI mayores o iguales a 60 permiten inferir la presencia de esteatosis con una razón de verosimilitud de 4,3.
Por su parte, un HSI de menos de 30 indica que se puede descartar EHmet (con un índice de probabilidad negativo de hasta 0,186), mientras que un HSI de 36 o más indica que la EHmet está presente (con un índice de probabilidad positivo a partir de 6.069). La seguridad diagnóstica es satisfactoria en áreas bajo la curva de 0,80-0,92, con elevado valor predictivo positivo (99%) y aceptable sensibilidad (61-80%). Su principal limitación reside en su incapacidad de distinguir diversos grados de esteatosis. El Controlled Attenuated Parameter (CAP) incluido en el Fibroscan® permite la detección de esteatosis hepática con alta seguridad cuando el resultado es>258-262dB/m, y debe ser corregido al alza en pacientes con diabetes u obesidad26. Por otro lado, la fracción grasa de densidad protónica mediante resonancia magnética (PDFF-MRI) es la prueba de referencia para valorar la esteatosis hepática en EHmet, ya que ha demostrado superioridad frente a biopsia hepática y cuantificación de la infiltración grasa27.
Recomendación 2.1.1: ante todo paciente con sospecha de EHmet se recomienda emplear pruebas no invasivas para estratificar su riesgo (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 98,3%).
Recomendación 2.1.2: se recomienda el uso de los índices séricos HSI y FLI para la detección de esteatosis (NdE: 3; grado de recomendación: débil; nivel de consenso: 91,7%).
Recomendación 2.1.3: se recomienda no tener en cuenta la normalidad de las transaminasas, ya que no se correlaciona con el diagnóstico ni la gravedad de la EHmet (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 91,7%).
Recomendación 2.1.4: se recomienda la utilización de la ecografía como la prueba de imagen de elección para el estudio de la enfermedad hepática crónica, si bien su sensibilidad es limitada para la detección de EHmet (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 92,5%).
Recomendación 2.1.5: cuando esté disponible, se aconseja utilizar el CAP para cuantificar la esteatosis hepática (NdE: 2; grado de recomendación: débil; nivel de consenso: 84,2%).
Recomendación 2.1.6: se recomienda utilizar la fracción grasa de densidad protónica mediante resonancia magnética (PDFF-MRI) como prueba de referencia para cuantificar la esteatosis hepática (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 92,5%).
¿Cómo detectar esteatohepatitis?La detección no invasiva de la esteatohepatitis metabólica es una necesidad por cubrir, ya que hasta la fecha no se han conseguido resultados lo suficientemente robustos como para que otros métodos diagnósticos puedan desplazar a la biopsia hepática como método de detección principal. Los marcadores séricos evaluados para predecir la existencia de esteatohepatitis están relacionados con las vías fisiopatológicas de la enfermedad (apoptosis/muerte celular, inflamación y estrés oxidativo). El más estudiado es la citoqueratina 18 fragmentada, un producto de degradación de la apoptosis de hepatocitos28. Otros marcadores estudiados son el fibroblast growth factor 21 (FGF21) y la adiponectina; sin embargo, estos han demostrado muy baja precisión diagnóstica. También se han estudiado marcadores de estrés oxidativo y de inflamación como la interleucina 6 (IL-6) y el factor de necrosis tumoral-α (TNFα). Los estudios basados en la metabolómica permitieron que un grupo español desarrollara el OWL Liver Test, el cual permite diferenciar la esteatohepatitis de la esteatosis simple con una buena sensibilidad y especificidad (ROC superior a 0,8 en paciente con diabetes y obesidad). Las limitaciones de uso en otras etnias y en pacientes con diabetes no controlados se ha resuelto recientemente al incorporar las transaminasas y la hemoglobina glucosilada (HbA1c) al algoritmo diagnóstico previo29. De la misma forma, existen biomarcadores de imagen basados en la resonancia magnética como DeMILI (NASH-MRi) que han comunicado resultados prometedores30. Los test metabolómicos como el OWLiver® y los marcadores de imagen basados en la RMN-DeMILI muestran una buena correlación con la biopsia para el diagnóstico de la esteatohepatitis.
No obstante, el método estándar en el diagnóstico de la esteatohepatitis sigue siendo la biopsia hepática.
Recomendación 2.2.1: se recomienda realizar más estudios para validar el impacto en la práctica clínica de los marcadores séricos de esteatohepatitis (NdE: 4; grado de recomendación: fuerte; nivel de consenso: 96,7%).
¿Cómo detectar la fibrosis?La fibrosis hepática se ha clasificado tradicionalmente según 4 niveles de gravedad histológica: F1 fibrosis leve; ≥F2 fibrosis significativa; ≥F3 fibrosis avanzada; y F4 cirrosis hepática. La fibrosis es un factor independiente que influye en el pronóstico, así como en la progresión de la enfermedad hepática y en el riesgo cardiovascular y la mortalidad por todas las causas31.
Marcadores séricos de fibrosis hepática- a)
Marcadores indirectos relacionados con la función hepática, como albúmina, bilirrubina, AST y ALT. Dentro de ellos fibrosis-4 (FIB-4), NAFLD Fibrosis Score (NFS) y Hepamet Fibrosis Score (HFS), entre otros.
- b)
Marcadores directos, que son componentes de la matriz extracelular, como el ácido hialurónico, metaloproteinasas de matriz y los subtipos de colágeno32. El más representativo es el Enhanced Liver Fibrosis (ELF).
Los índices clínico-analíticos más estudiados y validados son FIB-4, NFS y HFS. El HFS, recientemente desarrollado en nuestro país, ha demostrado una odds ratio diagnóstica significativamente mayor que el FIB-4 y NFS para descartar y/o diagnosticar fibrosis avanzada, independientemente de la presencia o ausencia de diabetes, del índice de masa corporal (IMC) y de los grupos de edad33, y menor número de pacientes con resultados indeterminados (20% frente a 30%). El uso combinado de HFS, NFS y FIB-4 permite una correcta exclusión de pacientes sin fibrosis avanzada, por lo que son los métodos de elección en atención primaria o en consultas no hepatológicas. Los pacientes en la zona gris (índice combinado>0 pero<3, es decir, con uno o dos métodos alterados) podrían beneficiarse de un segundo método no invasivo como ELF u Owl-Liver, los cuales permitirían definir qué pacientes están en riesgo de fibrosis avanzada.
Marcadores de fibrosis basados en la imagen- a)
Elastografía de transición por vibración controlada (VCTE, Fibroscan®) con medición de CAP puede evaluar esteatosis y fibrosis de forma simultánea34. La elastografía transitoria (ET) ha demostrado una gran utilidad diagnóstica para la predicción de fibrosis avanzada/cirrosis hepática y ha demostrado su eficiencia económica en atención primaria. Cuando se utiliza la biopsia hepática como estándar de referencia, la ET proporciona alta sensibilidad y valores predictivos negativos para la detección de cirrosis superiores al 95%35. Los puntos de corte de ET recomendados para descartar fibrosis avanzada y cirrosis hepática varían entre 8 y 13kPa, en función de la etiología subyacente36. En este sentido, cabe destacar que el riesgo a medio plazo de eventos hepáticos en pacientes con ET por debajo de estos parámetros es muy bajo (para EHmet el riesgo de evento hepático a cinco años con FibroScan®<12kPa es 0,3%)37.
- b)
Basados en ecografía: elastografía de impulso de fuerza de radiación acústica y elastografía de ondas de corte Shear Wave. Aunque aún no hay puntos de corte definidos, las principales ventajas teóricas de estas técnicas (que se incorporan a dispositivos de ecografía convencional) respecto a la ET por FibroScan® son la mayor tasa de éxito en pacientes obesos y el poder evaluar la morfología hepática en la misma exploración.
Algunos autores han propuesto estrategias que combinan marcadores séricos con ET38. La combinación secuencial reduce el área de incertidumbre y mantiene una buena sensibilidad y especificidad39; por otro lado, la combinación de FIB-4 o NFS con ELF se encuentra entre las recomendaciones del National Institute for Health and Care Excellence del Reino Unido para el diagnóstico de la fibrosis avanzada en pacientes con esteatohepatitis40.
Recomendación 2.3.1: se recomienda el uso de los índices séricos de fibrosis como una primera aproximación para la exclusión de fibrosis significativa en pacientes con sospecha de EHmet, especialmente en aquellos con factores de riesgo como diabetes, enfermedades inmunomediadas, obesidad y síndrome metabólico (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 98,3%).
Recomendación 2.3.2: se recomienda el uso de métodos no invasivos como FIB-4, NFS y HFS, ya que están validados en población con EHmet y tienen una alta eficiencia diagnóstica, aunque el FIB-4 es el más utilizado (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 92,5%).
Recomendación 2.3.3: se recomienda la combinación secuencial de índices no invasivos como FIB-4/NFS/HFS y ET o ELF, pues han demostrado alta capacidad diagnóstica y de estratificación de riesgo (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 96,7%).
Diagnóstico¿Qué papel tienen las ómicas y la metabolómica en el diagnóstico de la esteatosis hepática metabólica?Los estudios de metabolómica han demostrado alteraciones en el perfil de aminoácidos, en las especies lipídicas, incluidos los ácidos grasos circulantes, triglicéridos, fosfolípidos y ácidos biliares41, así como en los metabolitos derivados del eje intestino-hígado como ácidos grasos de cadena corta, ácidos biliares y aminoácidos aromáticos. Estos han emergido como potenciales biomarcadores al desempeñar un papel en la modulación del proceso patológico de EHmet42–44.
El algoritmo diagnóstico Owl-Liver ha sido validado en el proyecto NIMBLE para el diagnóstico de la esteatohepatitis metabólica y en el nuevo biomarcador MASEF combinando Owl-Liver, IMC y AST/ALT para el diagnóstico de la esteatohepatitis en riesgo de progresión45,46. En una cohorte de estimación de 790 pacientes y de validación de 565 casos se demostró una capacidad diagnóstica de 0,76 (IC 95%: 0,72-0,79) y 0,79 (IC 95%: 0,75-0,83) en la cohorte de validación47. Además, la estrategia de detección de un solo paso con el Panel OWLiver tiene una alta precisión para detectar esteatohepatitis y esteatohepatitis en riesgo de progresión en sujetos con alto riesgo de EHmet48.
El algoritmo proteómico SomaSignal de SomaScan ha sido validado para la detección de fibrosis hepática avanzada en EHmet. En pacientes con fibrosis significativa (>F2) no se ha demostrado superioridad de los métodos basados en ómicas frente a los métodos disponibles como FIB-4 (AUROC oscilando entre 0,61 [IC 95%: 0,54-0,67] para CAP-VCTE y 0,81 [0,75-0,86] para SomaSignal, similar a FIB-4). En pacientes con fibrosis avanzada (>F3) SomaSignal (AUC 0,90 [IC 95%: 0,86-0,94]) demostró un excelente rendimiento con un NNT de 4 (IC 95%: 4-5)49, datos que coinciden con los comunicados por Sanyal et al.50.
Recomendación 3.1.1: no se aconseja el uso de aproximaciones basadas en lipidómica o proteómica como herramientas de cribado, ya que no mejoran el rendimiento diagnóstico de FIB-4 (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 71%).
Recomendación 3.1.2: se aconseja validar el algoritmo diagnóstico Owl-Liver en población española como método de diagnóstico en un solo paso, ya que ha sido validado en el proyecto NIMBLE para el diagnóstico de esteatohepatitis e incluido en el biomarcador MASEF para el diagnóstico de esteatohepatitis en riesgo de progresión en un solo paso (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 81,6%).
Recomendación 3.1.3: se aconseja promover nuevos estudios para validar la utilidad del algoritmo proteómico SomaSignal de SomaScan para la detección de fibrosis hepática avanzada en EHmet antes de su implementación en la práctica clínica (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 85,5%) (tabla 1).
¿Qué pruebas deberían estar disponibles para atención primaria y otras especialidades que atienden a pacientes de alto riesgo de esteatosis hepática metabólica?La atención primaria es la puerta de entrada de los pacientes en el sistema asistencial, lo cual permite que los pacientes en riesgo de EHmet puedan ser atendidos también por endocrinólogos, internistas, dermatólogos, psiquiatras, cardiólogos, neurólogos o reumatólogos. Las técnicas que deberían estar disponibles en este nivel asistencial deben ser capaces de diagnosticar esteatosis hepática y estratificar el riesgo de fibrosis avanzada. Para el diagnóstico se debería contar con la ecografía hepática, para descartar hígado hiperecogénico, y los métodos no invasivos de esteatosis como el FLI51. Además, los métodos no invasivos para la detección precoz de fibrosis hepática52 de primera línea como FIB-4, NAFLD fibrosis score, y HFS deben confirmarse mediante la medición de la rigidez hepática (ET por VCTE) o a través de un análisis bioquímico usando el ELF.
Según el estudio NASH-PI52 la utilización de VCTE en atención primaria es eficiente económicamente, ya que reduce el nivel de gasto y la derivación de pacientes. Por tanto, el Fibroscan debería estar disponible en los centros de salud de atención primaria y/o en otras unidades asistenciales que atienden pacientes de alto riesgo53. Los métodos de confirmación, como la biopsia hepática, los métodos basados en resonancia magnética o en ómicas quedarán reservados para la atención en unidades de digestivo-hepatología.
Recomendación 3.2.1: se recomienda el uso y la disponibilidad de los métodos no invasivos de detección de EHmet con fibrosis hepática como FIB-4 y VCTE en atención primaria y otras unidades asistenciales de pacientes en riesgo de EHmet (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 93,3%).
Recomendación 3.2.2: se recomienda el uso de una combinación de métodos diagnósticos como FIB-4 junto a métodos de segunda línea, como elastografía de transición o ELF, ya que se trata de una estrategia validada, coste-efectiva y debería estar disponible en las consultas que atienden pacientes de alto riesgo para EHmet (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 93,3%).
Complicaciones¿Están aumentados los eventos cardiovasculares en pacientes con esteatosis hepática metabólica?Los pacientes con EHmet tienen mayor mortalidad en comparación con el resto de la población54. La principal causa de muerte es la enfermedad cardiovascular (ECV)55. Aún no está claro si este mayor riesgo de ECV se debe a los trastornos metabólicos asociados a la EHmet o si esta supone un riesgo adicional de manera independiente. Un metaanálisis que incluyó a 34.043 personas con NAFLD (EHmet) seguidas durante una mediana de 6,9 años mostró que la EHmet suponía un riesgo aumentado en un 64% de sufrir ECV después de ajustar los factores de riesgo cardiovascular (FRCV)56. Este hallazgo ha sido cuestionado de forma reciente en un gran estudio observacional en 18 millones de adultos europeos, en el cual no se observó ninguna asociación entre EHmet y eventos CV en un entorno de atención primaria57. No obstante, existen resultados contradictorios sobre la relación entre EHmet y mortalidad cardiovascular con resultados a favor58–60 y en contra61,62. Estos resultados contradictorios se pueden atribuir a varios factores, incluida la heterogeneidad en las poblaciones estudiadas, la prevalencia de FRCV, la edad del diagnóstico de la EHmet, la modalidad de diagnóstico de EHmet, la duración del seguimiento y el estadio de fibrosis, ya que la asociación positiva puede estar limitada a pacientes con fibrosis avanzada60,62. Los pacientes diagnosticados a una edad más temprana tendrían un perfil clínico menos esperanzador, con una mayor pérdida de esperanza de vida y un peor pronóstico a largo plazo en comparación con los pacientes mayores.
La asociación de EHmet y ECV se ha valorado en una cohorte de pacientes con diagnóstico de EHmet sin ECV basal, basada en el Registro Nacional de Pacientes de Suecia (1987-2016), de 10.023 pacientes, emparejados 10:1 en edad, sexo y municipio con individuos de la población general (n=96.313). El riesgo de ECV fue 2,6 veces mayor en los pacientes con EHmet en comparación con los controles, mayor para ECV no mortal (HR=3,71). La expectativa de vida fue, en promedio, 2,8 años más baja que los controles, con la mayor pérdida de años de vida cuando se diagnosticó entre los 40-60 años63.
Recomendación 4.1.1: se recomienda investigar EHmet en pacientes con riesgo cardiovascular, ya que la EHmet se asocia a un incremento de ECV no mortal (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 91,7%).
Recomendación 4.1.2: se aconseja intensificar la prevención de riesgo cardiovascular en pacientes con EHmet, con especial énfasis en pacientes con edad temprana al diagnóstico y en aquellos con fibrosis avanzada (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 87,5%).
¿Cómo influye la esteatosis hepática metabólica en la prevalencia de neoplasias hepáticas y extrahepáticas?La prevalencia e incidencia del CHC está aumentando mundialmente en relación directa con el incremento de la prevalencia e incidencia de EHmet. La EHmet aumenta la incidencia tanto de neoplasias hepáticas, sobre todo de CHC, como extrahepáticas64. Aunque la cirrosis hepática es el principal factor relacionado con el desarrollo de CHC, el riesgo de cáncer hepático está aumentado en pacientes con EHmet sin cirrosis. De hecho, en pacientes con CHC reclutados a lo largo de 12 años se observó un número significativo de pacientes con EHmet sin cirrosis (F0-F2)65. La incidencia de CHC en pacientes con EHmet sin cirrosis hepática está aumentada respecto a otras etiologías de enfermedad hepática. Se ha estimado que la presencia de DM2 duplica el riesgo de CHC y aumenta el riesgo de muerte por CHC en un 1,5, mientras que la presencia del síndrome metabólico junto con DM2 quintuplica el riesgo de CHC. Por último, la obesidad (IMC>30kg/m2) duplica el riesgo de CHC, mientras que un IMC>35kg/m2 cuadriplica el riesgo de CHC66,67.
El riesgo de cáncer extrahepático también aumenta, y se ha observado en el cáncer de útero (RR=2,3; IC 95%: 1,4-4,1), estómago (RR=2,3; IC 95%: 1,3-4,1), páncreas (RR=2,0; IC 95%: 1,2-3,3) y colon (RR=1,8; IC 95%: 1,1-2,8)68. Un estudio retrospectivo realizado recientemente encontró una relación estadísticamente significativa entre los cánceres gastrointestinales, pero no con los genitourinarios ni pulmonares69. Por otro lado, también se ha realizado recientemente un metaanálisis de gran tamaño, de 10 estudios de cohorte con 182.202 individuos de mediana edad (24,8% con EHmet) y 8.485 casos incidentes de cánceres extrahepáticos en diferentes sitios durante una mediana de seguimiento de 5,8 años. En él, la EHGNA se asoció significativamente con un riesgo entre 1,5 y dos veces mayor de desarrollar cánceres gastrointestinales (esófago, estómago, páncreas o cáncer colorrectal). Además, la EHGNA se asoció con un riesgo aproximadamente de 1,2 a 1,5 veces mayor de desarrollar cánceres de pulmón, mama, ginecológicos o del sistema urinario70.
¿Cuál es la principal causa de mortalidad en la esteatoris hepática metabólica?La mortalidad en los pacientes con EHmet está asociada al desarrollo de complicaciones cardiovasculares, complicaciones de la cirrosis hepática y de tumores71. En un estudio prospectivo de cuatro años de duración, con un total de 1.773 adultos con EHmet, se comprobó que la presencia de fibrosis avanzada F3 y F4 se encontraba asociada a un aumento del riesgo de complicaciones de la cirrosis y una mayor mortalidad52. Los pacientes con F3 presentaban mayor riesgo de desarrollar eventos cardiovasculares y neoplasias extrahepáticas, mientras que los pacientes con F4 sufrían mayor mortalidad de causa hepática72. En relación con la mortalidad asociada a la ECV, está especialmente relacionada con la enfermedad coronaria, la disfunción e hipertrofia miocárdicas, la esclerosis valvular aórtica y las arritmias cardiacas71,73.
Recomendación 4.3.1: se recomienda intensificar la prevención cardiovascular y de neoplasias extrahepáticas en pacientes con EHmet sin cirrosis, ya que existe una mayor mortalidad asociada al riesgo cardiovascular más elevado y al desarrollo de neoplasias extrahepáticas (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 96,7%).
Recomendación 4.3.2: se aconseja intensificar la prevención de descompensación hepática y hepatocarcinoma en pacientes con EHmet y cirrosis, ya que en pacientes con cirrosis la mortalidad está asociada al desarrollo de CHC y complicaciones de la cirrosis hepática (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 88,3%).
¿Cuál debería ser la periodicidad de evaluación de las complicaciones hepáticas y/o extrahepáticas?En los pacientes con EHmet está indicada la evaluación periódica de la progresión a fibrosis significativa y cirrosis. Los pacientes con fibrosis leve (índices de fibrosis hepática por métodos no invasivos [MNI] por debajo del punto de corte fibrosis) deben manejarse en atención primaria y se repetirán los MNI cada tres años. Los pacientes con fibrosis significativa se valorarán cada 12 meses o cada seis meses si muestran fibrosis avanzada (F3) para el diagnóstico precoz de la progresión a cirrosis, la aparición de hipertensión portal o el desarrollo de CHC74,75. Asimismo, se debe evaluar anualmente el riesgo cardiovascular en todos los pacientes con EHmet y en aquellos con fibrosis avanzada, con una periodicidad semestral76.
De la misma forma, se debe promover la participación de los pacientes con EHmet en todos los programas de detección precoz de cáncer o de cribado poblacional disponibles, con especial énfasis en el cáncer gastrointestinal y genitourinario, ya que actualmente solo están establecidos los de cáncer colorrectal, mama y cérvix.
Recomendación 4.4.1: en pacientes con EHmet sin fibrosis se aconseja evaluación cada tres años con métodos no invasivos de índices de fibrosis (FIB-4, HFS; NFS) (NdE: 2; grado de recomendación: débil; nivel de consenso: 85,8%).
Recomendación 4.4.2: en pacientes con fibrosis significativa (≥F2) se recomienda evaluación cada año (NdE: 2; grado de recomendación: débil; nivel de consenso: 92,5%).
Recomendación 4.4.3: en pacientes con fibrosis avanzada (F3-F4) se aconseja cada seis meses una ecografía hepatoportal para despistaje de CHC y del desarrollo de la hipertensión portal (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 87,5%).
¿Cómo es la interacción entre esteatosis hepática metabólica y diabetes: diferencial o bidireccional?El aumento en la prevalencia de EHmet se encuentra relacionado con el incremento de la prevalencia de síndrome metabólico, obesidad y DM2. Entre los pacientes con DM2, la prevalencia de EHmet se estima en un 40-70%, y la prevalencia de esteatohepatitis alrededor del 22%77. En España la prevalencia de DM2 en la población española es del 13,8%78, lo que situaría las tasas estimadas de EHmet en alrededor del 5,5-9,7%. Por otra parte, está demostrada la relación entre la resistencia a la insulina en las personas con DM2 y la fibrosis hepática (HR=1,53; IC 95%: 1,1-2,2; p=0,026)79. En la mayoría de estudios los pacientes con DM2 tienden a presentar etapas más avanzadas de EHmet, particularmente fibrosis avanzada. En un metaanálisis se demuestra cómo la DM2 se relaciona con una mayor incidencia de eventos hepáticos graves (cirrosis, complicaciones y mortalidad) (HR=2,25; IC 95%: 1,83-2,76; p<0,001)80. Por tanto, la presencia de DM2 empeora el pronóstico de los pacientes con EHmet.
Paralelamente, la presencia de EHmet tiene un impacto negativo sobre la DM2, en términos de aumento de incidencia y de complicaciones como los eventos cardiovasculares y la insuficiencia renal crónica81. Por tanto, la EHmet puede ser considerada como una complicación emergente de la DM2. Esta idea obligaría a su cribado y tratamiento precoz, utilizando diferentes herramientas terapéuticas con efecto beneficioso sobre factores como el peso y la resistencia a la insulina. Desde 2019 la Asociación Americana de Diabetes recomienda la detección de esteatohepatitis y fibrosis en pacientes con prediabetes o DM2 con niveles elevados de ALT o esteatosis detectada por ecografía82. Los pacientes sin diabetes con EHmet y fibrosis significativa muestran un riesgo aumentado de desarrollar DM2 en el seguimiento83. Además, la EHmet empeora las complicaciones de la diabetes y, a su vez, la diabetes empeora el pronóstico de EHmet.
Recomendación 4.5.1: se recomienda realizar una detección precoz de EHmet en todos los individuos con DM2 (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 95,8%).
Recomendación 4.5.2: se recomienda monitorizar el desarrollo de diabetes en pacientes con EHmet, ya que las personas sin diabetes con EHmet y fibrosis significativa muestran un riesgo aumentado de desarrollar DM2 (NdE: 2; grado de recomendación: débil; nivel de consenso: 95,8%).
Recomendación 4.5.3: se aconseja monitorizar el desarrollo de hipertensión arterial, ya que las personas normotensas con EHmet y fibrosis significativa muestran un riesgo aumentado de desarrollar hipertensión arterial (NdE: 2; grado de recomendación: débil; nivel de consenso: 81,7%).
¿Cómo es la relación entre la esteatosis hepática metabólica y la obesidad?La obesidad es el factor de riesgo para EHmet más común y mejor estudiado. Existen estudios con biopsia de hace décadas que ya constataban que existía una prevalencia casi 10 veces mayor de esteatohepatitis en individuos con obesidad frente a los pacientes de peso estándar: 18,5% frente al 2,7%84. En pacientes con IMC>35kg/m2, el 80,2% tenía EHmet, el 65,9% esteatosis (grado 1-3) y el 14,3% esteatohepatitis y/o fibrosis85. El riesgo aumenta en función del punto del espectro entre sobrepeso y obesidad severa en el que se encuentre el paciente, y oscila entre el 57% de las personas con sobrepeso que asisten a clínicas ambulatorias a más del 80% de las personas con obesidad mórbida. La mediana de prevalencia de esteatohepatitis en la población con obesidad es del 33%, y varía del 10% al 56%86. La prevalencia de EHmet en las personas obesas definidas como metabólicamente sanas es alta, ya que oscila entre el 29% y el 39%. Además, los sujetos con obesidad metabólicamente sanos con EHmet tienen el doble de riesgo de aparición de enfermedad metabólica87. Dada la creciente epidemia de obesidad, la incidencia de CHC relacionado con EHmet ha aumentado a una tasa del 9% anual88. En población infantil, un metaanálisis reciente ha señalado una prevalencia del 7,6% en niños en estudios de población general frente al 34,2% en estudios basados en clínicas de obesidad pediátrica89. Es destacable la mayor prevalencia en niños varones en comparación con niñas. En un estudio de niños con obesidad con EHmet y apnea obstructiva del sueño, la gravedad de la hipoxemia se encontraba asociada con la severidad de la EHmet, particularmente en relación con el estadio de fibrosis90.
Muchos pacientes con esteatohepatitis avanzada requerirán trasplante hepático. Un mayor grado de obesidad se asocia con un mayor riesgo de enfermedad clínica y descompensación mientras se espera el trasplante91. De la misma manera, existe también una mayor frecuencia de complicaciones postrasplante, pérdida del injerto y mortalidad entre pacientes con obesidad clase iii (IMC>40kg/m2)92. Por otro lado, la prevalencia de obesidad y sarcopenia entre los pacientes con esteatohepatitis y cirrosis es alta; de hecho, la sarcopenia ha sido consistentemente identificada como un predictor independiente de mortalidad postrasplante y pérdida del injerto92.
Recomendación 4.6.1: se recomienda la realización de diagnóstico precoz de EHmet en todas las personas con obesidad (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 94,2%).
Recomendación 4.6.2: se recomienda realizar una valoración del estado nutricional en todos los pacientes con EHmet, especialmente en aquellos en lista de espera de trasplante hepático (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 94,2%).
Recomendación 4.6.3: en pacientes con obesidad y EHmet se aconseja valorar comorbilidades como la insulinorresistencia, el síndrome de ovario poliquístico y el síndrome de apnea-hipopnea obstructiva del sueño (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 87,5%).
Tratamiento¿Qué objetivos terapéuticos recomendar y cómo seleccionar las medidas terapéuticas?Los objetivos terapéuticos en el manejo de EHmet confluyen en la mejora de la supervivencia y de la calidad de vida al evitar la progresión de la enfermedad hepática hacia la cirrosis y el hepatocarcinoma93, los eventos cardiovasculares94 o el desarrollo de neoplasias extrahepáticas68. La regresión de la fibrosis mejora el pronóstico de los pacientes al disminuir la tasa de complicaciones de la cirrosis95. El objetivo terapéutico será, por tanto, conseguir la regresión de la fibrosis.
En pacientes en los que no sea posible conseguir la regresión de la fibrosis se planteará una intervención a largo plazo con el objetivo de:
- •
Disminuir la tasa de desarrollo de hepatocarcinoma.
- •
Evitar la progresión a cirrosis en pacientes no cirróticos.
- •
Evitar la descompensación en pacientes con cirrosis hepática.
Las medidas terapéuticas se seleccionarán por disponibilidad. Por lo general, se comenzará con una intervención estructurada en el estilo de vida mediante dieta mediterránea y ejercicio físico, junto a un mejor control de las comorbilidades metabólicas o inflamatorias.
Recomendación 5.1.1: se recomienda que los objetivos terapéuticos persigan la regresión de la fibrosis con el impacto positivo consiguiente en el pronóstico (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 96,6%).
Recomendación 5.1.2: se recomienda que la disminución de la tasa de desarrollo de CHC, la detección precoz y la prevención de la progresión a cirrosis y de la descompensación hepática sean considerados como objetivos con alto impacto en la calidad de vida y supervivencia de los pacientes (NdE: 4; grado de recomendación: fuerte; nivel de consenso: 99,2%).
Papel de los cambios en el estilo de vida y la reducción de peso. ¿Cómo y dónde implementarlos?Los cambios en el estilo de vida (dieta hipocalórica y ejercicio físico) constituyen uno los pilares básicos del tratamiento de la EHmet, ya que diferentes estudios aleatorizados y basados en biopsias hepáticas han demostrado que un disminución mantenida>10% del peso inicial se encuentra asociada a una remisión de la esteatosis hepática en>90%, en un 50% en la esteatohepatitis y variable en la diminución de fibrosis96–98. Sin embargo, se ha observado también que tras la cirugía bariátrica se alcanzan estos mismos objetivos99 por un periodo más prolongado, de tal manera que se ha podido constatar una clara disminución de eventos hepáticos en un 82% y del riesgo cardiovascular asociado en un 70%100.
Respecto a la composición de macronutrientes, aquellas medidas conducentes a reducir tanto la lipogénesis de novo como el porcentaje de triglicéridos intrahepáticos se centran en la disminución del contenido de grasas saturadas, ácidos grasos trans, hidratos de carbono de absorción rápida y sustitución por grasas insaturadas. Por lo general, se considera que las dietas prototipo, como la dieta DASH, y en particular la dieta mediterránea, son el patrón nutricional más adecuado para alcanzar estos objetivos, por lo que son el modelo de elección en numerosas sociedades científicas101–104.
El ejercicio, combinado con la dieta hipocalórica, es la forma de intervención que ha dado más resultados de mejoría en la esteatosis y remisión de esteatohepatitis105,106. No obstante, el ejercicio contribuye de manera independiente a la reducción del contenido intrahepático de grasa, tal y como se ha demostrado en diferentes metaanálisis107. Lo importante es la regularidad e intensidad del ejercicio realizado, sin que existan diferencias entre la práctica de ejercicio aeróbico o de resistencia108. Una actividad física moderada, de entre 30-60min, y realizada un mínimo de tres veces a la semana, es suficiente para alcanzar metas de mejoría en EHmet109.
Recomendación 5.2.1: se recomienda una modificación del estilo de vida con dieta mediterránea hipocalórica y ejercicio físico aeróbico moderado con el objetivo de perder peso (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 93,3%).
Recomendación 5.2.2: se recomienda promover una pérdida del 10% del peso corporal mediante cambio en el estilo de vida, con dieta y ejercicio, que se acompaña de una mejoría de la esteatosis, esteatohepatitis y fibrosis en pacientes con EHmet (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 98,3%).
Recomendación 5.2.3: se recomienda que el contenido de macronutrientes de la dieta se centre en la limitación del aporte de productos ultraprocesados, grasas saturadas y trans, bebidas azucaradas y de alcohol (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 97,5%).
Recomendación 5.2.4: se recomienda el seguimiento de una dieta de patrón mediterráneo (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 97,5%).
Recomendación 5.2.5: se recomienda la realización de ejercicio físico regular, tanto aeróbico como de resistencia, de actividad física moderada, entre 30-60min un mínimo de tres a cinco veces a la semana que conforme junto a la dieta equilibrada el tándem para alcanzar los objetivos previstos de cambios en la composición corporal y en la salud cardiometabólica y hepática (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 96,6%).
¿Qué fármacos hipoglucemiantes e hipolipidemiantes son más apropiados?Además de los cambios en el estilo de vida, a la hora de pautar el tratamiento farmacológico para tratar la hiperglucemia asociada será recomendable seleccionar aquellos con beneficio hepático y/o cardiovascular, ya que son las principales causas de mortalidad. El fármaco ideal en los pacientes con DM2 y EHmet sería aquel que de forma concomitante resolviese la resistencia a la insulina/hiperglucemia y la EHmet, además de reducir el riesgo cardiovascular.
La pioglitazona es un fármaco del grupo de las tiazolidinadionas que ha demostrado inducir la resolución de la esteatohepatitis y mejorar la fibrosis para cualquier estadio de esta110. Además, mejora la dislipidemia aterogénica y reduce los eventos cardiovasculares. Entre los efectos adversos debe tenerse en cuenta el aumento de peso, pero con reducción de la grasa visceral, y el riesgo potencial de insuficiencia cardiaca y fractura ósea111. Dentro de los análogos del receptor de GLP-1 (arGLP-1), liraglutida demostró superioridad respecto a placebo en la resolución de la esteatohepatitis112, y semaglutida 0,4mg/día también mejoró la resolución de esteatohepatitis sin empeoramiento de la fibrosis. Además, presentan también beneficio cardiovascular y favorecen la pérdida de peso113.
Los inhibidores de SGLT-2 tienen también efectos beneficiosos sobre la reducción de peso y beneficios cardiorrenales, y aunque han demostrado una reducción de la esteatosis hepática114–116 no hay evidencia de beneficios en lo relativo a la esteatohepatitis y la fibrosis. El resto de fármacos hipoglucemiantes no han demostrado beneficio en la EHmet.
Los pacientes con DM2 y EHmet presentan mayor riesgo cardiovascular, por lo que se deben aplicar las recomendaciones según las guías de práctica clínica habitual de prevención cardiovascular. Las estatinas son seguras116 y se pueden prescribir a los pacientes con cirrosis no descompensada. La evidencia sobre el uso de otros hipolipidemiantes en pacientes con enfermedad hepática subyacente es muy escasa, pero los fibratos, la ezetimiba, los ácidos grasos omega 3 y los secuestrantes de ácidos biliares pueden usarse para tratar la dislipidemia en los pacientes con enfermedad hepática crónica.
Recomendación 5.3.1: para tratar la hiperglucemia se aconseja valorar el uso de fármacos con efecto beneficioso sobre la EHmet (arGLP-1, pioglizatona inh. SGLT-2) (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 86,6%).
Recomendación 5.3.2: se aconseja valorar añadir fármacos con beneficio cardiovascular, como son los arGLP-1, iSGLT2 y pioglitazona (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 89,1%).
Recomendación 5.3.3: se recomienda el uso de estatinas para tratar la dislipidemia asociada con el objetivo de reducir el riesgo cardiovascular (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 98,3%).
¿Disponemos de fármacos con eficacia probada?Los pacientes en riesgo de progresar y desarrollar complicaciones presentan habitualmente fibrosis significativa y esteatohepatitis o fibrosis avanzada. Las medidas terapéuticas se seleccionarán por disponibilidad, habitualmente comenzando por una intervención estructurada en el estilo de vida mediante dieta mediterránea y ejercicio físico, junto a un mejor control de las comorbilidades metabólicas o inflamatorias.
Sin embargo, el tratamiento de la EHmet es una necesidad no cubierta y son muchos los fármacos que no han conseguido demostrar ser superiores al placebo; consideramos fármacos de probada eficacia aquellos que consiguen una regresión de la fibrosis hepática, ya que esta regresión se ha asociado a una menor tasa de complicaciones95. El emricasan, un inhibidor pancaspasas; el simtuzumab, un anticuerpo monoclonal frente a LOL-2; el selonsertib, inhibidor de ASK-1; el cenicriviroc, inhibidor CCR2/CCR5 y el elafibranor, un agonista dual PPAR alfa/delta, demostraron no ser superiores a placebo en ensayos clínicos aleatorizados. También se han probado ciertas moléculas de uso en el manejo de la diabetes o la dislipidemia, como metformina o estatinas, con escaso éxito en EHmet. Sin embargo, su impacto global en la progresión de la enfermedad a cáncer de hígado queda por dilucidar.
Cusi et al.117 demostraron la superioridad de la pioglitazona frente a placebo en 101 pacientes. La pioglitazona se asoció con una mayor resolución de la esteatohepatitis, una mejoría de la fibrosis y de la esteatosis, aunque también provocaba una ganancia de peso corporal. No obstante, el tratamiento con pioglitazona se ha asociado a efectos adversos, como el aumento de fracturas óseas o un posible riesgo aumentado de cáncer de vejiga, los cuales, sin embargo, no han sido validados en metaanálisis recientes110. De hecho, la evidencia actual no respalda esta asociación del uso de pioglitazona con el desarrollo de cáncer de vejiga118. Los inhibidores SGLT2 demostraron capacidad para disminuir la infiltración grasa, aunque no mejoraron el estadio de fibrosis119.
Se han publicado los resultados favorables de un ensayo de fase 3 con resmetirom en personas con esteatohepatitis no cirrótica (principalmente fibrosis en estadios 2 y 3) de un año de duración, lo cual ha llevado a su aprobación por la FDA. La resolución de MASH sin empeoramiento de la fibrosis se logró en el 25,9% de los pacientes en el grupo de resmetirom 80mg y el 29,9% de los del grupo de resmetirom 100mg, en comparación con el 9,7% de los del grupo placebo (p<0,001 para ambas comparaciones con placebo). La mejoría de la fibrosis en al menos un estadio sin empeoramiento de la puntuación de actividad de EHmet se logró en el 24,2% de los pacientes en el grupo de resmetirom 80mg y el 25,9% de los del grupo de resmetirom 100mg, en comparación con el 14,2% de los del grupo placebo (p<0,001 para ambas comparaciones con placebo)120.
En lo relativo a la semaglutida, a dosis de 2,4mg/semana, se ha demostrado superioridad frente a placebo en la regresión de la fibrosis (37% vs. 22%) y resolución de la esteatohepatitis (63% vs. 34%); p<0,001 en ambas comparaciones a través del estudio ESSENCE.
El ácido obeticólico demostró superioridad frente a placebo en la regresión de la fibrosis tras 72 semanas de tratamiento. Sin embargo, este fármaco se asoció a eventos adversos como el desarrollo de prurito y la alteración del perfil lipídico, con elevación de LDL y un discreto descenso de HDL. Por intención de tratar el 23,1% de los pacientes que recibió 25mg/d de ácido obeticólico consiguió la regresión de al menos un estadio de fibrosis, frente a solo el 11,9% en el grupo placebo121. No obstante, esta molécula ha sido retirada del mercado en la Unión Europea.
Moléculas en desarrollo que han demostrado superioridad frente a placebo en estudios en fase 2 y continúan en programas fase 3:
- -
Lanifibranor: demostró una regresión significativa de al menos un estadio de fibrosis en el 42% de 83 pacientes tratados con 1.200mg de lanifibranor al día frente a un 24% en el grupo placebo en un estudio fase 2b. Asimismo, consiguió una resolución de la esteatohepatitis en el 44% frente a un 9% en el grupo placebo. Además, este agonista pan-PPAR disminuyó la insulinemia, la glucemia basal, la hemoglobina glucosilada y los triglicéridos, y aumentó las cifras de colesterol HDL, al tiempo que disminuyeron las enzimas hepáticas122,123.
- -
Efruxifermin: una proteína de fusión Fc-FGF21 de acción duradera que evita la proteólisis, ha demostrado un gran potencial para promover la regresión de la fibrosis. En un ensayo en fase 2, de 80 pacientes aleatorizados en cuatro brazos, la dosis de 50mg/día consiguió la regresión de un estadio de fibrosis en el 62% de los pacientes (8/13) y de dos estadios de fibrosis en el 38% (5/13) muy superior a placebo124.
- -
Pegozafermin: en 222 pacientes demostró regresión de al menos un estadio de fibrosis en el 27% frente al 7% del grupo placebo, y resolución de la esteatohepatitis en el 37% frente al 2% con placebo125.
- -
Survodutida: en 212 pacientes demostró superioridad no significativa frente a placebo en la regresión de la fibrosis (32-34% vs. 22%), la resolución de la esteatohepatitis (43-62% vs. 14%, p<0,001) y la esteatosis hepática126.
- -
Efinopegdutida: en 145 pacientes demostró superioridad frente a la semaglutida 1,0mg/semana en la disminución de la infiltración grasa hepática medida por PDFF127.
- -
Retatrutida (triagonista GLP1-GIP-glucagón), en 98 pacientes (fase 2a) mostró superioridad en la reducción de la grasa hepática (MRI-PDFF) hasta –82,4%, frente a placebo (+0,3%) tras 48 semanas de tratamiento128.
- -
En el ensayo en fase 2 SYNERGY-NASH, que incluyó a 190 pacientes con esteatohepatitis y fibrosis moderada o severa, la tirzepatida (un agonista dual de GLP-1 y GIP) fue más efectiva que placebo a las 52 semanas respecto a la resolución de la esteatohepatitis sin empeoramiento de la fibrosis, pero no en la reducción significativa de un estadio de fibrosis, quizá debido al pequeño tamaño muestral129.
Recomendación 5.4.1: se recomienda, cuando estén disponibles, el uso de fármacos que promueven la regresión de la fibrosis como el resmetirom y la semaglutida (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 96,7%).
Recomendación 5.4.2: no se recomiendan fármacos utilizados en el manejo de las comorbilidades como estatinas, metformina o vitamina E para el objetivo de mejorar la fibrosis, ya que no han demostrado eficacia en la regresión de la fibrosis de manera inequívoca (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 99,2%).
Recomendación 5.4.3: se recomienda utilizar pioglitazona en el tratamiento de EHmet en pacientes con diabetes sin cirrosis hepática, ni riesgo de insuficiencia cardiaca ni obesidad grado 2 (NdE: 4; grado de recomendación: fuerte; nivel de consenso: 93,3%).
Manejo multidisciplinar¿Cómo debería ser el manejo de la esteatosis hepática metabólica en atención primaria?Por la alta prevalencia de la EHmet, la mayoría de los pacientes son atendidos en atención primaria, por lo que es recomendable el acceso universal a las principales herramientas diagnósticas y pronósticas en este nivel asistencial2. La importancia del diagnóstico precoz de la enfermedad y de ofrecer a los pacientes una atención óptima, la cual pasa por seleccionar las poblaciones con mayor riesgo de progresión y complicaciones, ha aumentado el interés de las guías o documentos de consenso en las propuestas de manejo multidisciplinar. La EHmet suele ser asintomática o presentar síntomas inespecíficos, excepto cuando el diagnóstico se da en un estadio avanzado; también es frecuente el hallazgo casual en pruebas de imagen. La historia clínica debe recoger la presencia de factores de riesgo para EHmet y para otras causas de esteatosis o disfunción hepática, antecedentes personales y familiares de enfermedades asociadas, ingesta de alcohol y medicamentos y riesgo de exposición a virus hepatotropos. La exploración física debe incluir datos sobre la tensión arterial, el peso, la talla, el perímetro abdominal, el IMC y la posible detección de signos de hepatopatía avanzada130.
Son tareas para la atención de la EHmet en atención primaria:
- -
La detección y el diagnóstico precoz de la enfermedad y el estudio de otras causas de enfermedad hepática crónica.
- -
La prevención y el diagnóstico de otras hepatopatías transmisibles.
- -
La valoración de fibrosis mediante test no invasivos.
- -
La evaluación del riesgo cardiovascular y renal.
- -
El diagnóstico precoz y la vigilancia de neoplasias extrahepáticas.
- -
El tratamiento basado en la modificación de los estilos de vida y el control de los factores de riesgo cardiometabólico.
Se recomienda el cálculo automático y sistemático de test no invasivos de fibrosis en poblaciones en riesgo en atención primaria para mejorar la estratificación y el seguimiento131.
Para descartar fibrosis significativa se recomienda:
- -
Medida de la rigidez hepática por elastografía de transición<8kilopascales.
- -
Test patentados: ELF<9,8.
- -
Test no patentados: FIB-4<1,3 (<2 si≥65años) o NFS<–1.455 o HFS<0,12.
En cuanto a la corrección por edad del punto de corte para descartar fibrosis significativa con el FIB-4, existen nuevos estudios que insisten en su importancia por el pobre rendimiento de dicho score en población mayor, por lo que consideramos la introducción de ambos valores en la práctica clínica en atención primaria132.
Antes de derivar a un paciente con un test bioquímico no invasivo positivo para sospecha de fibrosis, se recomienda el uso de elastografía de transición y/o un test sérico patentado para descartar fibrosis avanzada133. Un estudio español reciente entre atención primaria y hospitalaria, aplicando en la práctica clínica un algoritmo de derivación de pacientes e incorporando la realización de la ET en atención primaria (con la secuencia y puntos de corte FIB-4≥1,3 y rigidez hepática≥8kPa) ha demostrado mejorar la estratificación de los pacientes en riesgo y la disminución del porcentaje de pacientes que se derivarían aplicando solo el FIB-445.
Recomendación 6.1.1: en todo paciente con EHmet se recomienda una historia clínica detallada para descartar comorbilidades, así como otras causas de enfermedad como hepatitis virales o hemocromatosis (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 97,5%).
Recomendación 6.1.2: se aconseja el acceso universal de los médicos de atención primaria a las calculadoras de esteatosis y de fibrosis, la ecografía abdominal, la determinación directa de los índices de fibrosis en los laboratorios y la elastografía de transición para estratificar el riesgo de EHmet-fibrosis (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 87,4%).
Recomendación 6.1.3: se recomienda derivar a hepatología a los pacientes con valores en la elastografía de transición ≥8kPa o ELF>9,8 para descartar fibrosis avanzada e iniciar cribado de CHC e hipertensión portal (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 95,8%).
Recomendación 6.1.4: se aconseja la vacunación contra la hepatitis A y B de los pacientes con EHmet (NdE: 3; grado de recomendación: débil; nivel de consenso: 82,4%).
Recomendación 6.1.5: se aconseja la valoración inicial del riesgo cardiometabólico y de neoplasias extrahepáticas para diseñar un plan de cuidados y seguimiento individualizado según el riesgo (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 89,1%).
¿Cuándo derivar al servicio de endocrinología/medicina interna y para qué?Los pacientes con EHmet pueden ser derivados al servicio de endocrinología/medicina interna según la disponibilidad y circuito local tanto desde hepatología, en el manejo de una EHmet con fibrosis avanzada, como desde atención primaria en los siguientes supuestos:
- a)
DM2 con mal control metabólico, pese al tratamiento intensivo propuesto desde atención primaria46.
- b)
DM2 con obesidad (IMC≥35kg/m2) que puede ser candidato a endoscopia metabólica o cirugía bariátrica134,135.
- c)
DM2 con complicaciones crónicas severas: pie diabético, neuropatía periférica, enfermedad renal crónica, retinopatía, ECV, claudicación intermitente, disfunción eréctil136.
- d)
HTA resistente.
- e)
AOS grave.
- f)
Dislipidemia severa.
- g)
Complicaciones agudas de la diabetes: hipoglucemias de repetición, hiperglucemia con cetosis, hiperosmolaridad.
- h)
Obesidad, sin diabetes, con IMC≥35kg/m2 o ≥30kg/m2, con dos o más comorbilidades que pueda beneficiarse del tratamiento con arGLP1 para la pérdida de peso y mejoría de la EHmet.
Recomendación 6.2.1: se recomienda que se consensúen protocolos multidisciplinares de derivación entre niveles en cada área sanitaria (NdE: 4; grado de recomendación: débil; nivel de consenso: 97,5%).
Recomendación 6.2.2: se aconseja la derivación a endocrinología o medicina interna de las personas con DM2 con mal control metabólico (HbA1c>8,5%), y/o complicaciones graves de la diabetes (lesión de órgano diana), obesidad grave, hipertensión arterial resistente al tratamiento, SAHS y dislipidemia grave, así como complicaciones agudas de la diabetes tras el tratamiento optimizado en atención primaria (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 84,9%).
¿Cuándo derivar al hepatólogo y para qué?Los pacientes con EHmet en riesgo de progresión deben ser derivados al hepatólogo para la correcta evaluación del daño hepático y el diseño del seguimiento y tratamiento más adecuado.
En áreas fuera de la hepatología es necesario referir a los pacientes con fibrosis significativa o avanzada. Para ello se puede realizar una detección en dos pasos137:
- a)
Utilizar biomarcadores de fibrosis fácilmente disponibles como FIB-4>1,3 o (FIB-4>2 si≥65años), HFS>0,12 y NFS>–1.456, y seleccionar a los pacientes con sospecha de fibrosis significativa138.
- b)
Un segundo paso para evaluar a los pacientes en riesgo de fibrosis es mediante ET o por onda de cizallamiento 2D, o por métodos bioquímicos como ELF u OWL-Liver139.
Esta detección y derivación en dos circuitos y dos pasos es económicamente eficiente y reduce la carga de enfermedad, ya que selecciona a los pacientes y reduce el gasto sanitario140,141.
El principal objetivo de la derivación será el correcto diagnóstico, seguimiento y tratamiento de los pacientes con fibrosis significativa o avanzada. Estos pacientes se beneficiarán de un seguimiento estrecho y personalizado y de la inclusión en ensayos clínicos. El seguimiento posterior debe ser multidisciplinar y conjunto entre todos los profesionales sanitarios implicados. Los pacientes que no cumplan criterios de riesgo de fibrosis no deben ser derivados a hepatología142.
Recomendación 6.3.1: se recomienda la derivación a digestivo-hepatología a todos los pacientes en riesgo de progresión de la enfermedad, es decir, pacientes con esteatohepatitis y fibrosis significativa o fibrosis avanzada, así como a todos los pacientes con enfermedad hepática crónica avanzada (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 95,8%).
Recomendación 6.3.2: se aconseja la detección de pacientes en riesgo utilizando métodos no invasivos en dos pasos (FIB-4/NFS/HFS+ELF/Owl/VCTE), puesto que es coste-efectiva al reducir la carga de enfermedad en las unidades de hepatología, y por tanto el gasto sanitario (NdE: 2; grado de recomendación: fuerte; nivel de consenso: 85,7%).
Recomendación 6.3.3: se recomienda derivar a hepatología con el objetivo de una correcta evaluación del daño hepático y valoración del riesgo de progresión, así como promover la intervención precoz en complicaciones mediante la optimización del tratamiento (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 95,8%).
¿Cómo monitorizar la evolución y qué parámetros debemos registrar?La monitorización de los pacientes con EHmet se realizará en atención primaria salvo que el paciente presente fibrosis avanzada o comorbilidades metabólicas de difícil control43.
La monitorización debe incluir tanto la evaluación periódica de otras comorbilidades como de la enfermedad hepática11.
La evaluación de las comorbilidades se realizará mediante:
- a)
Cálculo de los índices de fibrosis (FIB-4/HFS/NFS) cada dos a tres años.
- b)
Control metabólico cada seis meses mediante analítica sanguínea (glucemia en ayunas, HbA1c, función renal, colesterol total, cHDL, cLDL y triglicéridos) para evaluar el metabolismo hidrocarbonado y la presencia de dislipidemia aterogénica y analítica de orina para evaluar el cociente albúmina/creatinina (UACR).
- c)
Monitorización de la hipertensión arterial y obesidad (IMC y perímetro de cintura).
- d)
Promover el abandono del tabaco y evitar el consumo de alcohol.
Recomendación 6.4.1: en caso de bajo riesgo de fibrosis se recomienda una reevaluación mediante marcadores no invasivos cada dos a tres años, y en caso de fibrosis significativa se recomienda seguimiento anual (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 95,8%).
Recomendación 6.4.2: en caso de cirrosis se recomienda seguimiento semestral para valorar la progresión de la hipertensión portal y el despistaje de hepatocarcinoma (NdE: 3; grado de recomendación: fuerte; nivel de consenso: 98,3%).
Recomendación 6.4.3: en todos los casos se recomienda realizar cribado y monitorización de comorbilidades, así como ahondar en promover el abandono del tabaco y evitar el consumo de alcohol, recomendar ejercicio físico aeróbico moderado y dieta saludable y reforzar la adherencia terapéutica (NdE: 1; grado de recomendación: fuerte; nivel de consenso: 97,5%).
¿Cómo organizar la atención de los pacientes con esteatosis hepática metabólica? Importancia y composición de la unidad funcional en la esteatosis hepática metabólicaLa EHmet es una enfermedad crónica frecuente, progresiva y compleja, relacionada con el estilo de vida y asociada con numerosas comorbilidades metabólicas y complicaciones cardiovasculares y hepáticas. El manejo adecuado incluye la prevención, el despistaje y diagnóstico de la enfermedad hepática y de las comorbilidades, así como el tratamiento para prevenir la progresión de la enfermedad y las comorbilidades y sus complicaciones, que deberá ser multifactorial y progresivo/aditivo para adaptarlo a la fase evolutiva de la enfermedad143.
En este contexto los modelos tradicionales de atención, que sufren de escasa coordinación y comunicación entre profesionales, tienden a resultar insatisfactorios para los pacientes, los profesionales y el sistema de salud. Dentro de las intervenciones que han demostrado mejores resultados en la atención a los pacientes crónicos, el Chronic Care Model (CCM) es el más utilizado en la DM2, ya que contempla las actuaciones en la comunidad, el sistema de salud y la práctica clínica144, así como las clínicas multidisciplinares (CM)145, los cuales promueven la atención coordinada al integrar las consultas en un espacio clínico de uso común en oncología146. La información en pacientes con EHmet es escasa147, pero por las características y necesidades plurales de los individuos con EHmet, las cuales varían durante el curso clínico, consideramos que, globalmente, el CCM es el modelo ideal para integrar la atención en diferentes niveles asistenciales. En este modelo se pueden integrar las unidades funcionales que agrupan a los diversos profesionales de atención primaria y hospitalaria que participan en el proceso clínico de los pacientes con EHmet, sin necesidad de compartir el espacio físico de la consulta ni el centro. Finalmente, en pacientes que requieren cuidados complejos en el ámbito hospitalario, las CM en un solo espacio clínico pueden ser un modelo adecuado para ofrecer la atención coordinada de diferentes profesionales.
Los integrantes fundamentales mínimos serán el médico de atención primaria, el médico internista, el endocrinólogo y el hepatólogo, así como enfermeros, psicólogos y nutricionistas, entre otros. Los 3 primeros son clave para prevenir e identificar a las personas en riesgo de EHmet y su evaluación, incluyendo la estimación del riesgo de fibrosis y el manejo de los factores de riesgo y las comorbilidades asociadas. El hepatólogo se responsabilizará de la evaluación adicional de la enfermedad hepática y del manejo de la enfermedad hepática avanzada. En función de las necesidades, los recursos disponibles y la organización, existen otros profesionales que pueden formar parte de estos equipos. Las funciones de todos los profesionales en el manejo de pacientes con EHmet y el responsable clínico de referencia para el paciente deben ser especificadas en todo momento. Finalmente, deben planificarse reuniones sistemáticas de contenidos clínico y organizativo.
Recomendación 6.5.1: se aconseja que los integrantes fundamentales mínimos del equipo multidisciplinar sean el médico y enfermería de atención primaria, el médico internista, el endocrinólogo y el digestivo o hepatólogo. Los tres primeros son clave para prevenir e identificar a las personas en riesgo de EHmet y su evaluación, incluyendo la estimación del riesgo de fibrosis y el manejo de los factores de riesgo y las comorbilidades asociadas. El hepatólogo se responsabilizará de la evaluación adicional de la enfermedad hepática y del manejo de la enfermedad hepática avanzada. En función de las necesidades, los recursos disponibles y la organización, existen otros profesionales que pueden formar parte de estos equipos (NdE: 4; grado de recomendación: fuerte; nivel de consenso: 89,9%).
Recomendación 6.5.2: el abordaje multidisciplinar requiere que se recomiende que estén explicitadas las funciones de todos los profesionales e identificado el responsable clínico de referencia del paciente. Así también deben planificarse reuniones sistemáticas de contenidos clínico y organizativo (NdE: 4; grado de recomendación: fuerte; nivel de consenso: 96,6%).
DiscusiónEl nivel de consenso se consideró muy alto (≥90%) en 48 de las 71 recomendaciones; en 27 de ellas el nivel de consenso fue superior al 95%. Por otra parte, 21 de las respuestas obtuvieron un consenso del 80-89,9% y solo dos de ellas obtuvieron un consenso inferior al 80% (75% en la recomendación 2.2.1 y 71% en la 3.1.1). En ninguna recomendación el consenso estuvo por debajo del 70%. Las principales discrepancias se encontraron en la introducción de nuevas tecnologías diagnósticas, donde el valor añadido de un método de pago frente a métodos gratuitos y disponibles no es evidente. Además, suscitó debate el papel de la pioglitazona y su potencial efecto beneficioso frente al riesgo de eventos adversos. La aprobación de resmetirom y los positivos resultados presentados por semaglutida a dosis de 2,4mg/semana han suscitado entusiasmo y un alto nivel de consenso.
El método Delphi presenta diversas ventajas a la hora de generar consensos dentro de la investigación científica: por un lado se trata de cuestionarios individuales, anónimos y estructurados, lo cual reduce el sesgo de grupo y permite a los participantes realizar una reflexión más objetiva. Por otro lado, las diversas rondas e iteraciones permiten que los expertos revisen y ajusten sus opiniones según avanza el proceso. Sin embargo, también se debe tener en cuenta que se trata de un proceso prolongado por el mayor número de rondas, así como las posibles dificultades a la hora de alcanzar un consenso, sobre todo si se trata de temas complejos, controvertidos o polarizados. En el caso del presente consenso se estableció contacto con expertos de todo el ámbito nacional, con un porcentaje de expertas y expertos equitativo (de las respuestas obtenidas el 48,8% se identificaron como mujeres y el 51,2% como hombres), y de diversos rangos de edad entre los 30 y los 70 años, aunque con una particular presencia de especialistas en el tramo entre los 50 y los 60 años (36,3%). En lo relativo a las especialidades médicas, el cuestionario fue enviado a expertos de tres áreas diferentes: Digestivo y hepatología (27,5%), Endocrinología (37,5%) y Medicina interna y Medicina de familia (35%), por lo que las respuestas estuvieron bien compensadas, así como las características de los participantes.
En conclusión, este consenso multidisciplinar sienta las bases del manejo de una enfermedad compleja, dinámica, heterogénea y multisistémica. La visión poliédrica de los mecanismos de progresión de la enfermedad, los métodos diagnósticos y las opciones de prevención y tratamiento pueden suponer un valor añadido en el camino hacia la mejora de la calidad asistencial de los pacientes que viven con EHmet.
AutoríaRocío Aller y Miguel A. Rubio han contribuido de la misma forma en la realización de este artículo.
FinanciaciónNo existen formas de financiación para este artículo.
Consideraciones éticasNo existen consideraciones éticas a tener en cuenta para este artículo.
Conflicto de interesesManuel Romero-Gómez: consultorías con Abbvie, Alpha-sigma, Advanz, Apollo, Astra-Zeneca, Bausch Health, BMS, Boehringer-Ingelheim, Exo-Biologics, Gilead, Ipsen, MSD, Novo-Nordisk, Pfizer, Prosciento, Resolution Therapeutics, Roche, Rubió, Sagimet, Siemens y UCB pharma.
Becas de investigación de Gilead, Intercept, Siemens, Theratechnologies, Novo-Nordisk y Echosens.
Javier Escalada: ponente en reuniones sobre EHMET patrocinadas por Echosens, MSD y Novo Nordisk. Advisory board: Boehringer, Lilly y Novo Nordisk. Investigador principal en ensayos clínicos de Boehringer, Lilly y Novo Nordisk.
Mar Noguerol: no existe conflicto de intereses.
Antonio Pérez: ha sido consultor o ha recibido ayudas para la investigación, honorarios por conferencias o asistencia a congresos por parte de Sanofi Aventis, Almirall, Novo Nordisk, EliLilly, MSD, Abbott, Boehringer Ingelheim, Dexcom, Esteve, Novartis, Amgen, Menarini, Amarin, Daiichi Sankyo y AstraZeneca.
Juana Carretero: curso MAFLD Novo Nordisk y Boeringher.
Javier Crespo: no existe conflicto de intereses.
Juan J. Mascort: no existe conflicto de intereses.
Ignacio Aguilar: no existe conflicto de intereses.
Francisco Tinahones: no existe conflicto de intereses.
Pedro Cañones: no existe conflicto de intereses.
Ricardo Gómez-Huelgas: no existe conflicto de intereses.
Daniel de Luis: no existen conflictos de intereses.
Idoia Genúa Trullos: ayuda para asistencia a congresos de Novo Nordisk, Eli Lilly, Sanofi, Boehringer, Daiichi Sankyo, Menarini y Almirall.
Rocío Aller: no existen conflicto de intereses.
Miguel A. Rubio: asesoría científica y/o ensayos clínicos, y/o conferencias y/o colaboraciones con: Adventia, Amgen, Astra-Zeneca, Boehringer, Janssen, Lilly, Mundipharma, MSD, Novo-Nordisk, Roche, Rubió y Vegenat.
A Javier Pazó por el apoyo metodológico en la confección del RedCAP para realizar la primera ronda del Delphi.
A Sara Romero por la realización de la segunda ronda del Delphi y la corrección gramatical y de estilo del texto.
Alfredo Michán Doña. Departamento de Medicina, Hospital Universitario de Jerez. Biomedical Research and Innovation Institute of Cadiz (INIBICA)
Amaia Rodríguez. Laboratorio de Investigación Metabólica, Clínica Universidad de Navarra, CIBEROBN, IdiSNA, Pamplona
Ana de Hollanda. Servicio de Endocrinología y Nutrición, Hospital Clínic de Barcelona. CiberOBN
Ana Belén García Garrido. Médico de Familia de Atención Primaria, Centro de Salud José Barros, Muriedas, Cantabria.
Ana María Gómez Pérez. Unidad de Endocrinología y Nutrición, Instituto de Investigación Biomédica de Málaga y Plataforma en Nanomedicina (IBIMA-Plataforma BIONAND), Hospital Universitario Virgen de la Victoria, Málaga.
Ana Mª Sánchez Bao. Endocrinología y Nutrición, Complejo Hospitalario Universitario Ferrol
Anna Soria. Liver Unit, Hospital Clínic de Barcelona. FCRB-IDIBAPS, Universitat de Barcelona
Antonio Jesús Blanco Carrasco. Servicio de Endocrinología y Nutrición, Hospital Clínic de Barcelona
Blas Labrador Vázquez. Aparato Digestivo, Hepatología, Hospital Universitario de Gran Canaria-Doctor Negrín.
Carolina M. Perdomo Zelaya. Departamento de Endocrinología y Nutrición, Clínica Universitaria de Navarra, Pamplona. Instituto de Investigación en la Salud de Navarra (IdiSNA), Pamplona. CIBER Fisiopatología de la Obesidad y Nutrición (CIBERObn), Instituto de Salud Carlos III, Madrid.
Carolina Torrijos Bravo. Medicina Familiar y Comunitaria, Centro de Salud Joaquín Rodrigo, Madrid
Conrado Fernández Rodríguez. Servicio de Aparato Digestivo, Hospital Universitario Fundación Alcorcón. Departamento de Especialidades Médicas y Salud Pública, Universidad Rey Juan Carlos
Cristina Tejera-Pérez. Servicio de Endocrinología y Nutrición, Complejo Hospitalario Universitario de Ferrol (CHUF/SERGAS), A Coruña. Grupo de Epigenómica en Endocrinología y Nutrición, Unidad de Epigenómica, Instituto de Investigación Sanitaria de Santiago de Compostela (IDIS)
David León Jiménez. Servicio de Medicina Interna, Hospital Universitario Virgen del Rocío, Sevilla
David Primo Martín. Endocrinología y Nutrición, Hospital Clínico Universitario de Valladolid.
Dídac Mauricio. Servicio de Endocrinología y Nutrición, CIBERDEM, Hospital de la Santa Creu i Sant Pau, Barcelona
Diego Bellido Guerrero. Endocrinología y Nutrición, Complejo Hospitalario Universitario de Ferrol.
Elena González Arnáiz. Servicio de Endocrinología y Nutrición, Complejo Asistencial Universitario de León.
Eloy Sánchez Hernández. Servicio de Aparato Digestivo, Complejo Hospitalario Universitario de Ourense.
Emilio Ortega. Servicio de Endocrinología y Nutrición, Hospital Clínic de Barcelona. CIBER Fisiopatología Obesidad y Nutrición (CIBEROBN), Instituto de Salud Carlos III, Madrid
Fernando Gómez Peralta. Unidad de Endocrinología y Nutrición, Hospital General de Segovia. Coordinador del Área de Diabetes de la Sociedad Española de Endocrinología y Nutrición (SEEN)
Francisco Javier Carrasco Sánchez. Servicio de Medicina Interna, Unidad Cardio-Metabólica: IC (Riesgo vascular y lípidos), Hospital Universitario Juan Ramón Jiménez, Huelva. Universidad de Huelva.
Francisco Jesús Gómez Delgado. Unidad de Riesgo Vascular, Servicio de Medicina Interna y Cuidados Paliativos, Hospital Universitario de Jaén. Grupo PAIDI CTS-990, Universidad de Jaén
Irene Bretón Lesmes. Servicio de Endocrinología y Nutrición, Hospital General Universitario Gregorio Marañón, Madrid. Instituto de Investigaciones Sanitarias Gregorio Marañón (IiSGM)
Javier Ampuero. Hospital Universitario Virgen del Rocío. Instituto de Biomedicina de Sevilla. Universidad de Sevilla. CIBEREHD.
Jorge Francisco Gómez Cerezo. Universidad Europea de Madrid. Servicio de Medicina Interna, Hospital Universitario Infanta Sofía, Madrid.
José Carlos Arévalo Lorido. Servicio de Medicina Interna, Hospital Universitario de Badajoz.
José Luis Calleja. Servicio de Gastroenterología y Hepatología, Hospital Universitario Puerta de Hierro, Majadahonda. Universidad Autónoma de Madrid.
José María Fernández Rodríguez. Unidad de Insuficiencia Cardiaca (UMIPIC), Hospital Universitario Central de Asturias.
José Miguel Rosales Zábal. Unidad de Aparato Digestivo, Hospital Universitario Costa del Sol, Marbella, Málaga.
José Pablo Miramontes González. Medicina Interna, Hospital Universitario Río Hortega, Valladolid. Departamento de Medicina, Facultad de Medicina, Universidad de Valladolid.
Josep Vidal. Unidad de Obesidad, Servicio de Endocrinología y Nutrición, Hospital Clínic de Barcelona. Centro de Investigación Biomédica en Red en Diabetes y Enfermedades Metabólicas (CIBERDEM), Instituto de Salud Carlos III, Madrid.
Juan José González Soler. Medicina Interna, Complejo Hospitalario Universitario de Ourense
Juan Manuel Mendive. Medicina Familiar y Comunitaria, Centro de Atención Primaria La Mina, Sant Adrià de Besòs, Barcelona.
Judith Gómez Camarero. Servicio de Aparato Digestivo, Hospital Universitario de Burgos
Luis Castilla Guerra. Unidad de Riesgo Vascular, Servicio de Medicina Interna, Hospital Virgen Macarena, Sevilla. Departamento de Medicina, Universidad de Sevilla.
Luis Ibáñez-Samaniego. Unidad de Hepatología y Trasplante Hepático, Hospital General Universitario Gregorio Marañón, Madrid. Instituto de Investigación Sanitaria Gregorio Marañón, Madrid. CIBERehd, Instituto de Salud Carlos III, Madrid.
Manuel Delgado Blanco. Unidad de Hepatología, Hospital Universitario La Coruña.
Manuel A. Gargallo Fernández. Departamento de Endocrinología y Nutrición, Fundación Jiménez Díaz, Madrid.
María Dolores García de Lucas. Medicina Interna, Hospital Regional de Málaga.
María Dolores López Carmona. Medicina Interna, Hospital Regional de Málaga.
Mª Isabel Pérez Soto. Medicina Interna, Hospital Universitario de Vinalopó, Elche.
Mª José Carrera Santaliestra. Servicio de Endocrinología y Nutrición, Hospital del Mar, Barcelona. Departamento de Medicina (MELIS), Universitat Pompeu Fabra, Barcelona.
María Riestra Fernández. Servicio de Endocrinología y Nutrición, Hospital Universitario de Cabueñes.
María Teresa Arias-Loste. Hospital Universitario Marqués de Valdecilla, Santander. Grupo Investigación Clínica y Traslacional de Enfermedades Digestivas (IDIVAL), Universidad de Cantabria.
María Teresa Julián Alargada. Servicio de Endocrinología y Nutrición, Hospital Universitario Germans Trias i Pujol, Badalona.
Marta Bueno Díez. Servicio de Endocrinología y Nutrición, Hospital Universitari Arnau de Vilanova, Lleida.
Marta Casado Martín. Departamento de Hepatología, Hospital Universitario Torrecárdenas, Almería.
Marta Tejedor. Hospital Universitario Infanta Elena, Madrid.
Mercedes Ricote Belinchón. Medicina Familiar y Comunitaria, C. S. Mar Báltico DAE, Madrid.
Mercedes Vergara. Unitat de Hepatologia, Servei d’Aparell Digestiu, Parc Taulí Hospital Universitari. Institut d’Investigació i Innovació Parc Taulí I3PT, Universitat Autònoma de Barcelona, Sabadell. CIBERehd, Instituto Carlos III, Madrid
Miguel Fernández Bermejo. Unidad de Hepatología, Servicio de Aparato Digestivo, Hospital Universitario de Cáceres.
Miriam Fuentes Bermejo. Medicina Familiar y Comunitaria, Centro de Salud Cuzco, Fuenlabrada, Madrid.
Noelia Fontanillas Garmilla. Especialista en Medicina Familiar y Comunitaria. Universidad de Cantabria. Coordinadora del Grupo de Trabajo de Digestivo SEMERGEN
Nuria Muñoz Rivas. Unidad de Riesgo Cardiovascular, Medicina Interna, Hospital Universitario Infanta Leonor, Madrid. Universidad Complutense de Madrid.
Nuria Vilarrasa. Servicio de Endocrinología y Nutrición, Hospital Universitario de Bellvitge-IDIBELL. CIBERDEM
Pedro José Pinés Corrales. Facultativo especialista de área en el Complejo Hospitalario Universitario de Albacete. Facultad de Medicina de Albacete.
Rafael Bañares. Servicio de Medicina de Aparato Digestivo, Instituto de Investigación Sanitaria Gregorio Marañón. Cátedra de Medicina, Universidad Complutense de Madrid. CIBEREHD
Rosa Martín Mateos. Servicio de Gastroenterología, Hospital Universitario Ramón y Cajal. CIBERehd. Instituto Ramón y Cajal de Investigación Sanitaria (IRYCIS). Universidad de Alcalá, Madrid.
Salvador Benlloch. Hospital Arnau de Vilanova. Universidad CEU-Cardenal Herrera, Valencia. CIBEREHD
Sharona Azriel Mira. Servicio de Endocrinología y Nutrición, Hospital Universitario Infanta Sofía, Madrid. Universidad Europea de Madrid.
Sonia Blanco Sampascual. Servicio de Aparato Digestivo, Hospital Universitario Basurto–OSI, Bilbao.
Tomás de Vega Santos. Medicina Interna, Hospital Sierrallana, Torrelavega, Cantabria.
Vanesa Bernal-Monterde. Gastroenterología y Hepatología, Hospital Universitario Miguel Servet, Zaragoza. Instituto de Investigación Sanitaria de Aragón (IISA), ADIPOFAT Lab
Virginia Bellido. Unidad de Gestión Clínica de Endocrinología y Nutrición, Instituto de Biomedicina de Sevilla (IBiS), Hospital Universitario Virgen del Rocío/CSIC/Universidad de Sevilla.