El daño hepático tóxico inducido por fármacos (DILI) es una de las afecciones hepáticas más compleja debido a su capacidad de presentarse como cualquier otra enfermedad hepática aguda o crónica, potencial gravedad, y la ausencia de biomarcadores específicos para establecer la certeza diagnóstica que se sustenta en su sospecha y exclusión de causas alternativas. La incapacidad del proceso de desarrollo de los medicamentos de cribar completamente las moléculas hepatotóxicas e identificar a los sujetos susceptibles continúa haciendo imprescindible la farmacovigilancia poscomercialización. Los registros de hepatotoxicidad se convierten en un instrumento idóneo para la recogida sistemática, según criterios consensuados y con continuidad de datos bien definidos. Se describen sumariamente las aportaciones del Registro Español de Hepatotoxicidad, y de otros registros internacionales, y se invoca la oportunidad de incorporar a Latinoamérica en las iniciativas en marcha lo que promoverá la investigación y la comprensión de los complejos mecanismos involucrados en esta reacción adversa.
Drug-induced liver damage is one of the most complex liver diseases due to its similar presentation to other acute or chronic liver processes, its potential severity and the absence of specific biomarkers to confirm diagnosis, which is based on clinical suspicion and exclusion of alternative causes. Because the drug development process fails to completely screen out hepatotoxic molecules and identify susceptible individuals, postmarketing pharmacovigilance remains essential. Hepatotoxicity registries are the ideal instrument for systematic and continual data collection, using preestablished criteria based on consensus. The present article briefly describes the contributions of the Spanish Hepatotoxicity Registry and those of other international registries. Hopefully, Latin American registries will be incorporated into existing initiatives, which will stimulate research and improve understanding of the complex mechanisms involved in this adverse reaction.
El daño hepático tóxico inducido por fármacos (DILI) es probablemente una de las afecciones hepáticas más desconcertante y compleja y, por ello, viene desafiando desde hace decenios a clínicos, farmacólogos, toxicólogos, industria farmacéutica y autoridades reguladoras. Esto ocurre porque a diferencia de otros problemas de seguridad con el uso de medicamentos, las facetas de la hepatotoxicidad son múltiples, de difícil abordaje y con gran impacto potencial. Para los gastroenterólogos y hepatólogos, la enfermedad hepática tóxica es un temido diagnóstico diferencial no únicamente debido a su potencial gravedad, sino también a la imposibilidad en el momento actual de establecer con certeza el diagnóstico en la inmensa mayoría de los casos. La hepatitis aguda tóxica tiene una probabilidad nada despreciable de evolucionar a la cronicidad y a formas graves, e incluso ser fulminante, no en vano constituye hoy en día la causa más frecuente de insuficiencia hepática aguda en el mundo occidental, y aunque la gran mayoría de estos casos se deben a paracetamol en dosis > 150mg/kg (reacción tipo A, reproducible, dependiente de la dosis)1,2, las reacciones idiosincrásicas o impredecibles y no relacionadas con la dosis –las más difíciles de comprender y prevenir– son actualmente responsables de una séptima parte del total de incidencias en EE.UU. y Suecia1,2, y de una proporción similar de los trasplantes realizados en EE.UU. por fallo hepático fulminante en los últimos 15 años3. Aunque la aparición de una reacción adversa hepatotóxica idiosincrásica durante un tratamiento farmacológico es una posibilidad cierta pero infrecuente –se estima una frecuencia de 2.4 casos/100,000 personas-año4–, sin embargo, en un estudio prospectivo de una población de 80.000 habitantes del norte de Francia5, la incidencia de DILI fue de 14 casos por 100.000 pacientes-año, una tasa 16 veces superior a las reportadas a la agencia reguladora francesa. En un análisis sobre 461 pacientes con DILI identificados durante los primeros 10 años de funcionamiento del Registro Español de Hepatotoxicidad6, se estimó una incidencia anual de 34,2±10,7 casos por 106 habitantes con una tasa anual de DILI grave de 16,6±6,7 casos por 106 habitantes. De los pacientes que sufrieron DILI, el 53% requirió hospitalización, un 2% necesitó trasplante hepático, un 10% desarrolló daño hepático crónico y un 5% falleció como consecuencia del daño tóxico6. Puesto que no disponemos de marcadores específicos de daño tóxico y el diagnóstico descansa fundamentalmente en la sospecha clínica no es de extrañar que su diagnóstico sea infrecuente en comparación con otras formas de hepatopatía y que muchas incidencias pasen desapercibidas. En realidad, los estudios epidemiológicos tienden a sobrestimar los casos de toxicidad hepática grave y a infraestimar el número total, ya que la mayoría de los casos de DILI serían asintomáticos7.
En relación con la dificultad de diagnosticarlas, el primer elemento a considerar es que la lista de fármacos, drogas de abuso, plantas medicinales y suplementos dietéticos capaces de dañar el hígado crece de año en año8 y así, es arriesgado descartar como potencial responsable de un cuadro hepático cualquier sustancia que el paciente esté tomando9. Además, merece destacarse la marcada variabilidad geográfica encontrada entre los diferentes agentes responsables de causar daño hepático10. Así, los principales grupos farmacológicos involucrados en DILI en los países occidentales son los antibióticos, los fármacos activos en el sistema nervioso central y los antiinflamatorios no esteroideos (AINE), con notables diferencias entre los principios activos responsables. En el Registro Americano (Drug-Induced Liver Injury Network) destaca la nitrofurantoína, de la que prácticamente no existen casos registrados en España. Por el contrario, mientras en el Registro Español el ibuprofeno ocupa una destacada posición entre los agentes responsables de DILI en el DILIN existía un único caso registrado en el último análisis10. Esta circunstancia habla a favor de diferencias en la susceptibilidad al daño hepático entre poblaciones, probablemente condicionadas genéticamente. En algunos países asiáticos predomina la hepatotoxicidad inducida por productos de herboristería y medicina tradicional, un grupo en auge también en los países occidentales6,11, mientras que en India un estudio reciente señala a los fármacos antituberculosos, difenilhidantoína y dapsona, como los responsables asociados con más frecuencia a daño tóxico12. Por otra parte, en Argentina se ha comunicado recientemente la serie más amplia de la literatura médica de toxicidad hepática por nimesulida que además fue identificada en un único centro13. Estas circunstancias evidentemente apuntan a notables diferencias en prevalencia de enfermedades, las prácticas de prescripción y políticas farmacéuticas entre países.
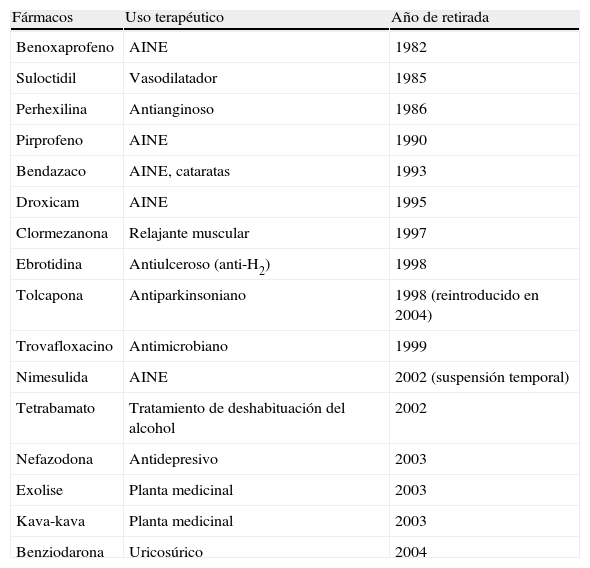
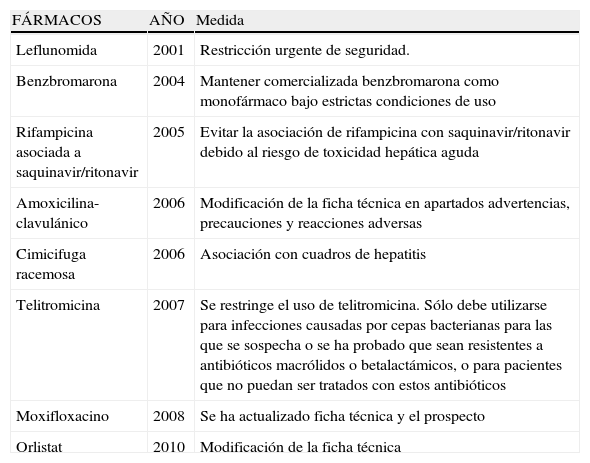
Estos hechos no hacen más que subrayar la importancia de estudiar el hígado en su relación con los fármacos desde una perspectiva epidemiológica y multidisciplinaria con importantes implicaciones en el terreno de la salud pública y en las estrategias de desarrollo farmacológico. Desde la perspectiva de la industria farmacéutica, el rigor en la información sobre hepatotoxicidad cobra una extraordinaria importancia si se considera que la identificación de reacciones hepatotóxicas es una de las causas más frecuentes tanto de adopción de medidas reguladoras y de advertencias y restricciones de uso de fármacos aprobados, como de retirada de fármacos en Europa y EE.UU. (tablas 1 y 2)14,15.
Fármacos retirados del mercado farmacéutico por hepatotoxicidad en España 1982-2010
| Fármacos | Uso terapéutico | Año de retirada |
| Benoxaprofeno | AINE | 1982 |
| Suloctidil | Vasodilatador | 1985 |
| Perhexilina | Antianginoso | 1986 |
| Pirprofeno | AINE | 1990 |
| Bendazaco | AINE, cataratas | 1993 |
| Droxicam | AINE | 1995 |
| Clormezanona | Relajante muscular | 1997 |
| Ebrotidina | Antiulceroso (anti-H2) | 1998 |
| Tolcapona | Antiparkinsoniano | 1998 (reintroducido en 2004) |
| Trovafloxacino | Antimicrobiano | 1999 |
| Nimesulida | AINE | 2002 (suspensión temporal) |
| Tetrabamato | Tratamiento de deshabituación del alcohol | 2002 |
| Nefazodona | Antidepresivo | 2003 |
| Exolise | Planta medicinal | 2003 |
| Kava-kava | Planta medicinal | 2003 |
| Benziodarona | Uricosúrico | 2004 |
Medidas administrativas adoptadas en España para reducir el riesgo de hepatotoxicidad de determinados fármacos desde 2000
| FÁRMACOS | AÑO | Medida |
| Leflunomida | 2001 | Restricción urgente de seguridad. |
| Benzbromarona | 2004 | Mantener comercializada benzbromarona como monofármaco bajo estrictas condiciones de uso |
| Rifampicina asociada a saquinavir/ritonavir | 2005 | Evitar la asociación de rifampicina con saquinavir/ritonavir debido al riesgo de toxicidad hepática aguda |
| Amoxicilina-clavulánico | 2006 | Modificación de la ficha técnica en apartados advertencias, precauciones y reacciones adversas |
| Cimicifuga racemosa | 2006 | Asociación con cuadros de hepatitis |
| Telitromicina | 2007 | Se restringe el uso de telitromicina. Sólo debe utilizarse para infecciones causadas por cepas bacterianas para las que se sospecha o se ha probado que sean resistentes a antibióticos macrólidos o betalactámicos, o para pacientes que no puedan ser tratados con estos antibióticos |
| Moxifloxacino | 2008 | Se ha actualizado ficha técnica y el prospecto |
| Orlistat | 2010 | Modificación de la ficha técnica |
Si bien la lesión hepatocelular aguda similar a la hepatitis viral es la forma de presentación más común de la hepatotoxicidad, ésta es capaz de expresarse como cualquier otra enfermedad hepática aguda o crónica, incluyendo hepatitis crónica, cirrosis hepática o biliar, enfermedades vasculares y tumores. Ni siquiera los fármacos producen un patrón constante de lesión hepática (por ejemplo, amoxicilina-ácido clavulánico es considerado una hepatotoxina que induce cuadros colestásicos/mixtos, pero frecuentemente provoca también reacciones hepatocelulares)16 y esta peculiaridad genera perplejidad en el clínico, erigiéndose en una dificultad añadida para la imputación diagnóstica. Sin embargo, el principal obstáculo para la caracterización de las reacciones hepatotóxicas es la ausencia de marcadores clínicos, biológicos o anatomopatológicos específicos de toxicidad hepática. Esto conlleva demoras en el diagnóstico de esta variedad de enfermedad hepática, ya que se sustenta, aún en la actualidad, en el descarte de otras causas específicas de hepatopatía. Tal carencia ha tratado de suplirse con algunos instrumentos diagnósticos que integran toda la información disponible para evaluar de forma probabilística la causalidad de un medicamento o tóxico, con el inconveniente de que no pueden ser comparados con un escala de referencia17. De entre ellos, la escala diagnóstica de CIOMS/RUCAM es la más ampliamente utilizada18, pero estudios recientes ponen en cuestión su consistencia y reproducibilidad entre facultativos19, y es evidente que con la gran cantidad de información clínica acumulada en los últimos años hay un margen para el ajuste de dicha escala20.
Otro desafío clave de la hepatotoxicidad es la incapacidad actual del proceso de desarrollo de los medicamentos de cribar completamente las moléculas hepatotóxicas e identificar a los sujetos susceptibles. Específicamente, es necesario mencionar que los ensayos clínicos para el registro de un fármaco no están diseñados específicamente para valorar la seguridad de una intervención terapéutica. La población de estudio está muy seleccionada tras la aplicación de estrictos criterios de inclusión y exclusión y una ausencia de subgrupos de pacientes especialmente vulnerables a los efectos adversos de los medicamentos, como son niños, embarazadas, ancianos, pacientes con enfermedades de base o pacientes polimedicados. Además, el seguimiento y monitorización son muy cuidadosos en el contexto del estudio experimental y la duración del tratamiento no suele ser lo suficientemente prolongada para posibilitar la detección de toxicidades que aparecen tardíamente o tras periodos prolongados de exposición.
Además, el tamaño de la muestra suele ser relativamente pequeño (excepcionalmente superan los 3.000 pacientes a lo largo de toda la investigación clínica) para poder poner de manifiesto un efecto adverso de escasa frecuencia (1:10.000). Se ha postulado que para detectar en un ensayo clínico un caso de hepatotoxicidad clínicamente expresiva que tenga esta frecuencia aproximada (con un 95% de confianza) se requeriría tratar a 30.000 pacientes (tres veces la incidencia esperada de la reacción adversa, «regla de tres»)21. Así, no debe sorprender que las reacciones hepatotóxicas idiosincrásicas sean típicamente descubiertas en las fases finales del desarrollo clínico o tras la comercialización del producto, cuando decenas de miles de individuos han sido expuestos al fármaco.
El mayor desafío en todo caso –ya que ayudaría a resolver muchos de los aspectos anteriormente mencionados– es la identificación de sujetos susceptibles a la hepatotoxicidad idiosincrásica. Dada la ausencia de modelos animales fiables que permitan profundizar en su patogenia, su relativa rareza, la dificultad de establecimiento de causalidad por la ausencia de un «patrón de oro» para el diagnóstico y la variabilidad étnica en la respuesta actualmente el mejor modelo de estudio sería el sujeto afectado bien caracterizado. Así pues, para recabar una información clínica nutrida y de calidad y recoger muestras biológicas con las que poder efectuar estudios genómicos, los esfuerzos cooperativos son imprescindibles.
Vigilancia poscomercialización de los problemas hepáticosLa farmacovigilancia de los trastornos hepáticos basada en la detección y notificación de alteraciones del perfil hepático durante un tratamiento farmacológico con o sin expresividad clínica es necesaria debido a las limitaciones comentadas del desarrollo preclínico y clínico de los medicamentos. De otra parte, es sabido el escaso valor predictivo de las elevaciones moderadas de ALT (x 2, x 3 por encima de los valores del límite superior de la normalidad), para daño hepático tóxico clínicamente relevante, toda vez que las cifras de incidencia de ALT x 3 LSN en controles expuestos a placebo (ensayos clínicos) oscilan entre 0,1-1%21.
El método básico de la farmacovigilancia en España22 es el sistema de notificación espontánea de sospechas de reacciones adversas por parte del profesional sanitario, la tarjeta amarilla, instrumento esencial para generar señales de alerta e identificación de riesgos y el más eficiente. Sus principales limitaciones, ampliamente reconocidas, son la notificación inconstante y selectiva, la infranotificación (se notifica < 1-10% de las reacciones adversas graves), la dificultad de control de factores de confusión en la evaluación de la señal y el no permitir obtener medidas de asociación válidas (cuantificación del grado de asociación entre el medicamento y la reacción adversa sospechada).
La comunicación de casos de sospecha de hepatotoxicidad a la comunidad científica mediante la redacción de Cartas al Editor u Observaciones Clínicas se constituye también en un método «no controlado» pero rápido de formulación de hipótesis. Como ventajas cabe destacar su bajo coste y la revisión por pares durante el proceso editorial, lo cual garantizaría en principio el rigor de la información. Nótese que recientemente se han identificado los elementos mínimos de información que deben recogerse en la comunicación de una sospecha de hepatotoxicidad23 para que el lector pueda establecer los límites de precisión en la relación de causalidad con el medicamento sospechoso.
Otra estrategia alternativa a implementar sería el Registro de Hepatotoxicidad, ubicado en un ámbito hospitalario y recogiendo los casos atendidos en su área de influencia, que puede estructurarse como una red multicéntrica, con la participación de diferentes hospitales que utilizan un protocolo de recogida de información común. Entre las ventajas de esta metodología de trabajo24 conviene señalar que puede constituirse como un sistema de recogida de información permanente lo que resulta particularmente interesante para un diagnóstico –la hepatotoxicidad– de baja frecuencia que condiciona la dispersión de la información y dificulta su conocimiento. La recogida sistemática y con continuidad de datos bien definidos puede resultar de gran utilidad en la evaluación asistencial, la investigación y generación de conocimientos sobre la enfermedad en estudio y la gestión de recursos. Estimula el diagnóstico de la enfermedad al aumentar su conocimiento y entrenamiento de los médicos colaboradores con una actitud más abierta y alerta a la recogida de información. En el caso de poder disponer de una población de referencia permitiría obtener estimaciones crudas de incidencia. Entre sus limitaciones destacan la ausencia de grupo control y la imposibilidad de realizar ajuste por factores de confusión. Se carece de datos de exposición poblacional a medicamentos específicos y resulta imposible estimar incidencias específicas por medicamento.
En España, y financiados por la Agencia Española del Medicamento, tenemos entre los registros de enfermedades el Registro Español de Hepatotoxicidad (Hospital Universitario, Universidad de Málaga) (http://www.spanishDILI.uma.es) que ha colaborado en la identificación de las señales de ebrotidina25, tetrabamato, nefazodona, nimesulida y amoxicilina-clavulánico6; y el Registro de Agranulocitosis (Universidad Autónoma de Barcelona). En los registros de pacientes expuestos destaca el Registro Español de acontecimientos adversos de terapias biológicas en enfermedades reumáticas: Biobadaser (www.biobadaser.ser.es) (Sociedad Española de Reumatología) y el de pacientes con psoriasis sometidos a terapias biológicas (Academia de Dermatología).
¿Qué hemos aprendido del Registro Español de Hepatotoxicidad?Los autores (RJA y MIL) coordinan desde 1994 un Registro Nacional y una Red Nacional (51 centros), que está integrado en el Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBERehd) y en el que participan otros grupos del CIBERehd, orientado a la detección prospectiva y estudio sistemático de todas las sospechas de hepatotoxicidad utilizando una metodología uniforme6.
Hasta el momento actual hay más de 790 casos incluidos en el Registro, y disponemos de muestras para extracción de ADN de pacientes y de controles pareados por edad, sexo y exposición al fármaco.
Este proyecto ha permitido la realización de estudios fenotípicos y genotípicos para: a) establecer características de expresión del daño hepático tóxico, factores pronósticos y evolutivos; b) mejorar los instrumentos de evaluación de causalidad; y c) profundizar en los mecanismos etiopatogénicos e identificación de sujetos susceptibles26.
Este trabajo coordinado con las diferentes unidades clínicas y la colaboración conjunta de hepatólogos y farmacólogos clínicos ha posibilitado avanzar en el conocimiento científico de la hepatotoxicidad y ha sido una herramienta metodológica poderosa para desarrollar una «cultura farmacoepidemiológica» en los clínicos haciéndoles más sensibles al fenómeno, incrementando así las probabilidades de identificar casos; y las garantías de certeza diagnóstica, permitiendo realizar estudios clínicos, vedados a unidades aisladas, como estudios de determinantes pronósticos6 y de historia natural de la enfermedad27. Ha facilitado también la adopción de medidas reguladoras y se sitúa pues como un instrumento para detectar o amplificar «señales de alerta» de hepatotoxicidad y por tanto de protección de la salud pública25. El trabajo de forma colaborativa resulta más eficiente y permite publicaciones en revistas de elevado impacto de la especialidad, lo que de una manera natural permite el establecimiento de colaboraciones con otros centros de investigación, otras sociedades científicas y una posición de liderazgo internacional en la materia.
Otros registros internacionales de hepatotoxicidadPara abordar la compleja problemática de la compilación de información en hepatotoxicidad, investigadores de varios países han desarrollado distintas estrategias. En Suecia, el Swedish Adverse Drug Reaction Committee (SADRAC) es una base de datos de la Agencia Estatal de Farmacovigilancia que incluye reacciones adversas hepáticas identificadas desde 1970. Dicha base de datos ha sido objeto de diferentes análisis publicados para avanzar en el conocimiento de la presentación, clínica y evolución de las reacciones hepatotóxicas28.
Más recientemente, en 2003, se crea en EE.UU. un grupo cooperativo formado por 5 instituciones académicas, el Drug Induced Liver Injury Network (DILIN) que fue patrocinado por los National Institutes of Health (NIH) con el mismo propósito (http://dilin.dcri.duke.edu/ web). El análisis de los 300 primeros casos recogidos de forma prospectiva ha sido publicado, con resultados comparables en muchos aspectos a los obtenidos en el Registro Español de Hepatotoxicidad29.
Hay otras iniciativas con una finalidad circunscrita a la identificación de factores genéticos como el DILIGEN en el Reino Unido que ha sido capaz de identificar entre otros un genotipo HLA B*5701 como factor de susceptibilidad al daño hepatotóxico por flucloxacilina30.
Conscientes de la necesidad de una cooperación coordinada entre investigadores académicos e Industria Farmacéutica en materia de hepatotoxicidad, en 2007 se constituyó un gran consorcio internacional denominado International Serious Event Consortium (iSAEC) (www.saeconsortium.org)31 que agrupa instituciones reguladoras como la FDA y la EMEA, centros académicos y las grandes multinacionales farmacéuticas. El objetivo de este gran consorcio es fomentar la investigación en la identificación de factores genéticos de susceptibilidad a la hepatotoxicidad (y a otras reacciones adversas de gran impacto como las torsades de pointes y las cutáneas generalizadas). Este proyecto ha entrado en el momento actual en una segunda fase incorporando nuevas instituciones en Asia y Europa y tiene la intención de generar una base de datos clínica uniforme para explorar la influencia de la variabilidad étnica en la aparición de hepatotoxicidad y profundizar en sus mecanismos biológicos de expresión de daño y ha venido a denominarse International Drug-Induced Liver Injury Consortium (IDILIC).
Estos esfuerzos cooperativos están poniendo de manifiesto la necesidad de establecer nuevos consensos en materia de definiciones y terminologías, criterios diagnósticos e instrumentos de causalidad11,31, e integrar en la práctica clínica las herramientas necesarias para incrementar el grado de certeza en el diagnóstico de hepatotoxicidad, todo lo cual en último término promoverá la investigación y la comprensión de los complejos mecanismos involucrados en esta reacción adversa.
Red Hispano Latinoamericana de HepatotoxicidadLatinoamérica representa a un conjunto de 23 países de habla hispana más Brasil que dependiendo de los diferentes flujos migratorios desde la época de la colonización tiene un predominio de población mestiza, amerindia o europea y que por tanto se caracteriza por la presencia de múltiples etnias. Su semejanza con la población española es evidente ya que, sin perder su identidad propia, comparte mayoritariamente con ésta unos vínculos indestructibles como son la lengua y tradición religiosa. De otra parte, Latinoamérica consiguió en sólo algunas décadas un despegue demográfico similar al obtenido por Europa en 2 siglos de transición. Así, entre 1950 y 1980 duplicó su población, incorporando a razón de más de 6 millones de habitantes por año, siendo la mitad de la población en 1980 menor de 20 años de edad. Ningún espacio continental ha crecido a esa velocidad en la historia y difícilmente podrá alguno hacerlo en el futuro32.
Estas singularidades le aportan riqueza y diversidad y hacen de este continente un espacio de gran interés para el estudio de las diferencias en la respuesta a los fármacos.
Es muy probable que los patrones de prescripción de fármacos puedan diferir notablemente de países industrializados y, además, existe una cifra elevada de automedicación (58,7%) que podría considerarse como parte de las respuestas de la población a los problemas de acceso y funcionamiento de los servicios de salud33. De otra parte, habría que señalar que ya sea por una concepción errónea de la seguridad de lo natural o por tradición cultural en grandes sectores de la población, el uso de las plantas para curar sus dolencias psicofísicas es una práctica que ha ido en aumento en los últimos tiempos. Finalmente, los factores genéticos que predisponen a los pacientes al desarrollo de hepatotoxicidad idiosincrásica pueden tener un impacto diferente según la procedencia étnica estudiada. Así, por ejemplo, en un estudio de asociación genética se encontraron notables diferencias en la distribución de alelos mutantes de la superóxido dismutasa mitocondrial que incrementarían el riesgo de toxicidad a los antituberculosos y a diversos fármacos, entre población asiática y española34. De igual modo, una tipificación de alta resolución de la región HLA en pacientes que habían desarrollado toxicidad hepática por amoxicilina-clavulánico identificó al haplotipo DRB1*1501-DQB1*0602 como factor de riesgo tanto en pacientes del norte de Europa como españoles35,36. No obstante, en pacientes españoles había una proporción más elevada de expresión hepatocelular del daño hepático que estaba ligada a la presencia del alelo B*1801 y que además comportaba una mayor gravedad36. Por tanto, la variabilidad étnica podría condicionar un patrón de susceptibilidad diferente a la hepatotoxicidad idiosincrásica.
La información sobre hepatotoxicidad en este continente es pues fragmentaria con publicaciones de casos o serie de casos aislados y sin continuidad en el tiempo37 y, en consecuencia, es claramente necesario un esfuerzo de aproximación uniforme a la identificación de casos de hepatotoxicidad bien caracterizados para ganar conocimiento de su epidemiología y factores de riesgo en esta área geográfica. La participación de diferentes unidades clínicas latinoamericanas en un proyecto de registro coordinado contribuirá a la capacitación y entrenamiento metodológico de los profesionales sanitarios en esta área para el trabajo colaborativo, en red, incrementando así su formación y la adquisición de herramientas para la investigación y transferencia de conocimientos. En realidad, esta cultura de colaboración en ciencia que responde a las necesidades de una sociedad globalizada y de servicios, es un nuevo paradigma y un valor añadido frente al concepto tradicional de grupos aislados trabajando en temáticas básicas o clínicas pero sin mecanismos de transferencia. Las más recientes estrategias de investigación promovidas por los sistemas públicos de I+D en España han asumido este concepto al fomentar la creación de redes temáticas o centros de investigación biomédica en red. Facilitar el establecimiento de relaciones de colaboración entre grupos que les haga capaces de afrontar retos científicos de mayor envergadura y con suficiente masa crítica para poder aspirar a mayores liderazgos internacionales es una aspiración ineludible de cualquier política científica en el momento actual.
Además, sería enriquecedor poder incorporar a Latinoamérica en los estudios internacionales actualmente en marcha, lo que posibilitaría una selección más eficiente de pacientes e incluir el concepto de desarrollo de biomarcadores, tanto para la prevención de la enfermedad mediante el diagnóstico de sujetos susceptibles como durante el desarrollo de los medicamentos.
En función de las consideraciones previas, el objetivo del proyecto de Registro Hispano-Latinoamericano de Hepatotoxicidad sería incorporar a países de Latinoamérica en la identificación y caracterización de pacientes con hepatitis tóxica y formar así una amplia red iberoamericana. Esta propuesta permitirá generar un conocimiento fácilmente trasladable a la práctica clínica con importante impacto en la salud pública, al facilitar la toma de decisiones en la evaluación riesgo/beneficio de los medicamentos y productos de herboristería.
Entre la metodología que se debe adoptar siguiendo la estrategia utilizada por el grupo español se tratará de:
- 1.
Identificar los casos de sospecha de hepatotoxicidad y mantenimiento de una base de datos que permita el registro de la información necesaria.
- 2.
Entrevistar a los pacientes y recoger información acerca de la exposición a medicamentos y a otros posibles agentes etiológicos. La metodología de recogida de información de las sospechas de hepatotoxicidad consiste en una entrevista directa con el paciente y no en la mera revisión de historias clínicas, en la cual se realiza una historia medicamentosa exhaustiva detallada para recoger información actualizada y con fechas sobre exposición a medicamentos y a otros posibles agentes etiológicos (productos de herboristería, automedicación). El proceso incluye recomendaciones a los pacientes para evitar nuevos episodios.
- 3.
Analizar los datos para identificar posibles nuevas asociaciones y cuantificar el riesgo. Una vez se envía una sospecha de toxicidad hepática al centro coordinador se analiza la información remitida en el protocolo estructurado que se ha diseñado para ello, se valoran las respuestas emitidas en cada apartado y si está correctamente cumplimentado, se estudia la posible imputación al fármaco más probable, se estudia la posibilidad/sospecha de ser la reacción producto de una interacción farmacológica, se analizan las principales causas hepáticas excluidas y, finalmente, tras la evaluación por 3 expertos independientes si se considera la reacción relacionada con la ingesta de un fármaco(s), se le aplica la escala de CIOMS para asignarle una puntuación numérica que es convertida en una categoría de probabilidad de sospecha de la hepatotoxicidad. Posteriormente los protocolos se introducen en la base de datos generada y son archivados. Las nuevas incidencias son analizadas para identificar posibles señales de alerta, nuevas asociaciones y cuantificar el riesgo.
- 4.
Obtener muestras biológicas de pacientes con hepatitis tóxica para la realización de estudios genéticos y de biomarcadores y avanzar en el mecanismo etiopatogénico del daño tóxico. Formular nuevas hipótesis de trabajo con el fin de responder problemas clínicos relevantes, sin fines comerciales.
- 5.
Realizar un análisis final de toda la información generada y publicación en una revista indexada.
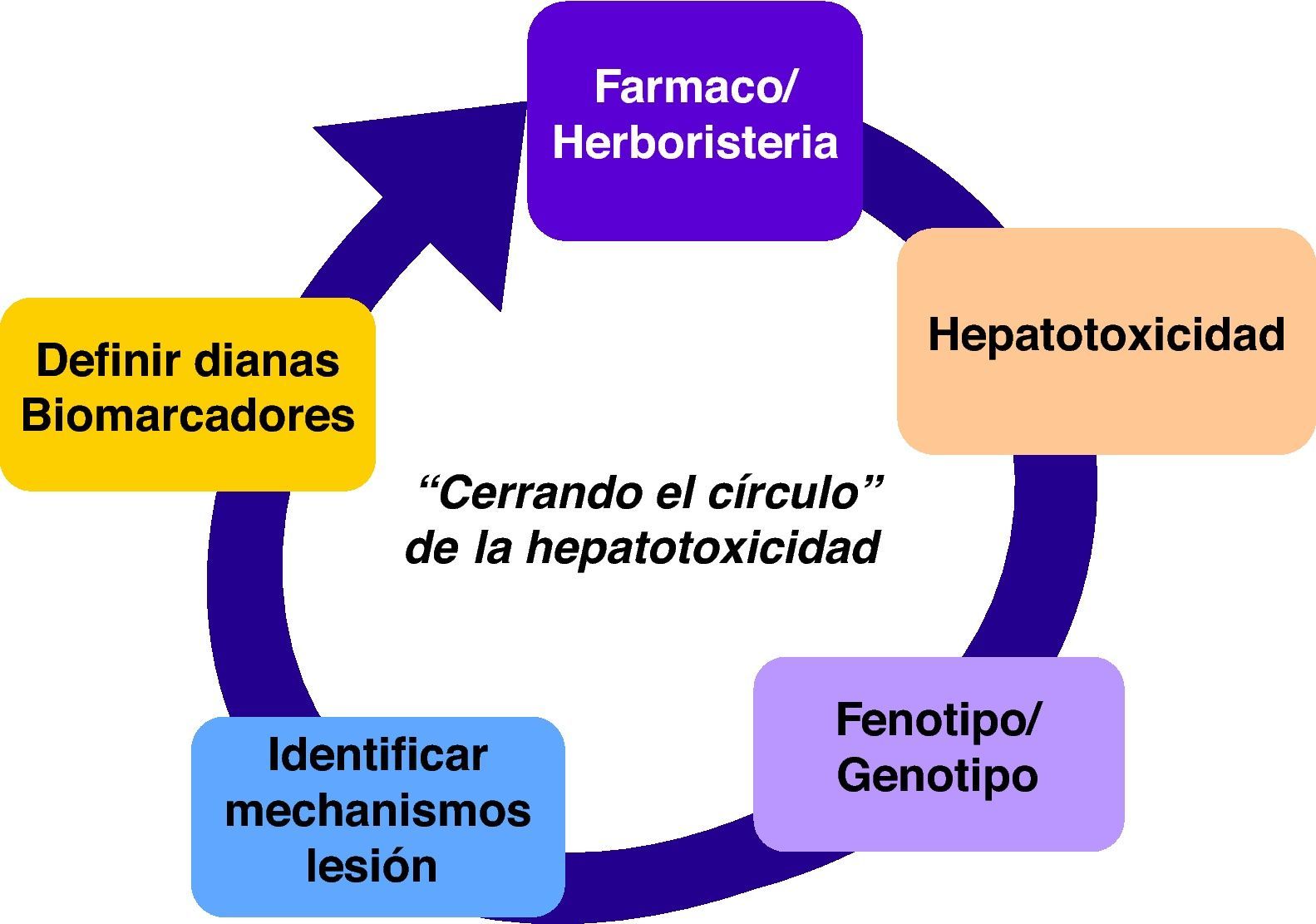
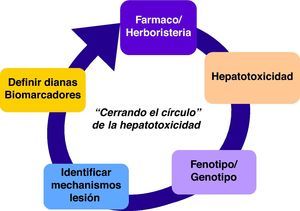
El establecimiento de esta red enfocada en hepatotoxicidad facilitará la adopción de criterios unificados y consensuados que permitirán trabajar de forma colaborativa. Por otra parte, en este proceso complejo de identificar casos de hepatitis tóxica (fig. 1), es fundamental realizar una correcta fenotipificación de los pacientes y la creación de un banco de muestras biológicas. Todo ello hará posible, a medio plazo, caracterizar mejor a los sujetos susceptibles y comprender los mecanismos de lesión para validar biomarcadores específicos, así como definir dianas/estructuras que hagan factible el diseño de fármacos más seguros y una terapéutica individualizada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Quisiéramos expresar nuestro sincero agradecimiento a todas las unidades clínicas que integran el Grupo de Estudio de Hepatopatías asociadas a medicamentos en España y las de Latinoamérica que de forma tan entusiasta y comprometida se están incorporando al proyecto. Además, reconocer el apoyo recibido desde la Agencia Española del Medicamento, la Agencia Española de Cooperación y Desarrollo (AECID) y el International Severe Adverse Events Consortium (presidente A. Holden).