Las recomendaciones del Ministerio de Sanidad español sobre vacunación en grupos de riesgo incluyen a la mesalazina entre los tratamientos con un posible efecto negativo en su efectividad. Sin embargo, esta no es la recomendación de la mayoría de los expertos. Nuestro objetivo fue evaluar el efecto de la mesalazina en la respuesta humoral a la vacuna contra el SARS-CoV-2 en los pacientes con enfermedad inflamatoria intestinal (EII).
MétodosVACOVEII es un estudio español, prospectivo y multicéntrico promovido por GETECCU, que evalúa la efectividad de la vacuna contra el SARS-CoV-2 en los pacientes con EII. En él se incluyen pacientes con EII con vacunación completa y sin infección previa por COVID-19. La seroconversión se fijó en 260 BAU/mL (determinación centralizada) y se evaluó a los seis meses después de la vacunación completa. En este subanálisis se comparan los resultados entre pacientes tratados con mesalazina y sin tratamiento.
ResultadosSe incluyeron un total de 124 pacientes sin terapia inmunosupresora, de los cuales 32 no recibían ningún tratamiento y 92 mesalazina únicamente. Seis meses después de la vacunación completa, no se observan diferencias significativas en las concentraciones medias de IgG anti-S entre ambos grupos. En el análisis multivariable los títulos de anticuerpos se asociaron de forma independiente con el uso de vacunas ARNm y con la infección por SARS-CoV-2.
ConclusiónLa mesalazina no tiene un efecto negativo sobre la respuesta a las vacunas contra el SARS-CoV-2 en los pacientes con EII.
The recommendations of the Spanish Ministry of Health on vaccination in risk groups include mesalazine among the treatments with a possible negative effect on its effectiveness. However, this is not the recommendation of most experts. Our objective was to evaluate the effect of mesalazine on the humoral response to the SARS-CoV-2 vaccine in patients with inflammatory bowel disease (IBD).
MethodsVACOVEII is a Spanish, prospective, multicenter study promoted by GETECCU, which evaluates the effectiveness of the SARS-CoV-2 vaccine in patients with IBD. This study includes IBD patients who have recieved the full vaccination schedule and without previous COVID-19 infection. Seroconversion was set at 260BAU/mL (centralized determination) and was assessed 6 months after full vaccination. In this subanalysis of the study, we compare the effectiveness of the vaccine between patients treated with mesalazine and patients without treatment.
ResultsA total of 124 patients without immunosuppressive therapy were included, of which 32 did not receive any treatment and 92 received only mesalazine. Six months after full vaccination, no significant differences are observed in the mean concentrations of IgG anti-S between both groups. In the multivariate analysis, antibody titers were independently associated with the use of mRNA vaccines and with SARS-CoV-2 infection.
ConclusionMesalazine does not have a negative effect on the response to SARS-CoV-2 vaccines in IBD patients.
La pandemia de la COVID-19, debida al virus SARS-CoV-2, ha provocado más de siete millones de muertes en todo el mundo desde su inicio en diciembre de 2019. El desarrollo de vacunas contra el virus ha sido la mejor arma para controlar la enfermedad, habiendo demostrado ser extremadamente eficaz en la reducción de las tasas de hospitalización y mortalidad1.
La enfermedad inflamatoria intestinal (EII) es una enfermedad crónica inmunomediada que causa lesiones en el tracto digestivo, y que incluye la enfermedad de Crohn (EC), la colitis ulcerosa (CU) y la colitis indeterminada (CI). Para su tratamiento, se utilizan con frecuencia fármacos inmunosupresores (tiopurinas, metotrexato, esteroides, inhibidores de JAK y agentes biológicos, como anti-TNF, vedolizumab y ustekinumab), siendo la vacunación en estos pacientes esencial para prevenir posibles complicaciones infecciosas. Tanto la EII en sí misma como su tratamiento pueden tener un impacto negativo en la efectividad de las vacunas, por lo que a menudo se desarrollan recomendaciones específicas en esta población2,3. Sin embargo, en cuanto a la vacunación contra el SARS-CoV-2 cabe destacar que los pacientes con EII fueron excluidos de la mayoría de los ensayos clínicos de registro de las vacunas, al igual que los pacientes con otras enfermedades inmunomediadas, por lo que los datos sobre la efectividad en esta población son más limitados y obtenidos en estudios posteriores.
Todas las vacunas contra el SARS-CoV-2 que han sido autorizadas por la Agencia Europea del Medicamento hasta el momento, pueden ser utilizadas en los pacientes con EII, independientemente de su estado de inmunosupresión y tratamiento4. Los primeros estudios ya sugerían que la respuesta a estas vacunas puede ser adecuada a corto plazo en pacientes con EII3, aunque con particularidades aún por definir. Su eficacia, medida por la respuesta del título de anticuerpos, parece ser menor en los pacientes que reciben terapia anti-TNF que en los que reciben vedolizumab5–7 u otros inmunosupresores4.
Por otro lado, actualmente se acepta que un nivel de anticuerpos de 260 BAU/mL (según las unidades estándar de la Organización Mundial de la Salud8) es el umbral mínimo para lograr una inmunización efectiva, según los estudios que evalúan la protección después de la vacunación en el ensayo COV0021414, el ensayo COVE9 y otras cohortes10–14. El uso de este punto de corte puede cambiar la interpretación de los resultados obtenidos hasta la fecha. En el estudio VACOVEII, nuestro objetivo principal fue evaluar la respuesta después de la vacunación completa contra el SARS-CoV-2, utilizando el punto de corte de 260 BAU/mL para definir la respuesta, así como para evaluar el impacto de las diferentes terapias inmunosupresoras sobre el mismo.
Algunas recomendaciones nacionales sobre vacunación en pacientes en grupos de riesgo, como aquellos con tratamiento inmunosupresor, como ocurre en los pacientes con EII, y entre ellas las del Ministerio de Sanidad español, incluyen a la mesalazina entre los tratamientos con un posible efecto negativo15. Sin embargo, esta no es ni la opinión ni la recomendación de la mayoría de los expertos16, aunque los datos al respecto son muy limitados. Un objetivo secundario del estudio, cuyos resultados se presentan en este artículo, fue evaluar el efecto de la mesalazina en la respuesta humoral a la vacuna contra la COVID-19 en los pacientes con EII.
MétodosDiseño del estudioVACOVEII es un estudio no intervencionista, prospectivo y multicéntrico cuyo objetivo principal es evaluar la efectividad humoral de la vacunación frente al SARS-CoV-2 en pacientes con EII y el impacto potencial de la terapia inmunosupresora sobre la misma. Este estudio ha sido realizado bajo el auspicio del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU), aprobado por su Comité de Investigación, y ha contado con la participación de trece hospitales españoles.
Se incluyeron pacientes diagnosticados de EII por los criterios habituales, mayores de 18 años, con y sin tratamiento inmunosupresor, que hubieran recibido la pauta completa de vacunación frente al SARS-CoV-2 con cualquiera de las vacunas comercializadas en España. Se consideró un régimen completo según ficha técnica de las diferentes vacunas (dos dosis de la vacuna ChAdOx1 nCoV-19, BNT162b2 o mRNA-1273; y una dosis de la vacuna JNJ-78436735). Se excluyeron los pacientes con infección previa conocida por SARS-CoV-2, demostrada por PCR o serología positiva previa a la vacunación, fueran o no sintomáticos, pero no se excluyeron de los análisis, por razones prácticas, si la infección se adquirió posteriormente. También se excluyó a los pacientes que tuvieran otras causas de inmunodeficiencia, primaria o secundaria (enfermedad neoplásica activa, infección por el virus de la inmunodeficiencia humana, trasplante de órgano sólido, enfermedad hematológica), estuvieran en tratamiento con quimioterapia y/o inmunoterapia o aquellos que hubieran recibido tratamiento inmunosupresor indicado por una razón distinta a la EII, y/o que tomaban cualquier fármaco inmunosupresor/inmunomodulador concomitante no utilizado en la EII. El tratamiento concomitante con corticoides tópicos y orales no fue un criterio de exclusión para el análisis del estudio completo, dado su bajo tamaño muestral.
A todos los pacientes consecutivos que cumplían con los criterios de selección en los 13 centros participantes se les ofreció participar en el estudio. Se incluyeron aquellos que aceptaron participar y firmaron un consentimiento informado y se les realizó una entrevista personal para recoger todas las variables del estudio.
La eficacia de la vacunación se evaluó a los 180 días (± 28 días) después de la vacunación completa. Los pacientes cuya determinación de anticuerpos se realizó fuera del marco de tiempo del protocolo fueron excluidos del análisis. El punto de corte para establecer la seroconversión se estableció en valores de anticuerpos anti-S 260 BAU/mL, de acuerdo con las recomendaciones del Ministerio de Sanidad de España.
VariablesSe recogieron variables demográficas como el sexo, la edad y el tabaquismo. El índice de masa corporal (IMC) se calculó utilizando las medidas de peso y altura obtenidas en la consulta. La comorbilidad se evaluó mediante el índice de Charlson ajustado por edad17. Las variables relacionadas con la EII incluyeron el tipo de enfermedad (enfermedad de Crohn, colitis ulcerosa o colitis indeterminada), su extensión, ubicación y comportamiento, así como su duración. La actividad de la enfermedad se evaluó mediante el índice de Harvey-Bradshaw18 para la enfermedad de Crohn y la puntuación parcial de Mayo19 para la colitis ulcerosa.
En cuanto al tratamiento de la EII, para este subanálisis, se establecieron dos grupos: pacientes sin ningún tratamiento específico para la EII o pacientes en tratamiento exclusivo con mesalazina. Ninguno de los pacientes incluidos en este subanálisis llevaba tratamiento con corticoides.
Todos estos datos se obtuvieron mediante entrevista con el paciente y/o según los registros electrónicos de cada centro participante. En cuanto a la vacunación, el tipo de vacuna (mRNA o no-mRNA), dosis y fecha(s) de administración se recogieron directamente de la historia clínica electrónica de cada centro.
Evaluación de la respuesta inmune humoralEl análisis de la respuesta de anticuerpos inducida por la vacuna contra el SARS-CoV-2 se realizó de forma centralizada en el Servicio de Microbiología Clínica del Hospital Universitario Miguel Servet (Zaragoza, España). Se utilizó LIAISON® SARS-CoV-2 Trimerics IgG (DiaSorin, Saluggia, Italia), un inmunoensayo de quimioluminiscencia indirecta (CLIA) para la detección de anticuerpos IgG anti-espícula (IgG anti-S) del SARS-CoV-2 en muestras de suero y plasma humanos. Los componentes principales de la prueba son partículas magnéticas (fase sólida) recubiertas con proteína de punta de SARS-CoV-2 trimérica recombinante y un reactivo conjugado que contiene un anticuerpo monoclonal de ratón IgG antihumano unido a un derivado de isoluminol. La señal de luz, por lo tanto, la cantidad de conjugado de isoluminol-anticuerpo, se mide mediante un fotomultiplicador como unidades relativas de luz (RLU) y es indicativa de anticuerpos contra el SARS-CoV-2, presentes en calibradores, muestras o controles. La conversión de unidades RLU a unidades BAU y el valor umbral (33,8 unidades BAU) se establecieron de acuerdo con las instrucciones del fabricante.
Además, se analizó en la muestra de todos los pacientes la presencia de infecciones pasadas por SARS-CoV-2 desapercibidas con el ensayo Elecsys Anti-SARS-CoV-2 (Roche Diagnostics, Mannheim, Alemania). Este inmunoensayo de electroquimioluminiscencia (ECLIA) utiliza una proteína recombinante que representa el antígeno de la nucleocápside (N) para la determinación de anticuerpos contra el SARS-CoV-2. Estos anticuerpos están presentes solo en infecciones naturales. Los resultados son determinados automáticamente por el software comparando la señal de electroquimioluminiscencia obtenida del producto de reacción de la muestra con la señal del valor de corte obtenido previamente por calibración, con un valor de umbral> 1 (índice de corte). De este modo, se pudo tener en cuenta en el análisis el impacto de la infección por SARS-CoV-2 durante el seguimiento, evaluando exclusivamente las cifras de anticuerpos y la tasa de seroconversión en los pacientes sin infección.
Recogida de datosLos datos del estudio se recopilaron y gestionaron utilizando La plataforma online de investigación colaborativa AEG-REDCap (de la Asociación Española de Gastroenterología). La Research Electronic Data Capture (REDCap20) es una plataforma de software segura diseñada para respaldar la captura de datos para estudios de investigación, proporcionando: 1) una interfaz intuitiva para la captura de datos validados; 2) pistas de auditoría para el seguimiento de la manipulación de datos y los procedimientos de exportación; 3) procedimientos de exportación automatizados para descargas de datos sin interrupciones a paquetes estadísticos comunes; y 4) procedimientos para la integración de datos e interoperabilidad con fuentes externas.
Análisis estadísticoLas variables continuas se expresaron como media y desviación estándar o mediana y rango intercuartílico, y las variables cualitativas como número total y porcentaje. La comparación de grupos se realizó mediante χ2 para las variables cualitativas y la prueba de la t de Student o la prueba de la U de Mann-Whitney para las variables cualitativas, según la normalidad o no de la muestra. Cuando estaban involucrados más de dos grupos, se utilizó ANOVA de grupos independientes. La normalidad se evaluó mediante la prueba de Kolmogorov-Smirnov. El análisis multivariable se realizó mediante modelos de regresión lineal. El sexo, la edad, el tipo de vacuna, el grupo de tratamiento, la infección por SARS-CoV-2 y el tabaquismo se incluyeron como variables independientes. La edad se trató como una variable lineal y su coeficiente se expresó por año incremental. Todos los análisis se llevaron a cabo considerando todas las demás variables potencialmente confusoras y limitando el análisis a cohortes específicas si fuera necesario.
Todas las pruebas fueron de dos colas con significación establecida en un valor de p de menos de 0,05. Los análisis se realizaron con el software Jamovi, versión 2.3.16 (https://www.jamovi.org. Sídney, Australia).
Dado que los resultados que se muestran en este artículo son los procedentes de un subanálisis realizado sobre el estudio principal VACOVEII, de cara a conocer si el tamaño muestral utilizado era el adecuado, se realizó un cálculo de potencia estadística a posteriori, considerando una proporción entre muestras de 2:1, con un nivel de precisión alfa del 0,05 para detectar una diferencia de 15 puntos porcentuales en la tasa de seroconversión. Con estos parámetros, la potencia obtenida fue de 42%.
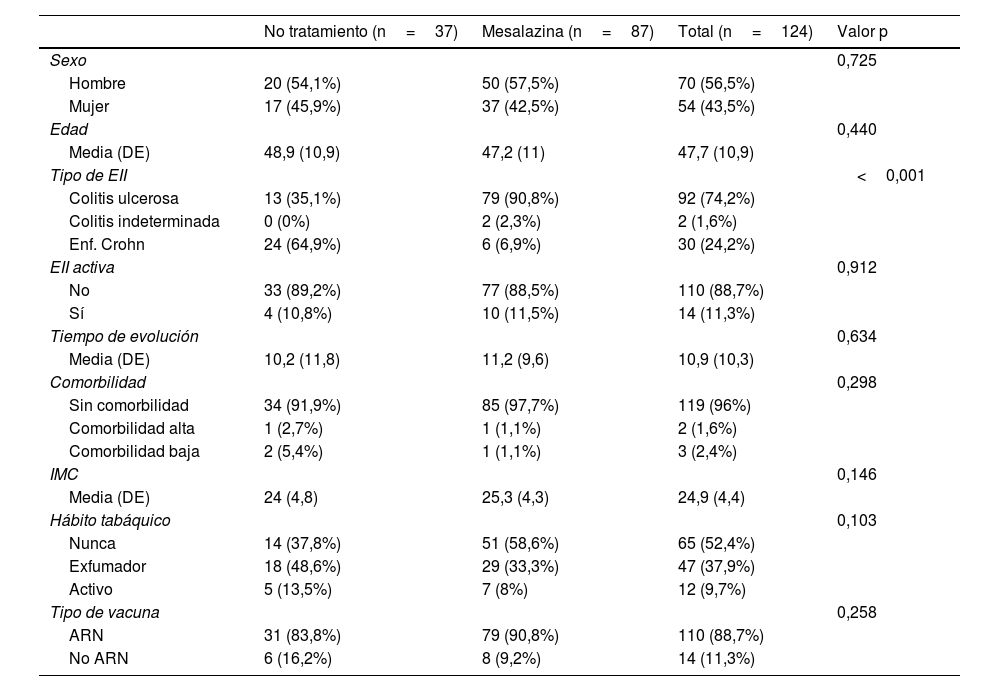
ResultadosCaracterísticas basales de la cohorteSe incluyeron un total de 124 pacientes, de los cuales 32 (25,8%) no recibían ningún tipo de tratamiento para la EII y 92 (74,2%) recibían mesalazina como único tratamiento.
Las características basales de los pacientes en función de su grupo de tratamiento se pueden consultar en la tabla 1.
Características basales de los pacientes en función del grupo de tratamiento
| No tratamiento (n=37) | Mesalazina (n=87) | Total (n=124) | Valor p | |
|---|---|---|---|---|
| Sexo | 0,725 | |||
| Hombre | 20 (54,1%) | 50 (57,5%) | 70 (56,5%) | |
| Mujer | 17 (45,9%) | 37 (42,5%) | 54 (43,5%) | |
| Edad | 0,440 | |||
| Media (DE) | 48,9 (10,9) | 47,2 (11) | 47,7 (10,9) | |
| Tipo de EII | <0,001 | |||
| Colitis ulcerosa | 13 (35,1%) | 79 (90,8%) | 92 (74,2%) | |
| Colitis indeterminada | 0 (0%) | 2 (2,3%) | 2 (1,6%) | |
| Enf. Crohn | 24 (64,9%) | 6 (6,9%) | 30 (24,2%) | |
| EII activa | 0,912 | |||
| No | 33 (89,2%) | 77 (88,5%) | 110 (88,7%) | |
| Sí | 4 (10,8%) | 10 (11,5%) | 14 (11,3%) | |
| Tiempo de evolución | 0,634 | |||
| Media (DE) | 10,2 (11,8) | 11,2 (9,6) | 10,9 (10,3) | |
| Comorbilidad | 0,298 | |||
| Sin comorbilidad | 34 (91,9%) | 85 (97,7%) | 119 (96%) | |
| Comorbilidad alta | 1 (2,7%) | 1 (1,1%) | 2 (1,6%) | |
| Comorbilidad baja | 2 (5,4%) | 1 (1,1%) | 3 (2,4%) | |
| IMC | 0,146 | |||
| Media (DE) | 24 (4,8) | 25,3 (4,3) | 24,9 (4,4) | |
| Hábito tabáquico | 0,103 | |||
| Nunca | 14 (37,8%) | 51 (58,6%) | 65 (52,4%) | |
| Exfumador | 18 (48,6%) | 29 (33,3%) | 47 (37,9%) | |
| Activo | 5 (13,5%) | 7 (8%) | 12 (9,7%) | |
| Tipo de vacuna | 0,258 | |||
| ARN | 31 (83,8%) | 79 (90,8%) | 110 (88,7%) | |
| No ARN | 6 (16,2%) | 8 (9,2%) | 14 (11,3%) |
IMC: índice de masa corporal; DE: desviación estándar; EII: enfermedad inflamatoria intestinal.
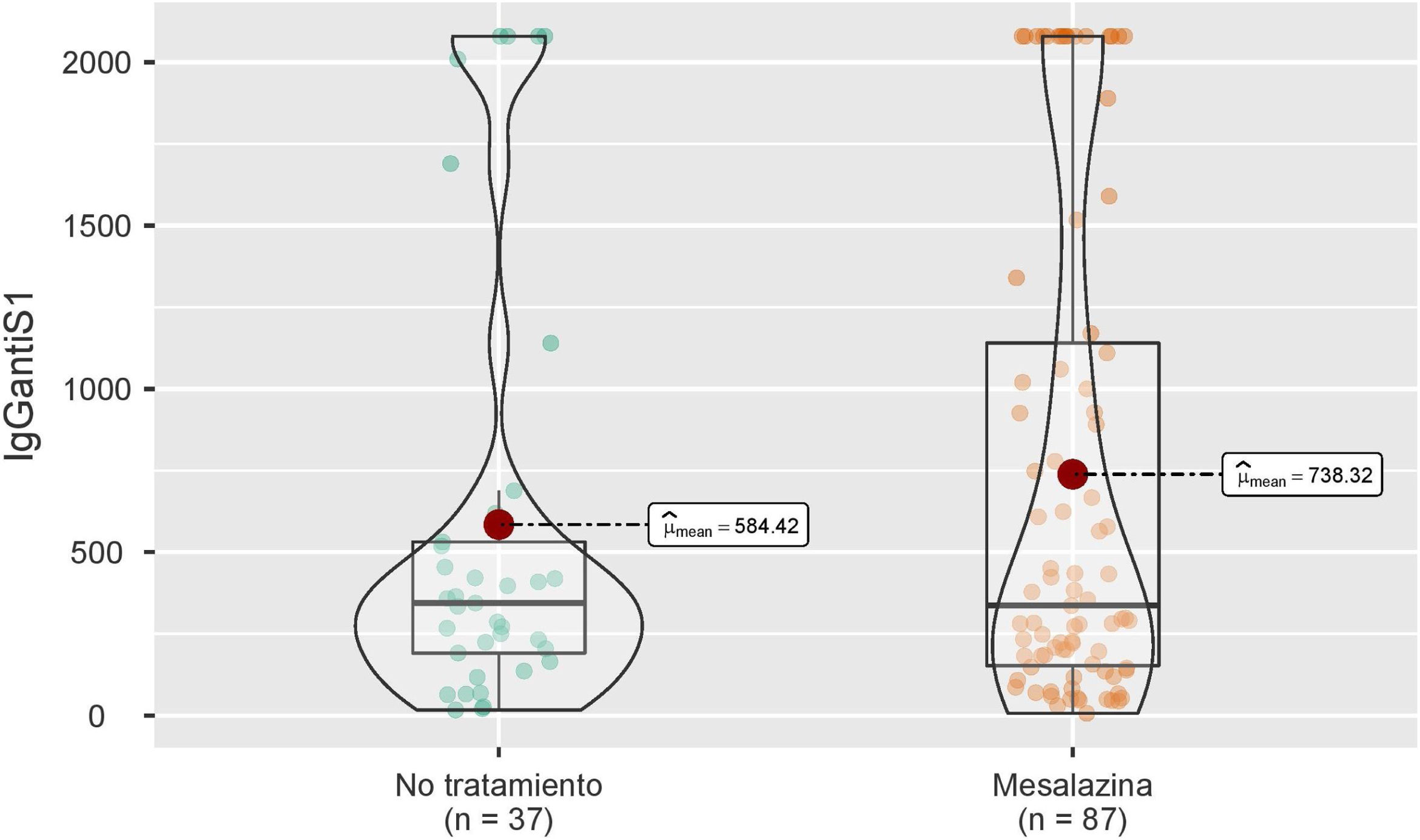
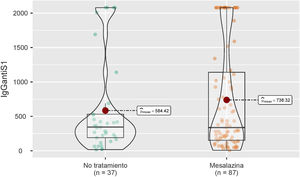
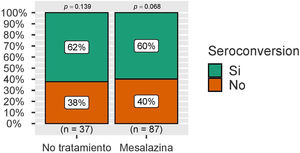
Seis meses después de la vacunación completa, se analizaron las concentraciones medias de IgG anti-S en el grupo de pacientes sin tratamiento y en el grupo de pacientes en tratamiento con mesalazina, sin observarse diferencias estadísticamente significativas entre ambos grupos (344 [191-531] vs. 336 [153-1.140]; p=0,564) (fig. 1).
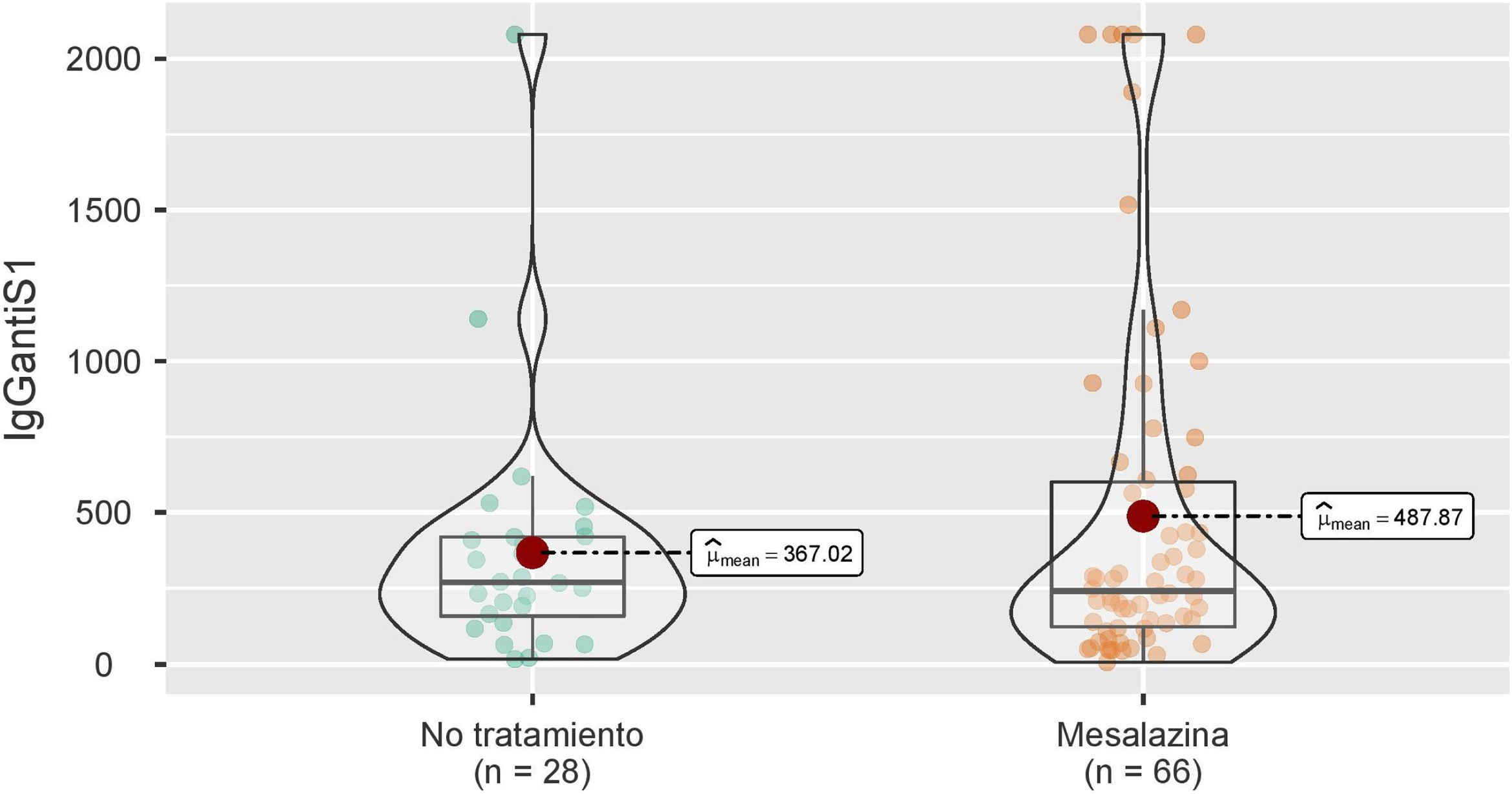
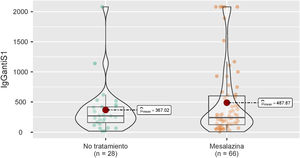
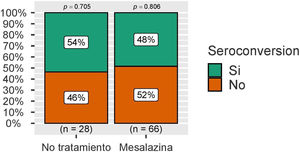
Estas cifras se analizaron también en los pacientes que durante el seguimiento no presentaron infección por COVID-19 (28 del grupo de pacientes sin tratamiento y 66 del grupo de paciente sin mesalazina), con resultados similares (269 [158-420] vs. 241 [123-601]; p=0,944) (fig. 2).
Se recogieron los datos de dosis de mesalazina que recibían los pacientes, sin observarse diferencias. Los pacientes con dosis altas presentaron valores de IgG anti-S de 564 (151-2.080), mientras que los pacientes con dosis bajas tuvieron niveles de IgG anti-S de 378,0 (212,5-1.085,0), siendo esta diferencia no significativa estadísticamente (p=0,525).
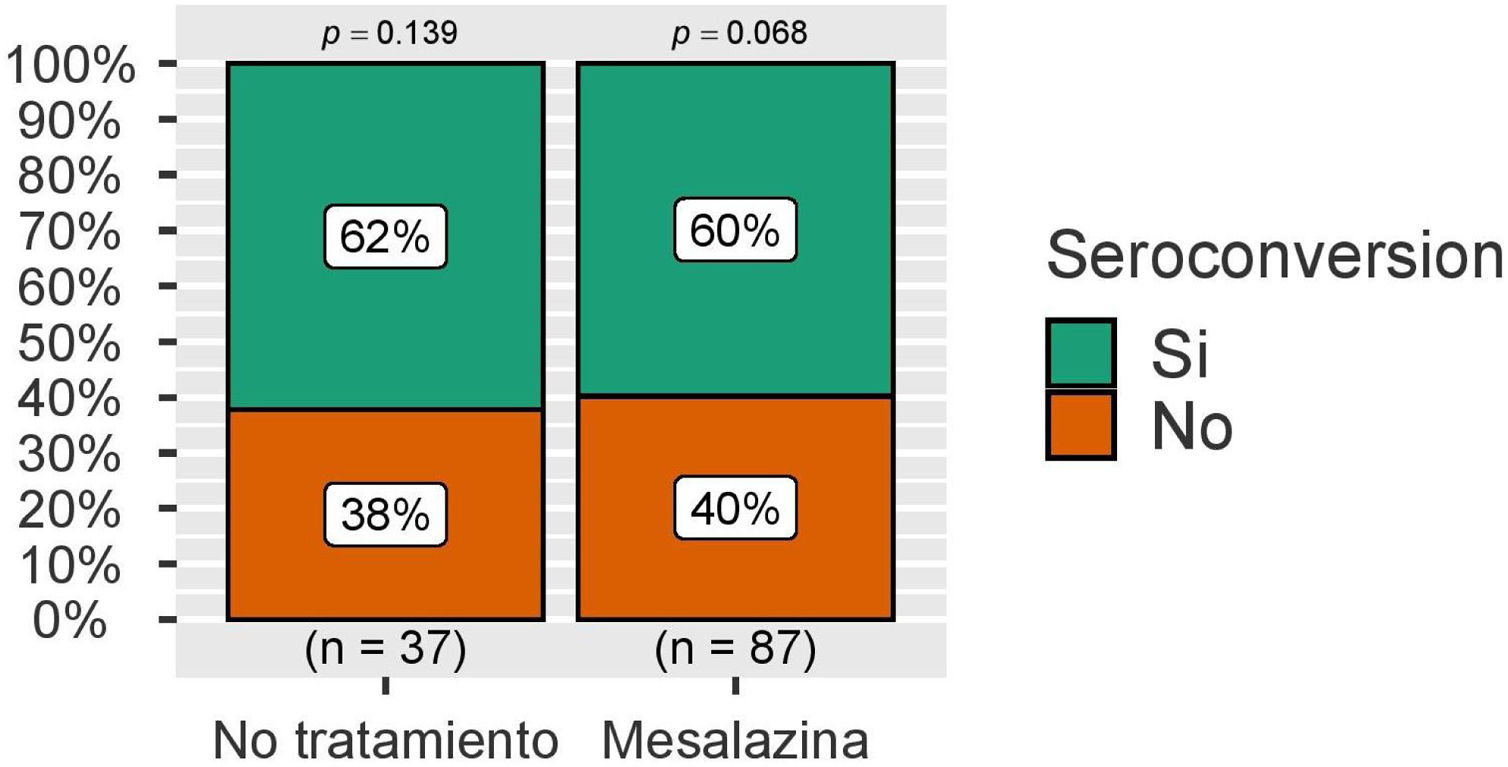
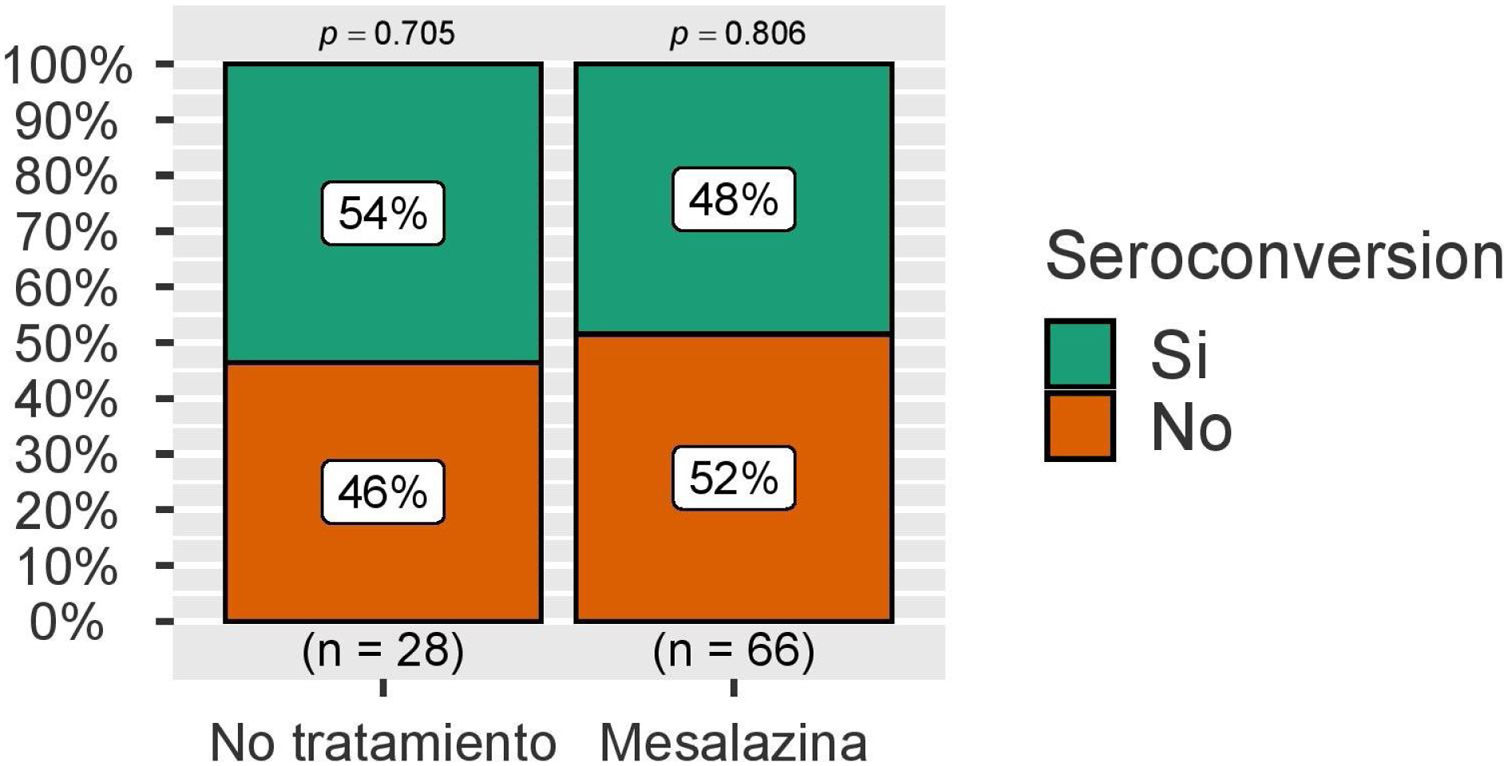
Con respecto a la seroconversión, definida como la presencia de niveles de IgG anti-S superiores a 260 BAU/mL, esta fue superior a 50% en ambos grupos, sin observarse de nuevo diferencias estadísticamente significativas (fig. 3). Estas cifras se analizaron también en el grupo de pacientes sin infección por COVID-19 durante el seguimiento, con resultados similares (fig. 4).
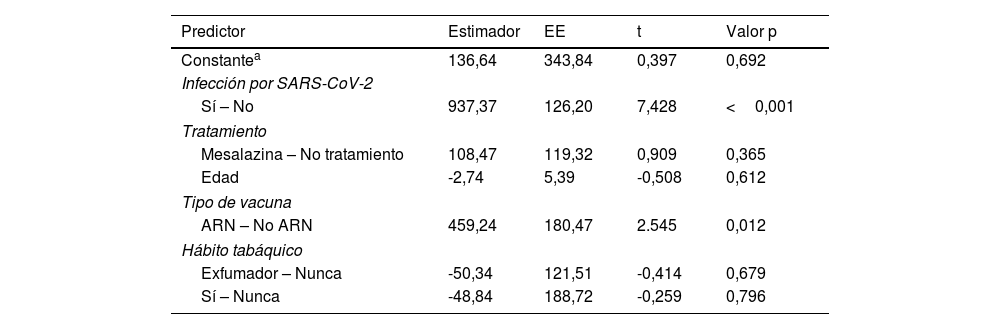
Para evaluar el impacto de las variables relevantes en la tasa de seroconversión se realizó un análisis multivariable, en el que los títulos de anticuerpos se asociaron de forma independiente con el uso de vacunas ARNm y con la infección por SARS-CoV-2, sin evidenciarse una vez más ningún impacto atribuible al tratamiento con mesalazina. Este modelo se muestra en la tabla 2
Modelo de regresión lineal para la variable principal título de anticuerpos IgG anti-S
| Predictor | Estimador | EE | t | Valor p |
|---|---|---|---|---|
| Constantea | 136,64 | 343,84 | 0,397 | 0,692 |
| Infección por SARS-CoV-2 | ||||
| Sí – No | 937,37 | 126,20 | 7,428 | <0,001 |
| Tratamiento | ||||
| Mesalazina – No tratamiento | 108,47 | 119,32 | 0,909 | 0,365 |
| Edad | -2,74 | 5,39 | -0,508 | 0,612 |
| Tipo de vacuna | ||||
| ARN – No ARN | 459,24 | 180,47 | 2.545 | 0,012 |
| Hábito tabáquico | ||||
| Exfumador – Nunca | -50,34 | 121,51 | -0,414 | 0,679 |
| Sí – Nunca | -48,84 | 188,72 | -0,259 | 0,796 |
El uso de terapias inmunosupresoras puede disminuir la respuesta a las vacunas en los pacientes con EII con respecto a la población general, y uno de los ejemplos más claros es la vacunación frente al virus de la hepatitis B, con diversos estudios que han demostrado una menor efectividad de la vacuna en aquellos pacientes en tratamiento con azatioprina y/o infliximab21. Es por ello que se establecen pautas específicas de vacunación en pacientes con tratamiento inmunosupresor, aunque es relevante establecer con exactitud qué consideramos fármacos inmunosupresores. De hecho, en este sentido, el Ministerio de Sanidad incluye a la mesalazina oral entre los fármacos con un potencial efecto inmunosupresor para tener en cuenta a la hora de establecer estrategias de vacunación específicas en estos pacientes15. Sin embargo, esta no es ni la opinión ni la recomendación de los expertos en EII, quienes no consideran la mesalazina como un fármaco inmunosupresor16.
El estudio VACOVEII es uno de los primeros en evaluar prospectivamente la eficacia de las vacunas contra el SARS-CoV-2 en pacientes con EII en la práctica clínica utilizando los valores de seroconversión actualmente recomendados. Los resultados del subanálisis que hemos presentado muestran que el tratamiento con mesalazina no influye negativamente en la respuesta a la vacunación frente al COVID-19. En el análisis por grupo de tratamientos, no se observaron diferencias ni en los niveles de anticuerpos ni en la tasa de seroconversión entre los pacientes sin tratamiento específico para la EII frente a los pacientes en tratamiento con mesalazina. Los títulos de anticuerpos se asociaron de forma independiente y exclusivamente con el uso de las vacunas ARNm y con la infección por SARS-CoV-2. Esto es congruente con los resultados de diferentes estudios previamente publicados al respecto, en los que se identifican como predictores de una mejor respuesta a la vacunación tanto la presencia de infección previa por SARS-CoV-2 como el tipo de vacuna utilizado. A pesar de disponer de escasos datos sobre la comparabilidad de la inmunogenicidad de los diferentes tipos de vacunas entre sí, las vacunas de ARNm se han relacionado repetitivamente con la presencia de títulos de anticuerpos más altos22.
Los resultados presentados son pasados seis meses tras la pauta completa de vacunación, una ventaja con respecto a muchos estudios previos, que analizan la respuesta en tiempos mucho más cortos6. Además, utilizamos como medida de protección y nivel de seroconversión 260 BAU/mL, umbral especialmente relevante para la práctica clínica, ya que algunas administraciones públicas de Salud, como ocurre en España23, lo han adoptado para la toma de decisiones sobre la indicación de algunos medicamentos. Este umbral es superior al establecido en estudios previos, lo que hace que la evaluación de la seroconversión sea mucho más exigente.
Tal y como sugieren algunos estudios ya publicados, la respuesta a las vacunas disponibles podría verse afectada en relación con el uso concomitante de determinados fármacos inmunosupresores5–7, sin embargo, no hay estudios que analicen por separado el posible efecto independiente del uso de la mesalazina.
Las tasas de seroconversión tras la vacunación completa en nuestra cohorte completa son bajas (menos de 50%). Estas tasas son claramente más bajas que en otras series en poblaciones similares, donde se alcanzan tasas superiores a 90%24, lo que subraya la importancia de utilizar el punto de seroconversión de 260 BAU/mL, evidente fortaleza del estudio VACOVEII. Otra fortaleza relevante es el momento en el que se analiza la respuesta. La mayoría de los estudios mencionados anteriormente evalúan la respuesta a un máximo de dos meses después de la administración. Esto es particularmente relevante porque numerosos estudios han demostrado que la pérdida de anticuerpos es constante entre los tres y los seis meses después de la administración de la vacuna25–27. Por lo tanto, una evaluación demasiado temprana puede proporcionar datos falsamente optimistas.
Nuestro estudio tiene algunas limitaciones. En primer lugar, una de las mayores oleadas de contagios en España se produjo durante el periodo de estudio, lo que dificulta el análisis, ya que la inmunidad natural juega un papel clave, si bien se ha tenido en cuenta en el análisis estadístico. Asimismo, la infección por SARS-CoV-2 se ha evaluado como una variable dicotómica, pero la presencia de diferentes variantes durante diferentes oleadas puede haber causado efectos diferenciales en la inmunidad. Por otro lado, la actividad de la enfermedad ha sido evaluada por índices clínicos, pero la actividad endoscópica o biológica no ha sido evaluada.
En conclusión, el tratamiento con mesalazina no mostró ningún efecto negativo en la respuesta a las vacunas contra la COVID-19 en los pacientes con EII, con tasas de seroconversión similares a los pacientes sin tratamiento específico para la EII. La recomendación del Ministerio de Sanidad de incluir a este fármaco dentro del grupo de fármacos inmunosupresores en cuanto a la vacunación en los pacientes con EII debería ser revisada.
Consideraciones éticasTodos los pacientes incluidos en el estudio eran mayores de edad en la fecha de inclusión y dieron su consentimiento informado para su participación. Este estudio fue evaluado y aprobado por el Comité de Investigación de GETECCU y por el Comité de Ética de la Investigación de la Comunidad de Aragón (CEICA) con código de estudio EPA21/028.
FinanciaciónDCD está parcialmente financiada por una beca Río Hortega del Instituto de Salud Carlos III (Beca número CM21/00067). Este estudio ha sido financiado y apoyado por GETECCU.
Conflicto de interesesEl Dr. Casas-Deza ha servido como consultor, ponente o ha recibido financiación de MSD, AbbVie, Pfizer, Kern Pharma, Takeda, Janssen, Ferring y Faes Farma. El Dr. Gisbert ha servido como consultor, ponente o ha recibido financiación de MSD, AbbVie, Pfizer, Kern Pharma, Biogen, Mylan, Takeda, Janssen, Roche, Sandoz, Celgene/Bristol Myers, Gilead/Galapagos, Lilly, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Norgine y Vifor Pharma. El Dr. Barreiro ha servido como consultor, ponente o ha recibido financiación de MSD, AbbVie, Janssen, Kern Pharma, Celltrion, Takeda, Gillead, Celgene, Pfizer, Sandoz, Biogen, Fresenius, Ferring, Faes Farma, Dr. Falk Pharma, Chiesi, Gebro Pharma, Adacyte y Vifor Pharma. El Dr. García-López ha servido como consultor, ponente o ha recibido financiación de AbbVie, Janssen, Kern Pharma, MSD, Pfizer, Takeda, Tillots y Vifor Pharma. La Dra. Calafat ha servido como consultora, ponente o ha recibido financiación de Takeda, Janssen, Gilead, Falk y Pfizer. El Dr. Domènech ha servido como consultor, ponente o ha recibido financiación de AbbVie, Adacyte Therapeutics, Biogen, Celltrion, Galapagos, Gilead, GoodGut, Imidomics, Janssen, Kern Pharma, MSD, Pfizer, Roche, Samsung, Takeda y Tillots. La Dra. Ferreiro ha servido como consultora, ponente o ha recibido financiación de AbbVie, Adacyte Therapeutics, Janssen, Kern Pharma, MSD, Takeda, Tillots, Casen Recordati, Pfizer, Palex, Shire Pharmaceuticals y Ferring. La Dra. Gutiérrez ha servido como consultora, ponente o ha recibido financiación de MSD, AbbVie, Janssen, Kern Pharma,Takeda, Galapagos, Pfizer, Sandoz, Fresenius, Ferring, Faes Farma y Adacyte. La Dra. Chaparro ha servido como consultora, ponente o ha recibido financiación de MSD, Abbvie, Hospira, Pfizer, Takeda, Janssen, Ferring, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Biogen, Gilead y Lilly.