Sr. Director: La flutamida (4 nitro-3 fluormetil-isobutirilamida) es un antiandrógeno no esteroideo que ha demostrado disminuir significativamente la mortalidad asociado a análogos de la hormona luteinizante (LHRH) en el carcinoma de próstata comparado con LHRH más placebo. La hepatotoxicidad en grado grave1 raramente se describe entre sus efectos adversos. Por otro lado, no hay referencias bibliográficas que relacionen el CA 19-9, marcador tumoral de neoplasia pancreática, con la hepatopatía tóxica. En este sentido, presentamos un caso de hepatitis tóxica grave por flutamida con elevación del CA 19-9.
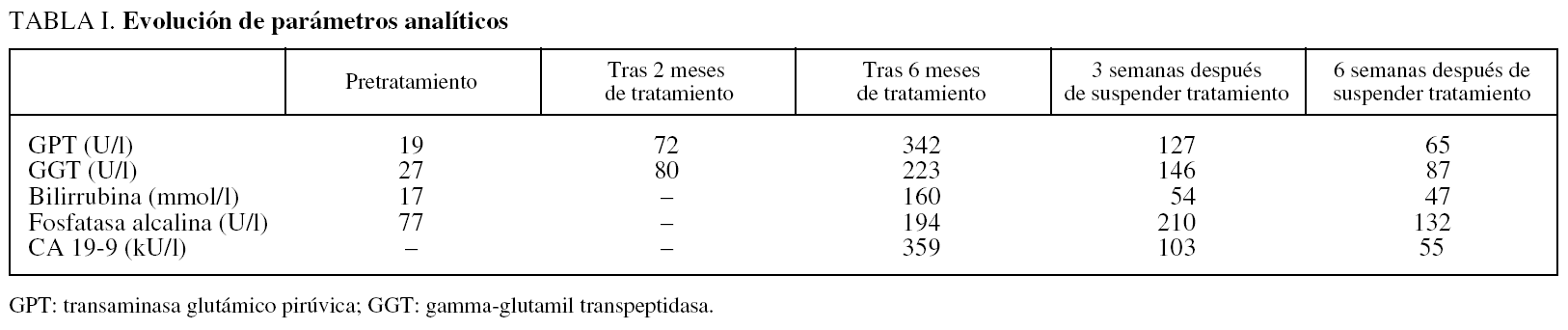
Varón de 91 años con hiperplasia benigna de próstata (HBP) en tratamiento con flutamida, 250 mg/8 h, y triptorelina, 3,75 mg/3 meses. A los 6 meses de iniciar el tratamiento, ingresó por alteración conductual y debilidad progresiva. En la exploración destacó ictericia con coluria, desorientación temporoespacial y asterixis, sin focalidad neurológica ni hepatomegalia o semiología de ascitis. En la analítica se objetivó: transaminasa glutámico oxalacética (GOT) 496 U/l, transaminasa glutámico pirúvica (GPT) 342 U/l, gamma-glutamil transpeptidasa (GGT) 223 U/l, bilirrubina total 160 μmol/l (fracción directa, 125 μmol/l) y amonio 420 μmol/l. Las serologías de hepatitis A, B, C, virus de inmunodeficiencia humana, virus de Epstein-Barr, citomegalovirus y virus herpes simple, así como los estudios inmunológicos (anticuerpos antinucleares, antimitocondriales, antimúsculo liso y antimicrosomales) y los valores de hierro y cobre resultaron normales o negativos. El CA 19-9 fue de 359 kU/l y el resto de los marcadores tumorales normales. La ecografía abdominal, la tomografía computarizada (TC) y la colangiorresonancia magnética también fueron normales. Ante la sospecha de hepatitis tóxica se retiró la flutamida. A los 15 días habían desaparecido ictericia y los signos encefalopáticos. A las 3 semanas los valores eran: GOT 216 U/l, GPT 127 U/l, GGT 146 U/l y bilirrubina total 54 μmol/l. El CA 19-9 había descendido a 103 KU/l. A las 6 semanas todos los parámetros se habían normalizado (tabla I).
El uso de la flutamida se ha extendido a la patología benigna, como la hiperplasia y el adenoma de próstata, el hirsutismo femenino y el acné. Su mecanismo de acción es la inhibición de la captación y/o la unión de esteroides androgénicos en los núcleos de la célula diana. Entre sus efectos adversos destaca la elevación de GOT y/o GPT menor al doble de la normalidad (30%), según Rosenthal et al2. El mecanismo lesional es la inhibición de la respiración mitocondrial. La hepatotoxicidad grave, como ocurrió en nuestro caso, es infrecuente. En la serie de Gómez et al3, de 1.091 enfermos con adenocarcinoma de próstata tratados con flutamida, 250 mg/8 h, se objetivaron marcadores de toxicidad hepática grave en 4 de ellos, y sólo 2 presentaron manifestaciones clínicas.
Por otro lado, valores de CA 19-9 entre 300 y 1.000 U/l o superiores tienen un valor predictivo positivo del 92 al 99% para el cáncer de páncreas4. Valores inferiores al dintel citado se han asociado a patología biliar no tumoral, principalmente a cuadros de colangitis5. Aunque no hemos hallado referencias de su relación con la hepatopatía grave por hepatotoxicidad, existen datos que demuestran su elevación en el fallo hepático agudo6.
Como en nuestro caso, una hepatitis tóxica grave que provoque fallo hepático agudo puede presentar elevaciones significativas del CA 19-9. En enfermos que necesiten un trasplante hepático urgente, la detección de este marcador tumoral no debe suponer retrasos terapéuticos.