En México, en los últimos años, se ha incrementado la prevalencia de sobrepeso y obesidad, condición que favorece el desarrollo de enfermedades crónico-degenerativas. Implementar estrategias para incrementar en la población el consumo diario de vegetales, leguminosas, cereales de grano entero y frutas implicará una ingesta adecuada de fibra soluble, antioxidantes, proteínas de origen vegetal y vitaminas.
ObjetivoEvaluar el efecto de un producto alimenticio comercial elaborado a base de 6 leguminosas sobre determinados parámetros antropométricos y bioquímicos en sujetos sanos.
MétodosEnsayo aleatorizado de intervención dietética, en el que los sujetos del grupo de estudio recibieron durante 3 meses 15g del producto, administrados diariamente en periodos de 5 días con 2 días de descanso. Antes y después de la intervención se realizó una valoración antropométrica y dietética, así como una cuantificación sérica de glucosa, perfil de lípidos, insulina, proteína C reactiva ultrasensible, malondialdehído y resistencia a la insulina (índice HOMA). Se utilizó la prueba U de Mann Whitney y una significación estadística de p<0,05.
ResultadosSe incluyeron 60 estudiantes universitarios (53% hombres). Al término de la intervención, en el grupo de estudio se obtuvo una disminución en los niveles séricos de glucosa (p=0,001), malondialdehído (p=0,001) e índice HOMA (p=0,017), sin cambios significativos en el resto de los parámetros.
ConclusionesLa ingesta diaria de 15g de un producto a base de leguminosas mejoró en el grupo estudiado los niveles séricos de glucosa y malondialdehído, así como la resistencia a la insulina, lo cual podría atribuirse al contenido de polifenoles e isoflavonas como la genisteína, presente en las leguminosas.
Prevalence of overweight and obesity, a condition that promotes development of chronic degenerative diseases, has increased in Mexico in recent years. Implementation of strategies to increase daily consumption of vegetables, legumes, whole grain cereals, and fruits by the population will result in an adequate intake of soluble fiber, antioxidants, protein of vegetable origin, and vitamins.
ObjectiveTo assess the effect of a commercial food product prepared using 6 legumes on some anthropometric and biochemical parameters in apparently healthy subjects.
MethodsA randomized dietary intervention trial where subjects in the study group received for three months 15g of the product, administered daily in periods of five days with two days of rest. Before and after intervention, anthropometric and dietary assessments were performed, and serum glucose, lipid profile, insulin, ultrasensitive C-reactive protein, malondialdehyde (MDA) and insulin resistance (HOMA index) were measured. A Mann-Whitney U test was used and values of P<0.05 were considered statistically significant.
ResultsSixty university students were included in the study (53% males). At the end of the intervention, decreases were seen in serum glucose levels (P=0.001), MDA (P=0.001) and HOMA index (P=0.017), but there were no significant changes in all other parameters.
ConclusionsDaily intake of 15g of the legume-based food product improved serum glucose and malondialdehyde levels in the study group, as well as insulin resistance; which could be attributed to the presence of polyphenols and isoflavones such as genistein in legumes.
La obesidad es el principal factor de riesgo modificable para el desarrollo de enfermedades crónico-degenerativas (ECD), como la diabetes mellitus (DM) y las enfermedades cardiovasculares, las cuales representan las principales causas de mortalidad a nivel mundial, junto con otras complicaciones1,2. En México se ha incrementado la prevalencia de sobrepeso y obesidad pasando de un 61,8% en el año 2000 al 72,5% en 20163. Al analizar por zonas geográficas los resultados de la Encuesta Nacional de Salud 2016 se observa que en el norte del país las cifras fueron mayores a la prevalencia nacional, con un 73,9%3,4.
Existe evidencia de que la nutrición desequilibrada está relacionada con las ECD. En los últimos años, las tendencias de los patrones alimentarios están relacionadas con el incremento en el consumo de comida rápida, abundante en grasa saturada, sodio, proteínas de origen animal, harinas refinadas y azúcar. Asimismo las cantidades también se han incrementado, por ejemplo, la capacidad de los vasos de las bebidas gaseosas se triplicó5. Por otro lado, estos alimentos contienen poca fibra, de ahí que el Acuerdo Nacional para la Salud Alimentaria de México ha considerado, en una de sus estrategias, incrementar el consumo diario de vegetales, leguminosas, cereales de grano entero y frutas, aumentando su disponibilidad y accesibilidad y promoviendo su consumo6,7.
Una forma de atender este problema es la recomendación de incluir en la dieta el consumo de suplementos y productos alimenticios. Estos productos deben contribuir a las necesidades y requerimientos específicos de la población, de tal forma que su ingesta no cause problemas de intolerancia o malabsorción, además de ser fáciles de preparar y aceptados desde el punto de vista sensorial; es decir, que sus atributos tales como el color, el olor, la textura y el sabor sean suficientes para ser consumidos con agrado y con la frecuencia recomendada8.
Un producto alimenticio tiene como objetivo el mejorar el aporte nutricional del individuo para el logro de una buena salud. En el consumo de estos productos intervienen factores tales como la cultura, los hábitos, el entorno físico y la disponibilidad de recursos. Estos productos se agregan a la dieta normal del individuo y pueden estar formulados a base de vitaminas, minerales, fibra, aminoácidos, proteínas, ácidos grasos, hidratos de carbono, antioxidantes, extractos o concentrados de hierbas y alimentos, entre otros, ya sea solos o en distintas combinaciones. Los productos o suplementos alimenticios se pueden encontrar envasados de acuerdo con su presentación, ya sea en forma de tabletas, cápsulas, líquidos o polvos; cabe señalar que no son sustituto de un alimento, ni único componente de una dieta correcta9.
Si bien hay pocos estudios relacionados con los productos alimenticios y su efecto en la salud humana, aquellos que se basan en proteínas vegetales consideran principalmente a la soja, mientras que los estudios con otras leguminosas son escasos. Es importante el desarrollo y evaluación de productos alimenticios que incentiven su consumo y aporten beneficios nutricionales que conduzcan a una dieta más equilibrada y de mejor calidad. El objetivo del presente estudio fue evaluar el efecto de un producto en polvo, a base de 6 leguminosas y elaborado en forma de batido de chocolate sin azúcar añadido, sobre el perfil de lípidos y algunos marcadores bioquímicos vinculados a la obesidad, síndrome metabólico y las ECD en un grupo de individuos adultos sanos. Los marcadores evaluados fueron los niveles séricos de malondialdehído (MDA) como indicador de peroxidación lipídica; proteína C reactiva ultrasensible (PCRus) por ser un mediador de la inflamación e indicador de riesgo coronario; e Índice HOMA (siglas en inglés), el cual estima la resistencia a la insulina en estado de ayuno determinada a través del modelo matemático de valoración homeostática (índice HOMA, por sus siglas en inglés).
Materiales y métodosDiseño del estudioSe trata de un estudio aleatorizado de intervención dietética con un producto alimenticio comercial a base de leguminosas, el cual se llevó a cabo en la Facultad de Medicina de la Universidad Autónoma de Baja California, en la ciudad de Mexicali, Baja California, México.
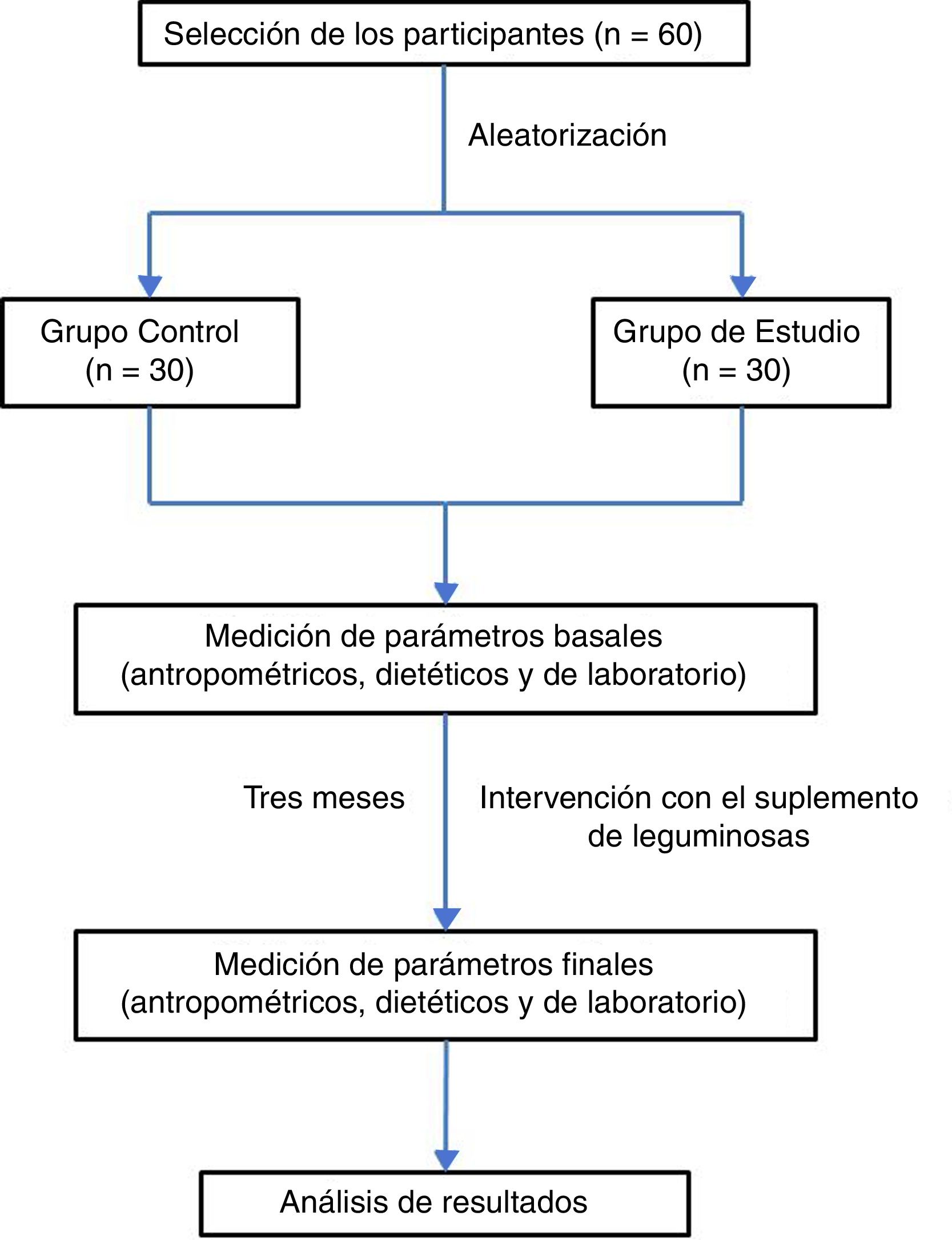
Sujetos de estudioLa muestra estuvo representada por 60 estudiantes del tercer semestre de la carrera de Medicina, de la Facultad de Medicina de la Universidad Autónoma de Baja California, en la ciudad de Mexicali, Baja California, México, siendo incluidos todos los sujetos independientemente de su género, aparentemente sanos, con edades entre 18 y 30 años, y que aceptaron participar en el estudio mediante la firma de su consentimiento informado. Se excluyeron aquellos que estuvieron bajo tratamiento con suplementos vitamínicos, antioxidantes o cualquier tipo de medicamento en los últimos 3 meses previos al inicio del proyecto, así como aquellos que no cumplieron con la valoración antropométrica, dietética y pruebas de laboratorio al inicio y al final del periodo que duró la intervención. Los participantes seleccionados fueron divididos en 2 grupos de 30 personas cada uno (grupo de estudio y grupo control), a través de una aleatorización simple y mediante el programa EpiDat 3.1. El estudio se realizó conforme a los principios éticos expresados en la Declaración de Helsinki y sus respectivas enmiendas.
Producto alimenticio de leguminosasSe trata de un producto comercializado bajo el nombre de Leggu Drik®, elaborado para VD Tecnología Nutricional (VDTEC), una empresa mexicana especializada en la formulación, producción y comercialización de alimentos obtenidos a base de ingeniería alimentaria. El producto está formulado como polvo para elaboración de una bebida con sabor a chocolate, sin azúcar añadido y con base en 6 leguminosas: soja (Glycine max), frijol (Phaseolus vulgaris), garbanzo (Cicer arietinum), lenteja (Lens culinaris), haba (Vicia faba) y alubia (Phaseolus vulgaris), siendo la soja el componente mayoritario en esta formulación. A partir de la información contenida en la etiqueta del producto, cada porción de 15g contiene 247,5kJ (58,5kcal), 1.026g de grasas totales, 0,0g de grasa saturada, 4,7g de hidratos de carbono totales, 0,55g de azúcares (fructosa), 1,5g de fibra total, 7,63g de proteína, 0,0g de sodio y 300mg de vitamina E.
Cuantificación de polifenoles en el producto alimenticio de leguminosasSe determinaron los niveles de polifenoles totales en el producto alimenticio mediante el método de Folin Ciocalteu10 como una estimación de la capacidad antioxidante de este. Se tomaron 3 muestras al azar del producto y cada una de ellas fue cuantificada por triplicado. El contenido de polifenoles totales se expresó como miligramos equivalentes a ácido gálico (AG) por gramo de producto.
IntervenciónEl producto alimenticio de leguminosas se preparó en el momento de su administración a los integrantes del grupo de estudio, adicionando 15g de este a 250ml de agua. La administración se realizó de lunes a viernes durante un periodo de 3 meses, el cual implicó un total de 65 días de administración. Para asegurar una adherencia del 100% a la ingesta del producto este se administró directamente en el aula. Si algún alumno, por alguna razón, no se encontró en el aula en el momento de la administración, se contactó con él por teléfono y se acordó la hora y el lugar para la administración del mismo. Al inicio y al final del periodo de intervención a todos los sujetos participantes en el estudio se les realizó una valoración antropométrica y dietética, y se les extrajo una muestra de sangre venosa para el procesamiento de las pruebas bioquímicas.
Valoración antropométricaEl peso y la estatura se obtuvieron mediante el uso de una báscula con estadiómetro, mientras que la circunferencia de cintura y cadera se determinó mediante una cinta métrica de fibra de vidrio, ambos instrumentos de la marca SECA® (Hamburgo, Alemania). Las mediciones se realizaron utilizando procedimientos estandarizados11. El índice de masa corporal (IMC) se calculó dividiendo el peso en kilogramos entre el cuadrado de la talla en metros.
Valoración dietéticaSe realizó mediante la aplicación de un cuestionario de frecuencia de consumo de alimentos de 7 días, el cual consistió en una lista de 124 alimentos sobre los que se preguntó la frecuencia con la que estos se consumieron durante un periodo de una semana12. Todas las encuestas fueron aplicadas por el responsable de la investigación. Se utilizaron modelos de plástico de tamaño natural de las porciones de alimentos para evitar discrepancias con el tamaño de las porciones. El cuestionario incluyó 124 preguntas integradas por grupos de alimentos. La incorporación de una ración estándar para cada alimento permitió cuantificar el consumo de estos y el de los nutrientes a partir del programa de nutrición ESHA® versión 10,11 (Salem, Oregón, EE. UU.).
Pruebas bioquímicas en sangreTodas las muestras sanguíneas se extrajeron en el laboratorio de análisis clínicos de la Facultad de Medicina de la Universidad Autónoma de Baja California, por punción de la vena antecubital y depositadas en tubos sin anticoagulante. Para la obtención del suero sanguíneo se permitió que la muestra reposara por no más de 30minutos para posteriormente centrifugarla a una velocidad de 4.500 revoluciones por minuto durante 10minutos, utilizando para ello una centrifugadora de tipo clínico IEC (International Equipment Co.). El suero obtenido fue separado y procesado el mismo día. Los participantes se presentaron al laboratorio entre las 7:00 y 8:00horas, con un ayuno mínimo de 12horas, con un buen descanso nocturno (por lo menos 6horas de sueño), una buena hidratación, sin haber practicado alguna actividad física vigorosa los 3 días previos a la punción venosa y sin haber modificado su dieta habitual.
La cuantificación de la concentración sérica de glucosa, colesterol total, triglicéridos y HDL-colesterol (HDL-C) se realizó utilizando reactivos comerciales de química líquida (SPINREACT, S.A., España) y a través de un analizador de química clínica (Erbachem 7, Erba Diagnostics Mannheim GmbH, Alemania). Los niveles de LDL-colesterol (LDL-C) y VLDL-colesterol fueron calculados mediante la fórmula de Frietwald13. La cuantificación sérica de insulina y PCR ultrasensible se realizó mediante ensayos inmunoenzimáticos (Monobind Inc., Lake Forest, CA, EE. UU.), utilizando un lector y lavador de microplatos de la marca Bio Tek (Bio Tek Instruments, Inc. Winooski, VT, EE. UU.). La resistencia a la insulina en estado de ayuno se evaluó a través del índice HOMA14 mediante la fórmula ([insulina (μUI/ml)] ×[glucosa (mmol/l)])/22,5. Se cuantificaron los niveles séricos de MDA como marcador de lipoperoxidación, mediante el método del N-metil-2-fenil-indol15. Para el caso de las determinaciones que precisaron el uso de estuches de reactivos comerciales, estas se realizaron siguiendo las instrucciones del fabricante y de acuerdo con los protocolos de control de calidad interno y externo establecidos en el laboratorio.
Análisis estadísticoLos resultados de las mediciones de las variables consideradas en el estudio no mostraron una distribución normal después de aplicar la prueba de Shapiro Wilk, por lo que dichos resultados se expresaron en términos de la mediana y rangos intercuartílicos. Para analizar diferencias entre grupos, antes y después de la intervención, se utilizó la prueba U de Mann Whitney. La significación estadística se estableció en p<0,05. El análisis se realizó mediante el paquete estadístico para las ciencias sociales SPSS (SPSS Inc., EE. UU.), versión 23.
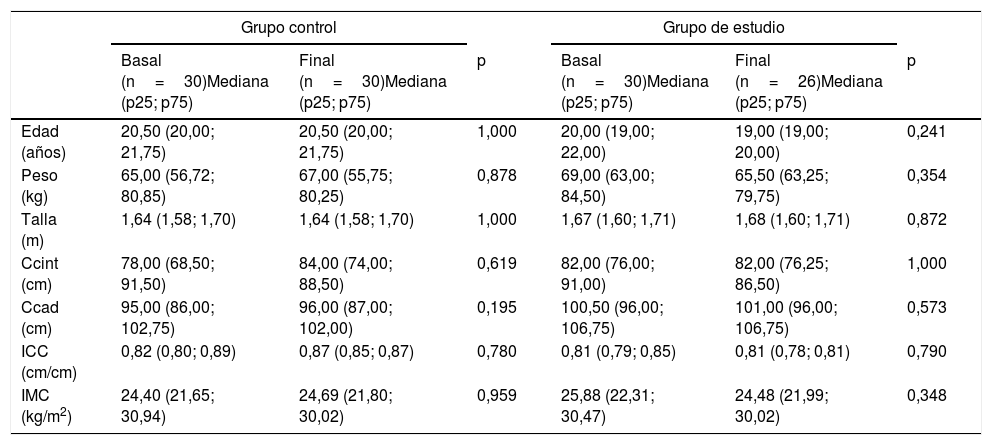
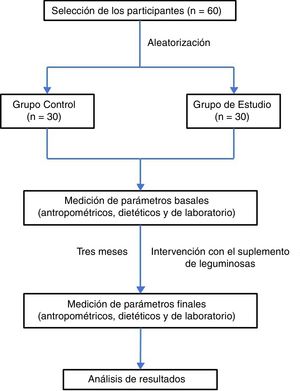
ResultadosEn función de los criterios de selección propuestos se incluyeron en el estudio un total de 60 sujetos, de los cuales el 53% fueron hombres. Esta población fue dividida de manera aleatoria en un grupo control (n=30; 53% hombres) y un grupo de estudio (n=30; 46% hombres). Se eliminaron 4 sujetos debido a que no cumplieron con la valoración antropométrica, dietética y pruebas de laboratorio al final del periodo de 3 meses que duró la intervención (fig. 1). Las características antropométricas de ambos grupos, antes y después de la intervención, se muestran en la tabla 1.
Características antropométricas del grupo control y grupo de estudio antes y después de la intervención
| Grupo control | Grupo de estudio | |||||
|---|---|---|---|---|---|---|
| Basal (n=30)Mediana (p25; p75) | Final (n=30)Mediana (p25; p75) | p | Basal (n=30)Mediana (p25; p75) | Final (n=26)Mediana (p25; p75) | p | |
| Edad (años) | 20,50 (20,00; 21,75) | 20,50 (20,00; 21,75) | 1,000 | 20,00 (19,00; 22,00) | 19,00 (19,00; 20,00) | 0,241 |
| Peso (kg) | 65,00 (56,72; 80,85) | 67,00 (55,75; 80,25) | 0,878 | 69,00 (63,00; 84,50) | 65,50 (63,25; 79,75) | 0,354 |
| Talla (m) | 1,64 (1,58; 1,70) | 1,64 (1,58; 1,70) | 1,000 | 1,67 (1,60; 1,71) | 1,68 (1,60; 1,71) | 0,872 |
| Ccint (cm) | 78,00 (68,50; 91,50) | 84,00 (74,00; 88,50) | 0,619 | 82,00 (76,00; 91,00) | 82,00 (76,25; 86,50) | 1,000 |
| Ccad (cm) | 95,00 (86,00; 102,75) | 96,00 (87,00; 102,00) | 0,195 | 100,50 (96,00; 106,75) | 101,00 (96,00; 106,75) | 0,573 |
| ICC (cm/cm) | 0,82 (0,80; 0,89) | 0,87 (0,85; 0,87) | 0,780 | 0,81 (0,79; 0,85) | 0,81 (0,78; 0,81) | 0,790 |
| IMC (kg/m2) | 24,40 (21,65; 30,94) | 24,69 (21,80; 30,02) | 0,959 | 25,88 (22,31; 30,47) | 24,48 (21,99; 30,02) | 0,348 |
ICC: índice cintura:cadera; IMC: índice de masa corporal.
El valor de p resulta de comparar los niveles basales y finales en el grupo de estudio y en el grupo control. Se utilizó la prueba U de Mann Whitney. La significación estadística se estableció en p<0,05.
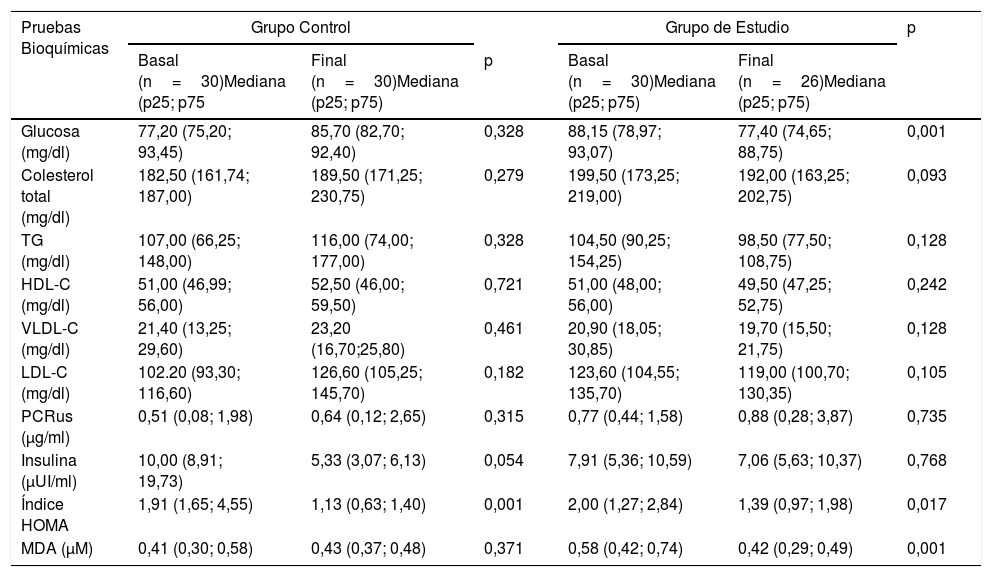
Los resultados de las pruebas bioquímicas se muestran en la tabla 2, en la que se observa que en el grupo de estudio se obtuvo una disminución significativa al término de la intervención en los niveles de MDA (p=0,001), glucosa (p=0,001) e índice HOMA (p=0,017), sin cambios significativos en el resto de los parámetros sanguíneos. Sin embargo, se puede observar una disminución en los niveles séricos de colesterol total y LDL-C sin significación estadística (p=0,092 y p=0,105, respectivamente). En este mismo grupo la concentración sérica de glucosa presentó una reducción de casi 10mg/dl al final de la intervención.
Resultados de las pruebas bioquímicas antes y después de la intervención
| Pruebas Bioquímicas | Grupo Control | Grupo de Estudio | p | |||
|---|---|---|---|---|---|---|
| Basal (n=30)Mediana (p25; p75 | Final (n=30)Mediana (p25; p75) | p | Basal (n=30)Mediana (p25; p75) | Final (n=26)Mediana (p25; p75) | ||
| Glucosa (mg/dl) | 77,20 (75,20; 93,45) | 85,70 (82,70; 92,40) | 0,328 | 88,15 (78,97; 93,07) | 77,40 (74,65; 88,75) | 0,001 |
| Colesterol total (mg/dl) | 182,50 (161,74; 187,00) | 189,50 (171,25; 230,75) | 0,279 | 199,50 (173,25; 219,00) | 192,00 (163,25; 202,75) | 0,093 |
| TG (mg/dl) | 107,00 (66,25; 148,00) | 116,00 (74,00; 177,00) | 0,328 | 104,50 (90,25; 154,25) | 98,50 (77,50; 108,75) | 0,128 |
| HDL-C (mg/dl) | 51,00 (46,99; 56,00) | 52,50 (46,00; 59,50) | 0,721 | 51,00 (48,00; 56,00) | 49,50 (47,25; 52,75) | 0,242 |
| VLDL-C (mg/dl) | 21,40 (13,25; 29,60) | 23,20 (16,70;25,80) | 0,461 | 20,90 (18,05; 30,85) | 19,70 (15,50; 21,75) | 0,128 |
| LDL-C (mg/dl) | 102.20 (93,30; 116,60) | 126,60 (105,25; 145,70) | 0,182 | 123,60 (104,55; 135,70) | 119,00 (100,70; 130,35) | 0,105 |
| PCRus (μg/ml) | 0,51 (0,08; 1,98) | 0,64 (0,12; 2,65) | 0,315 | 0,77 (0,44; 1,58) | 0,88 (0,28; 3,87) | 0,735 |
| Insulina (μUI/ml) | 10,00 (8,91; 19,73) | 5,33 (3,07; 6,13) | 0,054 | 7,91 (5,36; 10,59) | 7,06 (5,63; 10,37) | 0,768 |
| Índice HOMA | 1,91 (1,65; 4,55) | 1,13 (0,63; 1,40) | 0,001 | 2,00 (1,27; 2,84) | 1,39 (0,97; 1,98) | 0,017 |
| MDA (μM) | 0,41 (0,30; 0,58) | 0,43 (0,37; 0,48) | 0,371 | 0,58 (0,42; 0,74) | 0,42 (0,29; 0,49) | 0,001 |
HDL-C: colesterol ligado a lipoproteínas de alta densidad; HOMA: modelo matemático de valoración homeostática para evaluar la resistencia a la insulina; LDL-C: colesterol ligado a lipoproteínas de baja densidad; MDA: malondialdehído; PCRus: proteína C reactiva ultrasensible; TG: triglicéridos; VLDL-C: colesterol ligado a lipoproteínas de muy baja densidad.
El valor de p resulta de comparar los niveles basales y finales en el grupo de estudio y en el grupo control. Se utilizó la prueba U de Mann Whitney. La significación estadística se estableció en p<0,05.
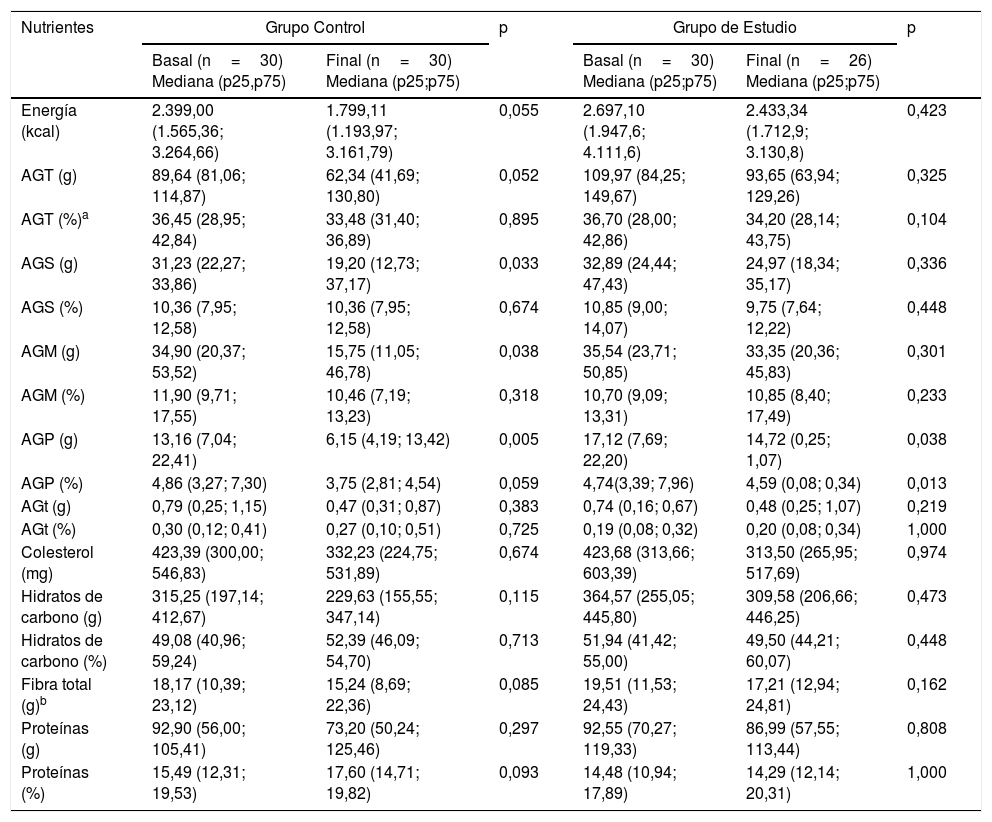
La dieta de los participantes se observó sin variación significativa al término del estudio, sin embargo, los datos más relevantes fueron la ingesta de ácigos grasos totales, la cual fue mayor a la recomendación de 2 a 30% por día; así como la ingesta de fibra total, la cual resultó inferior a la recomendación de 27 a 40g diarios de la Organización Mundial de la Salud (OMS)16, y a los 25 a 35g diarios sugeridos por la American Dietetic Association17. Los datos se presentan en la tabla 3.
Distribución de la ingesta de nutrientes en el grupo control y grupo de estudio antes y después de la intervención
| Nutrientes | Grupo Control | p | Grupo de Estudio | p | ||
|---|---|---|---|---|---|---|
| Basal (n=30) Mediana (p25,p75) | Final (n=30) Mediana (p25;p75) | Basal (n=30) Mediana (p25;p75) | Final (n=26) Mediana (p25;p75) | |||
| Energía (kcal) | 2.399,00 (1.565,36; 3.264,66) | 1.799,11 (1.193,97; 3.161,79) | 0,055 | 2.697,10 (1.947,6; 4.111,6) | 2.433,34 (1.712,9; 3.130,8) | 0,423 |
| AGT (g) | 89,64 (81,06; 114,87) | 62,34 (41,69; 130,80) | 0,052 | 109,97 (84,25; 149,67) | 93,65 (63,94; 129,26) | 0,325 |
| AGT (%)a | 36,45 (28,95; 42,84) | 33,48 (31,40; 36,89) | 0,895 | 36,70 (28,00; 42,86) | 34,20 (28,14; 43,75) | 0,104 |
| AGS (g) | 31,23 (22,27; 33,86) | 19,20 (12,73; 37,17) | 0,033 | 32,89 (24,44; 47,43) | 24,97 (18,34; 35,17) | 0,336 |
| AGS (%) | 10,36 (7,95; 12,58) | 10,36 (7,95; 12,58) | 0,674 | 10,85 (9,00; 14,07) | 9,75 (7,64; 12,22) | 0,448 |
| AGM (g) | 34,90 (20,37; 53,52) | 15,75 (11,05; 46,78) | 0,038 | 35,54 (23,71; 50,85) | 33,35 (20,36; 45,83) | 0,301 |
| AGM (%) | 11,90 (9,71; 17,55) | 10,46 (7,19; 13,23) | 0,318 | 10,70 (9,09; 13,31) | 10,85 (8,40; 17,49) | 0,233 |
| AGP (g) | 13,16 (7,04; 22,41) | 6,15 (4,19; 13,42) | 0,005 | 17,12 (7,69; 22,20) | 14,72 (0,25; 1,07) | 0,038 |
| AGP (%) | 4,86 (3,27; 7,30) | 3,75 (2,81; 4,54) | 0,059 | 4,74(3,39; 7,96) | 4,59 (0,08; 0,34) | 0,013 |
| AGt (g) | 0,79 (0,25; 1,15) | 0,47 (0,31; 0,87) | 0,383 | 0,74 (0,16; 0,67) | 0,48 (0,25; 1,07) | 0,219 |
| AGt (%) | 0,30 (0,12; 0,41) | 0,27 (0,10; 0,51) | 0,725 | 0,19 (0,08; 0,32) | 0,20 (0,08; 0,34) | 1,000 |
| Colesterol (mg) | 423,39 (300,00; 546,83) | 332,23 (224,75; 531,89) | 0,674 | 423,68 (313,66; 603,39) | 313,50 (265,95; 517,69) | 0,974 |
| Hidratos de carbono (g) | 315,25 (197,14; 412,67) | 229,63 (155,55; 347,14) | 0,115 | 364,57 (255,05; 445,80) | 309,58 (206,66; 446,25) | 0,473 |
| Hidratos de carbono (%) | 49,08 (40,96; 59,24) | 52,39 (46,09; 54,70) | 0,713 | 51,94 (41,42; 55,00) | 49,50 (44,21; 60,07) | 0,448 |
| Fibra total (g)b | 18,17 (10,39; 23,12) | 15,24 (8,69; 22,36) | 0,085 | 19,51 (11,53; 24,43) | 17,21 (12,94; 24,81) | 0,162 |
| Proteínas (g) | 92,90 (56,00; 105,41) | 73,20 (50,24; 125,46) | 0,297 | 92,55 (70,27; 119,33) | 86,99 (57,55; 113,44) | 0,808 |
| Proteínas (%) | 15,49 (12,31; 19,53) | 17,60 (14,71; 19,82) | 0,093 | 14,48 (10,94; 17,89) | 14,29 (12,14; 20,31) | 1,000 |
AGM: ácidos grasos monoinsaturados; AGS: ácidos grasos saturados; AGP: ácidos grasos poliinsaturados; AGT: ácidos grasos totales, AGt: ácidos grasos trans.
Los valores de p resultan al comparar los niveles basales y finales en el grupo de estudio y en el grupo control. Se utilizó la prueba U de Mann Whitney. La significación estadística se estableció en p<0,05.
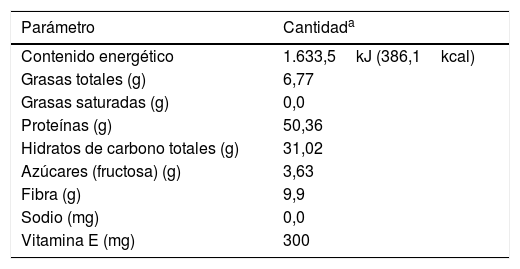
El producto alimenticio que se evaluó en este trabajo presenta una etiqueta con información nutricional en la que se indica que está constituido por los siguientes ingredientes: leguminosas en polvo (soja —Glycine max—, frijol —Phaseolus vulgaris—, garbanzo —Cicer arietinum—, lenteja —Lens culinaris—, haba —Vicia faba— y alubia —Phaseolus vulgaris—), fibra vegetal, fructosa, cocoa, goma guar, carboximetilcelulosa, goma xantana, canela, dióxido de silicio, lecitina, acetato de vitamina E, sucralosa y etilvainillina. En la tabla 4 se muestra la información nutricional contenida en la etiqueta del producto. Se puede observar que el contenido de proteínas e hidratos de carbono totales corresponde a un poco más del 80% p/p del producto, mientras que el contenido de fibra alcanza prácticamente un 10% p/p.
Información nutricional contenida en la etiqueta del producto alimenticio
| Parámetro | Cantidada |
|---|---|
| Contenido energético | 1.633,5kJ (386,1kcal) |
| Grasas totales (g) | 6,77 |
| Grasas saturadas (g) | 0,0 |
| Proteínas (g) | 50,36 |
| Hidratos de carbono totales (g) | 31,02 |
| Azúcares (fructosa) (g) | 3,63 |
| Fibra (g) | 9,9 |
| Sodio (mg) | 0,0 |
| Vitamina E (mg) | 300 |
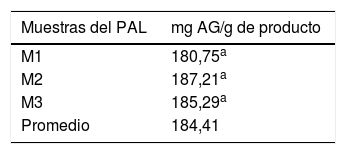
El contenido de polifenoles totales en cada una de las 3 muestras tomadas al azar del producto alimenticio se muestra en la tabla 5, donde se observa que el promedio de estas mediciones fue de 184,41mg equivalentes a ácido gálico/g de producto.
DiscusiónEn los últimos años diversos estudios han reportado una disminución en los valores de glucosa en sangre por la ingesta de leguminosas o de fibra dietética, lo cual concuerda con lo encontrado en la presente investigación. Entre estos estudios cabe mencionar el trabajo publicado por Simpson et al., quienes encontraron que una dieta alta en hidratos de carbono y fibra viscosa de leguminosas puede mejorar el control glucémico en pacientes diabéticos, tanto tipo 1 como tipo 218. Por su parte, Yao et al. encontraron que la ingesta de fibra disminuye el riesgo de desarrollar DM tipo 2 (DMT2). Proponen que el consumo de al menos 25g de fibra dietética al día podría tener efectos preventivos para el desarrollo de DMT219. Chandalia et al. demostraron que el consumo de una dieta con contenido elevado de fibra promueve el control glucémico, disminuyendo el estado de hiperinsulinemia, además de favorecer un descenso en las concentraciones plasmáticas de lípidos en pacientes con DMT220. Asimismo, Agrawal y Ebrahim informaron en 2013 de que la ingesta diaria o semanal de leguminosas se asocia de forma inversa con la presencia de diabetes en una población de la India. Como ellos mismos refieren en su informe, se requiere más investigación epidemiológica para confirmar dicha asociación21. Otros estudios en la misma línea han relacionado la ingesta de leguminosas con un menor riesgo de desarrollo de diabetes22–26.
En relación con la dieta de los participantes durante la intervención se demostró que no hubo diferencia significativa en la ingesta de nutrientes antes y después de la intervención (tabla 3). Cabe señalar que en el grupo control se obtuvo una disminución en la ingesta calórica de 600kcal al final del estudio, sin embargo, esta disminución solo mostró una tendencia a la significación estadística (p=0,055), en contraste con lo sucedido en el grupo de estudio (p=0,44). En relación con la falta de correspondencia observada en la ingesta calórica del grupo control, creemos que pudieron haber influido 2 aspectos, por un lado, dicho grupo no tuvo ningún tipo de limitación en la ingesta durante el estudio, y por otro lado, la investigación concluyó a finales del ciclo escolar, y al tratarse de estudiantes de una carrera tan exigente como la de medicina, muy probablemente los integrantes del grupo control sintieron una mayor presión como consecuencia de los exámenes finales, lo que pudo haber repercutido en su ingesta calórica. Es importante destacar que en el análisis de frecuencia de consumo de alimentos no se incluyó la ingesta de los nutrientes procedentes del producto alimenticio en estudio, por lo que la disminución significativa de los niveles de glucosa sanguínea e índice HOMA que se obtuvo al final de la intervención pudiera explicarse, al menos en parte, por la ingesta de fibra soluble, la cual es abundante en las leguminosas21.
En relación con el efecto de la ingesta de leguminosas sobre los niveles plasmáticos de colesterol total, LDL-C, triglicéridos y HDL-C, diversos trabajos sugieren que el consumo de estas, como parte de la dieta normal, tiene efectos benéficos en el perfil de lípidos, no solo en la diabetes, sino en el síndrome metabólico y en las enfermedades cardiovasculares26. Estos efectos beneficiosos consisten en una reducción en los niveles de colesterol total, LDL-C y triglicéridos27, así como un incremento en los niveles de HDL-C28, lo cual no se demostró en el presente estudio. En contraste con esta información y en concordancia con los hallazgos obtenidos, Mackay y Ball no encontraron cambios en las concentraciones plasmáticas de colesterol total y LDL-C en sujetos hipercolesterolémicos sometidos a una dieta rica en frijoles blancos y otras leguminosas29. Sin embargo, en este estudio el grupo tratado con el producto alimenticio mostró una tendencia a la disminución en la concentración sérica de LDL-C al pasar de 123,6mg/dl a 119,0mg/dl al término de la intervención, sin significación estadística (p=0,105).
Por otro lado, y en relación con la pérdida del balance entre las especies antioxidantes y las oxidantes presentes de manera sistémica en un organismo, fenómeno denominado estrés oxidativo (EO), hoy en día se acepta que es el responsable de un incremento en los procesos no deseables que ocurren en macromoléculas como las proteínas, los lípidos y el ADN. El EO está asociado a un gran número de enfermedades particularmente de tipo crónico-degenerativas como la DMT2, enfermedad de Parkinson, hipertensión arterial, enfermedad de Alzheimer y aterosclerosis, por mencionar algunas. En unos casos el EO se ha identificado como el agente causal de la enfermedad y en otros como una consecuencia de esta30. En los últimos años diversos estudios han demostrado que el consumo de frutas y hortalizas puede reducir la morbimortalidad por estas enfermedades, lo que se explica por su alto contenido de polifenoles y por su efecto protector como antioxidantes31,32.
Los polifenoles, particularmente los flavonoides y los ácidos fenólicos, destacan por su amplia distribución en alimentos de alto consumo humano como los frutos, las hortalizas y las leguminosas, así como por sus propiedades fuertemente antioxidantes22,31,33. Asimismo, y principalmente en la soja, se han identificado diversas isoflavonas que muestran un importante efecto inhibitorio sobre la alfa-glucosidasa. Entre estas isoflavonas podemos mencionar la genisteína, daidzeína y gliciteína, las cuales ejercen su efecto de una manera dosis-dependiente, siendo la genisteína la que muestra el mayor efecto inhibitorio34. Esta isoflavona ha sido identificada también en el frijol y en la lenteja, y ha sido implicada en la mejora de la homeostasis de la glucosa, tal como lo demostraron Squadrito et al.35, quienes en un estudio aleatorizado, doble ciego y controlado, en el que administraron 54mg diarios de genistina (el glucósido de la genisteína) durante un año a 60 mujeres posmenopáusicas con síndrome metabólico, encontraron una disminución significativa en el índice HOMA al término de la intervención, lo que concuerda con lo obtenido en el grupo de estudio del presente trabajo, a pesar de las diferencias en el diseño de los estudios.
En este mismo sentido, cabe señalar que en el grupo control también se obtuvo una disminución significativa en el índice HOMA (tabla 2); sin embargo, debemos precisar que en este grupo 4 sujetos presentaron niveles basales de insulina superiores a 20μUI/ml, de los cuales 3 tuvieron un IMC basal entre 30 y 32kg/m2, lo que nos hace suponer que estos sujetos cursaban con resistencia a la insulina. Si se recalculan las medianas de los índices HOMA antes y después de la intervención, sin tomar en cuenta los datos de estos 4 sujetos, se obtienen medianas de 2,03 y 1,01 respectivamente, que al ser comparadas con la prueba U de Mann Whitney nos arroja un valor de p=0,08.
La actividad inhibitoria sobre la alfa-glucosidasa y alfa-amilasa de extractos fitoquímicos de isoflavonas y sojasaponinas, así como su efecto hipoglucémico en DM, se ha demostrado en distintos estudios con modelos animales y con diversos diseños36–38. Por otro lado, se ha encontrado que el D-pinitol, un derivado del inositol purificado a partir de la soja, pude ser útil en el control del incremento posprandial de la glucosa sanguínea en pacientes con DMT239.
En relación con las propiedades antioxidantes del producto estudiado, la cuantificación de polifenoles totales en este por el método de Folin-Ciocalteu dio un resultado promedio de 184,06±5,46mg equivalentes a AG por gramo de producto. Basándonos en este resultado, y de acuerdo con la ingesta diaria recomendada para este producto (15g/día), los sujetos del grupo de estudio ingirieron una cantidad total de polifenoles de 2.760mg/día equivalentes a AG durante el tiempo que duró la intervención. Esto puede explicar nuestros hallazgos en relación con la disminución significativa en los niveles séricos de MDA al finalizar la intervención.
Si bien existe poca información sobre la ingesta de compuestos fenólicos procedentes de los alimentos, algunos investigadores señalan que el aporte de polifenoles en la dieta de algunas poblaciones puede estar entre 50 y 800mg/día, dependiendo del consumo de productos que los contienen40. Sin embargo, en un estudio realizado en una población de EE. UU. encontraron que la ingesta de polifenoles fue de 1.000mg/día41, lo que puede lograrse con una dieta rica en frutas, hortalizas y leguminosas, o con suplementos que aporten dicha cantidad. Es importante mencionar que también se suman a esta ingesta total de polifenoles el consumo de otros productos con buen contenido de estos como los cereales, el té, el vino y el café. En este sentido, y tomando como base la ingesta diaria de polifenoles encontrada en la población americana antes mencionada (1.000g/día), el consumo diario de 15g del suplemento alimenticio investigado en este trabajo aporta más del doble de este consumo.
Entre las limitaciones del presente estudio podemos mencionar el bajo tamaño de la muestra, el no haber excluido a los sujetos en función del IMC y los niveles de insulina, y que el producto alimenticio se administró de manera no continua durante el periodo de intervención (se administró 5 días a la semana, con 2 días de descanso, durante 3 meses). Sin embargo, a pesar de estas limitaciones, el presente trabajo permite sentar las bases para futuras investigaciones en relación con la preparación, administración y efectos de las leguminosas en forma de suplemento alimenticio sobre los niveles de marcadores de estrés oxidativo y el control glucémico.
ConclusionesLa administración de 15g diarios de un suplemento alimenticio a base de 6 leguminosas, durante un periodo de 3 meses, mostró una disminución significativa en los niveles de glucosa sanguínea y resistencia a la insulina (índice HOMA) en la muestra estudiada, sin modificación en los niveles de insulina, PCRus y perfil de lípidos, lo cual pudiera atribuirse al contenido de isoflavonas como la genisteína y de fibra total en las leguminosas. Por otro lado, se evidenció una disminución significativa en los niveles de MDA, un marcador de lipoperoxidación asociado a EO, lo cual puede ser atribuido a la ingesta de 2.760mg de polifenoles equivalentes a AG contenidos en la porción diaria del producto que se administró a los participantes durante la intervención. Sin embargo, es necesario llevar a cabo más estudios, con un número mayor de sujetos, para confirmar estos hallazgos.
AutoríaLa Dra. Josefina Ruiz Esparza Cisneros participó en el diseño del estudio, la aplicación y procesamiento de la encuesta de frecuencia de consumo de alimentos antes y después de la intervención, el análisis estadístico, la preparación y administración del suplemento y la redacción y aprobación del manuscrito.
M.C. Javier de Jesús Vasconcelos Ulloa participó en la estandarización y ejecución de las pruebas de laboratorio (MDA, glucosa y perfil de lípidos), la búsqueda de información bibliográfica y la redacción de los resultados.
El Dr. Daniel González Mendoza participó en la cuantificación de polifenoles totales en el suplemento alimenticio y en el análisis de los resultados.
El Med. Guillermo Beltrán González participó en el diseño del estudio y colaboró en el análisis de los resultados.
El Dr. Raúl Díaz Molina participó en el diseño del estudio, la estandarización y ejecución de las pruebas de laboratorio (MDA, perfil de lípidos, PCRus, insulina y glucosa), la colección de muestras sanguíneas de los sujetos de estudio y la redacción y aprobación del manuscrito.
FinanciaciónEl presente trabajo se desarrolló con apoyo financiero otorgado por el Consejo Nacional de Ciencia y Tecnología de México (CONACYT), a través del Programa de estímulos a la innovación 2015 (n.° de proyecto: 221.394).
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Los autores agradecen la participación voluntaria de todos los sujetos incluidos en el estudio; así como a la Dra. Isabel Campos Cavada por su apoyo en la revisión de la redacción del manuscrito.