Se han documentado menos de 300 schwannomas en el tracto gastrointestinal, la mayor parte de ellos en el estómago, siendo muy raros en intestino delgado y recto. Tienen características clínicas, histológicas, inmunohistoquímicas y moleculares distintas de las de los schwannomas de partes blandas.
Realizamos una revisión de 5 casos de schwannomas intestinales diagnosticados en el Hospital Clínico San Carlos en el periodo 2005-2015.
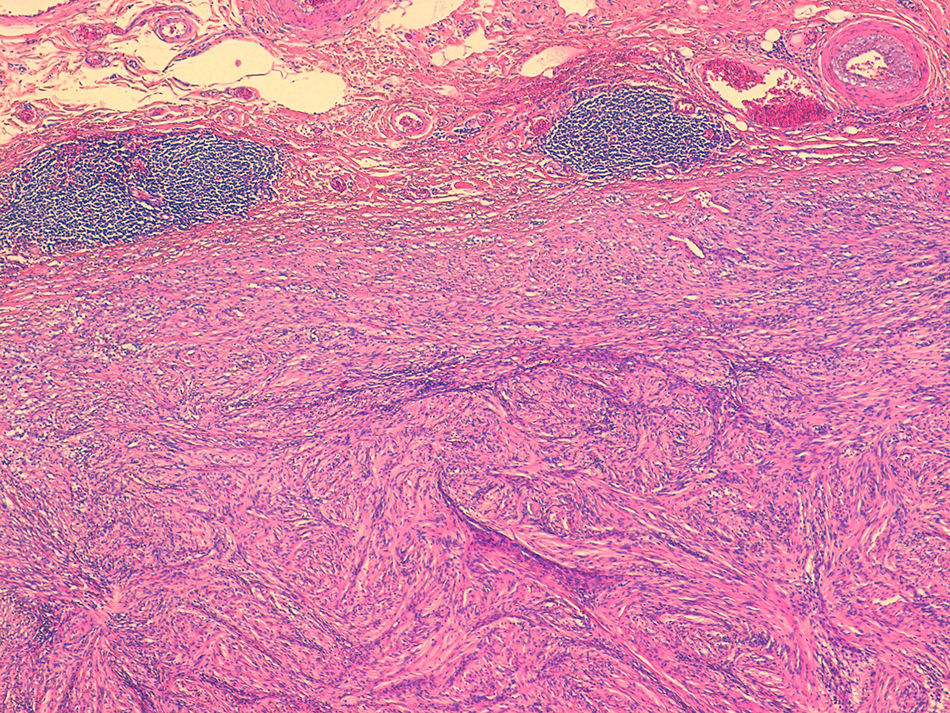
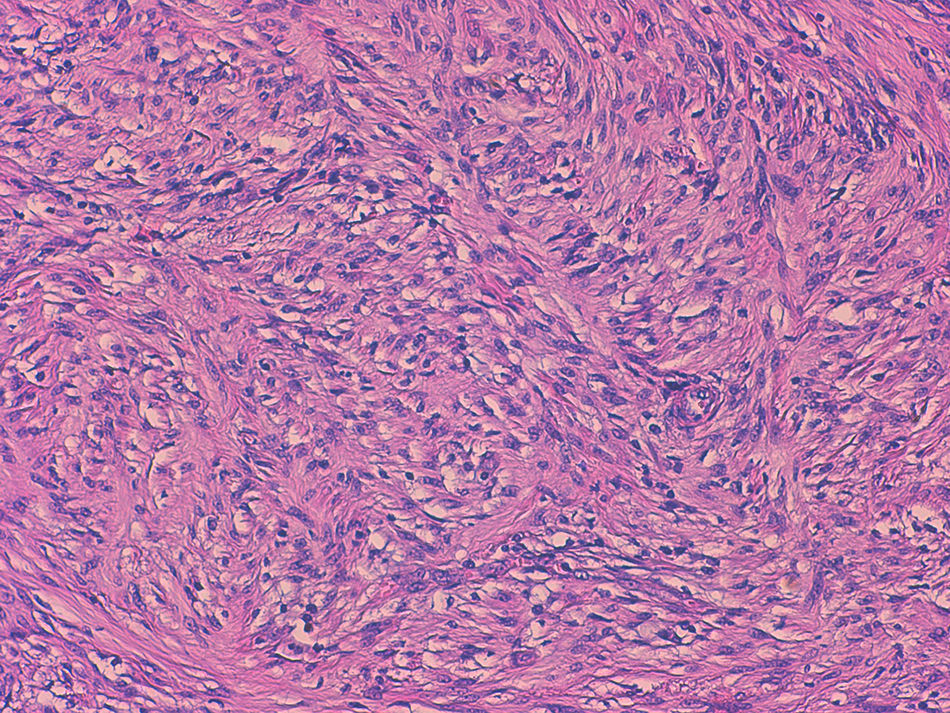
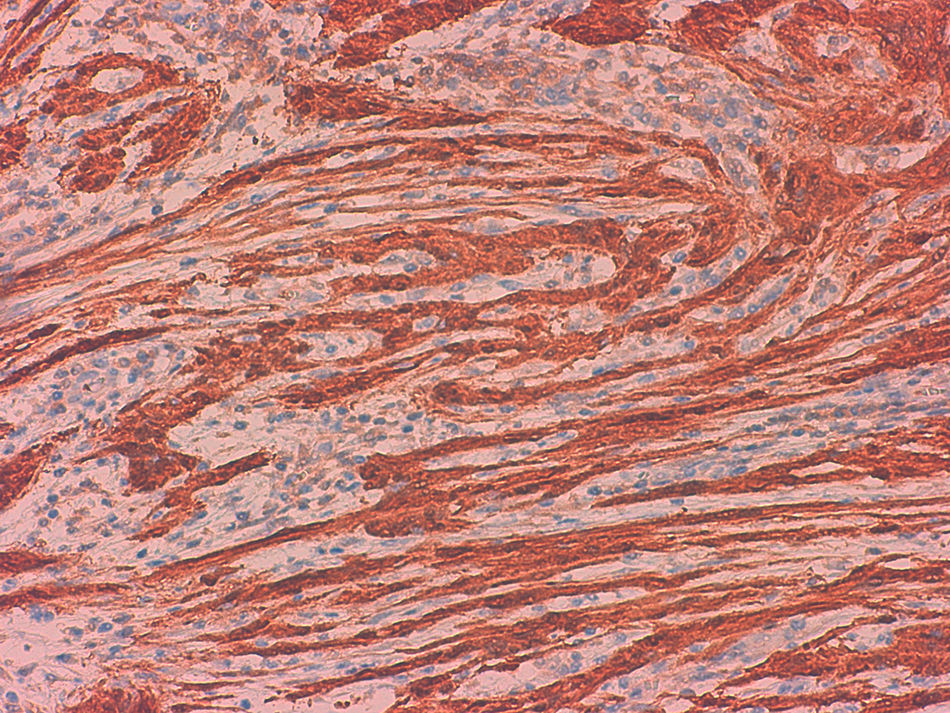
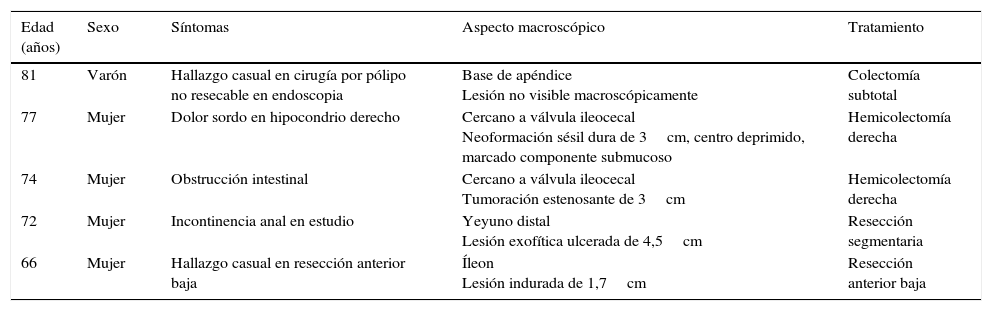
La media de edad fue de 74 años y 4 de los pacientes eran mujeres. Tres se localizaban en el ciego, uno en el yeyuno distal y uno en el íleon. El tamaño variaba entre 0,5 y 4,5cm. El estudio microscópico mostró 5 lesiones no encapsuladas, con células fusiformes en haces sin clara empalizada ni cuerpos de Verocay. En 4 de los casos se observó infiltrado linfocitario periférico, con infiltrado linfoplasmocitario difuso asociado. S100 mostró positividad difusa y el índice Ki-67 fue menor al 10%. No se observó recidiva en ningún paciente.
Less than 300 cases of gastrointestinal schwannoma have been reported to date. They occur most commonly in the stomach, being rare in the small bowel and rectum, and show characteristic clinical, histological, immunohistochemical and molecular features.
We reviewed five cases of gastrointestinal schwannoma diagnosed between 2005 and 2015 in our hospital (Hospital Clínico San Carlos, Madrid).
The patients were four women and one man, with a median age of 74 years. Three tumours were located in the caecum, one in the jejunum and one in the ileum. Tumour size ranged from 0.5 to 4.5cm. Microscopically, all were composed of monotonous benign-appearing spindle cells, without well-formed palisades or Verocay bodies. In all cases, except one, peripheral cuff-like lymphoid aggregates and/or diffuse lymphoplasmacytic infiltrate were present. S100 was diffusely positive and Ki-67 index was lower than 10%. None of the patients had recurrences or metastases.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora