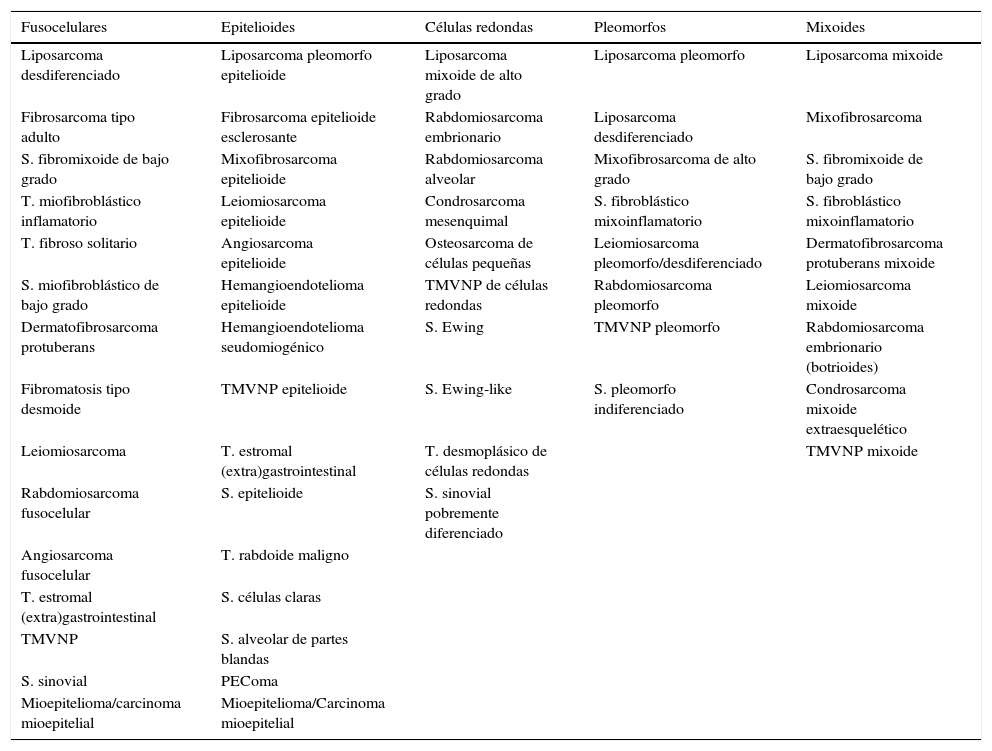
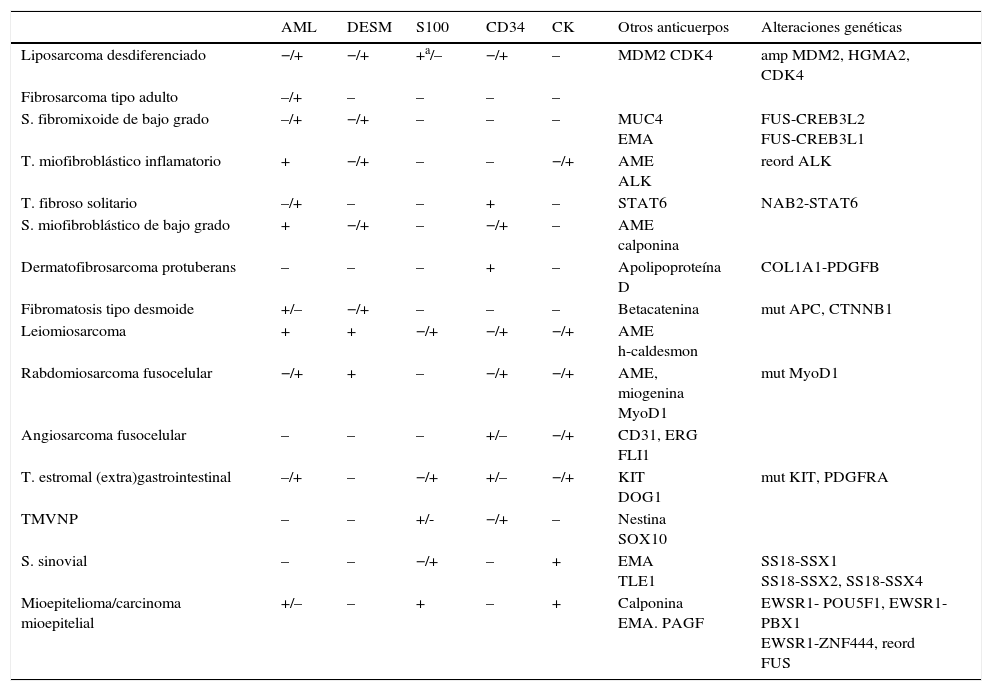
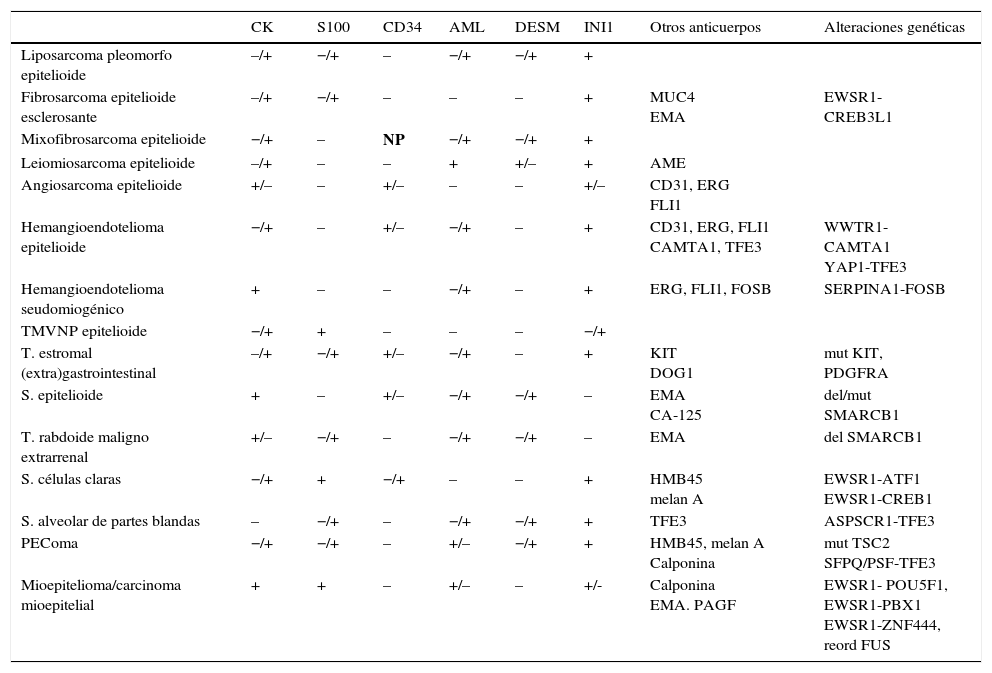
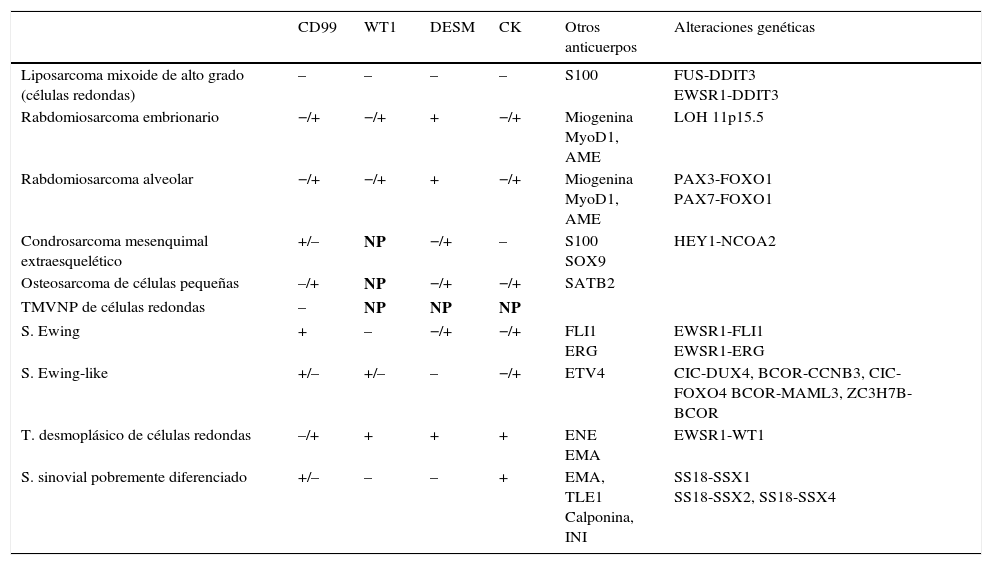
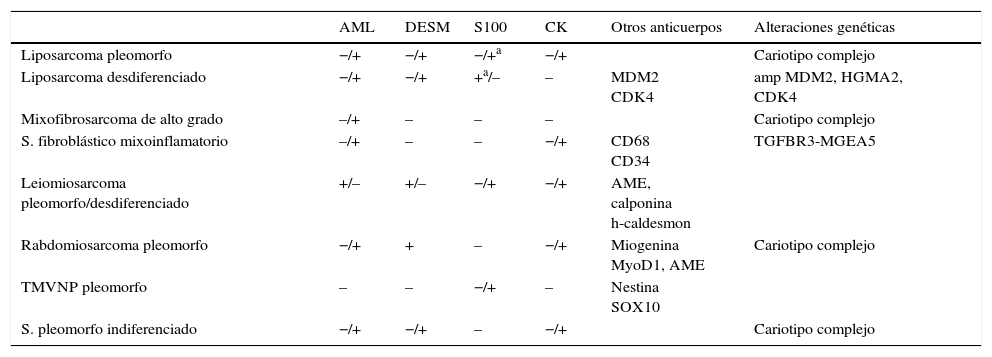
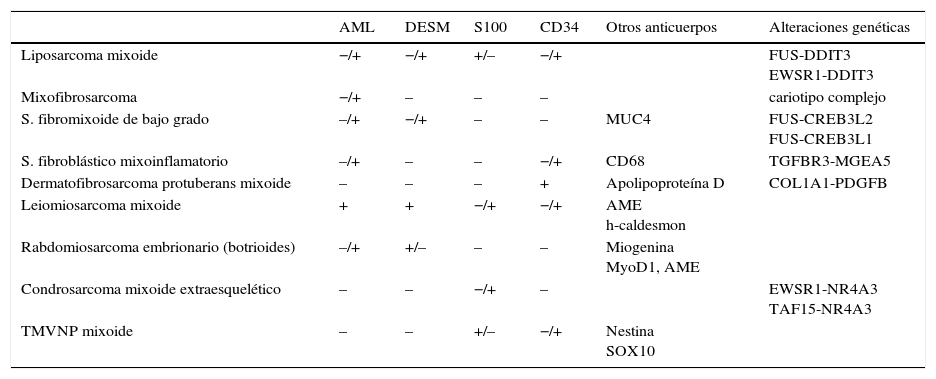
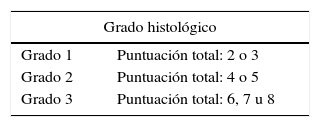
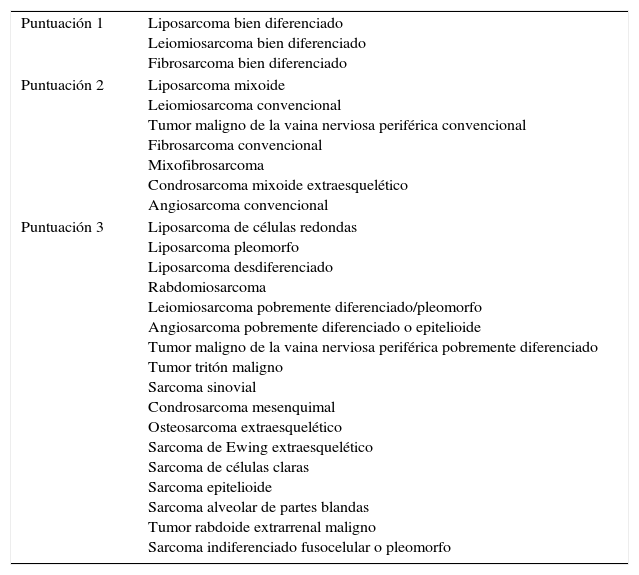
Los sarcomas de partes blandas son neoplasias poco frecuentes, que incluyen una amplia variedad de tipos histológicos, se presentan en cualquier localización y muestran una gran heterogeneidad, con solapamiento, en ocasiones, de la morfología de tumores con comportamiento clínico y biológico muy diverso. El diagnóstico es a menudo complejo, resultando necesarias guías que consensúen criterios que permitan homogeneizar la información, la terminología y la clasificación entre los diferentes centros. Basándonos en protocolos de otras sociedades científicas y en una revisión actualizada de la literatura, miembros del Club de Partes Blandas de la SEAP hemos elaborado este documento, en el que se revisan las diferentes fases del estudio de los sarcomas de partes blandas en los servicios de patología y se definen los datos fundamentales a incluir en los informes de estos tumores.
Soft tissue sarcomas are infrequent neoplasms that include a wide variety of histological types. They may present in any location and show a great morphological heterogeneity; indeed, they may have similar characteristics to tumours with diverse clinical and biological behaviour, making their diagnosis difficult. Thus, guidelines are required in order to unify the information, terminology and classification from different diagnostic centres. Several members of the SEAP Soft Tissue Pathology Club have created a document based on protocols from other scientific societies and on an updated review of the literature. The protocol includes the different phases of the study of soft tissue sarcomas in the pathology department and aims to define the data that should be included in the final pathology reports.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora