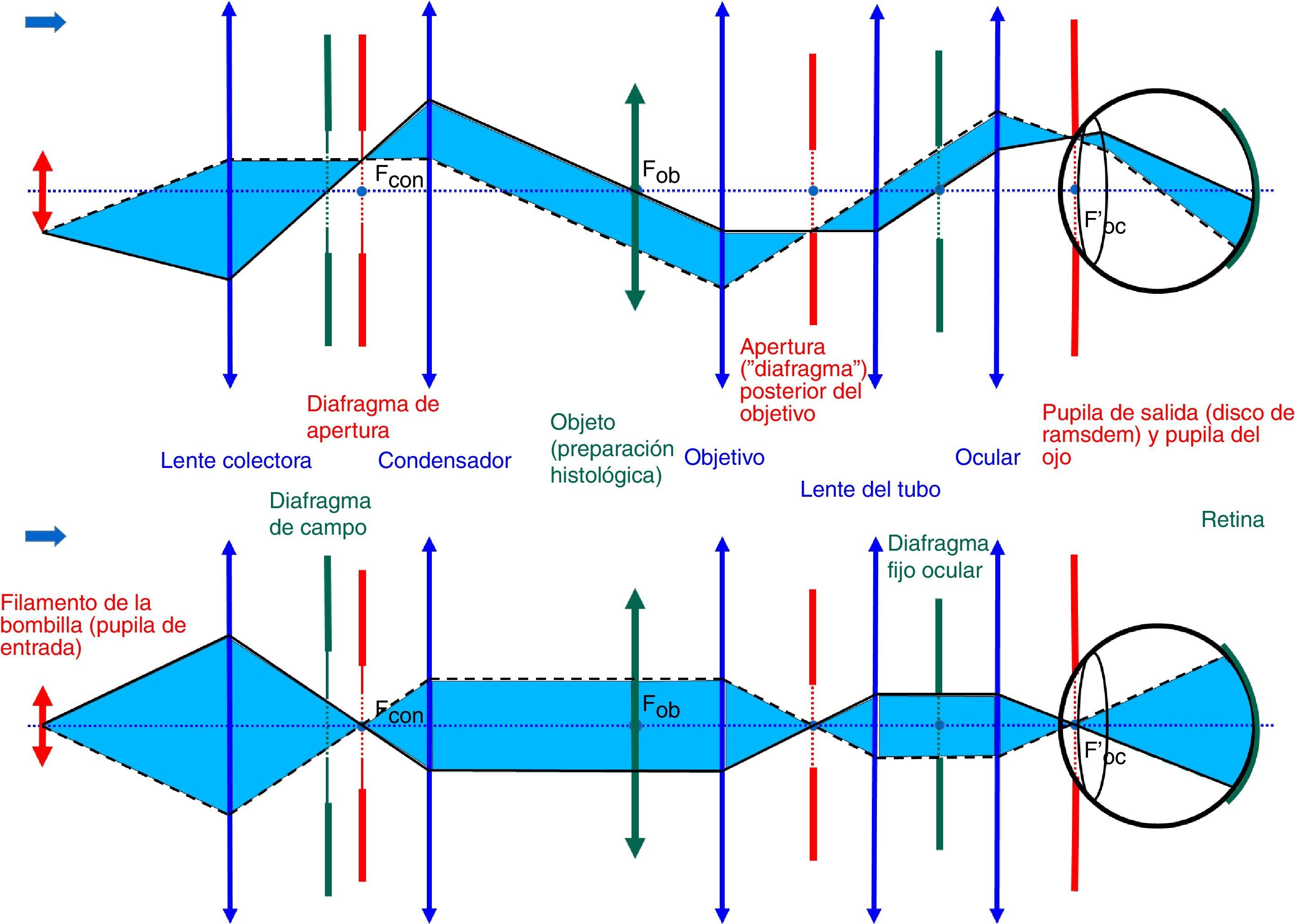
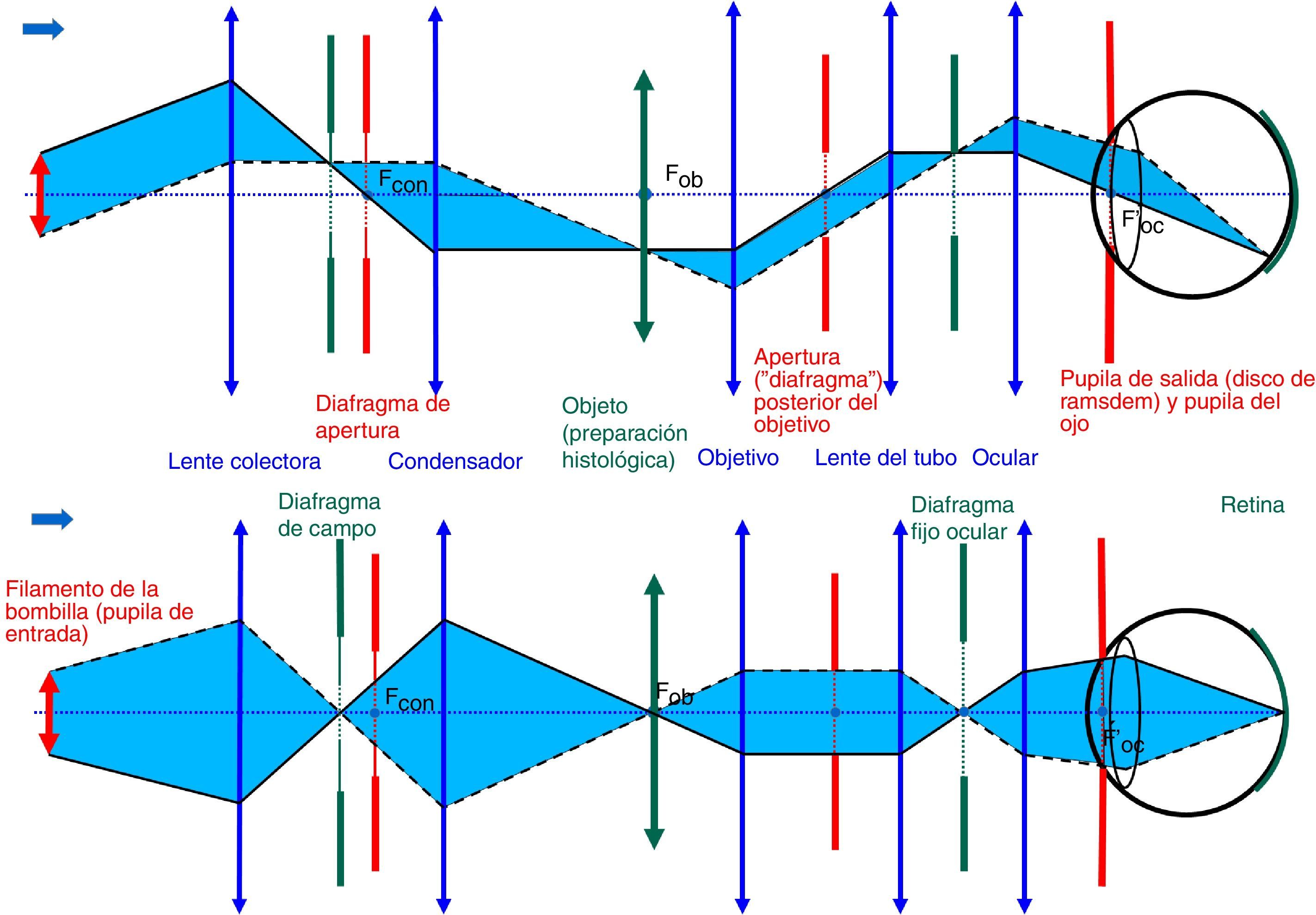
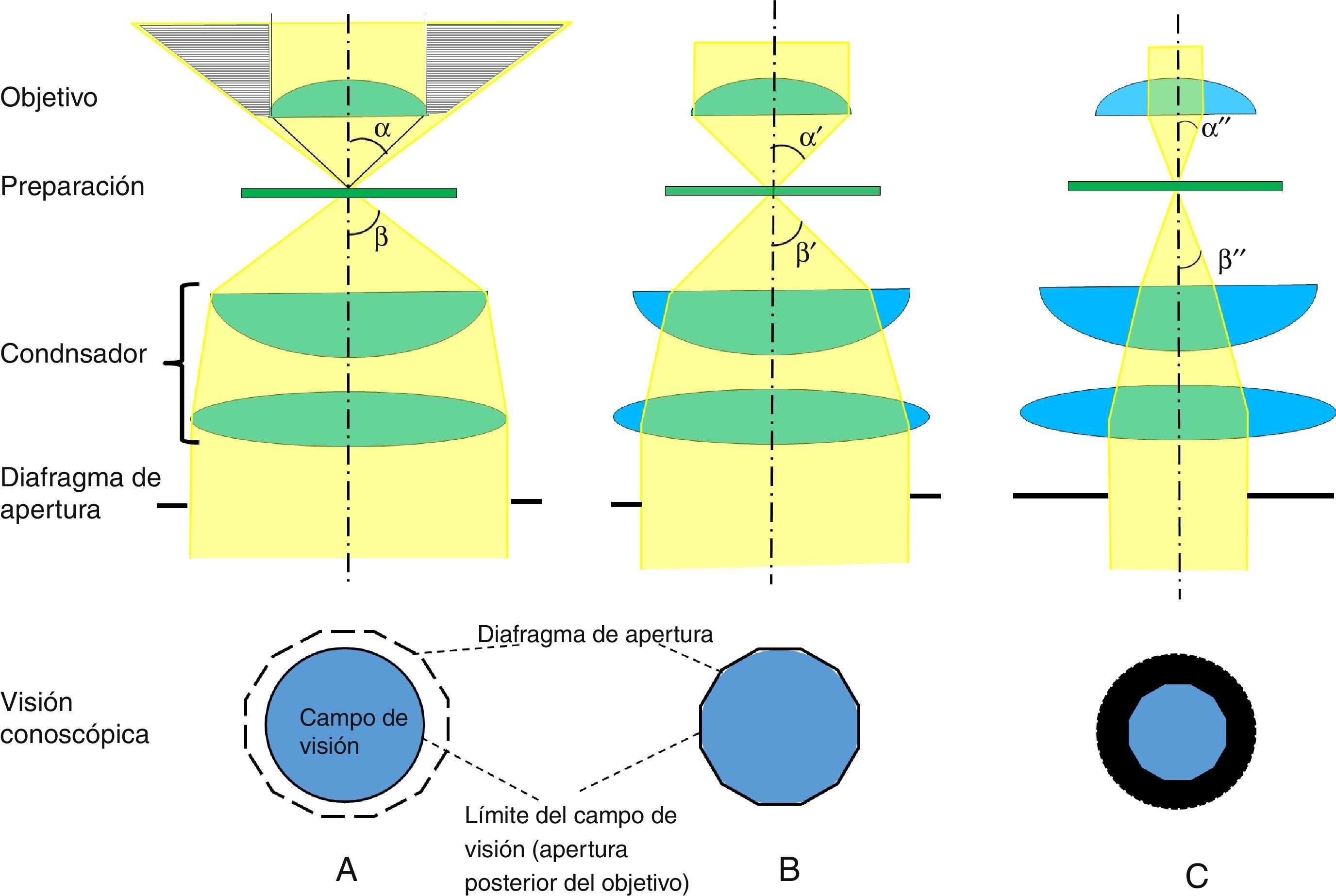
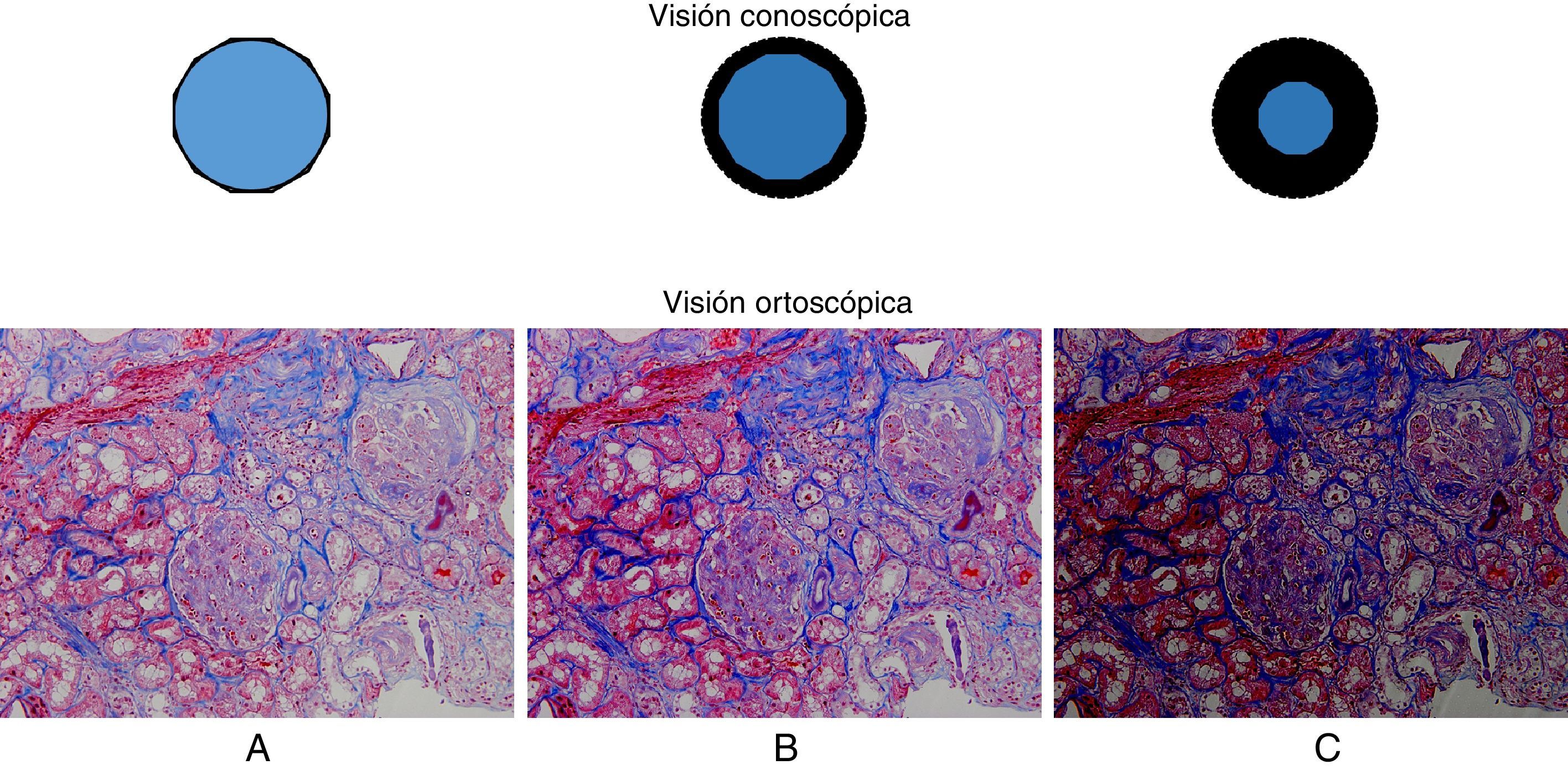
Un adecuado conocimiento y comprensión del concepto de planos conjugados es de capital importancia en la utilización del microscopio por cuanto que desde hace ya bastante tiempo el diseño de los microscopios se basa en la correcta situación de sus dos conjuntos de planos conjugados. En 1893 August Köhler publicó el trabajo «Un nuevo sistema de iluminación en microfotografía» donde dio a conocer los fundamentos básicos de una técnica de iluminación que actualmente lleva su nombre. El conocimiento y aplicación de los principios del sistema de iluminación de Köhler constituye el elemento de mayor importancia en el correcto manejo de un microscopio. Dichos principios no siempre son bien conocidos y comprendidos por los usuarios del microscopio constituyendo una fuente frecuente de errores en microscopía, particularmente en microfotografía. En este artículo revisamos los principios básicos del concepto de planos conjugados y del sistema de iluminación de Köhler.
Adequate knowledge and understanding of the concept of conjugate planes is of paramount importance in the use of the microscope and for a long time microscope design was based on the correct location of the two sets of conjugate planes. In 1893 August Köhler published the article «A new illumination system in microphotography» in which he introduced the basics of an illumination technique that now bears his name. The knowledge and application of the principles of the Köhler illumination system is the most important element in the proper handling of a microscope. These principles are not always well known or understood by the users of microscopes, frequently leading to errors in microscopy, particularly in photomicrography. This article reviews the basic principles of the concept of conjugate planes and Köhler illumination system.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora