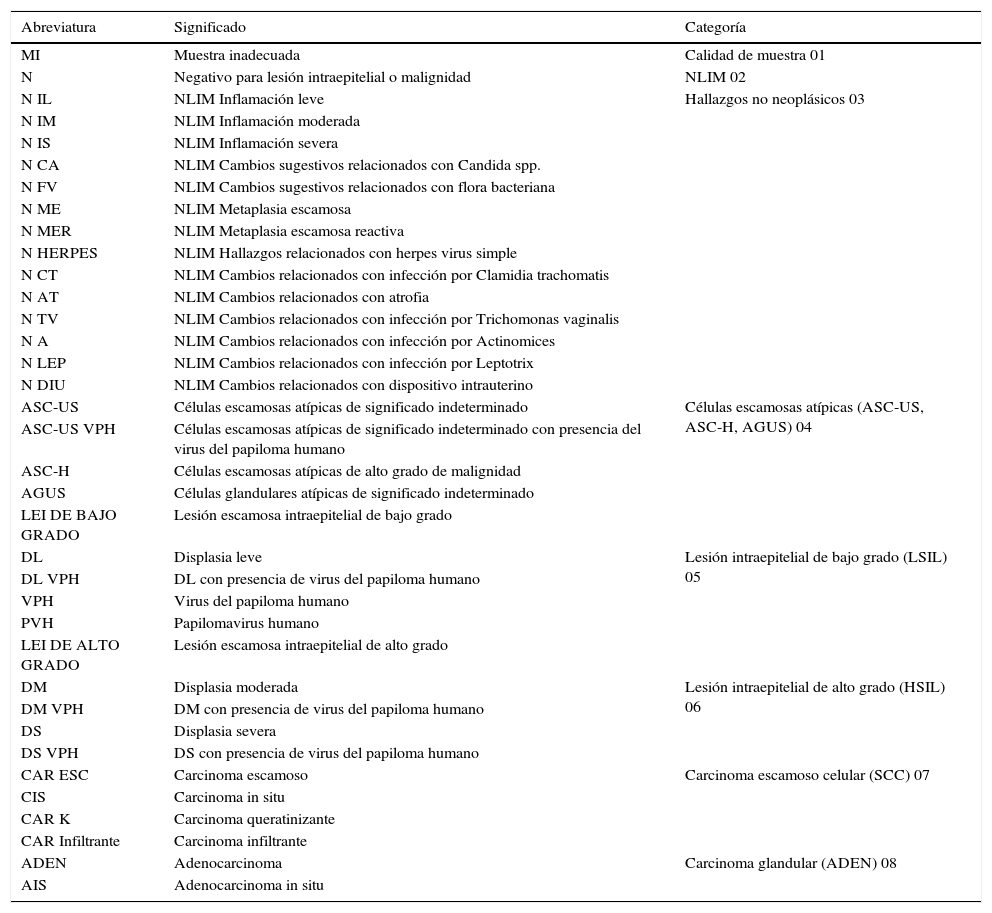
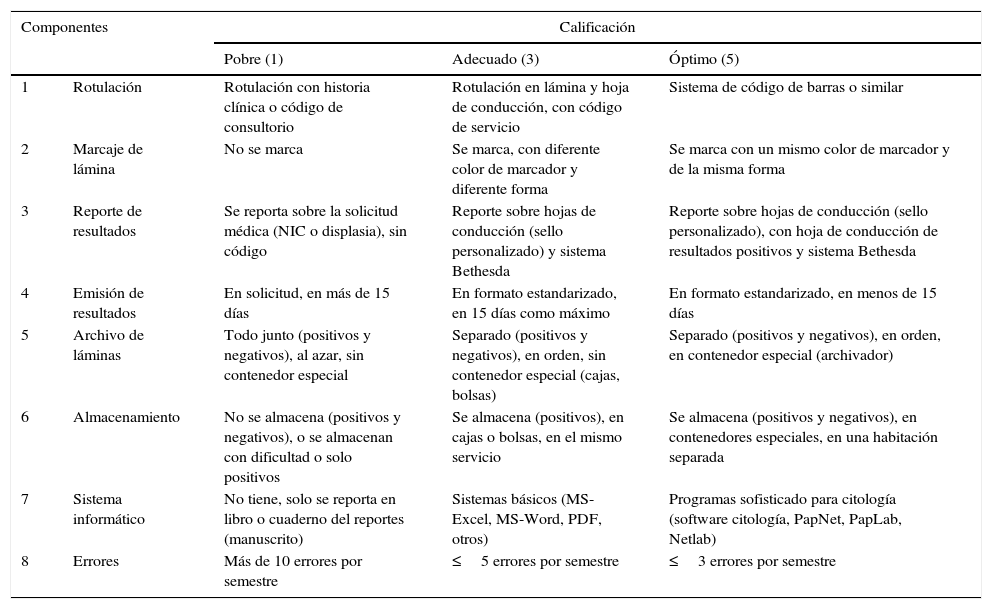
Con el objetivo evaluar el desempeño y la calidad de la etapa postanalítica del cribado citológico en el Hospital Nacional Docente Madre Niño «San Bartolomé» se diseñó una investigación de tipo analítico-correlacional con muestreo prospectivo y análisis transversal en todos los frotices referidos de redes y microrredes de salud durante 2016. Se evaluaron 8 parámetros (rotulación de láminas, marcaje de láminas, reporte de resultados, emisión de resultados, archivo de láminas, almacenamiento, sistema informático y errores postanalíticos) (α-Crombach=0,823) en base a la percepción de todos los técnicos, citotecnólogos y citopatólogos del hospital, y a 21 estudiantes de la especialidad de Citología de la Universidad Nacional Federico Villarreal.
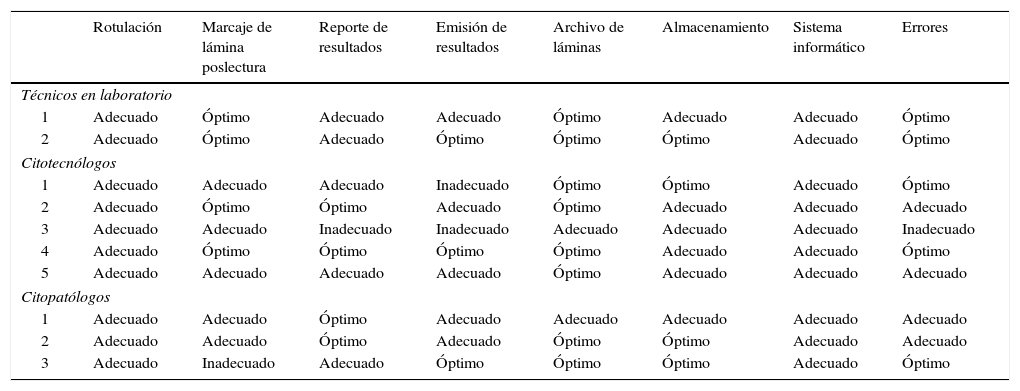
El procesamiento citológico reportó un rendimiento global adecuado (29 puntos) siendo 18 y 34 el puntaje mínimo y máximo, respectivamente. Esta valoración difiere significativamente en los ítems marcaje de lámina (p=0,722) y archivo de láminas (p=0,503). Se evidenció una diferencia global por grupo de evaluación (p<0,027). Se estableció una correlación directa entre el tipo de evaluador y el total de errores postanalíticos (rho=0,534; p<0,005).
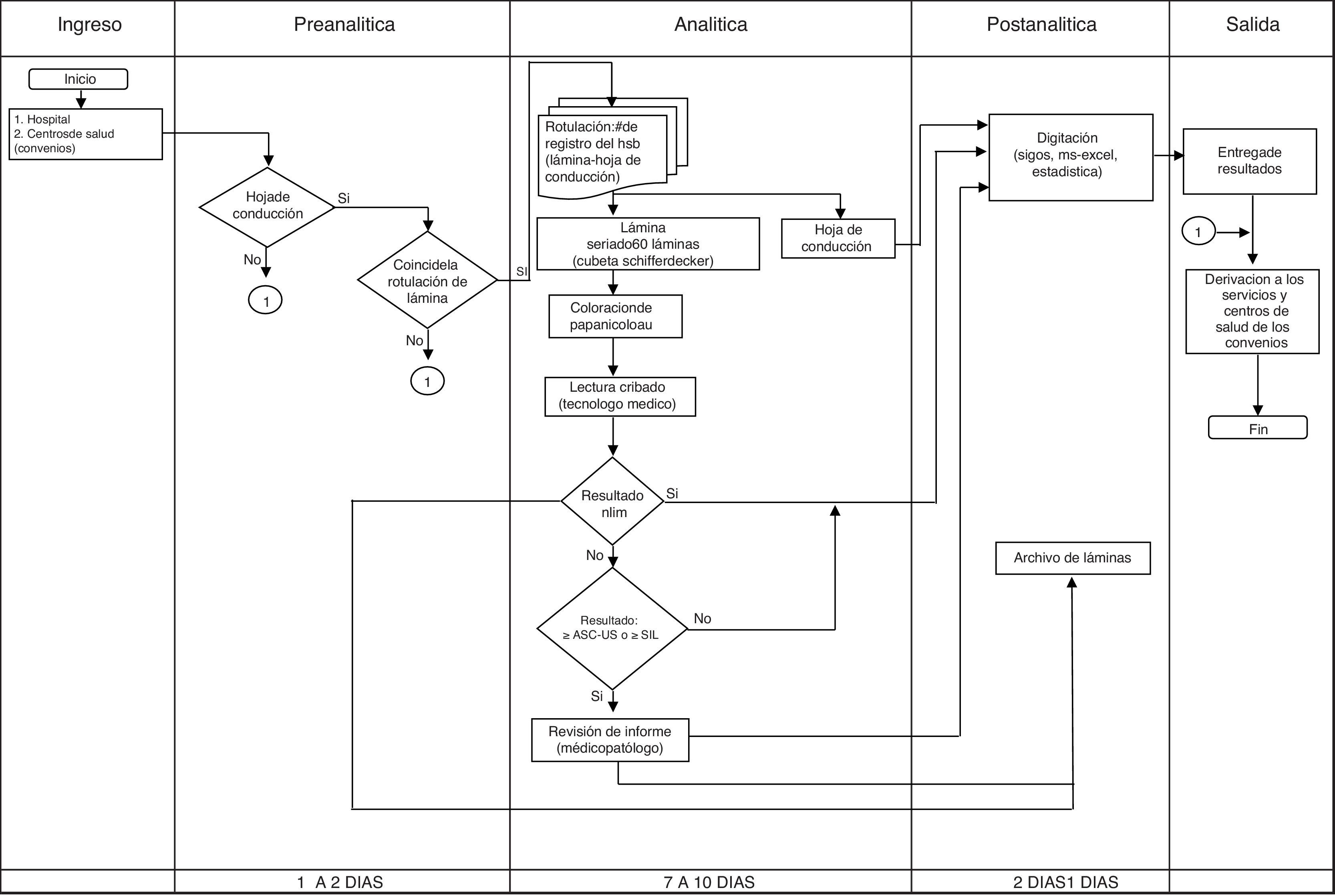
Estos procesos deben de tener un cumplimiento de requisitos interrelacionados de manera coordinada y dinámica que permita mantener la identidad de la unidad: muestra-solicitud-usuaria.
La evaluación del desempeño y la calidad de la etapa postanalítica para la detección del cáncer de cuello uterino mostro un desempeño «adecuado» que difiere de evaluaciones de otras instituciones. Esta nueva aproximación señala la importancia de los procesos postanalíticos relacionados con rescreening, las necesidades operativas y las metas organizacionales.
In order to evaluate the performance and quality of the post-analysis stage of cervical screening in the “Madre Niño” St Bartholomew's National Teaching Hospital, a correlational analytical study was designed, with prospective sampling and transversal analysis of all the smears referred from the health networks during 2016. Eight criteria were assessed (labelling of slides, marking of slides, reporting of results, sending of results, filing of slides, storage of slides, computer programme and post-analytic errors) (α-Crombach»=»0.823) based on the perception of all the technicians, cytotechincians and cytopathologists in the hospital as well as 21 cytology students at the Federico Villareal National University.
Cytology processing reported adequate global efficiency, with an average of 29 points and a range of 18 to 34. This assessment differs significantly in the marking of the slides (P=.722) and filing of slides (P=.503). A global difference was seen per evaluation group (P<.027). A direct correlation was established between the type of assessor and the total number of post-analytical errors (rho=0.534; P<.005).
These processes should fulfil certain requirements that are inter-related in a coordinated and dynamic way, in order to maintain the identity of the unit: sample-request-user.
The assessment of the performance and quality of the post-analytic phase in the detection of cervical cancer revealed an “adequate” performance which differs from the assessments in other centres. This new approximation points out the importance of the post-analytic processes related to rescreening, the operative needs and the organizational goals.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora