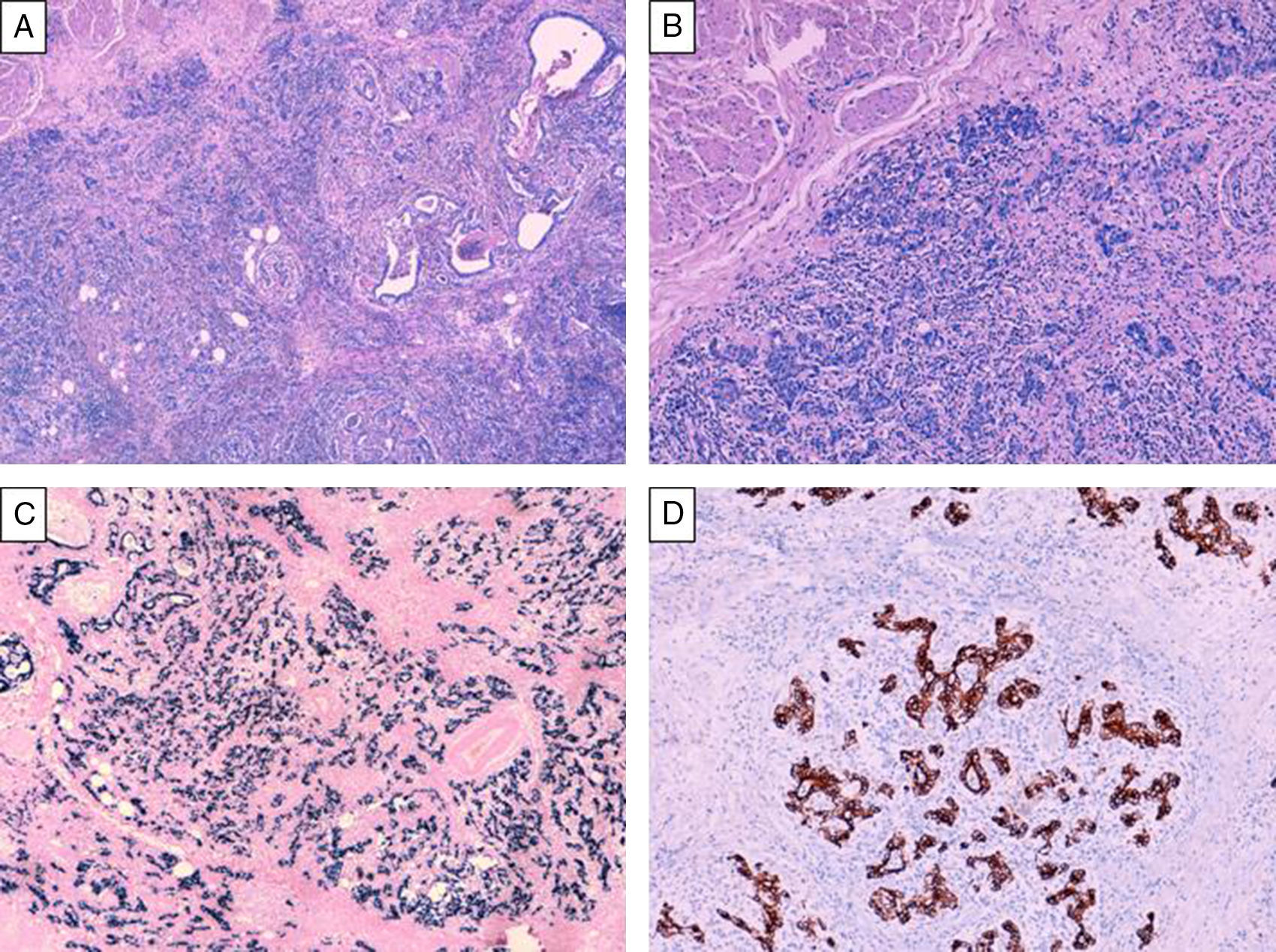
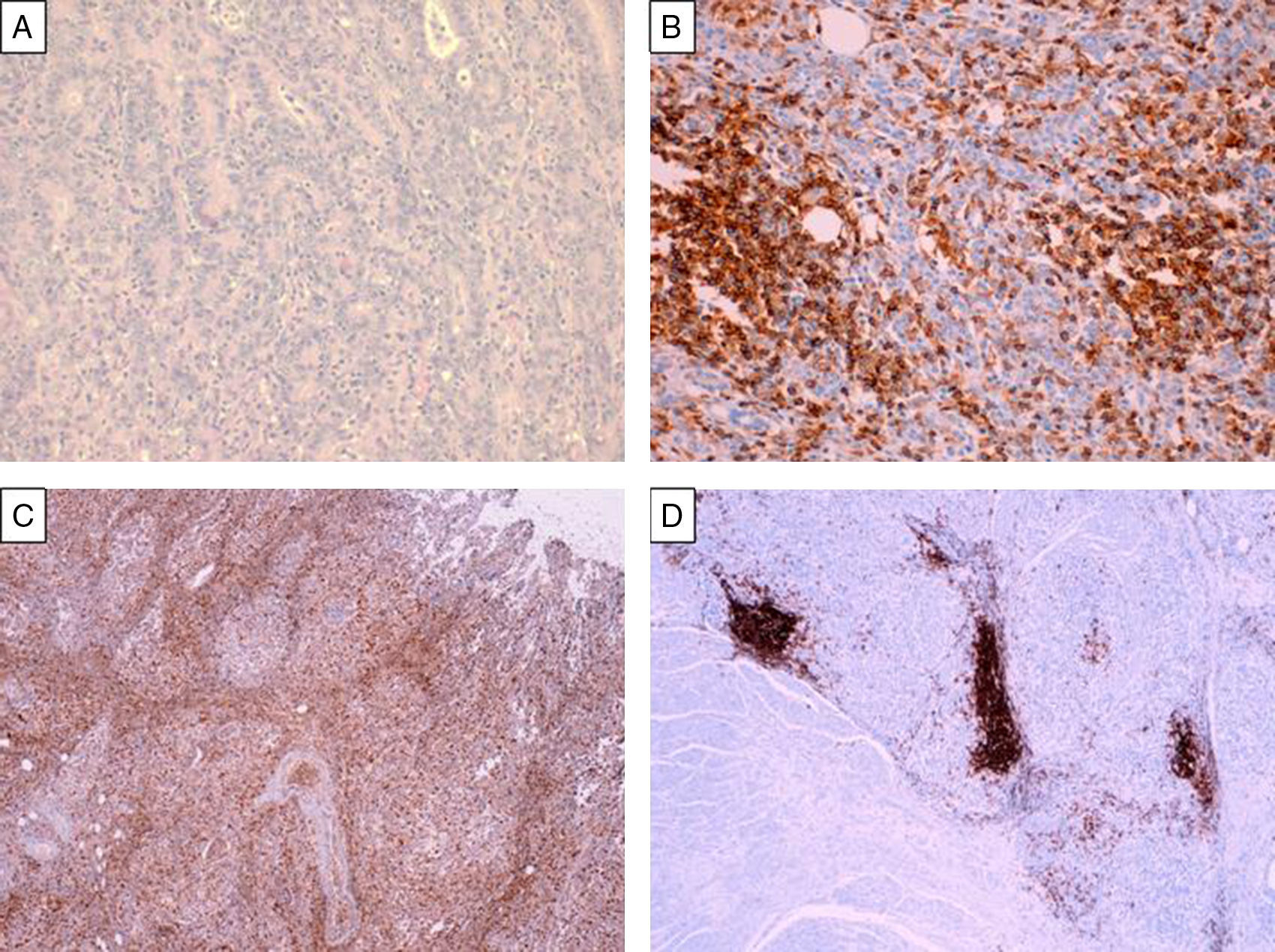
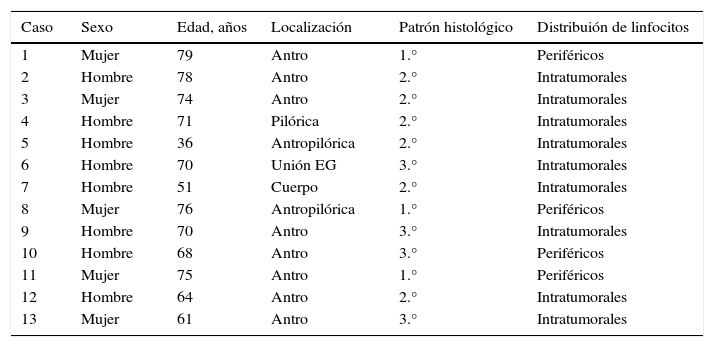
Los carcinomas gástricos con estroma linfoide son un grupo heterogéneo de neoplasias mal caracterizadas que históricamente no se han clasificado en entidades clínico-patológicas distintas. Conocer los criterios diagnósticos e identificarlos tiene una importancia relevante tanto clínica como pronóstica. Analizamos 13 casos de pacientes con carcinomas gástricos con estroma linfoide. Con criterios histopatológicos, inmunofenotípicos y moleculares, se definieron 3 subtipos (patrón 1, 2 y 3). Realizamos inmunohistoquímica para caracterizar las poblaciones linfoides (CD3, CD4, CD8 y CD20), para analizar la expresión de virus de Epstein-Barr (VEB) y la expresión de proteínas reparadoras del ADN. El objetivo de este estudio es definir criterios útiles que permitan distinguir estas inusuales lesiones y estudiar el inmunofenotipo de las poblaciones linfoides.
Gastric carcinomas with lymphoid stroma comprise a heterogeneous group of incompletely characterized neoplasms that have not as yet been classified as different clinico-pathological entities. We analysed 13 cases of gastric carcinoma with lymphoid stroma in order to establish diagnostic criteria for their identification. We defined 3 different subtypes (patterns 1, 2 and 3) based on histopathologic, immunophenotypic and molecular criteria. Immunohistochemistry was performed to identify lymphoid populations (CD 3, CD4, CD8 and CD20), the presence of Epstein-Barr Virus (EBV) and the expression of DNA mismatch repair proteins. Our aim is to define criteria that are helpful in the differential diagnosis of these unusual lesions and to clarify the immunophenotype of their lymphoid population.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora