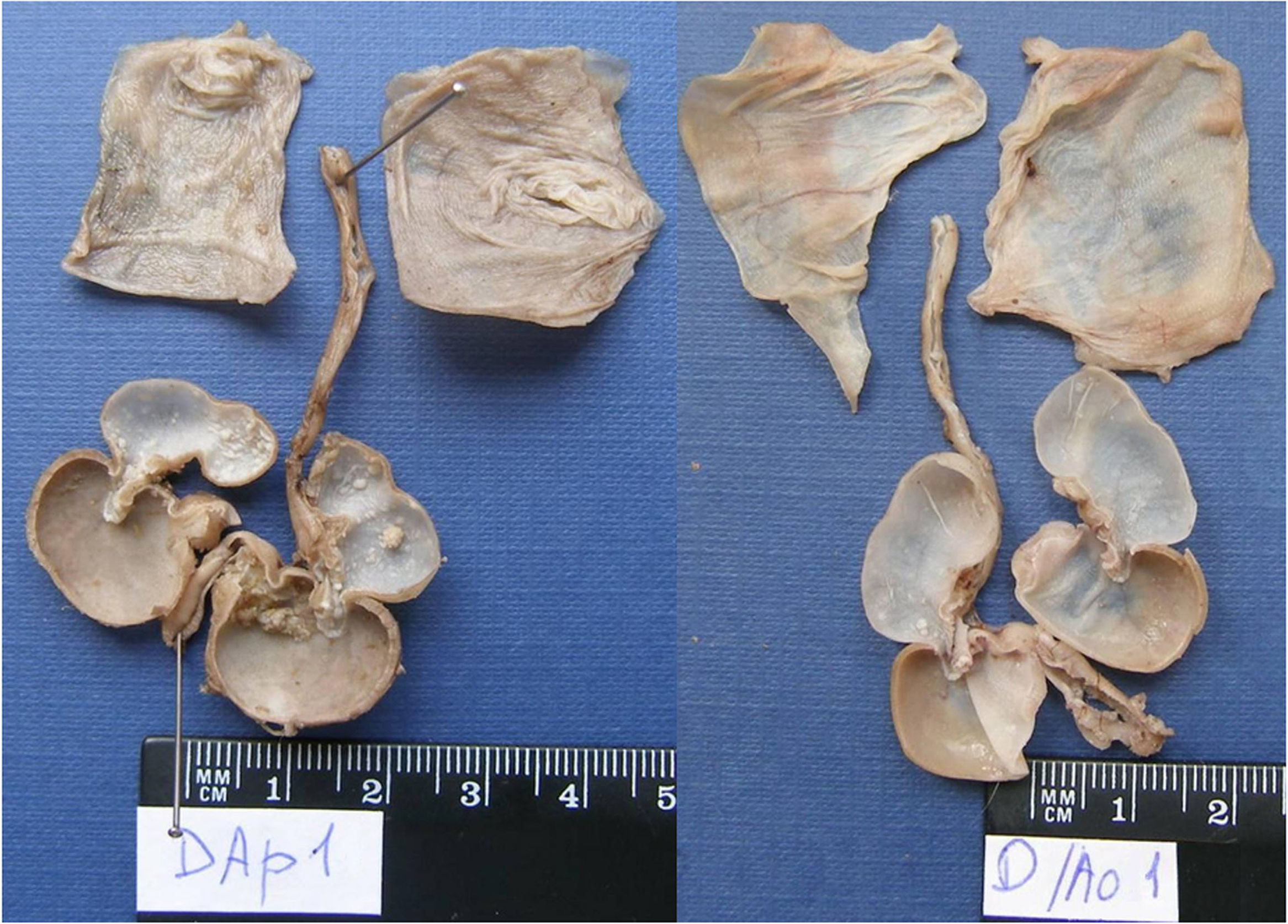
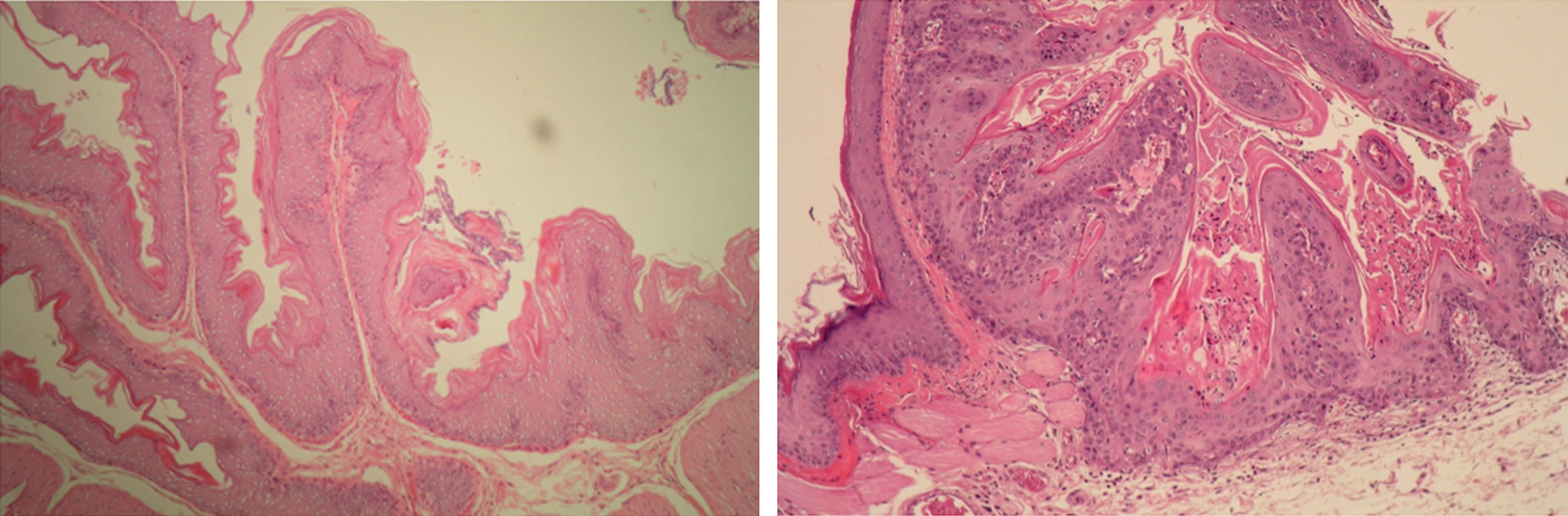
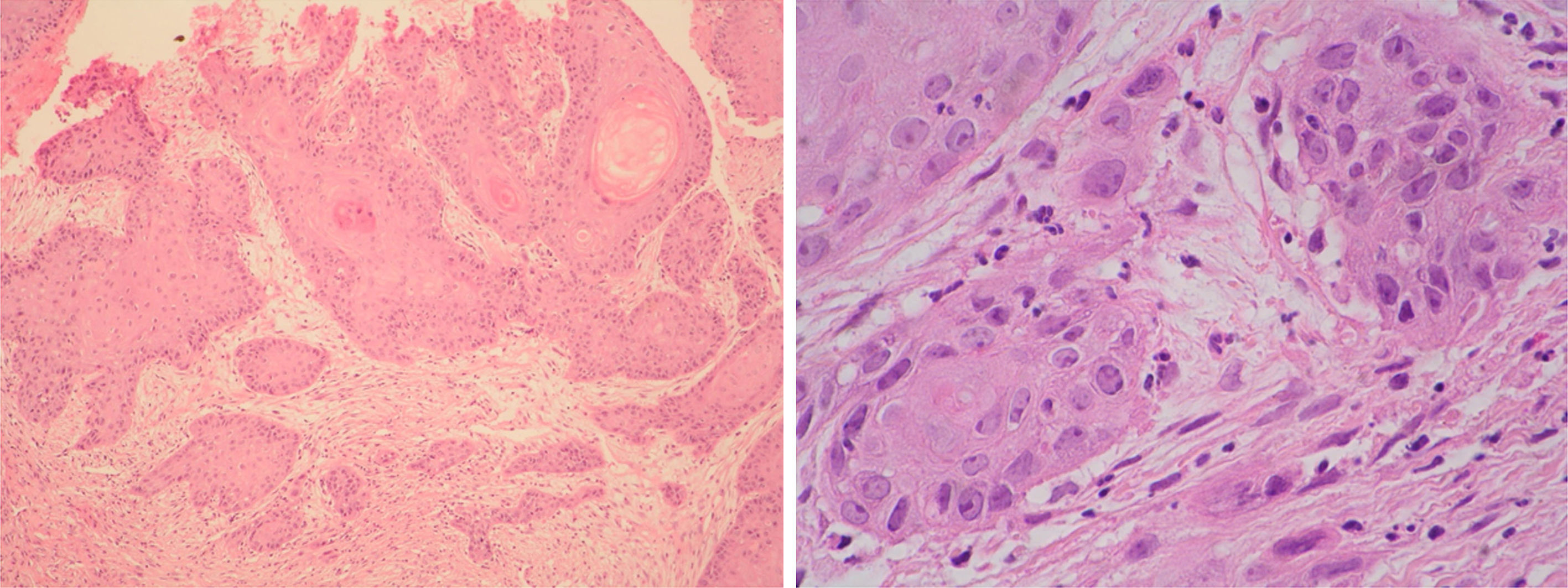
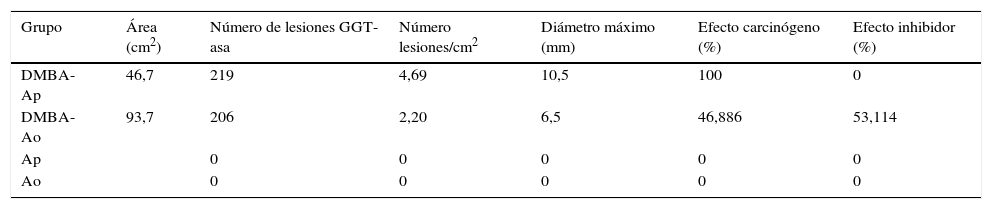
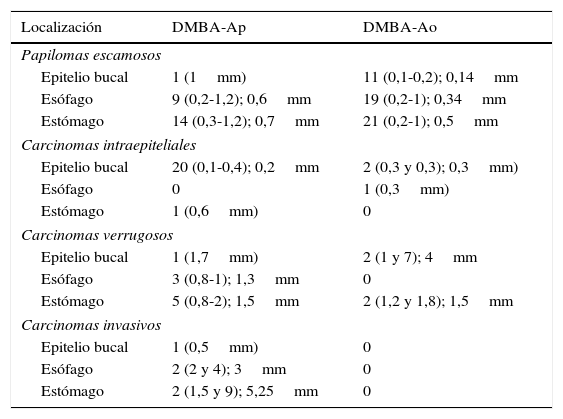
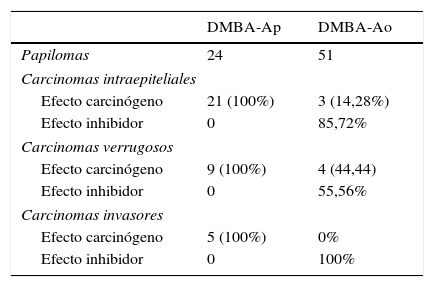
El DMBA es un carcinógeno químico que induce carcinomas a las pocas semanas de su aplicación. En 44 hámsteres machos distribuidos en 4 grupos —DMBA disuelto en aceite de parafina (DMBA-Ap), DMBA disuelto en aceite de oliva (DMBA-Ao), aceite de parafina y aceite de oliva— se aplicó diariamente, en las bolsas bucales, aceite de parafina o aceite de oliva virgen extra en las 2 primeras semanas, alternativamente, durante la aplicación bisemanal de DMBA al 0,5% disuelto en aceite de parafina o de oliva durante 5semanas, y diariamente, hasta la vigésima semana. Los animales de los grupos DMBA-Ao y aceite de oliva, recibieron una dieta adicional con aceitunas maduras variedad Picual. El efecto carcinógeno DMBA-Ap (35carcinomas) es el 100%, y el efecto inhibidor, 0. La combinación de aceite de oliva como disolvente del DMBA y la dieta ad líbitum con aceituna Picual tiene un efecto inhibidor del 80% —solo 3 carcinomas intraepiteliales y 4 carcinomas verrugosos—, y no se desarrollaron carcinomas invasores.
DMBA is a carcinogen that induces carcinomas within a few weeks of application. Forty-four male hamsters were divided into four groups: DMBA dissolved in paraffin oil (DMBA-Po), DMBA dissolved in olive oil (DMBA-Oo), paraffin oil and olive oil. Their mouths were swabbed daily with paraffin oil or extra virgin olive oil alternatively for the first two weeks, during the biweekly application of DMBA at 0.5% diluted in paraffin oil or olive oil for five weeks and daily until the twentieth week. The animals in the DMBA-Oo and olive oil groups received an additional diet of mature Picual olives. The DMBA-Po carcinogen effect (35 carcinomas) is 100% and the inhibitory effect 0. The combination of olive oil as DMBA solvent and the ad libitum diet with Picual olive has an inhibitory effect of 80%, with only three intraepithelial carcinomas and four verrucous carcinomas occurring and no invasive carcinomas.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora