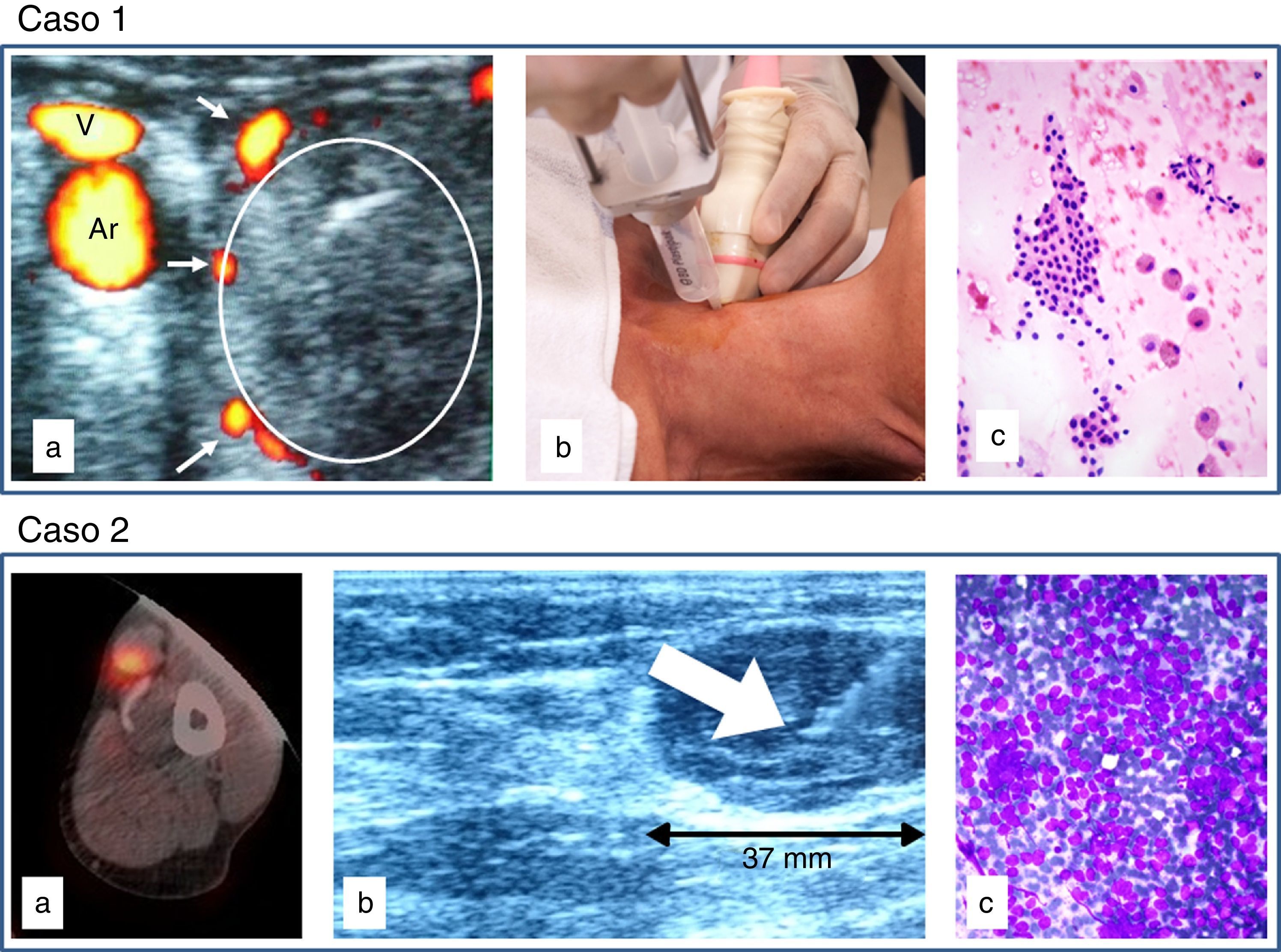
El desarrollo y perfeccionamiento de la ecografía a partir de los setenta supuso un gran avance en el ámbito de la punción aspiración con aguja fina (PAAF), posibilitando localizar lesiones no palpables y minimizar complicaciones. El uso de PAAF ecoguiada trajo como consecuencia que dicha técnica se desplazara por motivos logísticos de los servicios de anatomía patológica a los servicios de radiología. El «alejamiento del patólogo» trajo como consecuencia numerosos inconvenientes. Con la finalidad de recuperar el territorio perdido y optimizar el procedimiento se inició una experiencia pionera —y hasta donde sabemos única España— en el Servicio de Anatomía Patológica del Hospital Universitario Central de Asturias (HUCA) con la PAAF ecoguiada realizada por citopatólogo.
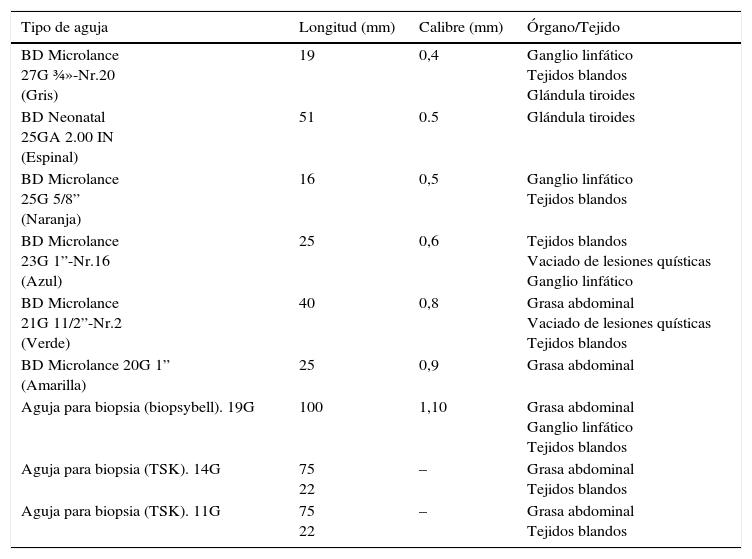
MétodoSe cuantificaron todas las PAAF realizadas en el HUCA desde el 1 de julio de 2015 hasta el 30 de junio de 2016. Se procedió a clasificarlas dependiendo de si fueron PAAF ecoguiadas realizadas por patólogo o PAAF no realizada por patólogo, teniendo como principal criterio si fueron valorables o insuficientes.
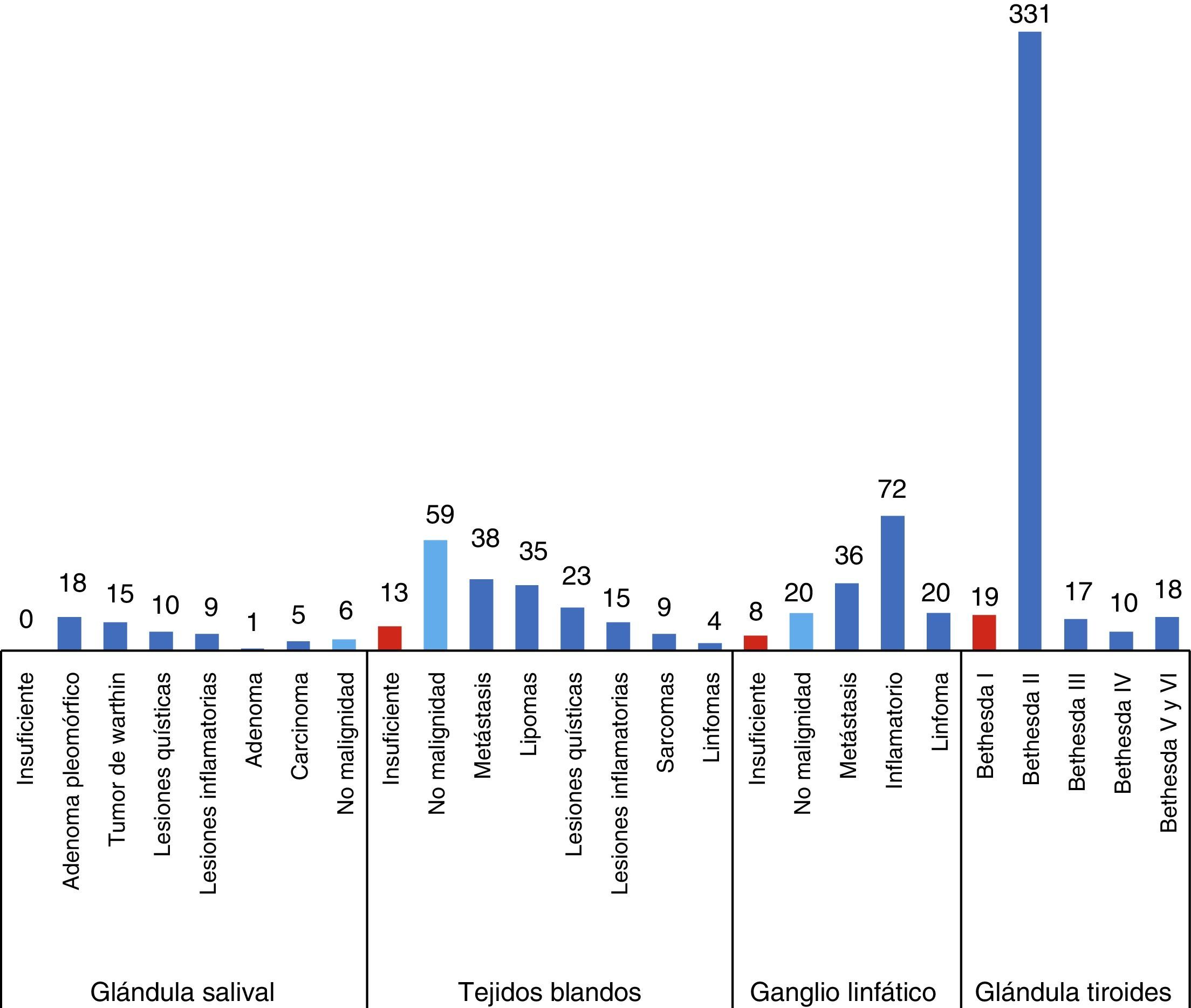
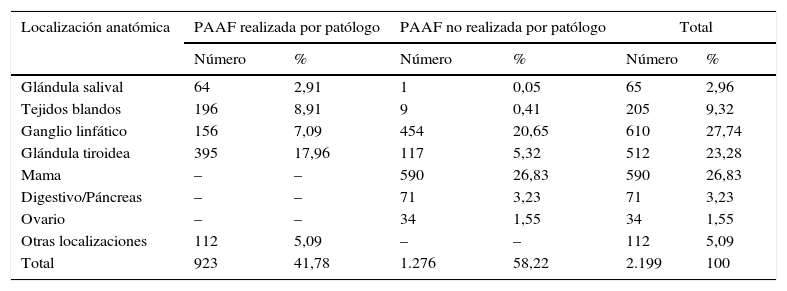
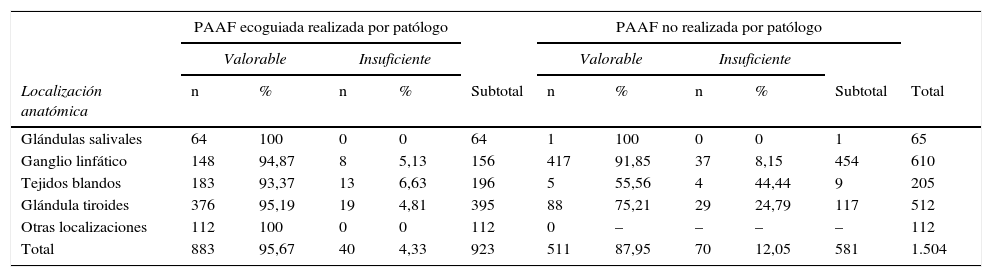
ResultadosCasi la mitad de las PAAF efectuadas fueron realizadas por citopatólogo (923). Las PAAF ecoguiadas realizadas por patólogo superaron en rendimiento diagnóstico a las PAAF no realizadas por patólogo. En todas las localizaciones anatómicas comprables, la PAAF ecoguiada realizada por patólogo tuvo un menor porcentaje de muestras insuficientes (4,33%) en comparación con la PAAF no realizada por patólogo (12,05%).
ConclusiónEl citopatólogo adecuadamente adiestrado es capaz de realiza PAAF ecoguiada con excelentes resultados. Los buenos resultados obtenidos han traído como consecuencia el aumento progresivo del número de PAAF solicitadas para llevar a cabo en el Servicio de Anatomía Patológica.
The development and improvement of ultrasound from the seventies has caused a breakthrough in fine needle aspiration (FNA), allowing the location of non-palpable lesions and minimizing complications. For logistic reasons, ultrasound-guided-FNA (US-FNA) is carried out in the department of radiology. However, the distance from the pathologist has many disadvantages. In order to correct this and thus optimize the procedure, the Department of Pathology at the University Hospital of Asturias (Hospital Universitario Central de Asturias [HUCA]) has initiated, for the first time in Spain, the Ultrasound-Guided-FNA Performed by Cytopathologists programme. We present our experience so far.
MethodFNA performed at HUCA were quantified from July 1st 2015 to June 30th 2016. FNA were classified as US-FNA-cytopathologists or US-FNA-without cytopathologists. Criteria of sufficient and insufficient samples were taken into account.
ResultsAlmost half of the FNA were made by cytopathologists (923). The performance of US-FNA-cytopathologists was better than US-FNA-without cytopathologists. US-FNA-cytopathologists had a lower percentage of inadequate samples (4.33%) compared to FNA carried out by non cytopathologists (12.05%).
ConclusionAdequately trained cytopathologists can perform US-FNA with excellent results. Our positive experience has resulted in an increase in the number of requests for FNA to be carried out in the Department of Pathology.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora