La incidencia del manejo inadecuado del dolor oncológico es muy elevada a pesar de la multitud de guías de práctica clínica creadas. El objetivo es revisar de forma sistemática las guías de práctica clínica actuales sobre el manejo del dolor oncológico, analizar su metodología y contenido de forma crítica, y conocer su calidad y validez.
Material y métodosRevisión sistemática en las principales bases de datos en inglés, francés y español entre 2008 y 2013. Se realizó un análisis de la calidad metodológica con AGREE-II, incluyendo fiabilidad interobservador. Se extrajeron las recomendaciones, clasificándolas por categorías y nivel de evidencia, con el fin de realizar un análisis de la variabilidad entre las guías y de la validez de su contenido.
ResultadosSeis guías fueron incluidas en el análisis, existiendo gran variabilidad tanto en la calidad formal y metodológica, como en el contenido y el nivel de evidencia de sus recomendaciones. La guía de Scottish Intercollegiate Guidelines Network fue la mejor valorada en AGREE-II mientras que la de la Sociedad Española de Oncología Médica resultó la peor valorada. La guía del Ministerio de Salud de Malasia fue la que contó con mayor validez, seguida por la Scottish Intercollegiate Guidelines Network.
ConclusionesLas guías actuales para el manejo del dolor en pacientes con cáncer presentan importantes limitaciones en su calidad y contenido. Entre las existentes, se recomiendan las del Ministerio de Salud de Malasia y Scottish Intercollegiate Guidelines Network, mientras que la de la Sociedad Española de Oncología Médica presenta oportunidades de mejora frente a estas.
Although several clinical practice guidelines have been developed in the last decades, cancer pain management is still deficient. The purpose of this work was to carry out a comprehensive and systematic literature review of current clinical practice guidelines on cancer pain management, and critically appraise their methodology and content in order to evaluate their quality and validity to cope with this public health issue.
Materials and methodsA systematic review was performed in the main databases, using English, French and Spanish as languages, from 2008 to 2013. Reporting and methodological quality was rated with the Appraisal of Guidelines, Research and Evaluation II (AGREE-II) tool, including an inter-rater reliability analysis. Guideline recommendations were extracted and classified into several categories and levels of evidence, aiming to analyse guidelines variability and evidence-based content comprehensiveness.
ResultsSix guidelines were included. A wide variability was found in both reporting and methodological quality of guidelines, as well as in the content and the level of evidence of their recommendations. The Scottish Intercollegiate Guidelines Network guideline was the best rated using AGREE-II, while the Sociedad Española de Oncología Médica guideline was the worst rated. The Ministry of Health Malaysia guideline was the most comprehensive, and the Scottish Intercollegiate Guidelines Network guideline was the second one.
ConclusionsThe current guidelines on cancer pain management have limited quality and content. We recommend Ministry of Health Malaysia and Scottish Intercollegiate Guidelines Network guidelines, whilst Sociedad Española de Oncología Médica guideline still needs to improve.
Considerando que el dolor de origen oncológico lo sufre más de la mitad de la población con cáncer1 y que concurre con una alta tasa de tratamiento inadecuado del dolor en esta población, en torno al 43%2, podemos afirmar que es un gran problema clínico y de salud pública. Así, se ha despertado el interés por el control del dolor de la comunidad científica3–8 y de instituciones como el Institute of Medicine9 o como la Organización Mundial de la Salud, en cuyo documento «WHO Normative Guidelines on Pain Management»10 describe la necesidad de crear guías de práctica clínica (GPC) para el manejo del dolor en diferentes poblaciones.
Una GPC es una herramienta concebida para optimizar la atención del paciente y servir de apoyo en la práctica clínica, así como en la política sanitaria y de salud pública. Su potencial beneficio va desde facilitar la traslación de la evidencia a la práctica, ayudar en la toma de decisiones y proveer estrategias terapéuticas beneficiosas dado un problema de salud11–13, hasta mejorar la organización, calidad y consistencia de la atención11,12. Las GPC han demostrado mejorar procesos de atención y resultados de salud de los pacientes14–16, pero su efectividad depende en gran medida de la adherencia de los profesionales17 y de sus características intrínsecas18, entre otros factores19. Guías de alto rigor metodológico pueden aumentar la calidad de la atención sanitaria20, mientras que guías de baja calidad pueden incluso degradarla21. Por ello, el Institute of Medicine redefinió sus estándares de calidad para guías de práctica clínica con la finalidad de establecer los requisitos básicos que garanticen el desarrollo de guías confiables22.
Existen varias revisiones que evalúan la calidad metodológica de GPC en pacientes oncológicos23–25, pero ninguna ha revisado la calidad y el contenido de estas en el manejo del dolor oncológico. Por ello, el objetivo de este trabajo es la realización de una revisión sistemática con un análisis de: a) la calidad formal y metodológica; b) el contenido; y c) la validez de las GPC actuales sobre el manejo del dolor en pacientes con cáncer.
Material y métodosFuentes de datosSe realizó una búsqueda sistemática de la literatura en las bases de datos PubMed, National Guideline Clearinghouse, SAGE Directory, GuíaSalud, NHS Evidence Search, Haute Autorité de Santé, y Belgian Health Care Knowledge Centre.
Adicionalmente, se realizó una búsqueda en las páginas de las sociedades científicas National Institute for Health and Clinical Excellence, New Zealand Guidelines Group, Scottish Intercollegiate Guidelines Network, Agence National de Sécurité du Médicament et des Produits de Santé, British Pain Society, European Association of Palliative Care, Société Française d’Accompagnement et de Soins Palliatifs, Sociedad Española de Cuidados Paliativos y Oncoline, y en el motor de búsqueda Google a fin de encontrar literatura no indexada.
Estrategia de búsquedaLa búsqueda fue realizada en junio de 2013. Se aplicaron los siguientes límites en las bases de datos: a) GPC como tipo de publicación; b) publicadas en los últimos 5 años (2008-2013); c) publicadas en inglés, francés o español; d) oncología general u oncología como tipo de especialidad; e) tratamiento, seguimiento, manejo, prevención, rehabilitación, evaluación de efectividad terapéutica, cuidados psicosociales y cuidados paliativos, y/o final de la vida como categoría de clasificación de las guías. Las palabras clave utilizadas fueron: «cancer pain», «pain» o «pain management»; «douleur cancéreuse», «douleur» y/o «cancer» en francés; y «dolor oncológico», «dolor» y/o «cáncer» en español.
En las páginas de las sociedades científicas se realizó la búsqueda por temáticas o con texto libre, utilizando los términos: «cancer pain» (inglés); «douleur» y «cancer» (francés); «dolor» y «cáncer» (español).
Criterios de selecciónNo se consideraron guías anteriores a 2008 ni versiones online, utilizando los siguientes criterios de inclusión: a) guía de práctica clínica como tipo de publicación; b) la guía está dirigida al manejo del dolor en pacientes con cáncer; y c) la guía está escrita en inglés, francés o español.
Las guías fueron excluidas en base a los siguientes criterios: a) la GPC se trata de una versión antigua de otra incluida; b) la GPC está dirigida a un solo tipo de terapia o subgrupo de la población con cáncer (cuidados al final de la vida, un determinado tipo de cáncer, una condición de salud concreta, etc.); c) el método de creación de la GPC no está basado en la evidencia; y d) la GPC no contiene recomendaciones explícitas. Se consideró recomendación válida toda afirmación o enunciado fácilmente identificable que sintetizase la evidencia de una o varias terapias de la/s que debe hacerse uso, puede hacerse uso o se aconseja sobre su uso, ya sea de forma positiva o negativa.
Todas las guías fueron valoradas en su versión completa. Aquellas dudosas para su inclusión o exclusión fueron revisadas por un revisor independiente.
Análisis de la calidad formal y metodológicaLa calidad metodológica de las GPC incluidas en este estudio fue evaluada con la herramienta Appraisal of Guidelines, Research and Evaluation II (AGREE-II), en su versión española26, por dos revisores independientes. Las discrepancias en las puntuaciones individuales (definidas como una diferencia entre los revisores ≥3 puntos sobre 7 para un mismo ítem) fueron debatidas, y modificadas en caso de mala identificación del contenido de la guía o malinterpretación de los criterios de AGREE-II, respetando discrepancias por otro motivo. Se llevó a cabo un análisis de la fiabilidad y concordancia entre observadores mediante el índice de Kappa ponderado cuadrático para el conjunto y para cada guía utilizando la macro !KAPPA for SPSS27 en SPSS 19.0. Para la interpretación de la fuerza de concordancia del índice Kappa se utilizaron los criterios propuestos por Landis y Koch28, y adicionalmente el porcentaje de acuerdo.
Se contactó con los autores de las guías a fin de recabar información ausente que pudiera ser relevante para el análisis con la herramienta AGREE-II.
Análisis del contenidoSe analizó el contenido de cada guía extrayendo las recomendaciones y clasificándolas por tipo de recomendación en base a categorías –distribuidas en áreas, dominios y subdominios–, así como por nivel de evidencia y fuerza de recomendación, por dos evaluadores independientes.
Las categorías antes mencionadas se dividieron en dos áreas: área de manejo clínico del paciente; y área de aspectos estructurales. Mientras que el área de manejo clínico del paciente está compuesta por 5 dominios del continuum asistencial del paciente oncológico (evaluación; tratamiento farmacológico; tratamiento no farmacológico; educación; y seguimiento), el área de aspectos estructurales estaba dividida en 3 aspectos, llamados aquí dominios, descritos por Donabedian29 (recursos materiales; recursos humanos; y organización). Por último, dentro de los dominios de tratamiento farmacológico y no farmacológico se definieron subdominios que pudiesen ayudar a clasificar las recomendaciones por terapéutica. Así, se definieron cuatro subdominios para tratamiento farmacológico (principios generales; no opioides; opioides; y control de efectos secundarios), y otros cuatro para el tratamiento no farmacológico (tratamiento psicológico; fisioterapia y terapias complementarias; terapia intervencionista; y radioterapia y medicina nuclear).
Para la clasificación por nivel de evidencia y fuerza de recomendación se utilizó la gradación Centre of Evidence-Based Medicine of Oxford Levels of Evidence30. Dada la existencia de sistemas de gradación diferentes en las guías analizadas, se realizó una tabla de equivalencia para comparar las recomendaciones en un sistema común. Se aprovechó el contacto con los autores para pedir los sistemas de gradación de evidencia y fuerza de recomendación a los que no los explicitasen en sus guías.
Por último, una vez clasificadas las recomendaciones por categorías y por nivel de evidencia y fuerza de recomendación, se decidió llevar a cabo un análisis de la variabilidad extrayendo las recomendaciones de más alto nivel de evidencia y fuerza de recomendación (nivel 1, A del CEBM de Oxford), sintetizándolas en un listado que nos permitiese comparar entre las guías la presencia o no del contenido más relevante sobre manejo del dolor en cáncer.
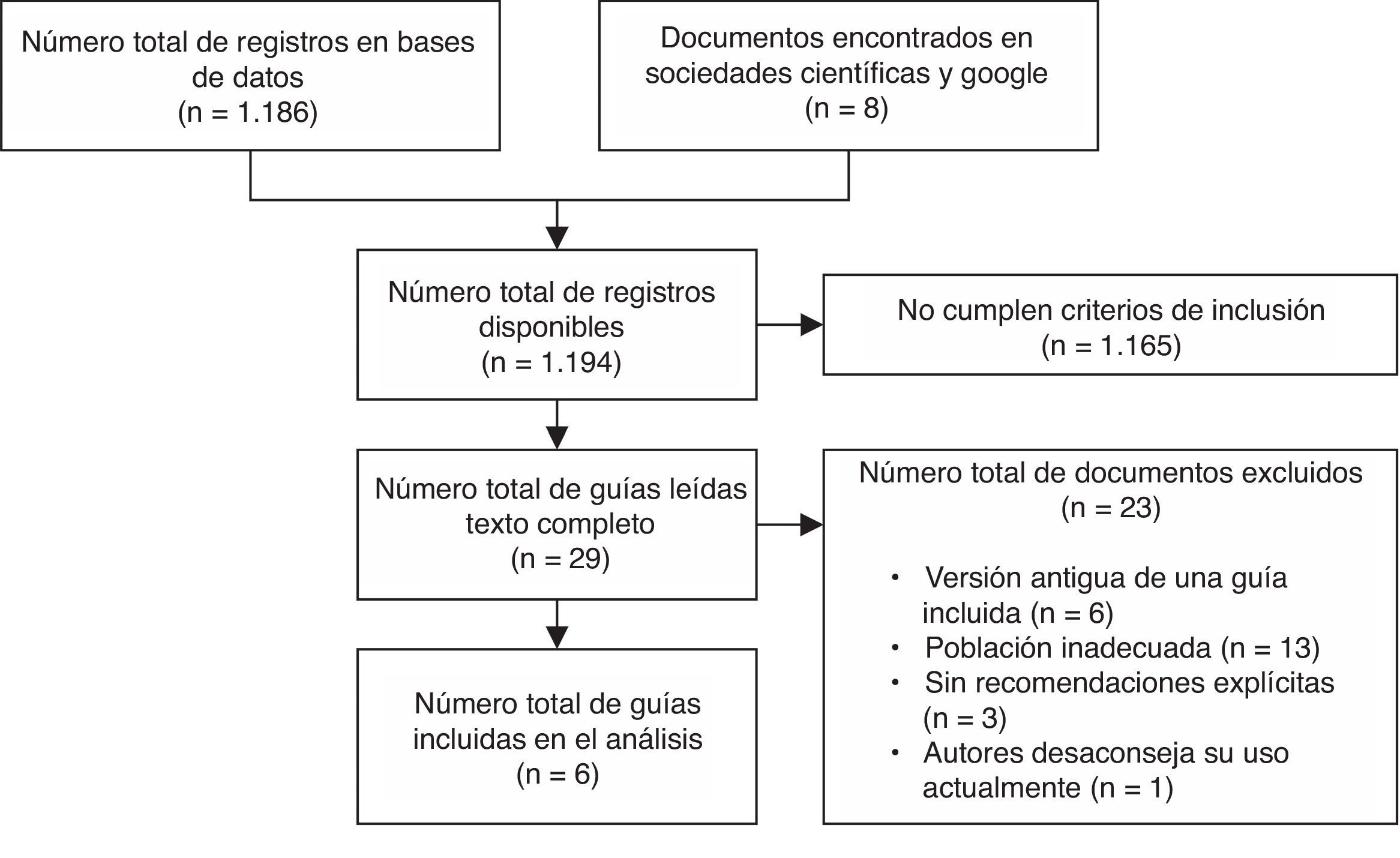
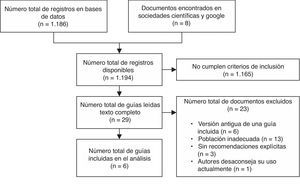
ResultadosResultados de la búsqueda bibliográficaLos resultados obtenidos con la estrategia de búsqueda se muestran en la figura 1. Tan solo 6 GPC fueron incluidas en el análisis31–36.
De las seis guías incluidas, cuatro son europeas31,32,35,36, una de Canadá34, y otra de Malasia33. En cuanto a organización que las ha desarrollado, cuatro son agencias gubernamentales –Scottish Intercollegiate Guidelines Network31 (SIGN) y National Health Service Quality Improvement Scotland32 del Reino Unido, Cancer Care Ontario34 (CCO) en el caso de Canadá, y el Ministerio de Salud de Malasia33 (MOHM)– y dos son sociedades científicas –Sociedad Española de Oncología Médica (SEOM)35 y European Society of Medical Oncology36–.
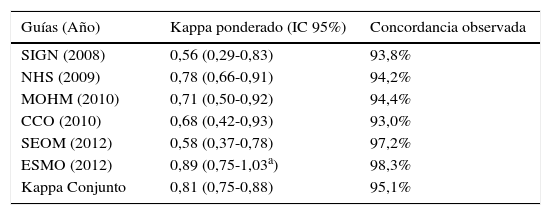
Calidad formal y metodológicaSe encontró una fiabilidad entre los evaluadores para la puntuación conjunta de todas las guías de 0,81 (IC 95% 0,75-0,88), lo que se consideraría una concordancia casi perfecta según Landis y Koch28.
De forma individual, existía variación de la concordancia en función de la guía analizada y el intervalo de confianza era muy amplio (tabla 1), pero todas las evaluaciones contaron con porcentajes de acuerdo por encima del 93% (rango de 93 a 98,3%).
Concordancia entre los dos evaluadores en el uso del instrumento AGREE-II
| Guías (Año) | Kappa ponderado (IC 95%) | Concordancia observada |
|---|---|---|
| SIGN (2008) | 0,56 (0,29-0,83) | 93,8% |
| NHS (2009) | 0,78 (0,66-0,91) | 94,2% |
| MOHM (2010) | 0,71 (0,50-0,92) | 94,4% |
| CCO (2010) | 0,68 (0,42-0,93) | 93,0% |
| SEOM (2012) | 0,58 (0,37-0,78) | 97,2% |
| ESMO (2012) | 0,89 (0,75-1,03a) | 98,3% |
| Kappa Conjunto | 0,81 (0,75-0,88) | 95,1% |
CCO: Cancer Care Ontario; ESMO: European Society of Medical Oncology; IC: intervalo de confianza; MOHM: Ministerio de Salud de Malasia; NHS: National Health Service Quality Improvement Scotland; SEOM: Sociedad Española de Oncología Médica;. SIGN: Scottish Intercollegiate Guidelines Network.
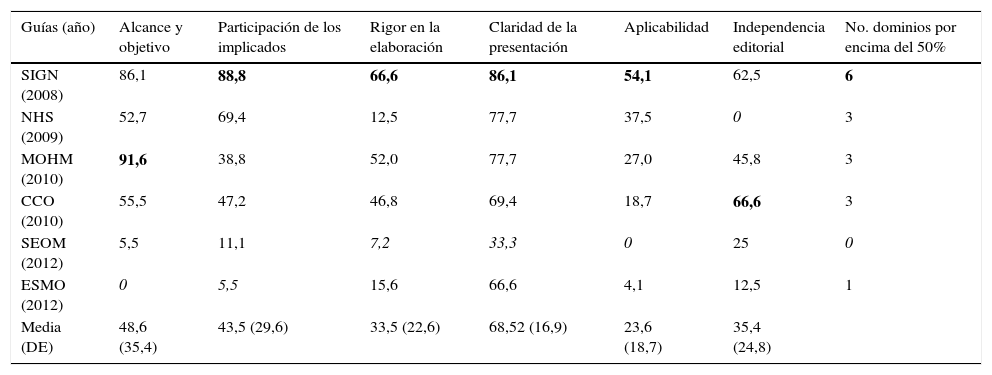
Los resultados de AGREE-II mostraron una variación en la calidad formal y metodológica entre guías (tabla 2). Esta variabilidad se mostró más evidente en el dominio de «alcance y objetivo» con una media de 48,6% (rango de 0 a 91,6%), mientras que el dominio de «claridad de presentación» parecía ser en el que menos diferencias había entre guías, media de 68,5% (rango de 33,3 a 86,1%).
Puntuaciones en porcentaje de los dominios del instrumento AGREE-II por dos evaluadores
| Guías (año) | Alcance y objetivo | Participación de los implicados | Rigor en la elaboración | Claridad de la presentación | Aplicabilidad | Independencia editorial | No. dominios por encima del 50% |
|---|---|---|---|---|---|---|---|
| SIGN (2008) | 86,1 | 88,8 | 66,6 | 86,1 | 54,1 | 62,5 | 6 |
| NHS (2009) | 52,7 | 69,4 | 12,5 | 77,7 | 37,5 | 0 | 3 |
| MOHM (2010) | 91,6 | 38,8 | 52,0 | 77,7 | 27,0 | 45,8 | 3 |
| CCO (2010) | 55,5 | 47,2 | 46,8 | 69,4 | 18,7 | 66,6 | 3 |
| SEOM (2012) | 5,5 | 11,1 | 7,2 | 33,3 | 0 | 25 | 0 |
| ESMO (2012) | 0 | 5,5 | 15,6 | 66,6 | 4,1 | 12,5 | 1 |
| Media (DE) | 48,6 (35,4) | 43,5 (29,6) | 33,5 (22,6) | 68,52 (16,9) | 23,6 (18,7) | 35,4 (24,8) |
CCO: Cancer Care Ontario; DE: Desviación Estándar; ESMO: European Society of Medical Oncology; MOHM: Ministerio de Salud de Malasia; NHS: National Health Service Quality Improvement Scotland; SEOM: Sociedad Española de Oncología Médica; SIGN: Scottish Intercollegiate Guidelines Network.
En negrita: puntuación más alta en cada apartado.
En cursiva: puntuación más baja en cada apartado.
En general, podemos decir que el dominio en el que peor puntuaron todas las guías fue el de «aplicabilidad», mientras que el dominio en el que mejor puntuaron fue el de «claridad de presentación».
A título individual, la guía de SIGN31 fue la que acumuló el mayor número de dominios con la puntuación más alta –exactamente 4 de los 6 dominios posibles– y además, fue la única guía que obtuvo una puntuación por encima del 50% en todos ellos (tabla 2). Por otro lado, la guía de la SEOM35 fue la que acumuló el mayor número de dominios con la puntuación más baja –3 de los 6 posibles– no llegando a una puntuación del 50% en ninguno de los seis.
La puntuación global de AGREE-II mostró una media de 5 para la guía mejor evaluada, la de SIGN31, seguida de una media de 4 para las de Malasia33 y la canadiense34. Las demás obtuvieron una puntuación global media entre 3 y 2, siendo la de la SEOM35 la peor valorada. Ninguna guía resultó recomendada sin modificaciones por los revisores, aunque en las de Scottish Intercollegiate Guidelines Network31 y Ministerio de Salud de Malasia33 los evaluadores concordaron en recomendarlas con modificaciones y en las de SEOM35 y European Society of Medical Oncology36 concordaron en no recomendarlas.
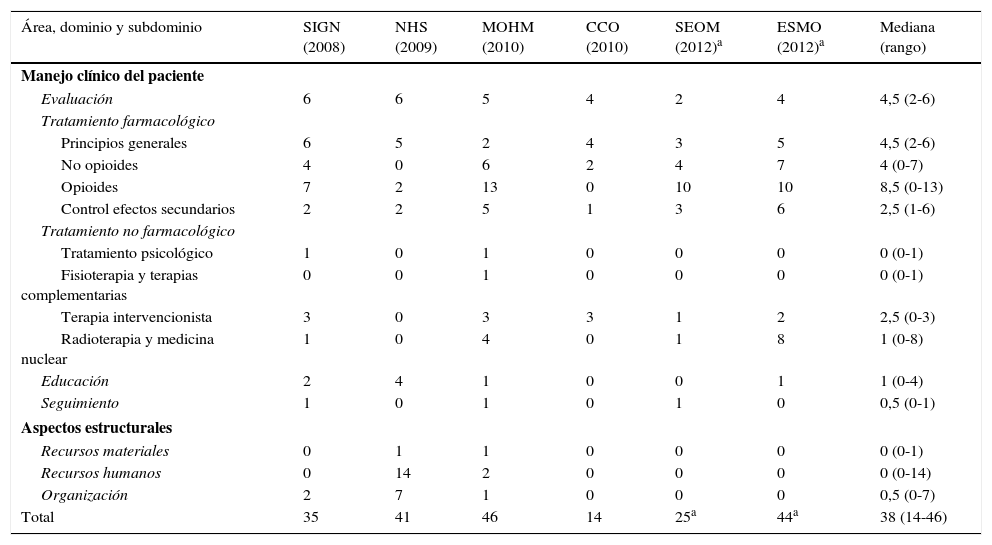
Contenido y variabilidadSe extrajeron 206 recomendaciones de las guías incluidas en el análisis, de las cuales se excluyeron 2 debido a que su redacción y contenido no permitía considerarlas como recomendaciones válidas. De las 204 recomendaciones analizadas, 42 (20,5%) pertenecen al subdominio de «tratamiento farmacológico con opioides», siendo la categoría con mayor número de recomendaciones. Por otra parte, las categorías con menor número de recomendaciones son los dominios o subdominios de: «seguimiento» con 3 (1,47%) recomendaciones; «recursos materiales» con 2 (0,98%); «tratamiento psicológico» con 2 (0,98%); y «fisioterapia y terapias alternativas» con 1 (0,49%). A título individual, cada guía recoge un número diferente de recomendaciones por categoría, existiendo mucha variabilidad entre guías (tabla 3).
Número de recomendaciones de cada guía por dominio y/o subdominio
| Área, dominio y subdominio | SIGN (2008) | NHS (2009) | MOHM (2010) | CCO (2010) | SEOM (2012)a | ESMO (2012)a | Mediana (rango) |
|---|---|---|---|---|---|---|---|
| Manejo clínico del paciente | |||||||
| Evaluación | 6 | 6 | 5 | 4 | 2 | 4 | 4,5 (2-6) |
| Tratamiento farmacológico | |||||||
| Principios generales | 6 | 5 | 2 | 4 | 3 | 5 | 4,5 (2-6) |
| No opioides | 4 | 0 | 6 | 2 | 4 | 7 | 4 (0-7) |
| Opioides | 7 | 2 | 13 | 0 | 10 | 10 | 8,5 (0-13) |
| Control efectos secundarios | 2 | 2 | 5 | 1 | 3 | 6 | 2,5 (1-6) |
| Tratamiento no farmacológico | |||||||
| Tratamiento psicológico | 1 | 0 | 1 | 0 | 0 | 0 | 0 (0-1) |
| Fisioterapia y terapias complementarias | 0 | 0 | 1 | 0 | 0 | 0 | 0 (0-1) |
| Terapia intervencionista | 3 | 0 | 3 | 3 | 1 | 2 | 2,5 (0-3) |
| Radioterapia y medicina nuclear | 1 | 0 | 4 | 0 | 1 | 8 | 1 (0-8) |
| Educación | 2 | 4 | 1 | 0 | 0 | 1 | 1 (0-4) |
| Seguimiento | 1 | 0 | 1 | 0 | 1 | 0 | 0,5 (0-1) |
| Aspectos estructurales | |||||||
| Recursos materiales | 0 | 1 | 1 | 0 | 0 | 0 | 0 (0-1) |
| Recursos humanos | 0 | 14 | 2 | 0 | 0 | 0 | 0 (0-14) |
| Organización | 2 | 7 | 1 | 0 | 0 | 0 | 0,5 (0-7) |
| Total | 35 | 41 | 46 | 14 | 25a | 44a | 38 (14-46) |
Durante el análisis del nivel de evidencia y fuerza de recomendación, un tercio de las recomendaciones (68) no pudieron ser clasificadas. Cincuenta (24,5%) no explicitan nivel de evidencia ni fuerza de recomendación –perteneciendo la mayoría (41) a la guía de NHS32–, mientras que de las otras 18 (8,82%) no se pudieron interpretar los niveles de evidencia y fuerzas de recomendación por la falta de un sistema de gradación en la guía –que tampoco se obtuvo a pesar de una petición expresa a los autores–. Estas 18 recomendaciones pertenecían a la GPC de la SEOM35.
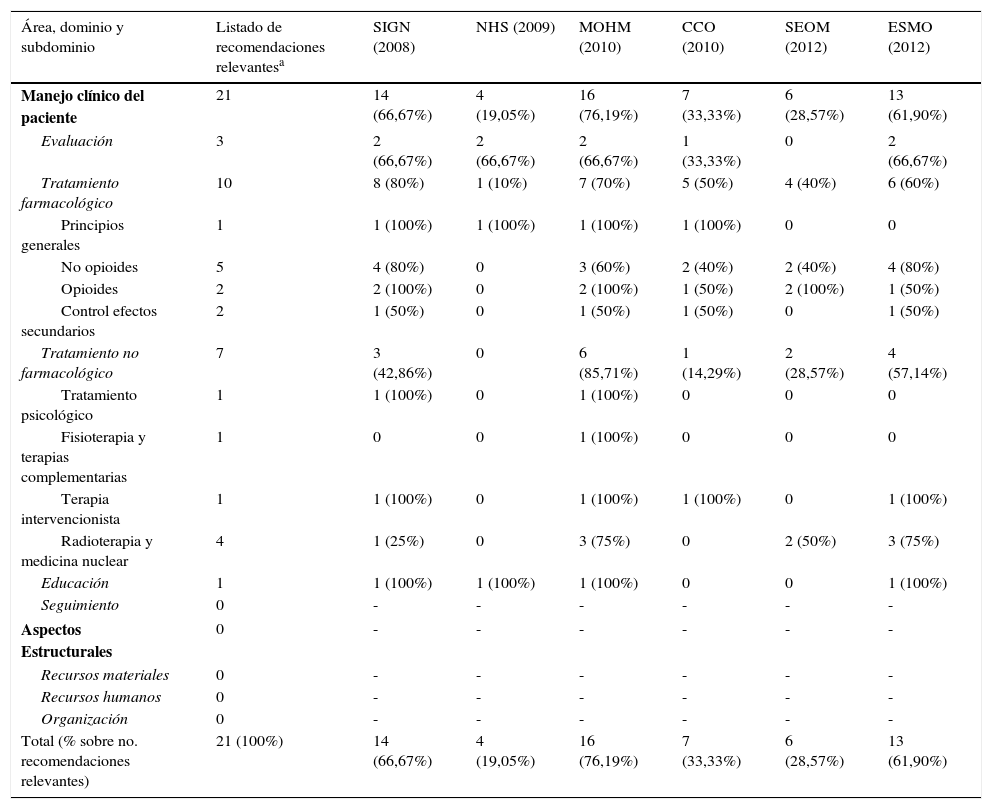
Con el más alto nivel de evidencia (1, A), se obtuvieron 21 recomendaciones relevantes para el manejo del dolor en pacientes oncológicos (tabla 4). Considerando estas recomendaciones en proporción al número de recomendaciones de cada una de las guías, ninguna de estas superó el 25%, encontrándose entre un 17,1% y un 25%.
Recomendaciones relevantes (nivel 1, fuerza A) en el manejo del dolor oncológico y guías que las contienen
| Recomendación | Dominio/subdominio | No. guías |
|---|---|---|
| El paciente debe ser el principal evaluador de su dolor | Evaluación | 431–34 |
| Una evaluación exhaustiva del dolor crónico debe incluir un examen del distrés psicológico | Evaluación | 431–33,36 |
| Un diagnóstico temprano y un tratamiento precoz son fuertes predictores de buenos resultados en compresión medular metastásica | Evaluación | 136 |
| Las intervenciones psicológicas, incluyendo educación psicológica y terapia cognitivo-conductual, son útiles y deben ser consideradas en pacientes con dolor oncológico con distrés psicológico y discapacidad asociados | Medidas no farmacológicas: tratamiento psicológico | 231,33 |
| El tratamiento del dolor oncológico en ambiente clínico y domiciliario debe estar basado en la Escala Analgésica de la OMS | Medidas farmacológicas: principios generales | 431–34 |
| El paracetamol y AINE, incluyendo inhibidores COX-2, son efectivos para tratar todas las intensidades del dolor y deben ser utilizadas en pacientes con dolor leve o en combinación con opioides en otros escalones de la escala analgésica de la OMS, salvo contraindicación. Si no hay respuesta significativa en una semana, estos fármacos deben de retirarse | Medidas farmacológicas: no opioides | 531,33–36 |
| AINE a largo plazo requieren protección de la mucosa gástrica. Los pacientes que toman antiinflamatorios no esteroideos con alto riesgo de complicaciones gastrointestinales deben tener prescrito misoprostol 800 mcg/día, dosis estándar de inhibidores de la bomba de protones o doble dosis de antagonistas H2 como profilaxis farmacológica | Medidas farmacológicas: control de efectos secundarios | 231,34 |
| Los cannabinoides no están recomendados para el tratamiento del dolor oncológico | Medidas farmacológicas: no opioides | 131 |
| Los antidepresivos tricíclicos (amitriptilina o imipramina) o anticomiciales (gabapentina, carbamazepina o fenitoína) deben prescribirse, con cuidadosa monitorización de efectos secundarios, como primera línea de coanalgésicos en pacientes con dolor neuropático. La elección de antidepresivos o anticomiciales debe estar basada en enfermedades concomitantes, terapia farmacológica y sus efectos adversos, e interacciones experimentadas | Medidas farmacológicas: no opioides | 431,33,34,36 |
| La titulación rápida vía IV o SC de la morfina es preferible como control inicial del dolor en pacientes que presentan dolor oncológico intenso | Medidas farmacológicas: opioides | 431,33–35 |
| Los opioides de liberación rápida deben utilizarse para tratar exacerbaciones del dolor de fondo controlado. Opioides intravenosos, así como fentanilo bucal, sublingual o intranasal, tienen un inicio más rápido de su actividad analgésica en el tratamiento del dolor irruptivo con respecto a la morfina oral | Medidas farmacológicas: opioides | 431,33,35,36 |
| Los laxantes deben de prescribirse de forma rutinaria para la profilaxis y el manejo del estreñimiento inducido por opioides | Medidas farmacológicas: control de efectos secundarios | 233,36 |
| Fisioterapia y terapias complementarias pueden usarse como coadyuvante para pacientes con dolor oncológico | Medidas no farmacológicas: fisioterapia y terapias complementarias | 133 |
| Los profesionales sanitarios tienen el deber de implementar intervenciones de educación del paciente para superar las barreras en el manejo del dolor oncológico | Educación | 431–33,36 |
| Los bifosfonatos pueden considerarse donde los analgésicos y/o la radioterapia son inadecuados para el manejo de metástasis óseas dolorosas | Medidas farmacológicas: no opioides | 431,33,35,36 |
| Denosumab debería ser considerado como alternativa válida de los bifosfonatos para el tratamiento de pacientes con/sin dolor debido metástasis ósea de tumores sólidos | Medidas farmacológicas: no opioides | 136 |
| La radioterapia es efectiva y segura. Los pacientes con dolor óseo metastásico deberían ser referidos pronto a un oncólogo y ser evaluados para radioterapia | Medidas no farmacológicas: radioterapia y medicina nuclear | 431,33,35,36 |
| La radioterapia monodósis es la preferible para metástasis óseas dolorosas no complicadas, y la posología debería ser 8-Gy en una única dosis | Medidas no farmacológicas: radioterapia y medicina nuclear | 233,36 |
| La radiación hemicorporal debería de considerarse en pacientes con metástasis óseas diseminadas para el alivio rápido del dolor | Medidas no farmacológicas: radioterapia y medicina nuclear | 133 |
| El bloqueo del plexo celiaco debería de considerarse en pacientes con cáncer pancreático y dolor | Medidas no farmacológicas: terapia intervencionista | 431,33,34,36 |
| El régimen de radioterapia hipofraccionada puede considerarse el abordaje de elección en compresión medular metastásica | Medidas no farmacológicas: radioterapia y medicina nuclear | 235,36 |
Existió una gran variabilidad de este contenido en las guías, no encontrándose ninguna recomendación presente en las 6 guías a la vez (tabla 4 y tabla 5). La recomendación más frecuente fue el uso de paracetamol y antiinflamatorios no esteroideos, en cinco de las seis guías, mientras que las menos frecuentes son: el diagnóstico y tratamiento precoz en la compresión medular metastásica; la evitación de cannabinoides (como primera opción); la fisioterapia y terapias complementarias como coadyuvante; el tratamiento con denosumab como alternativa a los bifosfonatos; y la radioterapia hemicorporal en el caso de metástasis óseas diseminadas para el alivio rápido del dolor (tabla 4).
Número y porcentaje de recomendaciones relevantes contenidas en cada guía por área, dominio y subdominio
| Área, dominio y subdominio | Listado de recomendaciones relevantesa | SIGN (2008) | NHS (2009) | MOHM (2010) | CCO (2010) | SEOM (2012) | ESMO (2012) |
|---|---|---|---|---|---|---|---|
| Manejo clínico del paciente | 21 | 14 (66,67%) | 4 (19,05%) | 16 (76,19%) | 7 (33,33%) | 6 (28,57%) | 13 (61,90%) |
| Evaluación | 3 | 2 (66,67%) | 2 (66,67%) | 2 (66,67%) | 1 (33,33%) | 0 | 2 (66,67%) |
| Tratamiento farmacológico | 10 | 8 (80%) | 1 (10%) | 7 (70%) | 5 (50%) | 4 (40%) | 6 (60%) |
| Principios generales | 1 | 1 (100%) | 1 (100%) | 1 (100%) | 1 (100%) | 0 | 0 |
| No opioides | 5 | 4 (80%) | 0 | 3 (60%) | 2 (40%) | 2 (40%) | 4 (80%) |
| Opioides | 2 | 2 (100%) | 0 | 2 (100%) | 1 (50%) | 2 (100%) | 1 (50%) |
| Control efectos secundarios | 2 | 1 (50%) | 0 | 1 (50%) | 1 (50%) | 0 | 1 (50%) |
| Tratamiento no farmacológico | 7 | 3 (42,86%) | 0 | 6 (85,71%) | 1 (14,29%) | 2 (28,57%) | 4 (57,14%) |
| Tratamiento psicológico | 1 | 1 (100%) | 0 | 1 (100%) | 0 | 0 | 0 |
| Fisioterapia y terapias complementarias | 1 | 0 | 0 | 1 (100%) | 0 | 0 | 0 |
| Terapia intervencionista | 1 | 1 (100%) | 0 | 1 (100%) | 1 (100%) | 0 | 1 (100%) |
| Radioterapia y medicina nuclear | 4 | 1 (25%) | 0 | 3 (75%) | 0 | 2 (50%) | 3 (75%) |
| Educación | 1 | 1 (100%) | 1 (100%) | 1 (100%) | 0 | 0 | 1 (100%) |
| Seguimiento | 0 | - | - | - | - | - | - |
| Aspectos Estructurales | 0 | - | - | - | - | - | - |
| Recursos materiales | 0 | - | - | - | - | - | - |
| Recursos humanos | 0 | - | - | - | - | - | - |
| Organización | 0 | - | - | - | - | - | - |
| Total (% sobre no. recomendaciones relevantes) | 21 (100%) | 14 (66,67%) | 4 (19,05%) | 16 (76,19%) | 7 (33,33%) | 6 (28,57%) | 13 (61,90%) |
La GPC del Ministerio de Salud de Malasia33 fue la más completa en este sentido, con un 76,19% de las 21 recomendaciones identificadas como relevantes (tabla 5), seguida de la de Scottish Intercollegiate Guidelines Network31 (66,67%). En cambio, las dos en las que menos contenido relevante se encontró fueron la guía de National Health Service Quality Improvement Scotland32 (19,05%) y la de la SEOM35 (28,57%). La media de recomendaciones relevantes encontrada en las guías fue 10 (47,62%) en un rango de 4 (19,05%) a 16 (76,19%).
DiscusiónEn nuestro estudio hemos encontrado una gran variabilidad y diferencia entre las pocas guías que abordan ampliamente este tema, tanto en la frecuencia de recomendaciones dentro de un mismo dominio o subdominio, como en el contenido de alta evidencia, en total y por categorías. Esta circunstancia, unida al aún deficiente manejo del dolor oncológico37, pone de manifiesto la necesidad de mejorar y crear nuevas herramientas que ayuden a progresar hacia una práctica de calidad38 y afrontar las barreras existentes39–41.
Una adecuada búsqueda bibliográfica durante el desarrollo de las GPC garantizaría que todas aquellas recomendaciones de alto nivel de evidencia estuviesen presentes en todas las guías cuyo alcance y población diana es el mismo. Aunque cierta variabilidad puede deberse a razones específicas del contexto de aplicación42, guías con el mismo alcance deberían llegar a conclusiones similares sobre temas donde existe suficiente evidencia de alta calidad. Las guías con mayor validez de contenido del presente estudio son las de MOHM33, SIGN31 y European Society of Medical Oncology36, pero distan bastante de contener toda la evidencia relevante necesaria para afrontar un control del dolor de forma integral. Precisamente, las de SIGN31 y MOHM33 son las que obtienen mejor puntuación con AGREE-II para «rigor en la elaboración» (tabla 2), aunque no hemos encontrado una relación franca entre este dominio y el contenido de alto nivel de evidencia. Si además consideramos que, en general, el dominio de «aplicabilidad» es el peor puntuado para todas las guías de este estudio, nos enfrentamos a una barrera de su uso y utilidad, tanto a nivel clínico como para la mejora de la calidad asistencial.
En base a las puntuaciones obtenidas con AGREE-II, la guía de SIGN31 es la que tiene una mayor calidad metodológica y formal. No obstante, hay que tener en cuenta la influencia de las características del organismo desarrollador de la guía y de algunos factores intrínsecos que condicionan estos resultados16,43.
Así, aquellas que cuentan con información detallada adicional y materiales de apoyo han demostrado estar correlacionadas con una mejor puntuación en todos los dominios (salvo «aplicabilidad»), y de forma más evidente en «rigor en la elaboración»16. Este es un factor que influye en la guía de SIGN31 y la de MOHM33, ambas con materiales adicionales.
Según los resultados obtenidos, la guía de SEOM35 es la que peor puntúa. Los defectos del aspecto formal, principalmente la redacción y descripción del método de desarrollo de la guía, deben considerarse como predictores en gran medida de dichos resultados.
Por otro lado, es difícil establecer qué guías son aceptables, buenas o malas, salvo francas diferencias en puntuación, ya que no existe todavía un criterio explícito y objetivo dentro de AGREE-II que lo permita26.
Solo existe un artículo que analice GPC relacionadas con el dolor oncológico25, cuyo análisis del contenido se realiza dentro de las competencias de la fisioterapia y en el que solo 2 guías permiten comparar resultados en AGREE-II: la de SIGN31 y la de CCO34. Sus resultados de AGREE-II para estas guías obtienen valores por encima de los nuestros y muy dispares. El único paralelismo encontrado es que la guía de SIGN es la mejor evaluada en su análisis comparativo entre las 6 guías identificadas entre 2001 y 2011, teniendo la mayor puntuación en todos los dominios salvo en «independencia editorial», en el que la guía de CCO es la mejor evaluada25. Parecen existir diferencias en la evaluación con AGREE-II entre grupos e incluso entre evaluadores del mismo grupo, como les sucede a los autores del estudio25, pero la guía de SIGN es la mejor valorada entre las coetáneas en ambas revisiones independientes.
Hemos analizado la fiabilidad interobservador mediante un índice de Kappa ponderado, matemáticamente equivalente al coeficiente de correlación intraclase44, obteniendo índices y/o porcentajes de acuerdo relativamente altos. Esto se convierte en una fortaleza de nuestro estudio pues, si bien no se puede garantizar la comparabilidad de los resultados de AGREE-II entre grupos, nos permite decir con un cierto grado de certeza qué guías son relativamente de mejor calidad y cuáles de peor calidad entre las analizadas en este trabajo.
La herramienta AGREE-II tiene otras limitaciones para evaluar la calidad general de las GPC; es bastante subjetiva en la evaluación de sus ítems45, y no evalúa si las recomendaciones son apropiadas y válidas45,46. Por ello, nuestro trabajo se completa con un análisis crítico del contenido para determinar la guía más fiable y válida. Si bien es cierto que no se ha comparado dicho contenido con una revisión independiente de la literatura47, lo cual puede considerarse una limitación, se ha analizado la evidencia más fuerte contenida en ellas.
Se puede hacer uso a nivel gestor del listado de recomendaciones relevantes sintetizadas en este trabajo, considerándolas como los mínimos estándares de la práctica clínica en el manejo del dolor en pacientes con cáncer. La comparación entre la realidad asistencial y estos estándares, a través de un sistema de indicadores validados, ayudaría a clarificar qué áreas precisan acciones de mejora en la estructura y/o el proceso de la atención. Un ejemplo de ello pueden ser los indicadores de dolor crónico oncológico recientemente publicados37.
Las GPC más válidas y útiles son la de Scottish Intercollegiate Guidelines Network31 y la del Ministerio de Salud de Malasia33. Recomendamos, con limitaciones, su uso a nivel clínico por encima de otras como la de National Health Service Quality Improvement Scotland32 y la de la SEOM35; esta última tiene mucho por mejorar frente a las extranjeras.
Por último, este trabajo clarifica cuáles son las limitaciones de las guías analizadas, con lo que puede servir de retroalimentación a autores de guías y usuarios, tanto en el desarrollo como en el uso de este tipo de herramientas de diseño de la calidad asistencial.