La diarrea es la segunda causa de muerte en el mundo y el rotavirus es el principal agente causante en el lactante y el niño menor de 5 años. Por este motivo, la OMS y la Alianza Mundial para las Vacunas y la Inmunización (GAVI) consideran de prioridad urgente la vacunación contra el rotavirus. La distribución mundial de los serotipos de rotavirus es variable de un país a otro, pero entre el 80 y el 90% de los casos están causados por 5 tipos: G1P[8], G2P[4], G3P[8], G4P[8] y G9P[8]. Actualmente se dispone de 2 vacunas frente a rotavirus, una monovalente fabricada a partir de una cepa humana atenuada G1P[8], y una pentavalente, recombinante bovina-humana, que contiene 5 cepas del rotavirus bovino WC3, 4 con un gen que codifica la proteína VP7 de los rotavirus humanos G1, G2, G3 y G4, y la quinta que expresa la VP4 del genotipo P[8].
Diarrhea is the second cause of death worldwide. The main causative agent in infants and children less than 5 years is rotavirus. Consequently, for the World Health Organization and the Global Alliance for Vaccines and Immunization (GAVI), rotavirus vaccination is an urgent priority. The global distribution of rotavirus serotypes varies from country to country, but in 80-90% of cases is caused by five types: G1P[8], G2P[4], G3P[8], G4P[8] and G9P[8]. Currently, two rotavirus vaccines are available, an attenuated monovalent G1P[8] vaccine, and a pentavalent human-bovine recombinant vaccine containing five strains of bovine WC3 rotavirus, four with a gene codifying the VP7 protein of human rotaviruses G1, G2, G3 and G4, and a fifth expressing the VP4 P[8] genotype.
La gastroenteritis por rotavirus,
una enfermedad infravalorada e inmunoprevenible
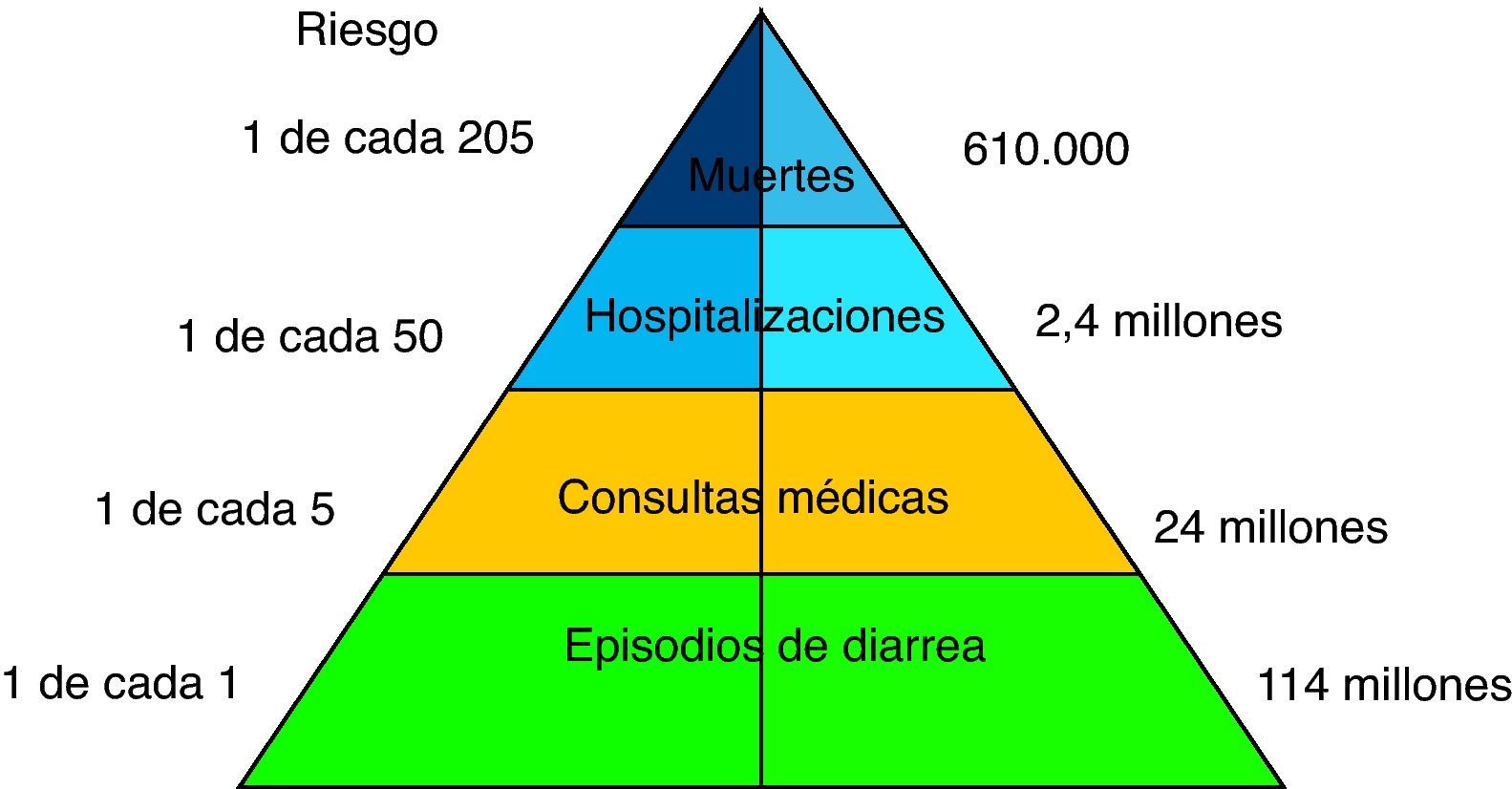
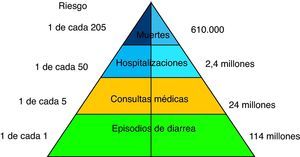
IntroducciónLa prevención de la enfermedad diarreica aguda es todavía uno de los retos más importantes de la salud pública y de la pediatría en el mundo, principalmente en los países de baja renta, donde las tasas de mortalidad y hospitalización que origina son elevadas. La diarrea es la segunda causa de muerte en el mundo y el rotavirus es el principal agente causante en el lactante y el niño menor de 5 años, con unas mayores incidencia y gravedad entre los 3 y los 24 meses de edad. En los países industrializados y en desarrollo se producen cada año alrededor de 114 millones de episodios de gastroenteritis por rotavirus; la mayoría solo precisan cuidados en el domicilio, pero generan 24 millones de visitas médicas y 2,4 millones de hospitalizaciones1 (fig. 1). La mortalidad es de aproximadamente 611.000 casos, un tercio de todos los fallecimientos por diarrea2,3. El 80% de las muertes anuales por esta causa ocurre en los países del sur de Asia y de África subsahariana.
Carga global anual de la gastroenteritis por rotavirus en los niños menores de 5 años1,15.
La gastroenteritis por rotavirus es la tercera enfermedad prevenible por vacunas como causa de muerte en los niños menores de 5 años en el mundo (16% de la mortalidad), después de las infecciones neumocócicas (28%) y del sarampión (21%)4. Al cumplir 5 años, la mayoría de los niños se han infectado al menos una vez, aunque estas infecciones a menudo no se diagnostican, por lo que la carga que suponen para el sistema de salud y la sociedad está infravalorada. En Europa, la gastroenteritis por rotavirus es la enfermedad prevenible por vacunas más frecuente en el niño, con 3,6 millones de episodios anuales, 700.000 visitas médicas, 87.000 hospitalizaciones y 231 muertes5,6. En España, según datos de diversos estudios realizados en los últimos años, se ha aislado rotavirus en el 21 al 31% de los casos de gastroenteritis aguda en los niños menores de 5 años7, con una incidencia anual de ingresos hospitalarios por esta causa de 2,2 por 1.000 niños menores de un año8.
La morbilidad de la infección por rotavirus es importante en todos los países, independientemente de su renta, pero la letalidad es mucho más alta en los países en desarrollo. Este virus, llamado «democrático», lo es solo en relación con la morbilidad, ya que la letalidad es muy diferente, en claro perjuicio de las áreas más pobres. La infección puede ser grave por la deshidratación secundaria a la gastroenteritis, sobre todo en los países en desarrollo; por el contrario, el impacto de la enfermedad en los países desarrollados se basa principalmente en su carga económica5,6.
El aumento de la proporción de hospitalizaciones por gastroenteritis por rotavirus observado en los últimos años probablemente se debe a la disminución de las diarreas causadas por bacterias y parásitos, que está en relación con varios factores. En primer lugar, la mejora de las condiciones higiénico-sanitarias tiene un mayor impacto en las diarreas transmitidas a través del agua y los alimentos contaminados, a diferencia de las gastroenteritis que se contagian de persona a persona, que es el mecanismo de transmisión característico de la infección por rotavirus. En segundo lugar, la rehidratación oral es más efectiva en los niños con diarrea que en aquellos en quienes la gastroenteritis cursa con vómitos abundantes, manifestación inicial frecuente de la enfermedad por rotavirus. Por este motivo, a pesar del uso generalizado de las soluciones de rehidratación oral, la gastroenteritis por rotavirus sigue causando una mortalidad importante en algunos países del mundo. Por último, el tratamiento antimicrobiano solo es efectivo frente a algunas bacterias y determinados parásitos, mientras que la infección por rotavirus no dispone de tratamiento etiológico. Por ello, la vacunación es el método profiláctico más efectivo frente a las infecciones por rotavirus, ya que el resto de las medidas preventivas, todas ellas muy importantes, tienen un reducido impacto sobre la morbilidad de la enfermedad, aunque sí condicionan diferencias en la letalidad.
Agente causal y distribución de serotiposEl género Rotavirus, perteneciente a la familia Reoviridae, está constituido por virus en forma de rueda (en latín rota), con una cápside externa que contiene las proteínas estructurales VP4 y VP7, y una cápside media que contiene la proteína VP6, que confiere la especificidad de grupo9. Se distinguen 7 serogrupos (A-G) y distintos serotipos según las proteínas VP7 (G1-G15) y VP4 (P1-P14), aunque actualmente las técnicas de detección molecular permiten clasificar al rotavirus en 23 genotipos (P[1]-P[23]).
La distribución mundial de los serotipos de rotavirus es variable de un país a otro, pero del 80 al 90% de los casos en todo el mundo están causados por 5 tipos: G1P[8], G2P[4], G3P[8], G4P[8] y G9P[8]10.
Vacunas antirrotavirusEl objetivo principal de la vacunación es proteger contra las formas graves de gastroenteritis, prevenir muertes y hospitalizaciones, y reducir la morbilidad y los costes socioeconómicos que genera la enfermedad.
La Organización Mundial de la Salud (OMS) ya consideró prioritario en 1985 el desarrollo de una vacuna para luchar contra las infecciones producidas por rotavirus. Desde entonces, varias iniciativas han intentado conseguir una vacuna segura y eficaz. También en 1985, el Instituto de Medicina de Estados Unidos consideró la infección por rotavirus como la primera de una lista de enfermedades para las cuales se necesitaban vacunas con urgencia en los países en vías de desarrollo. En los últimos años, la OMS y la Alianza Mundial para las Vacunas y la Inmunización (GAVI) han pasado a considerar de prioridad urgente la vacunación contra el rotavirus.
Desarrollo clínico de las primeras vacunasLas primeras vacunas, desarrolladas en el decenio de 1980, 10 años después del descubrimiento del rotavirus por Bishop11 (1973), reproducían la infección natural mediante la administración oral del virus atenuado, y de esta forma prevenían la enfermedad en las infecciones posteriores. Esta es la evolución natural de las infecciones por rotavirus que presentan los niños en los primeros años de vida; la gravedad es mayor en la primoinfección que en las reinfecciones, debido a la ausencia de inmunidad en la primera que se va adquiriendo en las siguientes. Las vacunas desarrolladas han sido siempre atenuadas, administradas por vía oral, debido a la importancia de la inmunidad local intestinal en la protección. Las primeras vacunas basadas en el modelo desarrollado por Jenner para la vacuna de la viruela estaban compuestas por cepas animales, de crecimiento más fácil que las humanas, pero relacionadas antigénicamente con virus humanos, y producían en el vacunado una respuesta inmunitaria heterotípica.
El primer ensayo clínico se realizó en 1983 con una vacuna monovalente de la cepa RIT 4237 de un rotavirus bovino atenuado12. La cepa bovina crecía bien en cultivo y se atenuaba de forma natural en los humanos, pero probablemente estaba demasiado atenuada, por lo que su replicación era baja, al igual que la respuesta inmunitaria que generaba, con una eficacia protectora escasa y variable, como se observó en estudios posteriores13. En 1985, Kapikian, del Instituto Nacional de la Salud de Estados Unidos, identificó una cepa de rotavirus del mono Rhesus que constituyó la vacuna RRV, también de origen animal y ensayada en lactantes, que tuvo una gran reactogenicidad y escasa eficacia14. Posteriormente, con el fin de ampliar la respuesta inmunitaria se desarrollaron cepas vacunales recombinantes multivalentes, obtenidas en el laboratorio a partir de cepas de origen animal con rotavirus humano por reordenamiento genético, y en los últimos años se han conseguido vacunas de cepas atenuadas de rotavirus humano15,16.
En 1998, la Food and Drug Administration (FDA) de Estados Unidos autorizó la primera vacuna (Rotashield®), obtenida por recombinación genética de cepas animales (Rhesus) y humanas, pero fue retirada pocos meses después13,16. Esta vacuna recombinante o reasortante Rhesus-humana, tetravalente (RRV-TV) (G1-G4), de virus vivos atenuados, de administración oral, fue la primera introducida y recomendada para la prevención de las infecciones por rotavirus. Contenía una cepa de rotavirus Rhesus (MMU 18006), serotipo G3, que es antigénicamente similar a la G3 humana, y 3 cepas humanas (el gen VP7 de origen humano, serotipos G1, G2 y G4), que por reordenamiento genético expresa los 4 serotipos. Se realizaron 4 ensayos clínicos, dos en Estados Unidos, uno en Venezuela y uno en Finlandia, que incluyeron 17.963 niños, y 3 ensayos adicionales con dosis menores de vacuna en Estados Unidos, Brasil y Perú. Se observó una eficacia del 80 al 82% para la prevención de la enfermedad grave y del 48 al 68% frente a todos los episodios diarreicos por rotavirus17–20. No se detectaron problemas de seguridad importantes en los ensayos clínicos precomercialización de la vacuna. Se produjo invaginación intestinal en 5 de 10.054 niños que recibieron la vacuna, en comparación con un caso entre los 4.633 del grupo placebo. La diferencia en las tasas de los 2 grupos no fue estadísticamente significativa, y la observada en los niños vacunados fue similar a la esperada en la población en general13,21.
Rotashield® se incorporó al calendario de vacunaciones sistemáticas de Estados Unidos en enero de 1999, con una pauta de 3 dosis, administradas a los 2, 4 y 6 meses de edad22. El 16 de julio de 1999, los Centers for Disease Control and Prevention (CDC) recomendaron interrumpir el programa vacunal hasta disponer de más estudios, al haberse comunicado al Vaccine Adverse Event Reporting System (VAERS) 15 casos de invaginación intestinal que sugerían una posible asociación con la vacuna23. Durante esos meses se habían vacunado en Estados Unidos más de 600.000 lactantes, con más de 1,5 millones de dosis administradas. El 15 de octubre de 1999, el laboratorio fabricante suspendió la producción de la vacuna y la retiró del mercado. Pocos días después, el Advisory Committee on Immunization Practices (ACIP) y los CDC suspendieron definitivamente la recomendación de empleo de la vacuna24.
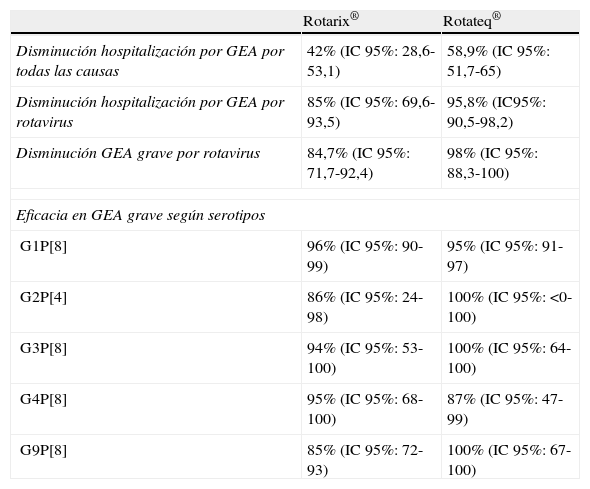
Vacunas antirrotavirus disponiblesGlaxoSmithKline desarrolló una vacuna monovalente a partir de una cepa humana atenuada G1P[8] (RIX 4414). Esta vacuna (Rotarix®) se aprobó en México en 2004, fue autorizada por la Agencia Europea del Medicamento (EMA) en febrero de 2006 y se comercializó en España en julio de ese año; en abril de 2008 fue aprobada por la FDA. La vacuna ha demostrado su eficacia frente a los serotipos G3, G4 y G9, ya que al compartir P[8] con la cepa vacunal proporciona una protección homotípica; también es eficaz frente al G2P[4] por protección heterotípica25. Los primeros ensayos clínicos, realizados en Finlandia, Brasil, México, Venezuela y Singapur, mostraron una eficacia del 85 al 93% frente a cualquier tipo de diarrea por rotavirus, y del 86 al 90% frente a las formas graves16,26. El estudio piloto incluyó 63.225 lactantes de 11 países de Latinoamérica y Finlandia, y mostró asimismo una eficacia del 85% para la prevención de la diarrea grave y la hospitalización (92% de protección frente a G1, 87% frente a G3, G4 y G9, y 41% frente a G2)27. Un estudio posterior realizado en varios países de Europa mostró también una eficacia protectora del 87,1% para cualquier tipo de gastroenteritis por rotavirus, y del 95,8% para las graves (96% para G1, 100% para G3 y G4, 95% para G9 y 75% para G2P[4])28. Los resultados de reactogenicidad de estos ensayos clínicos indican un excelente perfil de seguridad.
Merck & Co., Inc., desarrolló una vacuna pentavalente, recombinante bovina-humana, que contiene 5 cepas del rotavirus bovino WC3, 4 con un gen que codifica la proteína VP7 de los rotavirus humanos G1, G2, G3 y G4, y la quinta que expresa la VP4 del genotipo P[8]. Esta vacuna (Rotateq®, distribuida en Europa por Sanofi Pasteur MSD) fue autorizada por la FDA en febrero de 2006 y por la EMA en junio de 2006, y se comercializó en España en enero de 2007. La vacuna tiene una eficacia demostrada frente a los serotipos G1, G2, G3, G4 y G9, por protección homotípica. El estudio piloto (REST, Rotavirus Efficacy and Safety Trial) incluyó 68.038 lactantes y mostró una eficacia del 94,5% para evitar hospitalizaciones y visitas a los servicios de urgencias29. La eficacia para la protección frente a cualquier forma de gastroenteritis por rotavirus fue del 74,9% para G1, del 63,4% para G2, del 82,7% para G3, del 48,1% para G4 y del 65,4% para G9. Esta vacuna fue incluida en el calendario vacunal infantil de Estados Unidos en 2007.
En la tabla 1 se muestran los datos de eficacia de los principales ensayos clínicos realizados con Rotarix® y Rotateq®.
Eficacia de las vacunas antirrotavirus disponibles16,27,29
| Rotarix® | Rotateq® | |
| Disminución hospitalización por GEA por todas las causas | 42% (IC 95%: 28,6-53,1) | 58,9% (IC 95%: 51,7-65) |
| Disminución hospitalización por GEA por rotavirus | 85% (IC 95%: 69,6-93,5) | 95,8% (IC95%: 90,5-98,2) |
| Disminución GEA grave por rotavirus | 84,7% (IC 95%: 71,7-92,4) | 98% (IC 95%: 88,3-100) |
| Eficacia en GEA grave según serotipos | ||
| G1P[8] | 96% (IC 95%: 90-99) | 95% (IC 95%: 91-97) |
| G2P[4] | 86% (IC 95%: 24-98) | 100% (IC 95%: <0-100) |
| G3P[8] | 94% (IC 95%: 53-100) | 100% (IC 95%: 64-100) |
| G4P[8] | 95% (IC 95%: 68-100) | 87% (IC 95%: 47-99) |
| G9P[8] | 85% (IC 95%: 72-93) | 100% (IC 95%: 67-100) |
GEA: gastroenteritis aguda; IC 95%: intervalo de confianza del 95%.
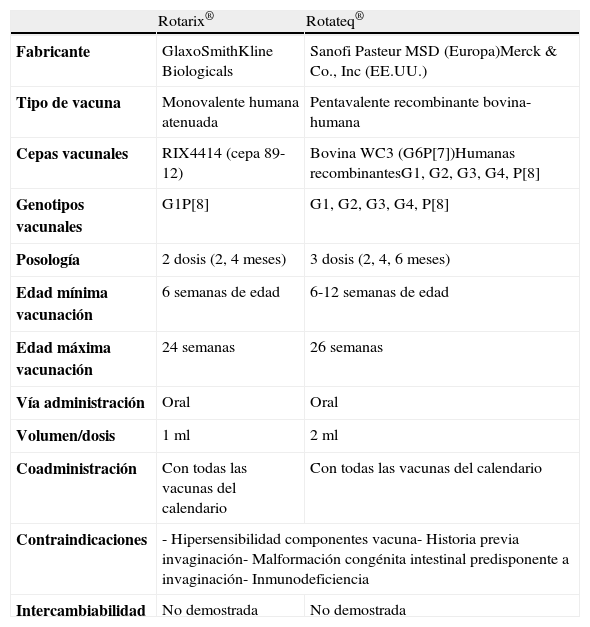
Su administración por vía oral, la adaptación al calendario vacunal vigente por su compatibilidad con el resto de las vacunas y el número de dosis necesarias (2 o 3, según la especialidad farmacéutica) han facilitado su inclusión en los calendarios de vacunación sistemática de diversos países30–32. En la tabla 2 se muestran las principales características de ambas vacunas.
Características de las vacunas disponibles frente al rotavirus
| Rotarix® | Rotateq® | |
| Fabricante | GlaxoSmithKline Biologicals | Sanofi Pasteur MSD (Europa)Merck & Co., Inc (EE.UU.) |
| Tipo de vacuna | Monovalente humana atenuada | Pentavalente recombinante bovina-humana |
| Cepas vacunales | RIX4414 (cepa 89-12) | Bovina WC3 (G6P[7])Humanas recombinantesG1, G2, G3, G4, P[8] |
| Genotipos vacunales | G1P[8] | G1, G2, G3, G4, P[8] |
| Posología | 2 dosis (2, 4 meses) | 3 dosis (2, 4, 6 meses) |
| Edad mínima vacunación | 6 semanas de edad | 6-12 semanas de edad |
| Edad máxima vacunación | 24 semanas | 26 semanas |
| Vía administración | Oral | Oral |
| Volumen/dosis | 1ml | 2ml |
| Coadministración | Con todas las vacunas del calendario | Con todas las vacunas del calendario |
| Contraindicaciones | - Hipersensibilidad componentes vacuna- Historia previa invaginación- Malformación congénita intestinal predisponente a invaginación- Inmunodeficiencia | |
| Intercambiabilidad | No demostrada | No demostrada |
El impacto observado con los programas de vacunación es muy importante, especialmente en los países de la Región de las Américas de la OMS. México fue uno de los primeros en incorporar la vacuna en los calendarios de vacunación sistemática infantil, en mayo de 2007, y a los 2 años ya se observó un 66% de reducción en las muertes por diarrea en los niños menores de 12 meses y un 68% en los de 12-23 meses de edad33. En un reciente (enero 2011) número de The Pediatrics Infectious Disease Journal se recogen diversos artículos que analizan la reducción de las hospitalizaciones por gastroenteritis por rotavirus a los 2 años de la introducción de estas vacunas en Panamá, El Salvador, México, Bélgica, Australia y Estados Unidos34. Las cifras oscilan entre un 65 y un 94% de reducción en las hospitalizaciones por rotavirus, y entre un 11 y un 48% en las consultas por diarrea de cualquier causa. Así mismo, se ha observado un efecto indirecto de los programas de vacunación, con impacto en las tasas de hospitalización en los niños de grupos de edades que no son objeto de vacunación.
Seguridad de las vacunas antirrotavirusEl riesgo de invaginación intestinal observado con la vacuna Rotashield® se estimó en un caso por cada 10.000 niños vacunados en los primeros 10 días posvacunación23,24. El riesgo se concentraba en los 3-7 días posteriores a la vacunación, en especial tras la primera dosis, y con menor frecuencia tras la segunda. Se estableció una correlación entre el riesgo de invaginación y la edad al recibir la vacuna, con un mayor riesgo en los lactantes vacunados a partir de los 3 meses de edad35.
Tras la retirada de Rotashield®, la FDA quiso garantizar que la siguiente generación de vacunas fuese más segura y estableció una población mínima de 60.000 lactantes a incluir en cada uno de los ensayos clínicos de las 2 vacunas que en aquellos momentos se estaban desarrollando, que era el mayor tamaño muestral utilizado para la investigación de una vacuna antes de su autorización. Además, los laboratorios fabricantes de las 2 vacunas seleccionaron para los ensayos clínicos solo lactantes con edades comprendidas entre 6 y 12-13 semanas, un periodo en que la invaginación intestinal natural es poco frecuente. Los resultados de ambos estudios no mostraron riesgo de invaginación intestinal asociado a la vacuna (riesgo relativo [RR] de 0,80 e intervalo de confianza del 95% [IC 95%] de 0,3-1,8 para la vacuna pentavalente, y RR de 0,85 e IC 95% de 0,3-2,4 para la monovalente)27,29.
La vigilancia ha continuado después de la comercialización de las 2 vacunas. En Estados Unidos, hasta septiembre de 2008 se habían distribuido alrededor de 21 millones de dosis de vacuna pentavalente y se habían declarado al VAERS 328 casos de invaginación intestinal. Aunque estos datos no indicaban un incremento respecto a la incidencia esperada, se detectó una pequeña agrupación (cluster) de casos en los 7 días siguientes a la administración de la primera dosis, lo que obliga a una vigilancia estrecha y mantenida36.
Respecto a la vacuna monovalente, los datos preliminares hasta septiembre de 2008 del programa de vacunación en México mostraron una tasa de invaginación ajustada por edad cuatro a cinco veces superior tras la primera dosis de la vacuna que en las dosis posteriores, lo que podría corresponder a un riesgo de uno a 2 casos adicionales de invaginación intestinal por cada 100.000 niños vacunados37. Un estudio similar, realizado también en México, ha mostrado un incremento del riesgo de invaginación de 1,7 veces en los 30 días posteriores a la primera dosis, en especial durante la primera semana38. Así mismo, los datos de vigilancia poscomercialización de Australia han identificado un incremento del riesgo de tres a cinco veces en los primeros 7 días posvacunación, tanto con la vacuna monovalente como con la pentavalente39.
Patel et al.40 han publicado recientemente los datos de un estudio de casos y controles realizado en 53 hospitales de Brasil y 10 de México, correspondiente al periodo 2008-2010, que incluye 615 casos de invaginación intestinal. En México se ha observado un incremento significativo del riesgo de invaginación en los primeros 7 días tras la administración de la primera dosis (odds ratio [OR]: 5,8; IC 95%: 2,6-13), con un exceso de 41 casos anuales (aproximadamente un caso por 51.000 vacunados) y 2 muertes. Los datos de Brasil son menos concluyentes, pero también indican un incremento del riesgo, aunque menor y tras la segunda dosis de la vacuna (OR: 1,9; IC 95%: 1,1-3,4), con un exceso de 55 casos anuales (un caso por 68.000 vacunados) y 3 muertes. No obstante, el análisis riesgo-beneficio es absolutamente favorable a la vacunación, ya que el programa de vacunación frente al rotavirus evita cada año alrededor de 80.000 hospitalizaciones y 1.300 muertes por diarrea en los niños menores de 5 años en estos 2 países.
Se han establecido varias hipótesis para explicar la posible relación entre la vacuna y la invaginación intestinal. Una alta carga antigénica de la vacuna, una respuesta intestinal anómala a las proteínas animales (Rhesus) de la vacuna Rotashield® y la llamada «teoría del gatillo» (el efecto trigger) en un pequeño grupo de lactantes con predisposición a desarrollar invaginación intestinal, son las 3 posibles explicaciones más importantes. Las cepas bovinas tienen una replicación intestinal menor que las Rhesus y las humanas, y son más atenuadas, lo que podría asociarse a una menor respuesta inflamatoria intestinal.
El mayor riesgo observado en la mayoría de los estudios en los 7 días posteriores a la primera dosis de la vacuna se explicaría por ser el momento de máxima replicación del virus en el intestino, lo que produce una respuesta inflamatoria local intestinal y del tejido linfático, que puede estar relacionada con la patogenia de la invaginación41.
Circovirus porcino y vacunas antirrotavirusEl 15 de marzo de 2010, GlaxoSmithKline notificó a la FDA la presencia de DNA de un circovirus porcino de tipo 1 en la vacuna Rotarix®. Un grupo de investigadores, utilizando una nueva técnica de detección viral más sensible que las habituales, descubrió de forma casual este material viral, que había estado presente desde el inicio de los ensayos clínicos con la vacuna42. Unas semanas después, Merck & Co, Inc., informó a la FDA de que también había identificado fragmentos de DNA de un circovirus porcino de tipo 1 y de otro relacionado con un tipo 2 en su vacuna Rotateq®. Los circovirus porcinos de los tipos 1 y 2 son pequeños virus circulares, compuestos por una única cadena de DNA, que se encuentran con frecuencia en los productos del cerdo que se consumen a diario. No se replican en el hombre y no hay evidencia de que representen un riesgo para su salud, ya que no causan infección ni enfermedad en los humanos; el tipo 2, a diferencia del 1, puede producir enfermedad en el cerdo. Estos virus no representan, pues, un problema para la salud humana, hecho que han refrendado los informes emitidos por la OMS y la EMA, en los que recomiendan continuar con la vacunación43. En España, la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) suspendió la vacunación frente al rotavirus, al no permitir la liberación de nuevos lotes de ambas vacunas44. Finalmente, en una nota publicada el 4 de noviembre de 2010, la AEMPS informó de que se había decidido volver a la normalidad en la utilización de la vacuna Rotateq®, pero no con Rotarix®.
Recomendaciones de la vacunación antirrotavirus en EspañaEl Comité Asesor de Vacunas (CAV) de la Asociación Española de Pediatría publicó, a mediados de 2006, un informe sobre el papel de la vacuna frente a rotavirus en los calendarios de vacunación infantil en nuestro país45, y recomendó su inclusión en el calendario vacunal en 200846. Los argumentos del CAV son básicamente los beneficios en salud de los niños vacunados y el ahorro en los costes indirectos que genera la enfermedad, mayores que los costes directos. No obstante, el Consejo Interterritorial del Sistema Nacional de Salud no considera que en estos momentos sea una prioridad la inmunización sistemática infantil frente al rotavirus con financiación pública.
ConclusionesLa vacunación antirrotavirus es una prioridad de salud pública para los países de baja renta. El Programa Ampliado de Inmunización ha incluido en los últimos años esta vacuna en los calendarios de inmunización infantil de diversos países.
El cuarto Objetivo de Desarrollo del Milenio (2000) establece la reducción en 2 tercios de la mortalidad de los niños menores de 5 años para el año 2015: la vacunación antirrotavirus es un punto importante para alcanzar este objetivo.
La inclusión de la vacuna antirrotavirus en el calendario de vacunaciones sistemáticas en los países desarrollados debe basarse en datos epidemiológicos, farmacoeconómicos y de eficiencia. La incidencia de gastroenteritis por rotavirus, las visitas médicas, la hospitalización y los costes que origina, y el impacto de la infección nosocomial, son datos necesarios para la toma de decisiones en salud pública.
Conflicto de interesesInvestigadores en ensayos clínicos financiados por GlaxoSmithKline, y ponentes en symposiums organizados por GlaxoSmithKline, Esteve, Sanofi Pasteur MSD, Novartis y Pfizzer.