El tratamiento con fármacos antifactor de necrosis tumoral alfa (TNF-α) en la enfermedad de Crohn es relativamente seguro aunque se han comunicado diferentes efectos secundarios cutáneos como la aparición o exacerbación de una psoriasis secundaria al tratamiento con anti-TNF-α que, en ocasiones, puede llevar a la suspensión del tratamiento. Por ello, son necesarias nuevas alternativas terapéuticas con nuevos mecanismos de acción. Se ha publicado que ustekinumab, un anticuerpo monoclonal que se une a la subunidad p40 de la interleucina 12/23, podría inducir repuesta en pacientes con enfermedad de Crohn y además ha demostrado su eficacia en pacientes con psoriasis. Presentamos un caso de una paciente con enfermedad de Crohn que desarrolló psoriasis tras el tratamiento con 2 fármacos anti-TNF-α (infliximab y adalimumab) que fue posteriormente tratada con ustekinumab con resolución de las lesiones de la psoriasis y mantuvo la remisión de la enfermedad de Crohn.
Treatment with anti-tumor necrosis factor (TNF)-α for Crohn's disease is relatively safe, although various cutaneous adverse effects have been reported such as the development or exacerbation of anti-TNF- α-induced psoriasis, which can sometimes lead to treatment withdrawal. Therefore, new alternative treatments with new mechanisms of action are required. Ustekinumab, a monoclonal antibody against the p40 subunit of interleukin 12/23, could induce response in patients with Crohn's disease and has demonstrated efficacy in patients with psoriasis. We present the case of a woman with Crohn's disease who developed psoriasis after treatment with two anti-TNF- α drugs (infliximab and adalimumab). The patient was subsequently treated with ustekinumab with resolution or psoriasis lesions and maintenance of remission of Crohn's disease.
El tratamiento convencional de la enfermedad de Crohn moderada-severa incluye corticoides e inmunosupresores como la azatioprina, 6-mercaptopurina o metotrexato1,2. Los pacientes que no responden a estas terapias convencionales son tratados con fármacos anti-TNF-α1,2. En la actualidad el uso de fármacos anti-TNF-α cada vez es más amplio y no sólo reducido a los no respondedores a inmunosupresores sino también en el manejo de la enfermedad perianal, en un manejo más intensivo siguiendo un tratamiento top-down o en pacientes intolerantes a los inmunosupresores. Aproximadamente un tercio de los pacientes no responden a la terapia anti-TNF-α. Asimismo, un tercio de los pacientes inicialmente respondedores a la terapia anti-TNF-α pierden respuesta o no toleran el tratamiento3–5.
El tratamiento con fármacos anti-TNF-α es relativamente seguro6 aunque se han comunicado reacciones infusionales y en el lugar de inyección y un incremento del riesgo de infecciones7. También se han comunicado efectos secundarios cutáneos como la aparición o exacerbación de una psoriasis secundaria al tratamiento con anti-TNF-α que en ocasiones puede llevar a la suspensión del tratamiento8. Por ello, son necesarias nuevas alternativas terapéuticas con nuevos mecanismos de acción, particularmente para aquellos pacientes que fallan o no toleran las terapias anti-TNF-α.
Las interleucinas 12 y 23 han sido implicadas en la fisiopatología de la enfermedad de Crohn, y un reciente estudio genético ha encontrado una asociación significativa entre la enfermedad de Crohn y un gen que codifica una subunidad del receptor de la IL-239–11. La inhibición de la vía IL 12/23 es efectiva en el tratamiento de modelos animales con colitis. Además, se ha publicado recientemente un estudio fase IIa que concluye que ustekinumab, un anticuerpo monoclonal que se une a la subunidad p40 de la IL12/23, podría inducir respuesta en pacientes con enfermedad de Crohn moderada-severa12.
No hemos encontrados casos descritos de pacientes con enfermedad de Crohn tratados con este fármaco fuera de ensayos clínicos.
Presentamos el caso de una paciente con enfermedad de Crohn y psoriasis inducida por anti-TNF-α (infliximab, adalimumab) tratada con ustekinumab.
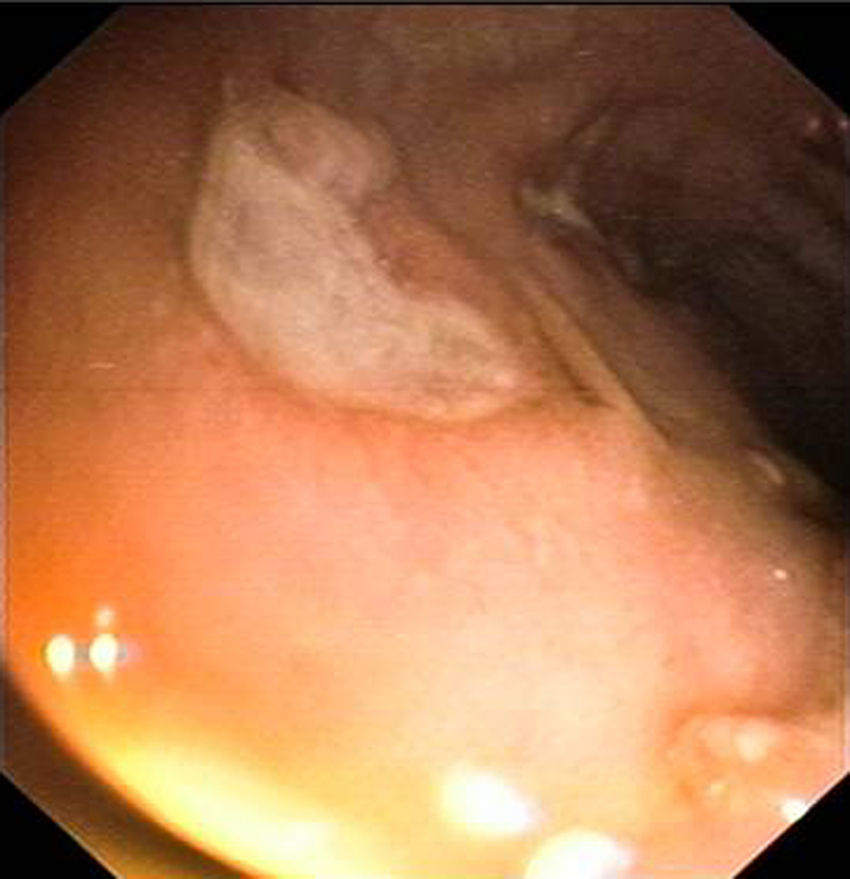
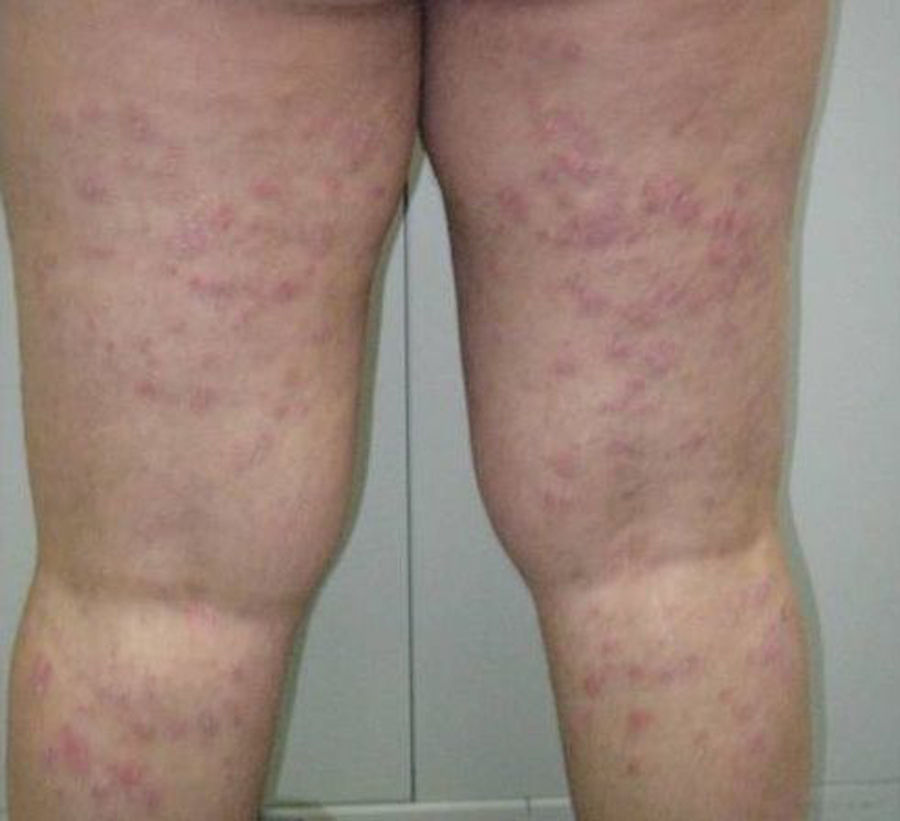
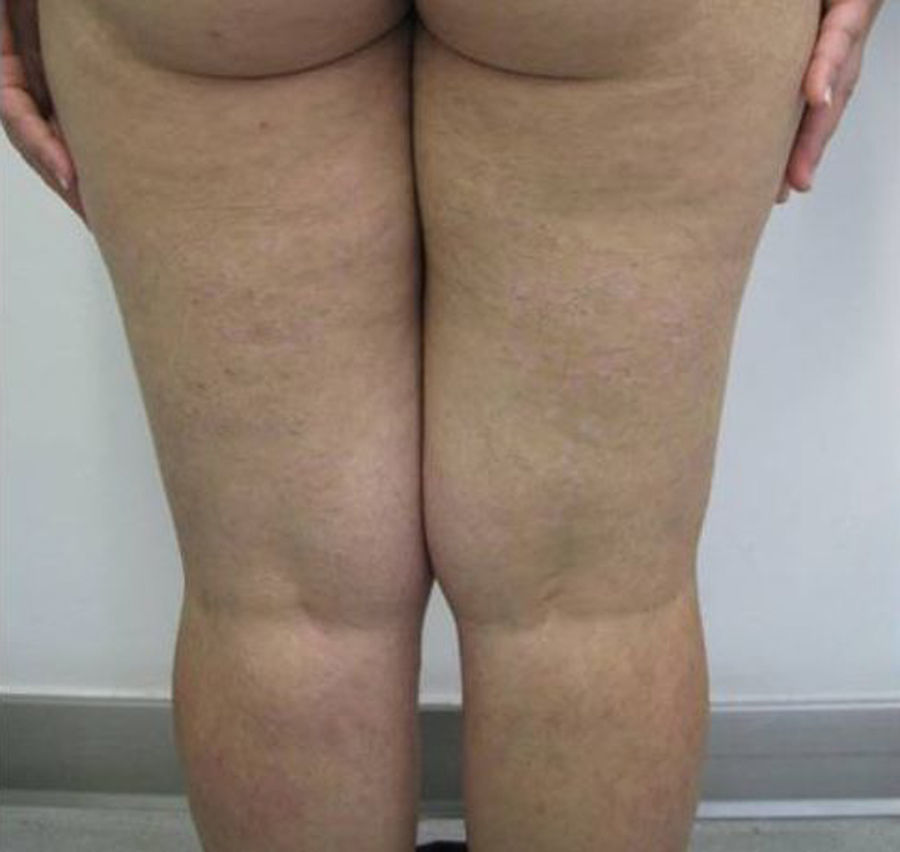
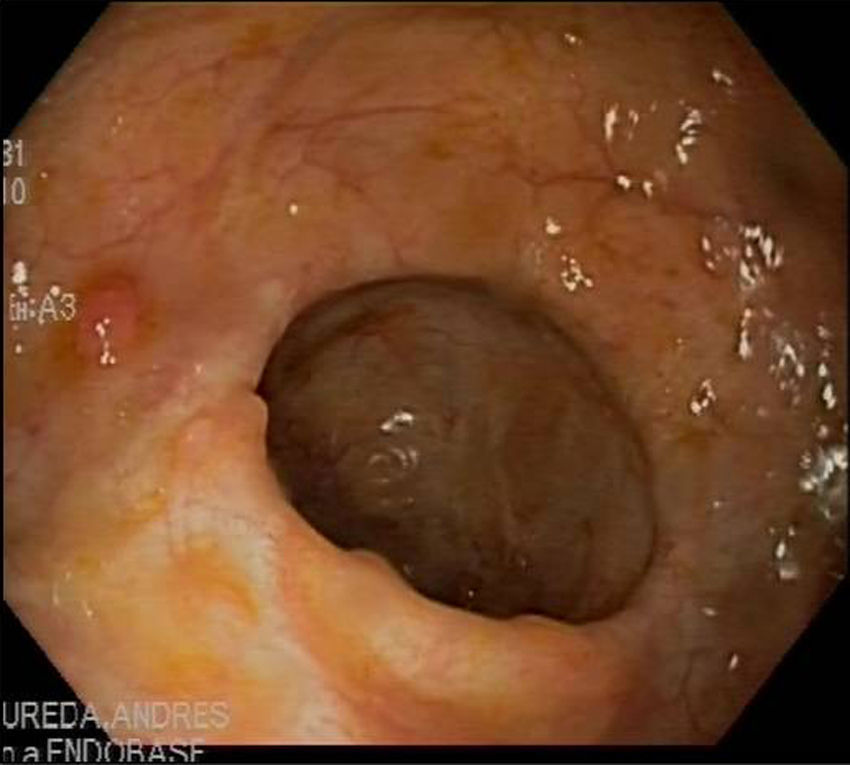
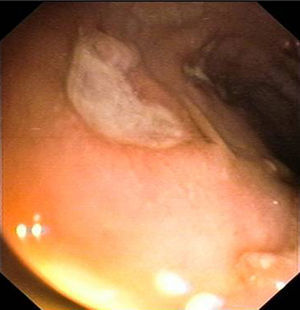
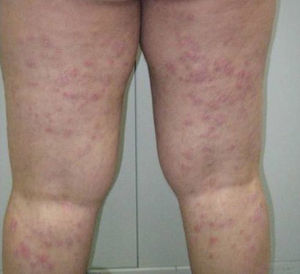
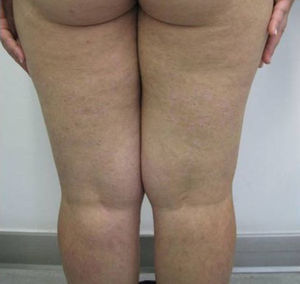
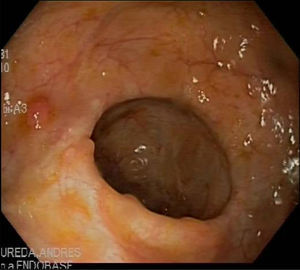
Observación clínicaMujer de 29 años diagnosticada en el año 2001 de enfermedad de Crohn con afectación ileocolónica con presencia de fístulas enteroentéricas y curso dependiente de corticoides (Clasificación de Montreal A2 L3 B3) de 49kg de peso que seguía tratamiento con azatioprina 100mg/día y mesalazina 3g/día. En remisión clínica hasta octubre del año 2006, mes en el que ingresa por presentar lesiones cutáneas en cara anterior de piernas en forma de placas y nódulos eritematosos y dolorosos acompañado de diarrea de 4 deposiciones/día. En la analítica destacaba hemoglobina 12,6g/dl, leucocitos 10.999/mm3, VSG 75, proteína C reactiva 26,8mg/dl y fibrinógeno 790mg/dl. La colonoscopia mostró afectación pancolónica con eritema y úlceras extensas y afectación ileal con eritema y úlceras (fig. 1). Las biopsias fueron compatibles con enfermedad de Crohn. Se realizaron biopsias de las lesiones cutáneas y se informó de paniculitis septal con vasculitis y foliculitis crónica granulomatosa. Se añadió al tratamiento corticoides presentando una mejoría inicial con recaída al retirarlos. En diciembre de 2006, se inició tratamiento con infliximab 5mg/kg con inducción (0,2 y 6 semanas) y continuando con mantenimiento cada 8 semanas con desaparición de las lesiones cutáneas y remisión de la sintomatología digestiva tras la segunda infusión de infliximab. En octubre de 2007 presenta lesiones eritematodescamativas en extremidades inferiores y zona anterior de tronco que se biopsian. El estudio anatomopatológico mostró rasgos de psoriasis y toxicodermia. Se decidió suspender el tratamiento con infliximab con desaparición de las lesiones cutáneas y se mantuvo el tratamiento con azatioprina y mesalazina. En mayo de 2009 presenta un nuevo ingreso por brote de la enfermedad de Crohn con dolor abdominal y diarrea de 9 deposiciones/día que mejoró con tratamiento con corticoides. Al disminuir los corticoides presenta empeoramiento clínico y nueva aparición de lesiones cutáneas en forma de nódulos eritematosos y dolorosos indicativos de eritema nodoso. Ante esta situación se decide, en junio de 2009, iniciar tratamiento con adalimumab con dosis de inducción de 160mg y a las 2 semanas con 80mg para continuar con dosis de 40mg cada 2 semanas con buena evolución clínica y remisión de los síntomas digestivos y de las lesiones cutáneas. En septiembre de 2009 acude por aparición de nuevas lesiones en forma de placas eritematosas descamativas en abdomen y en cara interna de muslos (fig. 2). Las biopsias realizadas muestran de nuevo hallazgos compatibles con psoriasis. Se inicia tratamiento con corticoides tópicos y fototerapia asociado al tratamiento de su enfermedad de Crohn con adalimumab, azatioprina y mesalazina. Las lesiones no respondieron al tratamiento y empeoraron con aparición de dolor en las mismas por lo que se decidió suspender el adalimumab en marzo de 2010. En abril de 2010, se solicitó uso compasivo con ustekinumab, autorizándose por lo que se inicia tratamiento a dosis de 90mg cada 8 semanas por vía subcutánea, continuándose el tratamiento con azatioprina y mesalazina. A las 2 semanas del inicio del tratamiento las lesiones cutáneas (fig. 3) y el dolor que presentaba en ellas desaparecieron, manteniéndose la remisión desde el punto de vista digestivo. Se realizó una colonoscopia de control en septiembre de 2010 apreciándose una mejoría de las lesiones endoscópicas con desaparición de las úlceras en colon y con una disminución de la afectación ileal (fig. 4).
La exacerbación de una psoriasis preexistente o el inicio de una nueva erupción psoriasiforme ha sido comunicada durante el tratamiento con anti-TNF-α en pacientes con enfermedad inflamatoria intestinal. Su prevalencia en pacientes con enfermedad inflamatoria intestinal es desconocida. Los datos procedentes de la Sociedad Británica de Reumatología muestran una incidencia de psoriasis en pacientes con artritis reumatoide tratados con anti-TNF-α de 1,04 por 1.000 personas-año13. En un estudio en pacientes con enfermedad inflamatoria intestinal las lesiones psoriasiformes se observaron en el 9% de los pacientes tratados con infliximab14. Las manifestaciones cutáneas se han observado con los 3 fármacos anti-TNF-α (infliximab, adalimumab y certolizumab) que se han utilizado en el tratamiento de la enfermedad inflamatoria intestinal aunque la mayoría de casos documentados han sido en pacientes en tratamiento con infliximab, probablemente debido a que fue el primer anti-TNF-α que se aprobó en esta enfermedad. Estas lesiones pueden aparecer en cualquier momento, desde días a años del inicio del tratamiento. En un estudio recientemente publicado observaron una media de tiempo de la aparición de lesiones psoriasiformes de 17 meses en los pacientes tratados con infliximab y de 12 meses en los tratados con adalimumab. Existe un mayor riesgo de aparición en mujeres y si hay antecedentes familiares o personales de psoriasis previa15.
Al contrario que en las enfermedades reumáticas la localización más frecuentemente encontrada es la psoriasis palmoplantar16. En la mayoría de pacientes las lesiones se han resuelto tras la interrupción del tratamiento, el porcentaje de retirada del tratamiento anti-TNF-α es aproximadamente del 40% en los pacientes que presentan lesiones psoriasiformes. La reaparición de las lesiones es la regla tras la reintroducción del fármaco o el cambio a otro anti-TNF-α, lo que indica que la patogenia de la psoriasis inducida por anti-TNF-α es estrictamente dependiente del TNF-α15,16.
El mecanismo de acción por el cual se desencadena una psoriasis con tratamientos con anti-TNF-α no está todavía aclarado, se han indicado algunas hipótesis. Las células dendríticas plamocitoides podrían tener un papel en la inducción de las lesiones psoriasiformes inducidas por anti-TNF-α. Las células dendríticas plasmocitoides producen interferón alfa (IFN-α) natural. El TNF inhibe la producción de interferón por las células dendríticas plasmocitoides. Dado que la producción de IFN-α por las células dendríticas plasmocitoides está bajo la regulación del TNF-α, el bloqueo del TNF-α puede llevar a la producción incontrolada e ilimitada de IFN-α que puede causar la aparición de las lesiones psoriásicas17,18. Esta hipótesis está apoyada por los recientes estudios sobre el papel del IFN-α en la patogenia de la psoriasis19. El IFN-α también induce la maduración y estimulación de las células dendríticas mieloides y la expresión de las células T vía IL-15 en la piel, lo que podría dar lugar al desarrollo de una psoriasis inducida por anti-TNF-α20. También se ha demostrado un incremento paradójico de la producción del TNF-α en las glándulas exocrinas de la piel en pacientes que han desarrollado psoriasis inducida por anti-TNF-α21. Recientemente se ha comunicado un aumento de células Th 17 cutáneas en un paciente con psoriasis inducida por infliximab, las células Th 17 pueden producir IL-17 y IL-22 que desempeñan un papel central en la patogenia de la psoriasis22.
En la mayoría de casos reportados las lesiones cutáneas responden al tratamiento tópico con corticoides, queratolíticos y análogos de la vitamina D o con fototerapia mientras se continúa el tratamiento con anti-TNF-α, solo se recomienda la retirada en los casos de psoriasis severa o con lesiones extensas superiores al 5% de la superficie corporal8,23. Algunos autores, a pesar de que las lesiones reaparecen en la mayoría de los casos tras el cambio a otro anti-TNF-α, recomiendan intentar la sustitución antes de abandonar esta estrategia de tratamiento24,25.
En el caso de nuestra paciente, dado el curso agresivo de la enfermedad de Crohn y después de haber presentado lesiones de psoriasis tras el tratamiento con los 2 fármacos anti-TNF-α aprobados para el tratamiento de la enfermedad de Crohn (infliximab y adalimumab), se optó por el cambio a otro agente biológico, ustekinumab, que en estudios preliminares ha demostrado su eficacia en esta enfermedad. Este fármaco posee un mecanismo de acción diferente inhibiendo las interleucinas 12 y 23 y su utilización está aprobada en los pacientes con psoriasis12.
La paciente tras 8 meses de tratamiento con ustekinumab permanece en remisión clínica de su enfermedad de Crohn y no ha vuelto a desarrollar lesiones de psoriasis. La dosis elegida para el tratamiento con ustekinumab fue de 90mg cada 8 semanas por vía subcutánea, esta dosis es más elevada que la que se utiliza en la psoriasis y se eligió en función del ensayo clínico fase IIa de ustekinumab en la enfermedad de Crohn12 en el que la dosis de ustekinumab utilizada por vía subcutánea era de 90mg y en cuanto a la frecuencia se optó por la administración cada 8 semanas, aunque de momento no hay evidencias de que esta pauta y vía de administración sea la adecuada para los pacientes con enfermedad de Crohn.
A la espera de los resultados del estudio recientemente concluido (clinical trials: NCT00771667) el ustekinumab podría representar una alternativa terapéutica razonablemente segura, a diferencia del natalizumab, en los pacientes con enfermedad de Crohn que no responden o no toleran o que pierden respuesta a la terapia anti-TNF-α.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.