INTRODUCCIÓN
La hepatitis crónica C es la primera causa de cirrosis hepática y carcinoma hepatocelular en nuestro medio y, por lo tanto, la mayoría de los pacientes con indicación de trasplante hepático (TH) están infectados por el virus de la hepatitis C (VHC)1. Desgraciadamente, la recurrencia de la infección por el VHC tras el trasplante es universal2 y se ha convertido en el principal problema médico de los programas de TH3. La historia natural de la infección por el VHC tras el trasplante es muy distinta de la de los pacientes inmunocompetentes, esencialmente porque la velocidad de progresión de la enfermedad es muy superior en los individuos inmunodeprimidos. De hecho, una tercera parte de los pacientes trasplantados por hepatopatía secundaria a infección por el VHC desarrollan cirrosis después de 3 a 5 años de efectuado el trasplante4. Una vez establecida la cirrosis, la probabilidad de desarrollar una descompensación es de hasta un 50% durante el primer año del diagnóstico5. Como resultado de este curso acelerado, la supervivencia a largo plazo de los pacientes trasplantados por cirrosis asociada al VHC es significativamente inferior a la de los trasplantados por otras causas (cirrosis alcohólica, enfermedad colestásica, cirrosis por el virus de la hepatitis B)6.
Es muy importante conocer qué factores se asocian con una mayor agresividad de la recurrencia de la hepatitis C postrasplante. Esto sería de gran utilidad para identificar a los pacientes con mayor riesgo de perder el injerto y, por lo tanto, seleccionar los candidatos a tratamientos encaminados a prevenir la recurrencia de la infección. Desgraciadamente la mayoría de los estudios que han analizado este problema son de tipo retrospectivo y, por consiguiente, los datos de los que disponemos distan mucho de poder considerarse definitivos. Entre los factores que se han asociado a una mayor gravedad de la recurrencia de la infección del injerto por el VHC se han descrito algunas variables virológicas, como una carga viral alta pretrasplante y la propagación postrasplante de variantes víricas mayoritarias en la fase de pretrasplante7-9. En cuanto al donante, hay indicios que apuntan a que la edad avanzada y la presencia de esteatosis hepática moderada o grave en el injerto pueden condicionar una recurrencia más grave10-13. Entre las variables postrasplante asociadas a una evolución rápida de la hepatitis C figuran el tipo de inmuno-depresión (administración de bolos de corticoides), los episodios de rechazo o la infección por citomegalovirus10,14,15.
PREVENCIÓN DE LA RECURRENCIA DE LA INFECCIÓN POR EL VHC EN EL INJERTO HEPÁTICO
Tratamiento antiviral antes del trasplante
El tratamiento antiviral pretrasplante parece de antemano una buena estrategia terapéutica, pues la erradicación de la infección antes del trasplante evitará los problemas asociados a la recidiva en el injerto. Hay que tener en cuenta que la fuente principal (si no única) de producción de viriones, el hígado, se extrae del organismo durante el trasplante, lo cual representa una ventaja a la hora de diseñar estrategias terapéuticas. Como desventajas, el tratamiento con interferón y ribavirina es mal tolerado en pacientes con cirrosis avanzada y, lógicamente, los efectos secundarios potencialmente graves son mucho más frecuentes en estos pacientes.
Existen 3 estudios que han analizado la tolerabilidad y eficacia del tratamiento antiviral pretrasplante (tabla I). El primero incluyó únicamente a 15 pacientes, utilizó pautas de tratamiento diferentes y no aportó datos referentes a la evolución de la infección postrasplante16. En un segundo estudio, Everson17 trató a 102 pacientes con cirrosis hepática en evaluación pretrasplante utilizando interferón y ribavirina a dosis bajas. La dosis de ambos fármacos se incrementaba según la tolerancia de los pacientes. Los resultados de este estudio pueden considerarse satisfactorios, por cuanto el 40% de los pacientes obtuvo respuesta virológica durante el tratamiento, que se mantuvo una vez suspendido éste en un 20%. Quizá el resultado más esperanzador es que en ninguno de los pacientes trasplantados que consiguieron negativizar el ARN del VHC de forma persistente se produjo recurrencia de la infección tras el trasplante.
Nuestro grupo diseñó un estudio en el que el tratamiento antiviral se iniciaba pocos meses antes del trasplante y se mantenía hasta su realización18. De un total de 60 pacientes evaluados se incluyó a 30; tras una mediana de 12 semanas de tratamiento se produjo respuesta virológica en 9 pacientes (30%). Los factores asociados a la negativización del ARN del VHC fueron una carga viral basal baja (< 500.000 UI/ml) y una reducción rápida de la carga viral durante el tratamiento (más de 2 log10 en las primeras 4 semanas). Los pacientes infectados con genotipos 2 o 3 respondieron mejor que los infectados con genotipo 1, aunque las diferencias no llegaron a ser significativas por el tamaño de la muestra. Tras el trasplante se produjo la recurrencia de la infección en 3 de los 9 pacientes que habían respondido, por lo cual la eficacia global fue del 20%. En cuanto a los efectos adversos, fueron frecuentes y motivaron ajustes de dosis en el 60% los pacientes y la utilización de factores estimulantes hematopoyéticos (filgrastim o eritropoyetina) en una tercera parte. En 6 pacientes se produjeron acontecimientos adversos graves que obligaron a la suspensión temporal o definitiva del tratamiento, pero ninguno falleció. Aunque estos resultados disten mucho de ser satisfactorios, es importante enmarcarlos en el contexto de pacientes que van a recibir un TH y en los que existen una elevada probabilidad de que sufran una recurrencia grave de la infección que les lleve a la muerte en pocos años.
En resumen, el tratamiento antiviral antes del trasplante tiene una aplicabilidad limitada con los fármacos disponibles actualmente. Sin embargo, en individuos con un buen perfil virológico (carga viral baja, genotipos 2 o 3) y con cirrosis compensada (indicación de trasplante por hepatocarcinoma) debería administrarse tratamiento. En individuos en lista de espera con cirrosis descompensada y buen perfil virológico, la indicación debe individualizarse. En cuanto a los efectos adversos, es fundamental un seguimiento clínico frecuente para su detección temprana. Finalmente, habrá que esperar a ensayos que evalúen la eficacia de los nuevos interferones pegilados en este grupo de pacientes.
Inmunoprofilaxis
La gran variabilidad genética del VHC y la falta de modelos in vitro o de animales de experimentación pequeños capaces de sustentar la replicación vírica dificultan enormemente el estudio de la capacidad neutralizante de anticuerpos dirigidos contra el virus19,20. Hay, sin embargo, evidencias indirectas de la existencia de anticuerpos con capacidad neutralizante del virus. Así, en un estudio realizado por Feray et al21 se constató que la infección del injerto por el VHC era significativamente inferior en pacientes que habían recibido inmunoglobulina hiperinmunitaria antihepatitis B fabricada a partir de donantes de plasma antes de 1990 (cuando no se realizaba cribado anti-VHC) frente a los que no recibieron estos preparados. Estos datos apuntan a la presencia de anticuerpos con capacidad neutralizante en las preparaciones de inmunoglobulina, anticuerpos que provenían de donantes anti-VHC positivos.
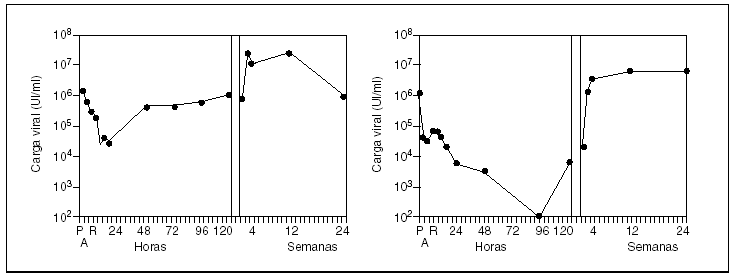
El mejor conocimiento de la cinética de la infección por el VHC durante y después del TH es fundamental para el diseño de estudios encaminados a prevenir la infección mediante la utilización de inmunoglobulinas. Hoy sabemos que inmediatamente después de la reperfusión del injerto y durante las primeras 12 h del trasplante se produce una reducción significativa de la carga viral (entre 2 y 5 log), debida en gran parte a la extracción del hígado infectado2 (fig. 1). Pasadas 24-48 h se produce una rápida elevación de las concentraciones de ARN del VHC. Este incremento indica que el virus es capaz de infectar e iniciar su ciclo replicativo en el injerto con extrema rapidez. Cualquier tratamiento encaminado a prevenir la infección del injerto debe pues iniciarse durante el mismo acto quirúrgico, para evitar que el VHC penetre en los hepatocitos.
No disponemos todavía de datos sobre la eficacia de las inmunoglobulinas anti-VHC en el contexto del trasplante, pero hay ya diversos estudios que están evaluando esta posibilidad.
TRATAMIENTO DE LA INFECCIÓN POR EL VHC TRAS EL TRASPLANTE HEPÁTICO
Tratamiento temprano
Desde un punto de vista teórico, el tratamiento de la infección en las fases tempranas del trasplante parece una buena estrategia terapéutica, pues se podría eliminar el virus antes de que cause daño al injerto. Además, el tratamiento antiviral de la hepatitis aguda C en pacientes inmunocompetentes es muy eficaz, pues consigue la eliminación del virus en más del 90% de los individuos tratados22. Sin embargo, no son situaciones comparables, pues la infección del injerto se produce en el contexto de una respuesta inmunitaria previa que ha sido incapaz de eliminar el virus y el paciente trasplantado está sometido a una inmunodepresión muy intensa.
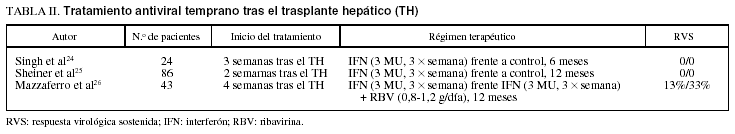
Entre los inconvenientes del tratamiento antiviral temprano están el riesgo de rechazo23 y la mala tolerancia al tratamiento en pacientes que han sido sometidos a una cirugía mayor. Además, hay que considerar la rapidez con la que el VHC inicia su replicación tras el trasplante2 (fig. 1). Teóricamente, el momento idóneo para iniciar el tratamiento sería aquel en que las concentraciones de ARN del VHC están en los niveles más bajos, es decir, durante las primeras 24 h que siguen al trasplante. Ello comporta, lógicamente, dificultades prácticas muy difíciles de solventar y explica la escasa eficacia comunicada hasta el momento (tabla II).
Fig. 1. Cinética del virus de la hepatitis C durante la infección del injerto hepático en 2 pacientes. La concentración de ARN del virus de la hepatitis C se expresa en UI/ml en escala logarítmica. El tiempo se expresa en horas/semanas tras el trasplante. P: previo al trasplante; A: fase anhepática; R: reperfusión.
Existen 2 estudios controlados que han evaluado la eficacia antiviral del interferón como monoterapia iniciado a la pocas semanas de realizado el trasplante24,25. Aunque dichos estudios indican que el tratamiento retrasó la aparición de hepatitis, no se produjo respuesta virológica sostenida en ningún paciente tratado. La combinación de interferón y ribavirina iniciada a las pocas semanas del trasplante arroja resultados más esperanzadores26, aunque, como se ha mencionado anteriormente, la aplicabilidad de dicho tratamiento es escasa y los efectos secundarios, extraordinariamente frecuentes.
Tratamiento de la hepatitis crónica C tras el trasplante hepático
En la mayoría de los centros el tratamiento de la hepatitis C se inicia transcurridos 6 o 12 meses desde el trasplante, cuando el diagnóstico de hepatitis crónica C se ha confirmado mediante una biopsia hepática. La tolerancia al tratamiento es mejor y el grado de inmunodepresión significativamente inferior al de las primeras fases del trasplante. A pesar de estas ventajas, los resultados del tratamiento con interferón y ribavirina administrados durante 12 meses no son satisfactorios; en la mayoría de los estudios únicamente se obtiene una respuesta virológica sostenida en alrededor del 20% de los pacientes tratados (tabla III)23,27-33.
Uno de los problemas fundamentales que tienen que afrontar el paciente y el médico que administra el tratamiento antiviral a este tipo de pacientes es el de los efectos adversos, que en muchas ocasiones obligan a la reducción de dosis (o a la suspensión del tratamiento), con el consiguiente efecto negativo sobre la eficacia antiviral.
Uno de los efectos secundarios más temidos del tratamiento con interferón es el rechazo. A pesar de que datos publicados recientemente señalan que la incidencia de rechazo en pacientes tratados no es superior a la de controles33, otros estudios describen la aparición de rechazo tipo ductopénico en pacientes que habían recibido tratamiento con interferón23,34,35. La aparición de este tipo de rechazo puede conducir a la pérdida del injerto y, por lo tanto, es especialmente importante proceder a la realización de una biopsia hepática ante la mínima sospecha. El efecto adverso que con más frecuencia obliga a la reducción o suspensión del tratamiento es la anemia hemolítica secundaria a la administración de ribavirina33. La administración de inmunodepresores u otros fármacos que bloquean la producción de eritrocitos en la médula ósea (micofenolato, cotrimoxazol) y la insuficiencia renal que con frecuencia sufren los pacientes trasplantados son algunos de los cofactores que explican la elevada incidencia de este efecto secundario. La utilización de eritropoyetina se ha demostrado eficaz para prevenir o reducir la anemia, aunque existen muy pocos datos sobre la dosis y el momento más apropiado para su uso.
Hay todavía pocos datos sobre la eficacia del tratamiento antiviral utilizando interferón pegilado. Se han comunicado resultados que indican una eficacia algo superior a la del interferón convencional, pero habrá que esperar a la publicación de series con un número suficiente de pacientes para confirmar estos datos.
Es importante recordar que la hepatitis C va a progresar a formas graves (cirrosis, hepatitis colestásica fibrosante) en algunos pacientes, pero permanecerá estable en otros. La práctica de biopsias hepáticas frecuentes (anuales) en pacientes trasplantados con hepatitis C ayudará a identificar a los individuos con una progresión rápida de su enfermedad que pueden beneficiarse del tratamiento antiviral. En los pacientes con hepatitis leves, es preferible la abstención terapéutica o, en cualquier caso, reservar el tratamiento para individuos con un buen perfil de respuesta (genotipos 2 o 3, carga viral baja, ausencia de medicaciones que puedan interferir o agravar los efectos adversos de los antivirales).
NUEVAS PERSPECTIVAS EN EL TRATAMIENTO DE LA HEPATITIS C
Es evidente que durante los últimos años se han producido avances muy notables en el conocimiento de la biología molecular del virus C. La construcción de clones infecciosos y de un replicón del virus, así como el descubrimiento de la estructura tridimensional de enzimas clave para el ciclo vital del VHC, ha resultado crucial para que se hayan iniciado programas encaminados al hallazgo de fármacos activos contra el virus. Los fármacos que a priori parecen más prometedores son los inhibidores de la polimerasa y proteasa virales, tal como quedó demostrado en un ensayo en fase I que utilizó un inhibidor de la proteasa viral36. En este estudio se constató que la administración de 4 dosis de una molécula inhibidora de la proteasa viral producía reducciones de la carga viral de entre 2 y 3 log en todos los pacientes tratados. Es muy probable que en los próximos 5-10 años dispongamos de fármacos mucho más potentes contra el VHC de los que existen actualmente.
Además de fármacos dirigidos específicamente a inhibir enzimas clave en el ciclo vital del virus, existen otras estrategias que pueden resultar útiles en la lucha contra el VHC. La fibrosis hepática es el factor que determina el pronóstico y la evolución de la hepatitis crónica C, y la intervención terapéutica en los mecanismos de fibrogénesis es un campo en el que se ha avanzado de forma notable37,38. En este sentido, parece que el sistema renina-angiotensina-aldosterona desempeñaría un papel esencial, dada su activación en situaciones de lesión tisular para promover la reparación de tejidos. La angiotensina II tiene una acción claramente profibrogénica en el corazón y riñón, y su bloqueo reduce la lesión en estos órganos38-41. Es por ello que hay un interés creciente por estudiar la acción de este sistema en la fibrogénesis hepática37,38,42. Existen estudios experimentales que demuestran que el bloqueo del sistema renina-angiotensina-aldosterona tiene efectos antifibrogénicos en el hígado de ratas sometidas a ligadura de conducto biliar43. En un estudio retrospectivo publicado recientemente se analizó el posible efecto de la administración de inhibidores de la enzima de conversión de la angiotensina o de bloqueadores del receptor de la angiotensina en la evolución de la fibrosis hepática en pacientes sometidos a TH e infectados por el VHC. Se pudo constatar que la probabilidad acumulativa de desarrollar fibrosis avanzada era muy inferior en aquellos que habían recibido estas fármacos en comparación con controles44. Lógicamente, estos resultados requieren validación en estudios prospectivos, pero abren la puerta a nuevas vías para modificar la historia natural de la recurrencia de la infección por el VHC en el injerto hepático.
CONCLUSIONES
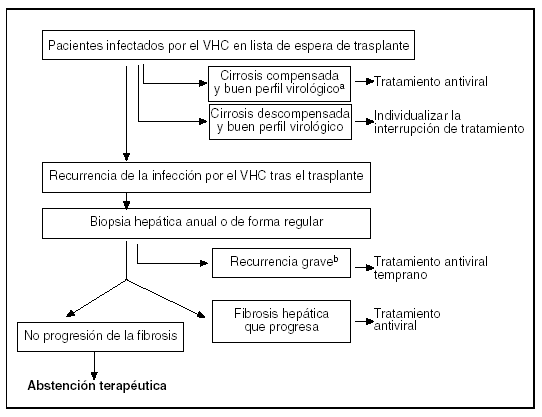
La recurrencia de la infección por el VHC tras el TH es actualmente el primer problema de los programas de trasplante. Existen diversas estrategias encaminadas a reducir el impacto que la infección por el VHC tiene en el injerto a medio y largo plazo (fig. 2). Sin embargo, ninguna de ellas puede considerarse óptima y, por lo tanto, es necesario un gran esfuerzo para el desarrollo de nuevos tratamientos.
Fig. 2. Algoritmo de manejo de la recurrencia de la hepatitis C antes y después del trasplante hepático. VHC: virus de la hepatits C.aGenotipos 2 o 3, carga viral baja; bhepatitis colestásica fibrosante, presencia de gran actividad necroinflamatoria acompañada de fibrosis.
Una primera estrategia para intentar evitar la infección del injerto hepático es la administración de tratamiento antiviral en pacientes que se hallan en lista de espera para trasplante. La aplicabilidad del tratamiento es baja y la tolerancia, mala, pero la respuesta es satisfactoria en pacientes con un buen perfil virológico (genotipos 2 o 3, pacientes con carga viral baja), especialmente en individuos con cirrosis compensada en los que la indicación de trasplante es el carcinoma hepatocelular. Además, la cinética viral durante el tratamiento permite identificar a los pacientes que tienen probabilidades de responder y puede evitar prolongarlo innecesariamente en aquéllos con baja probabilidad de respuesta. En pacientes con cirrosis descompensada y un buen perfil de respuesta la indicación del tratamiento debe individualizarse.
En caso de recurrencia de la infección, el tratamiento puede iniciarse inmediatamente después del trasplante o demorarse hasta que se haya demostrado la presencia lesión hepática. La primera estrategia tiene muchos inconvenientes (mala tolerancia, baja aplicabilidad), y además, supone administrar el tratamiento a un gran número de pacientes que no van a desarrollar una recurrencia grave. Finalmente, los datos sobre cinética viral en el postrasplante inmediato no indican que se trate de una estrategia lógica. Únicamente en pacientes en los que se produce una recidiva grave (hepatitis colestásica fibrosante) debería intentarse el tratamiento temprano.
En general, en pacientes con hepatitis C tras el TH es aconsejable proceder a la realización de biopsias seriadas. La escasa eficacia y pobre tolerabilidad de los tratamientos actuales aconsejan que sólo en aquellos casos en los que se demuestra una progresión de la enfermedad (fibrosis que rebasa los espacios porta, actividad necroinflamatoria grave) se indique el tratamiento antiviral. Además, hay que tener en cuenta que los regímenes terapéuticos actuales se basan en datos obtenidos en pacientes inmunocompetentes y es posible que no sean útiles en pacientes trasplantados. Para el futuro inmediato es muy importante diseñar estudios encaminados a evaluar la eficacia de nuevos esquemas terapéuticos (prolongar el tratamiento, utilización de factores estimulantes).