El trasplante se ha convertido en el tratamiento de elección de las hepatopatías terminales, con tasas de supervivencia a 5 años en torno al 68-74% en los registros europeos y norteamericanos (www.unos.org, www.eltr.org, www.ont.es). Estos resultados se deben en gran medida al desarrollo de inmunosupresores potentes, fundamentalmente los inhibidores de calcineurina (ICN). Sin embargo, estos inmunosupresores no están exentos de efectos secundarios, destacando su nefrotoxicidad. Además, dos de las indicaciones más frecuentes de trasplante, la cirrosis por virus de la hepatitis C (VHC) y el carcinoma hepatocelular pueden recurrir en el nuevo injerto, y se debate si el administrar una inmunosupresión específica pudiera ser menos perjudicial en estas condiciones. Con el mayor uso de donantes subóptimos y del trasplante de carcinoma hepatocelular (CHC) con criterios expandidos es previsible un aumento de recurrencias agresivas. En esta revisión, intentaremos dilucidar si existe alguna estrategia de inmunosupresión que permita minimizar el riesgo de recurrencia tumoral o de hepatitis C agresivas.
Transplantation has become the treatment of choice in end-stage liver disease, with 5-year survival rates of around 68-74% in European and North-American registries (www.unos.org, www.eltr.org, www.ont.es). These results are largely due to the development of powerful immunosuppressive agents, mainly calcineurin inhibitors. However, these immunosuppressive drugs are not free of adverse effects, especially nephrotoxicity. Moreover, two of the most frequent indications for transplantation, cirrhosis due to hepatitis C virus and hepatocellular carcinoma, can recur in the transplanted graft. Whether specific immunosuppression could be less harmful in these conditions is the subject of debate. With the greater use of suboptimal donors and of expanded criteria for liver transplantation in patients with hepatocellular carcinoma, aggressive recurrences can be expected to increase. The present review attempts to elucidate whether there is an immunosuppression strategy that could minimize the risk of aggressive tumoral recurrence or recurrence of hepatitis C.
La cirrosis secundaria a la infección crónica por el virus de la hepatitis C (VHC) es una de las principales indicaciones de trasplante hepático en adultos en nuestro medio. Así, en el año 2010, el 25% de trasplantes se realizaron por cirrosis por VHC y el 11% por cirrosis VHC+ carcinoma hepatocelular (CHC), según datos del Registro Español de Trasplante Hepático (RETH) (www.ont.es). La reinfección del injerto es constante y además se produce a las pocas horas de reperfundirlo1. La respuesta más común a la infección es la hepatitis crónica C del injerto, que cursa de forma similar a la descrita en no trasplantados, aunque en presencia de niveles de viremia mayores y con mayor celeridad en la progresión de la fibrosis, desarrollando fibrosis avanzada y/o cirrosis en menos tiempo (mediana: 9-12 años frente a 25-50 años)2–4. Aproximadamente un 25% desarrolla una cirrosis del injerto tras 5 años de seguimiento2–4. Globalmente la recidiva de la enfermedad condiciona que el pronóstico a largo plazo sea inferior al obtenido en pacientes trasplantados por otras etiologías, con una supervivencia global a los 5 años del 70 frente al 80% en los negativos para el VHC, tal y como reportan varios estudios longitudinales5,6. Según datos del RETH en trasplantados adultos entre 1991 y 2010, la supervivencia a los 10 años (sin CHC asociado) de los VHC (+) es de un 53,9 frente al 66,4% de los VHC (-).
Por todo ello, la hepatitis C recurrente constituye uno de los problemas principales de los distintos programas de trasplante. Su seguimiento y tratamiento requieren lograr un delicado equilibrio entre mantener una supresión inmunitaria permitiendo a su vez una respuesta natural eficaz contra el virus. Entre las distintas estrategias para evitar una recurrencia agresiva, el uso adecuado de los fármacos inmunosupresores es especialmente importante. En 2008 se publicaron los resultados de una encuesta internacional a 81 centros de trasplante7. Los datos revelan que un tercio de los centros tenía protocolos de inmunosupresión específicos para receptores VHC (+), y la gran mayoría usaba tacrolimus (Tac) como inhibidor de calcineurina (ICN). Menos del 10% usaba pautas sin esteroides y el 98% los retiraba en el primer año (más de la mitad en los 3 primeros meses). La duración del tratamiento corticoideo fue significativamente menor en Estados Unidos que en el resto del mundo (10,8 vs 29,4 semanas, p<0,001).
Globalmente se acepta que en estos pacientes debe evitarse una inmunodepresión excesiva, y sobre todo los cambios bruscos en el estado neto de inmunodepresión. Un estudio prospectivo de nuestro grupo confirmó los beneficios de evitar la sobreinmunodepresión y de evitar cambios bruscos en la misma8. Tras instaurar una pauta de inmunosupresión en la que se evitaban los bolos de corticoides, las terapias triples o cuádruples a dosis plenas, y la reducción rápida de esteroides, la tasa de recidiva de la hepatitis por VHC grave se redujo del 54 al 33%. Más controvertido es el papel de cada uno de los inmnunosupresores sobre la replicación del VHC y la evolución de la hepatitis C del injerto.
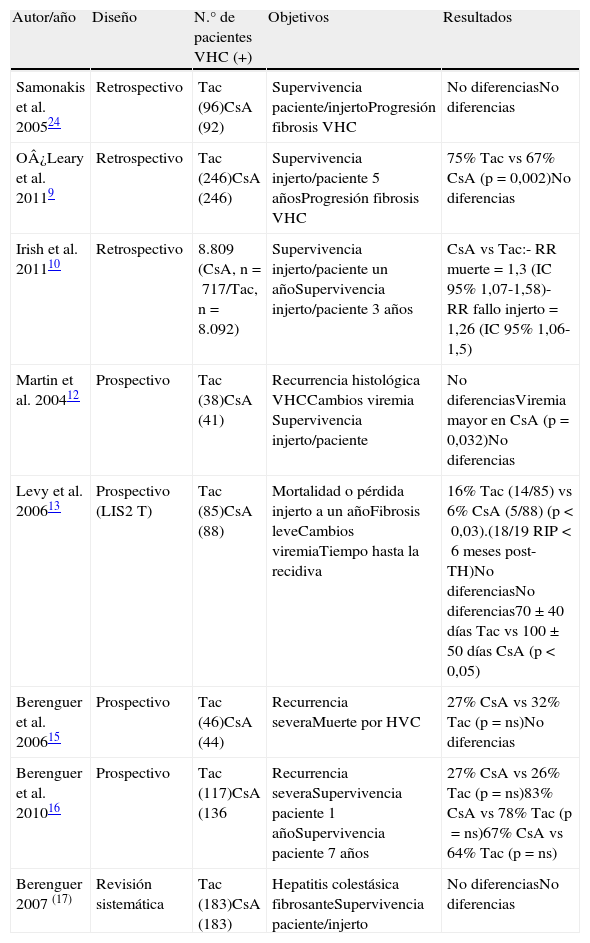
Inhibidores de la calcineurinaExiste un debate recurrente acerca de si alguno de los ICN (ciclosporina [CsA] o Tac) presenta ventajas respecto al otro respecto a la evolución de la hepatitis C del injerto. Estudios basados en modelos in vitro (replicón y hepatocitos cultivados) han demostrado que la CsA inhibe la replicación del VHC mientras que este efecto no se produce con Tac. Sin embargo, ni la mayoría de estudios retrospectivos ni los prospectivos han confirmado estos resultados en la práctica clínica (tabla 1). En un análisis retrospectivo de la UNOS10, por el contrario, en que se analizaron los resultados de unos 9.000 VHC (+) trasplantados en Estados Unidos, se observó una menor supervivencia del paciente e injerto al año y a los 3 años en receptores VHC tratados con CsA frente a Tac, así como un mayor riesgo de rechazo. Pese a ser una de las series retrospectivas más numerosas, los resultados deben interpretarse con cautela, por diversas razones, entre las que destaca la elevada diferencia en el porcentaje de pacientes tratados con Tac (92%) frente a CsA (8%)11.
Estudios que analizan la influencia del tipo de inhibidor de la calcineurina en trasplantados por cirrosis VHC(+)
| Autor/año | Diseño | N.° de pacientes VHC (+) | Objetivos | Resultados |
| Samonakis et al. 200524 | Retrospectivo | Tac (96)CsA (92) | Supervivencia paciente/injertoProgresión fibrosis VHC | No diferenciasNo diferencias |
| O¿Leary et al. 20119 | Retrospectivo | Tac (246)CsA (246) | Supervivencia injerto/paciente 5 añosProgresión fibrosis VHC | 75% Tac vs 67% CsA (p = 0,002)No diferencias |
| Irish et al. 201110 | Retrospectivo | 8.809 (CsA, n=717/Tac, n=8.092) | Supervivencia injerto/paciente un añoSupervivencia injerto/paciente 3 años | CsA vs Tac:- RR muerte=1,3 (IC 95% 1,07-1,58)- RR fallo injerto=1,26 (IC 95% 1,06-1,5) |
| Martin et al. 200412 | Prospectivo | Tac (38)CsA (41) | Recurrencia histológica VHCCambios viremia Supervivencia injerto/paciente | No diferenciasViremia mayor en CsA (p=0,032)No diferencias |
| Levy et al. 200613 | Prospectivo (LIS2T) | Tac (85)CsA (88) | Mortalidad o pérdida injerto a un añoFibrosis leveCambios viremiaTiempo hasta la recidiva | 16% Tac (14/85) vs 6% CsA (5/88) (p<0,03).(18/19 RIP<6 meses post-TH)No diferenciasNo diferencias70 ± 40 días Tac vs 100 ± 50 días CsA (p<0,05) |
| Berenguer et al. 200615 | Prospectivo | Tac (46)CsA (44) | Recurrencia severaMuerte por HVC | 27% CsA vs 32% Tac (p=ns)No diferencias |
| Berenguer et al. 201016 | Prospectivo | Tac (117)CsA (136 | Recurrencia severaSupervivencia paciente 1 añoSupervivencia paciente 7 años | 27% CsA vs 26% Tac (p=ns)83% CsA vs 78% Tac (p=ns)67% CsA vs 64% Tac (p=ns) |
| Berenguer 2007 (17) | Revisión sistemática | Tac (183)CsA (183) | Hepatitis colestásica fibrosanteSupervivencia paciente/injerto | No diferenciasNo diferencias |
CsA:ciclosporina A; NS:no significativo; RR:riesgo relativo; Tac:tacrolimus.
Desafortunadamente hay pocos estudios prospectivos que hayan analizado este efecto in vivo. En un estudio de Martin et al.12 se evaluó el efecto de ambos ICN sobre la replicación viral distribuyendo de forma aleatorizada a 79 pacientes que recibieron CsA o Tac. Se objetivó un aumento significativamente mayor de la carga viral en los pacientes que recibían CsA, si bien no se pudo clarificar si este efecto era debido a que recibían mayores dosis acumuladas de corticoides que el grupo de Tac. No hubo diferencias en la recidiva de la hepatitis C ni en la supervivencia.
En otro estudio prospectivo, multicéntrico13 y con un seguimiento de 12 meses (estudio LIS2T), 495 receptores fueron aleatorizados a recibir CsA o Tac+esteroides±azatioprina (Aza). En el subgrupo de 173 pacientes VHC (+) (CsA 88 vs Tac 85) la mortalidad y/o pérdida del injerto en el primer año fue mayor en el grupo de CsA, si bien prácticamente todos los fallecimientos tuvieron lugar en los 6 primeros meses y el estudio no se diseñó para evaluar el impacto del VHC. El porcentaje de pacientes con fibrosis leve y la viremia fueron similares en ambos grupos. El tiempo hasta la recidiva de la hepatitis fue más precoz en el grupo de Tac.
En otro ensayo controlado similar14, 488 receptores fueron aleatorizados a recibir CsA (58 VHC+) o Tac (46 VHC+) como inmunosupresor de base (junto con azatioprina y prednisona que se interrumpían a los 3 meses). El objetivo primario era la mortalidad y/o necesidad de retrasplante y/o fracaso inmunológico (necesidad de cambio de inmunosupresión por rechazo). Los resultados globales fueron favorables al grupo de Tac. Sin embargo, en el análisis detallado del subgrupo de pacientes VHC (+) no se encontraron diferencias entre los tratados con CsA frente a aquellos tratados con Tac.
Finalmente, en un estudio prospectivo15 en el que se investigó la relación entre el tipo de ICN y el desarrollo de recidiva grave (definida como fibrosis en puentes, cirrosis, hepatitis colestásica y/o fallecimiento debido a la recurrencia VHC) por medio de biopsias de protocolo, la única diferencia entre los 44 pacientes aleatorizados a CsA (n=44) y aquellos tratados con Tac (n=46) fue que el tiempo hasta la recidiva fue menor en el grupo de Tac comparado con el grupo de CsA (59 vs 92 días). Este estudio se ha ampliado hasta alcanzar 136 pacientes con CsA y 117 con Tac y tampoco se han encontrado diferencias en todas las variables estudiadas ni en la supervivencia16.
Una revisión sistemática17 estudió el efecto de los ICN sobre el pronóstico de pacientes trasplantados por cirrosis por VHC. De todas las publicaciones valoradas, solo 5 cumplían criterios para ser incluidas en el análisis. Se incluyeron un total de 366 pacientes distribuidos en 2 brazos de tratamiento, uno basado en CsA y otro en Tac, sin encontrarse diferencias significativas en la mortalidad del paciente ni en la pérdida del injerto; en 2 de los 5 trabajos tampoco se encontraron diferencias en la tasa de hepatitis colestásica fibrosante (HCF).
Por tanto, hasta la fecha no se han demostrado diferencias en la supervivencia del injerto ni del paciente, ni en la evolución de la hepatitis C recurrente en función del ICN utilizado. En consecuencia, y según se recoge en el último documento de consenso de la Sociedad Española de Trasplante Hepático, no puede recomendarse el uso de un ICN específico en pacientes trasplantados VHC (+)18.
Influencia del tipo de inhibidor de la calcineurina en los resultados de la terapia antiviralEl hecho de que la CsA, y no el Tac, haya demostrado actividad in vitro contra el VHC19 ha proporcionado un motivo racional para investigar si alguno de los ICN mejora los resultados de la terapia antiviral en la hepatitis C recurrente. En algunas de las series unicéntricas descriptivas de terapia antiviral, el tratamiento con CsA se ha asociado con mayor RVS debido a menor recaída virológica. Desafortunadamente, solo existe un estudio prospectivo aleatorizado20 que haya analizado este aspecto, con un número muy escaso de pacientes incluidos. En este estudio no se observaron diferencias significativas en la respuesta virológica sostenida (RVS) según los pacientes recibieran CsA o Tac (datos preliminares).
CorticoidesLos datos sobre el efecto de los corticoides son contradictorios (tabla 2). Existe consenso en asegurar que el uso de bolos de corticoides en el tratamiento del rechazo celular es perjudicial para los receptores VHC (+)2–4,6,21,22, al condicionar un aumento llamativo de la replicación viral, una recidiva más agresiva (mayor incidencia de hepatitis aguda, tiempo hasta la recidiva menor, mayor riesgo de progresión a cirrosis o de desarrollo de hepatitis colestásica) y un incremento de la mortalidad precoz post-TH2–4,23. A la luz de estos resultados, numerosos programas de trasplante han adoptado estrategias encaminadas a reducir (retirada precoz) o evitar (regímenes inmunosupresores libres de esteroides) el uso de corticoides en pacientes VHC. Sin embargo, el posible beneficio de dichas estrategias debe ser validado en estudios prospectivos.
Estudios que analizan la influencia de los esteroides en trasplantados por virus de la hepatitis C positivos
| Autor/año | Diseño | N.° de pacientes VHC (+) | Pauta esteroides | Resultados |
| Brillanti et al. 200225 | Retrospectivo | 80 | n=44, retirada lenta hasta 24 meses o indefinidamenten=36, 5mg a partir del 7.° mes | Retirada lenta esteroides: mejor evolución VHC |
| Samonakis et al. 200524 | Retrospectivo | 188 | Tratamiento de mantenimiento medio 4 meses | Retirada precoz de esteroides: peor evolución VHC |
| Margarit et al. 200527 | Prospectivo | 35 | n=20, Tac monoterapian=15, Tac+GC | Sin diferencias en recidiva según pauta de inmunosupresión |
| Vivarelli et al. 200726 | Prospectivo | 37 | n=31, retirada precoz (3 meses)n=17, retirada lenta (25 meses) | Retirada precoz esteroides: peor evolución VHC |
| Llado et al. 200828 | Prospectivo | 89 | n= 46, CsA+Basiliximab+GCn= 43, CsA+Basiliximab | Sin diferencias en recidiva según pauta inmunosupresión |
| Klintmalm et al. 201129 | Prospectivo | 295 | n= 77, Tac+GCn= 72, Tac+GC+MMFn=146, Daclizumab+Tac+MMF | Sin diferencias en recidiva según pauta inmunosupresión |
| Segev et al. 200830 | Metanálisis | 30 estudios | Pautas con/sin esteroides | Menos recidiva con pautas sin esteroidesNo recomendaciones por heterogenicidad estudios. |
| Sgourakis et al. 200931 | Metanálisis | 1418 pacientes | Pautas con/sin esteroides | Mejor evolución recidiva VHC sin esteroides |
| Manousou et al. 200934 | Prospectivo | 103 | n= 54, monoterapia con Tacn= 49, Tac+Aza+GC(GC retirados entre 3-6 meses) | Pauta con retirada lenta esteroides asociada a progresión más lenta a fibrosis severa |
CsA:ciclosporina; GC:esteroides A; Tac:tacrolimus.
Respecto a la retirada precoz de esteroides, estudios iniciales retrospectivos24,25 no demostraron beneficio e incluso apuntaron a una mayor progresión de la hepatitis C en los pacientes con retirada precoz de corticoides. Un único estudio prospectivo26 con un número muy reducido de pacientes, evidenció una supervivencia libre de fibrosis avanzada significativamente inferior en el grupo en el que se retiraron precozmente los esteroides (n=21) frente al que se mantuvieron los esteroides (n=16).
En cuanto a las pautas inmunosupresoras libres de esteroides, diversos estudios con distintos regímenes, unos con corticoides y otros sin ellos, globalmente muestran que no hay diferencias en la viremia, en la supervivencia ni en la progresión de la fibrosis27,28. En el estudio aleatorizado con mayor número de pacientes incluidos (n=245), Klintmalm el al.29 no encontraron diferencias en las tasas de recidiva agresiva de la hepatitis C ni en la supervivencia del injerto/paciente entre los protocolos sin o con esteroides.
Un metanálisis de Segev et al.30 concluye que las pautas sin esteroides se acompañan de menor recidiva, si bien en ninguno de los ensayos aleatorizados incluidos se alcanzó significación estadística. Además, la definición de recidiva varió entre los estudios, lo que, junto a la heterogeneidad de los mismos, dificulta la interpretación de los datos. En otro metanálisis31, los autores también concluyen que tanto la recidiva como la hepatitis aguda del injerto son menos graves en los pacientes con pautas sin esteroides. Sin embargo, no se evaluó la dosis ni la pauta de reducción de los esteroides.
En el documento de consenso español18 se recomienda evitar la utilización de bolos de esteroides en los rechazos leves-moderados. Asimismo se concluye que las pautas sin esteroides son seguras, y que si estos se utilizan deben retirarse progresivamente (no antes del sexto mes).
Micofenolato mofetiloLos datos respecto a micofenolato mofetilo (MMF) tampoco son concluyentes. Zekry et al. evaluaron el papel del MMF32, constatando un aumento de la carga viral en aquellos a los que se les cambiaba la azatioprina por MMF, si bien no se analizó si este aumento se asociaba a cambios histológicos. En un trabajo33 106 receptores VHC (+) fueron aleatorizados a recibir triple terapia con MMF (Tac+MMF+esteroides, n=50) o doble terapia (Tac+esteroides, n=56). No hubo diferencias en la tasa de recidiva de la hepatitis C, pérdida del injerto o muerte por VHC recurrente, ni tampoco en los hallazgos histológicos (solo se realizaron biopsias ante deterioro analítico).
En el estudio de Klintmalm et al.29 antes mencionado, se aleatorizaron los pacientes a 3 brazos de tratamiento, 2 de ellos con MMF y uno sin MMF (Tac+corticoides [CS] [n=77]; Tac+MMF+CS [n=72]; daclizumab+Tac+MMF [n=146]), sin encontrarse diferencias en la progresión a fibrosis ni en el tiempo libre de recidiva de la hepatitis C.
AzatioprinaEn un trabajo prospectivo aleatorizado y con 3 años de seguimiento34, 96 pacientes se aleatorizaron a 2 brazos de tratamiento, uno en monoterapia con Tac (n=54) frente a otro con triple terapia con Tac+Aza+prednisona (n=49). La probabilidad de alcanzar una fibrosis 4 o el tiempo hasta el desarrollo de hipertensión portal fue menor en el grupo con triple terapia (en el que la Aza se mantenía durante más de un año y los esteroides durante 3-6 meses). En la discusión, los autores admiten que no son capaces de establecer si el beneficio se debió a la retirada lenta de esteroides o bien al potencial papel protector de la Aza.
Cabe destacar que hasta la fecha no hay ninguna publicación que demuestre peores resultados respecto a la recidiva del VHC en los pacientes tratados con Aza. Por el contrario, una revisión sistemática35 que analizó el impacto de AZA y MMF en la hepatitis C recurrente mostró que la recidiva fue menos grave en 5 de los 9 estudios en los que se usaba Aza (frente a solo 2 de los 17 en los que se usaba MMF). En ninguno de los estudios Aza se asoció a peor recidiva (frente a 6 de los 17 en los que se usaba MMF).
Anticuerpos monoclonales OKT3Su uso se asocia a incrementos de la viremia36 y constituye un factor de riesgo independiente para el desarrollo de recidiva grave y pérdida del injerto2–4,6,37.
Anticuerpos antirreceptor de interleucina 2Los datos con inducción mediante anticuerpos monoclonales anti-interleucina 2 (IL-2) son igualmente contradictorios. Dos ensayos controlados y aleatorizados38,39 no demostraron efecto sobre la supervivencia, pero el seguimiento era corto, y con datos escasos sobre el efecto en la recidiva VHC. En el estudio de Klintmalm et al.29, en el que uno de los brazos incluía inducción con anti-IL-2, tampoco se hallaron diferencias frente a los brazos sin anti-IL-2.
Inhibidores de la mTORSirolimus (SRL) y everolimus ejercen su acción por medio de su unión a la proteína mTOR (mammalian target of rapamycin: diana de la rapamicina en células de mamífero), interfiriendo en la transducción de la señal intracelular provocada por la unión de la interleucina 2 a su receptor, lo que inhibe la proliferación de los linfocitos T40.
No existen hasta el momento estudios que hayan evaluado prospectivamente el efecto de estos fármacos en la evolución de la hepatitis C recurrente. Datos de laboratorio sugieren que los inhibidores de la mTOR (imTOR) podrían alterar la capacidad replicativa del VHC, así como la actividad necroinflamatoria sobre el injerto41. La cascada mTOR participa en la activación de las células estrelladas y en la formación de la matriz extracelular en hígado. Estudios en animales42,43 han demostado una reducción significativa en el desarrollo de fibrosis en roedores tratados con sirolimus a través de una inhibición de genes responsables de la fibrogénesis. Un estudio reciente44 analizó la capacidad de diversos inmunosupresores (sirolimus, everolimus, tacrolimus y ciclosporina) para detener la progresión de la fibrosis hepática experimental, constatando que el tratamiento con imTOR se asociaba con una progresión de fibrosis significativamente menor que el tratamiento con ICN.
En un estudio prospectivo pero no aleatorizado45 de 67 receptores VHC (+), los niveles de viremia fueron significativamente menores y la supervivencia mayor en el grupo de 38 pacientes tratados con sirolimus (vs ICN).
En un trabajo retrospectivo46, con análisis de las biopsias de protocolo, la incidencia de fibrosis avanzada (estadio F ≥ 2 METAVIR) fue significativamente inferior en el grupo de SRL (n = 173) que en el grupo control (n=282) al primer (15,3 vs 36,2%, p<0,001) y segundo año (30,1 vs 50,5%, p=0,001). En el análisis multivariante, el uso de sirolimus fue un factor predictivo independiente de fibrosis mínima al primer y segundo año. La supervivencia no se modificó según el tipo de inmunosupresión.
Finalmente, en un trabajo retrospectivo de 141 pacientes (88 tratados con sirolimus)47 no se encontraron diferencias entre los grupos con/sin sirolimus, respecto al tiempo hasta la recidiva, la gravedad de la misma al diagnóstico, ni la supervivencia. En las biopsias seriadas, no obstante, la actividad inflamatoria y la fibrosis media fueron significativamente menores en el grupo de sirolimus.
Son necesarios estudios prospectivos que evalúen específicamente la influencia de los imTOR sobre la recidiva VHC, aunque con los datos disponibles parece razonable concluir que no son perjudiciales en su evolución.
ConclusionesSalvo el tratamiento del rechazo con OKT3 o bolos de corticoides, ningún inmunosupresor concreto parece ser determinante en el curso de la hepatitis C del injerto. Por ello, no se puede recomendar una pauta de inmunosupresión concreta para los receptores VHC (+). Las únicas recomendaciones son, evitar los cambios bruscos en la inmunosupresión, así como la sobreinmunosupresión (triple y cuádruples terapias a dosis plenas).
Inmunosupresión en trasplantados por carcinoma hepatocelular (CHC)El CHC supone una indicación frecuente de TH, representando el 14% de las indicaciones de TH en Europa (www.eltr.org) y hasta el 25% en centros con alta prevalencia de VHC. Según datos del RETH, el CHC supuso la segunda causa de trasplante hepático en adultos (después de las cirrosis hepatocelulares) durante el año 2010 (22% de los trasplantes hepáticos). Desde la publicación de los criterios de Milán48 el trasplante se ha consolidado como el mejor tratamiento para pacientes seleccionados con tumor no resecable, con cifras de supervivencia entre un 60-80% a los 5 años. No obstante, a pesar de una selección rigurosa, en 10-30% casos se produce una recurrencia tumoral49, habitualmente en los 2 primeros años post-TH, con un mal pronóstico debido a los malos resultados de los tratamientos médico-quirúrgicos. Con la aplicación de criterios expandidos (fuera de los criterios de Milán) la tasa de recurrencia podría aumentar en los próximos años, por lo que se hace necesario adoptar diversas estrategias para minimizarla. Una de ellas es establecer pautas de inmunosupresión que permitan minimizar el riesgo de recidiva tumoral pero sin aumentar el riesgo de rechazo, pautas sobre las que no existe consenso en la actualidad.
Los fármacos inmunosupresores inhiben la capacidad de vigilancia tumoral del sistema immunitario por lo que pueden aumentar la posibilidad de recurrencia del CHC. Desafortunadamente la mayoría de la información disponible sobre los efectos de la inmunosupresión en la recurrencia tumoral provienen de trabajos experimentales y de estudios no aleatorizados ni multicéntricos. Así, trabajos experimentales han demostrado que la CsA promueve la carcinogénesis a través de varios mecanismos: aumenta la capacidad invasora de las células cancerígenas por medio del incremento de la expresión del factor transformador del crecimiento beta (transforming-growth factor β, TFG-β)50, inhibe los fenómenos de reparación del DNA in vitro51 y promueve la angiogénesis por la vía del factor de crecimiento endotelial vascular (vascular endothelial growth factor, VEGF)52. Respecto a tacrolimus, un estudio mostró que, in vitro, promueve la proliferación de líneas celulares de hepatoma, a diferencia del sirolimus que la inhibe53.
Estos efectos se traducen en hechos clínicamente relevantes tal como queda reflejado en una serie de estudios: a) los pacientes en el brazo de dosis altas de CsA de un ensayo aleatorizado54 que comparaba 2 regímenes de CsA tuvieron una incidencia mayor de tumores, sobre todo de piel y hematológicos; b) un grupo italiano55 constató la existencia de una relación directa entre la dosis acumulada de CsA administrada el primer año post-TH y la supervivencia libre de recurrencia tumoral (a mayor dosis, menor supervivencia sin recurrencia); c) un estudio posterior del mismo grupo56 confirmó que la exposición a Tac o CsA era un factor independiente de CHC recurrente (junto con la invasión microvascular y el grado histológico); d) el grupo de Pittsburg57 llevó a cabo una estimación del tiempo que el CHC tardaba en doblar su tamaño en humanos, comprobando que en pacientes trasplantados, los ICN se asociaban a una reducción significativa del tiempo de duplicación, frente a la resección hepática sin inmunosupresión (37 días vs 273 días).
Por tanto, estudios in vitro y en animales han documentado un efecto adverso de los ICN sobre los tumores, y series clínicas han mostrado que tienen un impacto dependiente de la dosis sobre la recurrencia del CHC y la supervivencia. En este escenario parece necesario adoptar pautas inmunosupresoras que permitan minimizar el uso de ICN. Hasta la fecha, los únicos tipos de inmunnosupresores que parecen reducir la recurrencia del CHC post-TH son los imTOR, que en la teoría cumplen con los 2 requisitos adecuados para este uso: acción antiproliferativa e inmunosupresora a la vez. La base racional de su posible efecto antitumoral es que la activación de la proteincinasa mTOR induce proliferación celular y evita la muerte programada de las células, lo que conduce a su crecimiento desordenado. Así, a diferencia de los ICN, sirolimus inhibe la proliferación de células de hepatoma in vitro58, y en modelos animales59 (ratas tratadas con sirolimus tuvieron una supervivencia significativamente mayor y desarrollaron menos metástasis respecto a un grupo control). Este efecto antitumoral es debido en gran medida a las propiedades antiangiogénicas de los imTOR (pues disminuyen la producción del VEGF), efecto que además se produce con las mismas concentraciones en sangre necesarias para prevenir el rechazo52, lo que les confiere una propiedad especialmente atractiva para usarlos como inmunosupresión de mantenimiento. Además actúan sobre el tumor ya establecido al inducir microtrombosis60.
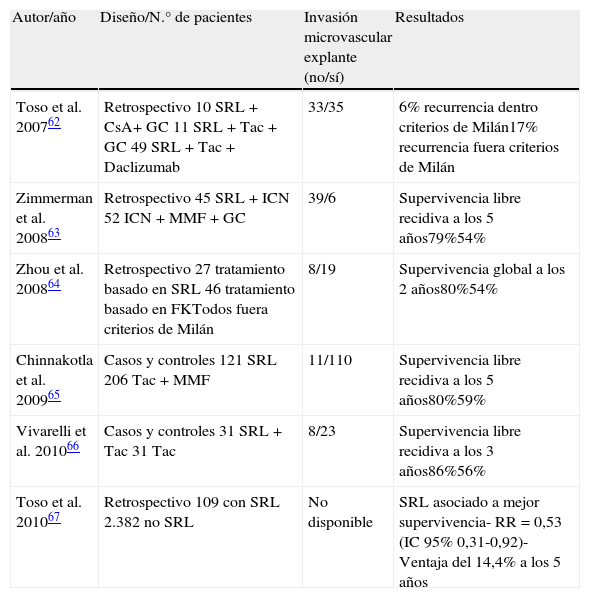
Estos efectos antitumorales de los imTOR se han traducido en beneficios clínicos en varios estudios unicéntricos, desafortunadamente no aleatorizados (tabla 3) en los que se describe un beneficio significativo en relación con la recurrencia tumoral y a la supervivencia de los pacientes.
Estudios que analizan la recurrencia de carcinoma hepatocelular en trasplantados con pautas de inmunosupresión con imTOR
| Autor/año | Diseño/N.° de pacientes | Invasión microvascular explante (no/sí) | Resultados |
| Toso et al. 200762 | Retrospectivo10 SRL+CsA+ GC11 SRL+Tac + GC49 SRL+Tac+Daclizumab | 33/35 | 6% recurrencia dentro criterios de Milán17% recurrencia fuera criterios de Milán |
| Zimmerman et al. 200863 | Retrospectivo45 SRL+ICN52 ICN+MMF+GC | 39/6 | Supervivencia libre recidiva a los 5 años79%54% |
| Zhou et al. 200864 | Retrospectivo27 tratamiento basado en SRL46 tratamiento basado en FKTodos fuera criterios de Milán | 8/19 | Supervivencia global a los 2 años80%54% |
| Chinnakotla et al. 200965 | Casos y controles121 SRL206 Tac+MMF | 11/110 | Supervivencia libre recidiva a los 5 años80%59% |
| Vivarelli et al. 201066 | Casos y controles31 SRL+Tac31 Tac | 8/23 | Supervivencia libre recidiva a los 3 años86%56% |
| Toso et al. 201067 | Retrospectivo109 con SRL2.382 no SRL | No disponible | SRL asociado a mejor supervivencia- RR=0,53 (IC 95% 0,31-0,92)- Ventaja del 14,4% a los 5 años |
Toso et al.62 analizaron un protocolo de inmunosupresión con sirolimus de novo+ICN en dosis bajas administrados menos de 12 meses en 70 trasplantados por CHC (34 dentro de criterios de Milán y 36 con criterios expandidos). Tras un período de seguimiento medio de 49 meses, solo 8 pacientes desarrollaron recurrencia tumoral (2 de 34 [6%] de los que cumplían criterios de Milán, y 6 de 36 [17%] de los que tenían criterios expandidos). Respecto a la tolerancia, el 80% de los inicialmente tratados con SRL seguían con el imTOR a los 4 años post-TH. Las causas más frecuentes de retirada de SRL fueron la toxicidad hematológica, los problemas de cicatrización y las úlceras orales. Dos tercios de los tratados con SRL presentaron dislipidemia, más de la mitad anemia y leucopenia y un tercio desarrollaron hernias incisionales. Más de la mitad de pacientes (52%) tuvieron un rechazo agudo, aunque no se produjo ninguna pérdida de injerto por este motivo.
Zimmerman et al.63 compararon retrospectivamente 2 grupos de trasplantados por CHC, 45 tratados con SRL+ICN frente a 52 tratados con ICN+MMF+corticoides. La supervivencia libre de recurrencia tumoral al año y a los 5 años fue significativamente superior en el grupo de SRL (93 vs 75% al año y 79 vs 54% a los 5 años).
En otro estudio retrospectivo64 en 73 trasplantados por CHC fuera de criterios de Milán, los autores constataron que los 27 receptores tratados con SRL alcanzaban una supervivencia media global significativamente mayor (594±35 días) que los 46 pacientes tratados con Tac (480±42 días, p=0,01), si bien no hubo diferencias en la supervivencia libre de recidiva entre ambos grupos. La recurrencia fue significativamente mayor en el grupo de Tac en los 6 primeros meses (20 vs 4%, p = 0,038).
Un estudio de casos y controles65 comparó los resultados de 121 pacientes tratados con SRL frente a 106 tratados con Tac y MMF. La supervivencia libre de recidiva tumoral fue significativamente mayor en el grupo de SRL, con cifras de supervivencia del paciente al año del 94% (vs 79%), a los 3 años del 85% (vs 66%) y a los 5 años del 80% (vs 59%).
El grupo de Bolonia66 realizó otro estudio de casos y controles, donde la supervivencia libre de tumor a los 3 años fue significativamente mayor en el grupo tratado con SRL y dosis bajas de Tac frente al grupo tratado con Tac monoterapia (86 vs 56%). La presencia de invasión microvascular fue similar en ambos grupos y la exposición a Tac fue significativamente más alta en el segundo grupo.
Un análisis de los resultados del trasplante por CHC del registro americano de trasplante (SRTR)67 sobre 2.491 trasplantados por tumor, reveló en el análisis multivariante que el tratamiento de mantenimiento con sirolimus se asociaba con una mejor supervivencia global (RR=0,53 (IC 95%; 0,31-0,92)) de manera que el grupo de SRL obtuvo una ventaja en la supervivencia a los 5 años del 14,4% (83 vs 69%) respecto al grupo sin SRL. Sin embargo, no se analizó individualmente la supervivencia libre de recidiva. Los autores argumentan que al estudiar las causas de muerte, menos de la mitad de los tratados con SRL fallecieron por etiología tumoral (5 vs 11%) sin alcanzar significación estadística (p=0,15). Desafortunadamente, en el estudio no se especificaba el porcentaje de tumores que cumplían criterios de Milán, ni se aportaban datos del grado de diferenciación tumoral ni de la invasión vascular, factores predictivos claves de recidiva. Al analizar los resultados de los 12.167 trasplantados sin CHC del mismo registro, el tratamiento con SRL no influyó en la supervivencia, lo cual sugiere un efecto beneficioso específico para trasplantados por CHC, hecho importante a la hora de planificar una inmunosupresión individualizada.
Un metaanálisis reciente68 estudió los efectos del SRL sobre la recurrencia del CHC y la supervivencia, incluyendo 5 de los estudios reseñados en la tabla 3, con 2.950 pacientes. Respecto a las pautas sin SRL, los regímenes inmunosupresores basados en SRL mejoraron la supervivencia global al año (OR = 4,53, IC 95% = 2,31-8,89, p<0,001), a los 3 años (OR =1,97, IC 95% =1,29-3, p=0,002) y a los 5 años (OR=2,47, IC 95% =1,72-3,55, p<0,001) post-TH. Además, mostraron una reducción significativa de la tasa de recurrencia tumoral (OR=0,42, IC 95% = 0,21-0,83, p=0,01), sin diferencias significativas en cuanto a complicaciones mayores (incluyendo trombosis de la arteria hepática y rechazo agudo) post-TH. Los autores especifican que debido a la heterogeneidad de los estudios no puede concluirse que la mejoría en la supervivencia de los pacientes con SRL esté motivada por los efectos antitumorales del imTOR.
Respecto a la toxicidad, aunque los imTOR son seguros y en general bien tolerados, presentan una serie de efectos secundarios que se deben considerar69, como úlceras orales, dislipidemia, mielotoxicidad, edemas periféricos, proteinuria, retraso en la cicatrización de heridas con mayor incidencia de hernia incisional, así como aumento de incidencia de rechazo agudo en algunas series.
Aunque los resultados son alentadores, el hecho de provenir de series no controladas y en su mayoría unicéntricas no permite concluir que los imTOR tienen un impacto clínico efectivo antitumoral en el CHC. No obstante, los estudios in vitro, en animales y las experiencias clínicas referidas proporcionan una base suficiente para desarrollar estudios prospectivos aleatorizados de sustitución de ICN por imTOR en el CHC. En este sentido se esperan los resultados de un ensayo internacional multicéntrico, prospectivo y aleatorizado (estudio SILVER), actualmente en marcha70.
En cuanto al papel de la inmunosupresión una vez aparecida la recidiva tumoral post-TH, tampoco existen datos provenientes de ensayos clínicos. La actitud general suele ser la de minimizar el uso de ICN y/o cambiar a un imTOR. Un reciente estudio multicéntrico español71 evaluó la eficacia y seguridad del uso de la combinación de un imTOR más sorafenib en 30 pacientes con CHC recurrente post-TH (el ICN fue sustituido por un imTOR: en 22 pacientes everolimus, y en 8 sirolimus). Esta combinación se mantuvo hasta que se produjo progresión tumoral sintomática, descompensación hepática, muerte o toxicidad inaceptable. Solo en 5 pacientes (16%) la enfermedad estaba confinada al hígado. En un paciente hubo respuesta parcial y en 13 (43%) la enfermedad se estabilizó. La supervivencia global media fue de 19,3 meses (IC 95%: 14,4-25,1 meses) y la mediana de tiempo hacia progresión fue de 6,77 meses (IC 95%: 2,3-11,1 meses). Se registraron 4 casos (13%) de toxicidad severa. El diseño retrospectivo y la falta de grupo control dificultan la interpretación de los resultados.
En definitiva, en la actualidad no puede recomendarse categóricamente la instauración de pautas de inducción basadas en imTOR a todo paciente trasplantado por CHC, especialmente dentro de los criterios de Milán, cuyas tasas de recurrencia son bajas y el impacto de los imTOR no parece determinante. Por el contrario, sí parece indicado cambiar a un régimen con imTOR cuando la indicación haya sido con criterios expandidos (fuera de criterios de Milán), si hay criterios de mal pronóstico en el explante (tumor multinodular, invasión vascular, tumor pobremente diferenciado) o si hay recidiva tumoral. En estos pacientes, la presencia del VHC no contraindicaría la utilización de imTOR ya que no existen datos definitivos que indiquen una peor o mejor evolución de la hepatitis C en sujetos tratados con estos inmunosupresores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.