Análisis de la evolución del cáncer colorrectal en España en el período 1951–2007, y su relación con el consumo de alcohol y cigarrillos.
Material y métodosAnálisis de correlación entre las tasas de incidencia, mortalidad y años potenciales de vida perdidos y la edad media del fallecimiento y el consumo per cápita de alcohol y cigarrillos con un período de retardo de 15 años.
ResultadosLa incidencia de cáncer colorrectal ha experimentado un aumento constante en ambos sexos en contraposición con lo ocurrido en otros países. La mortalidad aumentó durante el período 1951–2000, para después estabilizarse en varones y decrecer en mujeres. Los años potenciales de vida perdidos presentan un comportamiento similar a la mortalidad, mientras que la edad media del fallecimiento experimenta un continuo aumento en el período de estudio en ambos sexos.
En cuanto al consumo de alcohol, los coeficientes en ambos sexos varían desde 0,41 a 0,67 y destacan los valores obtenidos en relación con la incidencia en Zaragoza. Para el consumo de cigarrillos, los coeficientes de correlación presentan valores positivos próximos a uno respecto a la incidencia en Navarra y Zaragoza y algo menores para la mortalidad y los años potenciales de vida perdidos en ambos sexos.
ConclusionesSe deben aplicar medidas legislativas y educativas en materia de promoción de la salud respecto al consumo de alcohol y cigarrillos por parte de las autoridades de forma urgente para disminuir las tasas de incidencia, mortalidad y años potenciales de vida perdidos por cáncer colorrectal.
To analyze trends in colorectal cancer in Spain from 1951–2007, and their relationship with alcohol and cigarette consumption.
Material and methodsWe performed a correlation analysis between incidence, mortality and potential years of life lost rates, the mean age at death, and per capita consumption of alcohol and cigarettes with a time span of 15 years.
ResultsIn contrast with the tendency in other countries, the incidence of colorectal cancer steadily increased in both genders. Mortality increased from 1951–2000 and then stabilized in men and decreased in women. Years of potential life lost showed a similar pattern to mortality, while the mean age at death continuously increased during the study period in both genders.
For alcohol consumption, the coefficients in both genders ranged from 0.41 to 0.67, with the highest incidence values being obtained for Zaragoza. For cigarette consumption, the correlation coefficients showed positive values close to 1 in the incidence in Zaragoza and Navarre, and somewhat lower values for mortality and potential years of life lost in both genders.
ConclusionsLegislative measures on alcohol and cigarette consumption should be urgently applied by authorities in the field of education and health promotion to decrease the incidence, mortality and potential years of life lost rates for colorectal cancer.
Junto con la incidencia, las tasas de mortalidad son uno de los indicadores de salud más importantes y utilizados, por requerir un método sencillo para su cálculo a partir de datos fácilmente accesibles. Por otro lado, si se pretende profundizar en el impacto del cáncer colorrectal en una comunidad es conveniente calcular otros indicadores, por ejemplo, las tasas de años potenciales de vida perdidos (APVP), que permiten no sólo contabilizar muertes, sino también la prematuridad de éstas, y proporcionar mayor importancia a aquellas muertes ocurridas a edades más jóvenes.
En la actualidad, la incidencia de cáncer colorrectal ocupa el segundo lugar en mujeres después del cáncer de mama (se excluye el cáncer de piel), mientras que en varones ocupa el segundo lugar, después del cáncer de pulmón, o el tercero, tras el cáncer de pulmón y de próstata, según los registros de cáncer consultados1.
En cuanto a la mortalidad, el cáncer colorrectal constituye la segunda causa de muerte por cáncer en España tras el cáncer de pulmón. En 2007, murieron 13.516 españoles por cáncer colorrectal (7.870 varones y 5.646 mujeres), lo que representa el 13,1% del total de muertes por cáncer durante ese año2.
En 2007, y centrados en tumores, los APVP por cáncer colorrectal ocuparon el segundo lugar en varones después del cáncer de pulmón y el tercer lugar en mujeres después del cáncer de mama y de pulmón2.
En contraposición a lo ocurrido en España, durante la segunda mitad del siglo xx muchos países industrializados, como Reino Unido, EE. UU., Australia, Francia, Canadá y Suecia, han disminuido sus tasas de incidencia y mortalidad3, de manera que, en algunos casos, países con tasas más altas que España en el pasado presentan en la actualidad valores más bajos4.
Existe una importante variación de la incidencia de cáncer colorrectal en el mundo, del orden de 25 veces. Estos grandes contrastes geográficos a nivel mundial son consecuencia probablemente de las enormes diferencias en las exposiciones a los distintos factores conductuales5. Algunos de estos factores dependientes de la conducta son de riesgo, como el tabaquismo6, el consumo excesivo de alcohol7 y de carnes rojas y procesadas8–13, el bajo consumo de hortalizas y ácido fólico14–18, el estilo de vida sedentario, el sobrepeso y la obesidad4,19–21 y la diabetes22. Otros factores dependientes del comportamiento tienen efecto protector, como la ingesta de pescado12, el tratamiento hormonal sustitutivo23, el uso de anticonceptivos orales24, el consumo de calcio25 y el ejercicio físico26–28. En cuanto al consumo de fibra dietética, los resultados de diversos estudios epidemiológicos fueron inconsistentes29–33. Respecto a la grasa animal, un metaanálisis de 13 estudios de casos y controles concluye que no se relaciona con el riesgo de cáncer de colon después del ajuste de la energía total34 y la mayoría de los estudios de cohortes no apoyan una asociación causal entre este factor y el cáncer colorrectal35.
Mientras que el efecto de los factores dietéticos fue ampliamente estudiado en numerosos estudios epidemiológicos, el papel de otros factores, como el consumo excesivo de alcohol y el tabaquismo, en relación con el cáncer colorrectal fue objeto de un menor tratamiento por parte de la comunidad científica.
En este estudio se pretende analizar la evolución de la incidencia, la mortalidad, los APVP y la edad media del fallecimiento por cáncer colorrectal en España durante el período 1951–2007 y su relación con el consumo de alcohol y cigarrillos.
Material y métodosPara obtener estadísticas comparables de incidencia y mortalidad, de acuerdo al control del sesgo que produce la edad, es conveniente que las tasas de incidencia y mortalidad sean tasas ajustadas, por lo que se utilizó como ejemplo la población mundial estándar.
Las tasas de incidencia ajustadas a la población mundial por cáncer colorrectal para varones y mujeres se obtuvieron de las publicaciones de los registros de cáncer españoles supervisados por la International Agency for Research on Cancer. Estas tasas se publican para períodos de 3-5 años. En este estudio, para poder llevar a cabo comparaciones con el resto de las tasas de mortalidad y APVP anuales calculadas, así como correlaciones con los consumos anuales per cápita de alcohol y cigarrillos, se asigna el valor publicado de la tasa de incidencia al año intermedio para cada período y para el resto de los años se calcula mediante el método de intrapolación lineal. Se incluyeron únicamente los datos de los registros de Navarra y Zaragoza, provincias contiguas del norte de España con poblaciones de 600.646 y 923.911 habitantes, respectivamente, y no del resto de registros de cáncer españoles debido a la disponibilidad de los datos publicados, desde 1973 en Navarra y desde 1968 en Zaragoza1,36–40.
Los datos anuales del número de muertes en España por cáncer colorrectal (códigos 153 y 154 en la octava y novena revisiones de la Clasificación Internacional de Enfermedades, y códigos C18–C21 en la décima revisión) se obtuvieron de las estadísticas oficiales de mortalidad publicadas por el Instituto Nacional de Estadística (INE) a través de las “Defunciones según la Causa de Muerte” para los años 1951–2007, último año con datos disponibles en el momento de la realización de este estudio2. Los datos se agrupan según el sexo y los grupos de edad quinquenales que comienzan en el grupo de “0 a 4 años”, con excepción del último grupo considerado, grupo de edad abierto de “80 o más años”. Paralelamente, las poblaciones de referencia se obtuvieron a mediado de cada año oficial a partir de las “Estimaciones de Población” publicadas por el INE, según el sexo y los grupos de edad similares41.
A partir de los datos del número de fallecidos y de la población de referencia, según el sexo y los grupos de edad, se calcularon las tasas anuales específicas.
Las tasas de mortalidad anuales ajustadas a la población mundial por cáncer colorrectal para varones y mujeres se obtuvieron por el método directo, y se utilizó como referencia la población mundial estándar para el período 1951–20071 teniendo en cuenta los mismos grupos de edad.
Entre los distintos autores consultados no existe consenso a la hora de establecer los límites para considerar una muerte como prematura42–46. En este estudio se ha utilizado el método de límites fijos (1-70 años)42 justificado en la facilidad del cálculo y en la ausencia de importantes diferencias en relación con métodos de cálculo más complejos47. Toda persona que fallece entre los 1-70 años durante el período de estudio se considera que ha dejado de vivir una serie de años, los que van desde la edad del fallecimiento hasta los 70 años. Para cada grupo de edad se seleccionó el punto medio del intervalo como edad del fallecimiento, excepto para el grupo de “1 a 4 años” que se consideró como media 3 años. Para los siguientes grupos de edad se seleccionaron 7 años, 12 años y sucesivos hasta los 67 años. Una vez obtenidos los APVP específicos por sexo y grupos de edad y junto con los datos de población se calcularon las tasas de APVP anuales específicas, y a partir de éstas, se siguió la misma metodología que para la mortalidad, se obtuvieron las tasas de APVP anuales ajustadas a la población mundial anuales por cáncer colorrectal para varones y mujeres42.
Se calculó la edad media del fallecimiento y su desviación estándar según el sexo por el método aritmético y se consideró que en cada grupo de edad las personas fallecidas tenían la edad correspondiente a su marca de clase, con excepción del último grupo de edad, “80 o más años” para el que se fijó la edad de fallecimiento de cada persona en 82 años.
Los datos de mortalidad agrupados según el sexo y los grupos de edad quinquenales permitieron calcular la proporción de muertes ocurridas a los “70 o más años” del total de defunciones.
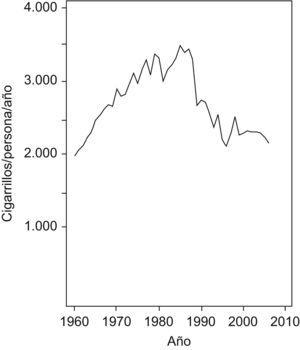
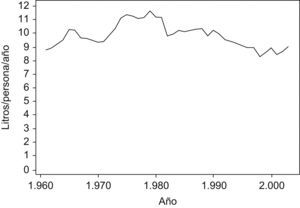
El consumo de alcohol anual se calculó en el período 1961–2003 a partir de los datos publicados por Food and Agriculture Organization of United Nations48. El consumo anual de cigarrillos, considerado tabaco rubio y negro, se obtuvo a partir de las cifras oficiales de ventas de cigarrillos publicados para el período 1960–198849 y por el Ministerio de Economía para el período 1989–200650 y de los datos de contrabando de este producto. Aunque no existen estadísticas oficiales en España de esta última actividad, las estimaciones procedentes de diversas fuentes indican que el tabaco de contrabando representó un 25% del total de cigarrillos consumidos durante el período 1960–199051, un 30% como nivel máximo en un estudio de 199352, y descendió a partir de ese momento hasta alcanzar el 15% en 199553 y el 5% en 199954; esto engrosa de forma importante el consumo per cápita de cigarrillos respecto a considerar exclusivamente el consumo de cigarrillos de curso legal.
Se representan gráficamente en escala lineal las tasas de incidencia, mortalidad y APVP anuales ajustadas a la población mundial por cáncer colorrectal para varones y mujeres y el consumo anual per cápita de alcohol y cigarrillos en los años disponibles para cada variable de estudio.
Se calcularon los coeficientes de correlación de Pearson para las tasas calculadas y las variables consumo de alcohol y cigarrillos con un intervalo de retardo de 15 años, es decir, las distintas tasas por cáncer colorrectal para cada año se correlacionaron con los datos de consumo 15 años atrás. La evolución de pólipo a cáncer es un proceso en múltiples etapas que evoluciona a través de hiperplasia celular, formación de adenomas, crecimiento y displasia, hasta la transformación maligna y el cáncer invasivo. Desde el punto de vista clínico, la probabilidad de que un pólipo adenomatoso degenere en cáncer depende del aspecto macroscópico de la lesión, sus características histológicas y su tamaño. Los pólipos adenomatosos tardan más de 5 años en crecer lo suficiente como para manifestar expresión clínica. El estudio de la historia natural de los pólipos mayores de 1 cm no tratados muestra que el riesgo de progresión es del 8% a los 10 años y del 24% a los 20 años55,56. Por todo esto, en este estudio se ha seleccionado 15 años como intervalo de retardo fijo para la correlación entre las variables de consumo de alcohol y cigarrillos e incidencia, mortalidad y APVP por considerar que es tiempo proporcionado a las condiciones temporales de transformación maligna de la mucosa colorrectal desde la exposición a los agentes de consumo indicados hasta pólipos y su posterior evolución a cáncer. La modificación del período de retardo conllevaría la obtención de coeficientes de correlación distintos.
El coeficiente de correlación de Pearson mide el grado de covariación entre distintas variables relacionadas linealmente. La magnitud de la relación entre 2 variables viene especificada por el valor que toma el coeficiente de correlación cuyo valor absoluto varía entre 0 y 1; a mayor valor absoluto mayor correlación entre variables.
El análisis estadístico se realizó con el programa STATA 10.057.
La observación de una relación entre 2 variables a nivel poblacional no implica necesariamente que la misma relación se mantenga a nivel individual. Esto se conoce como falacia ecológica. Aunque son varios los sesgos que componen la falacia ecológica, en este estudio se han podido cometer los de agregación y de especificación58,59. El primero de éstos hace referencia a que en un estudio ecológico, los niveles de exposición representan los niveles medios para la población en estudio. Debido a que el interés real reside en el riesgo individual determinado por la exposición individual, los estudios ecológicos sólo estarían justificados en aquellas situaciones ideales en las que cada individuo dentro de un grupo presenta el mismo nivel de exposición, como ocurre en exposiciones ambientales, tales como la contaminación del aire, la radiación natural y la calidad del agua. No obstante, en otras ocasiones dentro del grupo la exposición es heterogénea debido a que algunos individuos no están expuestos y es probable que los expuestos lo estén a diferentes niveles. En estas situaciones la relación exposición-respuesta observada a nivel del grupo no refleja necesariamente la relación exposición-respuesta a nivel individual. Por otro lado, el sesgo de especificación es el equivalente al sesgo de confusión de los estudios de observación, pero a nivel ecológico. En este tipo de sesgo, un factor extraño, que está correlacionado simultáneamente con la enfermedad y con el factor de exposición estudiado, se distribuye desigualmente en los distintos grupos y produce una distorsión y falseamiento en las estimaciones de la magnitud del efecto, lo sobrevalora, lo subestima o incluso lo anula. En este estudio, factores como dieta, ejercicio físico y sobrepeso pueden comportarse como factores de distorsión, pero no se han podido aplicar técnicas epidemiológicas para ajustar el modelo a estas variables confusoras debido a la ausencia de datos de incidencia, mortalidad, APVP, consumo de alcohol y tabaco según distintos grupos establecidos en función de diferencias a nivel de dieta, ejercicio físico y sobrepeso en España en cado uno de los años que componen el período de estudio que permitieran llevarlas a cabo. Por esto, el trabajo comprende únicamente el análisis de las correlaciones de las tasas de mortalidad y APVP, según el sexo, a nivel del conjunto de la población española, con independencia de edad o área geográfica, y de las tasas de incidencia, según el sexo, circunscritas a los registros de cáncer de Navarra y Zaragoza, por las razones esgrimidas anteriormente, con los consumos de alcohol y tabaco per cápita para España con independencia de sexo, edad y área geográfica.
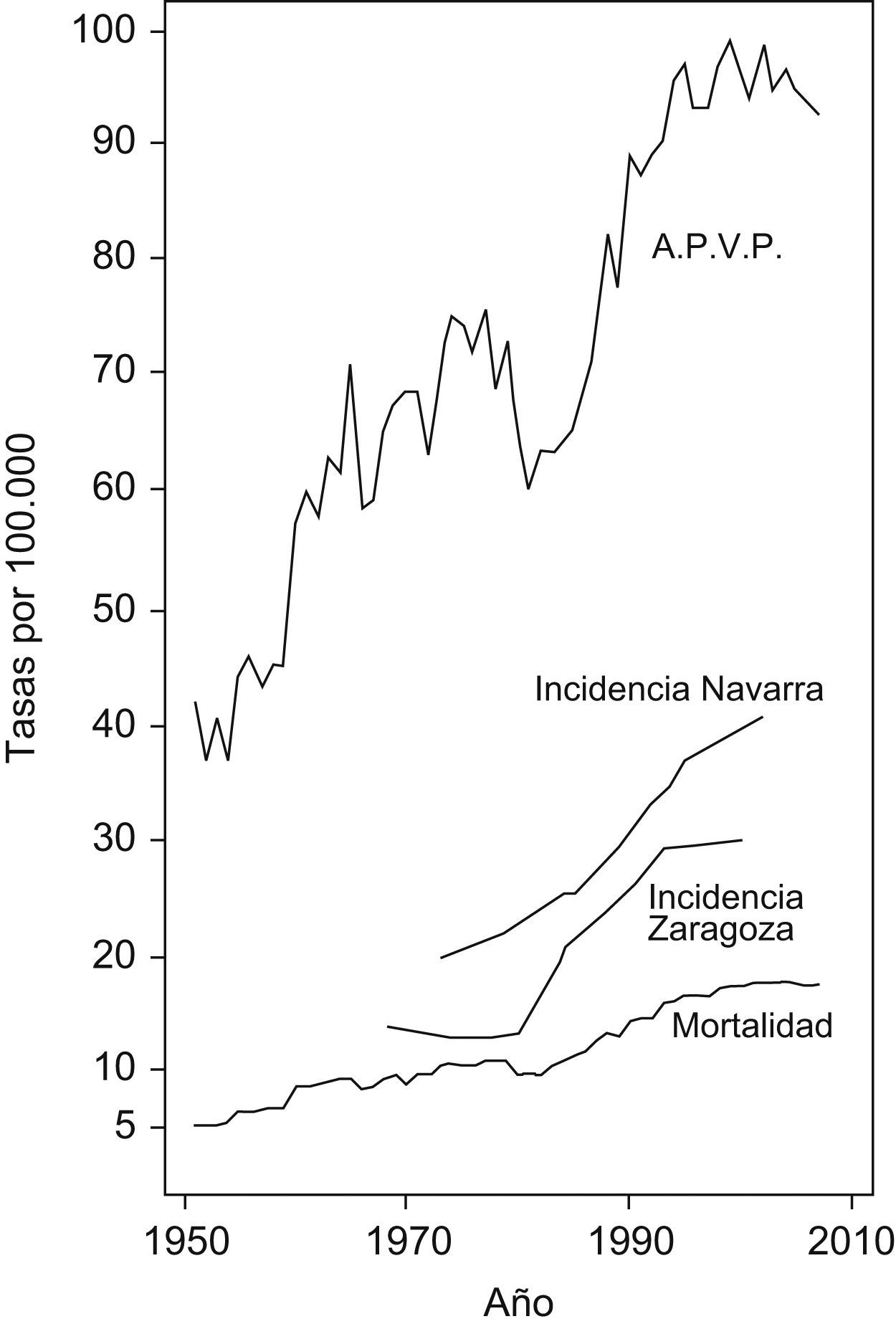
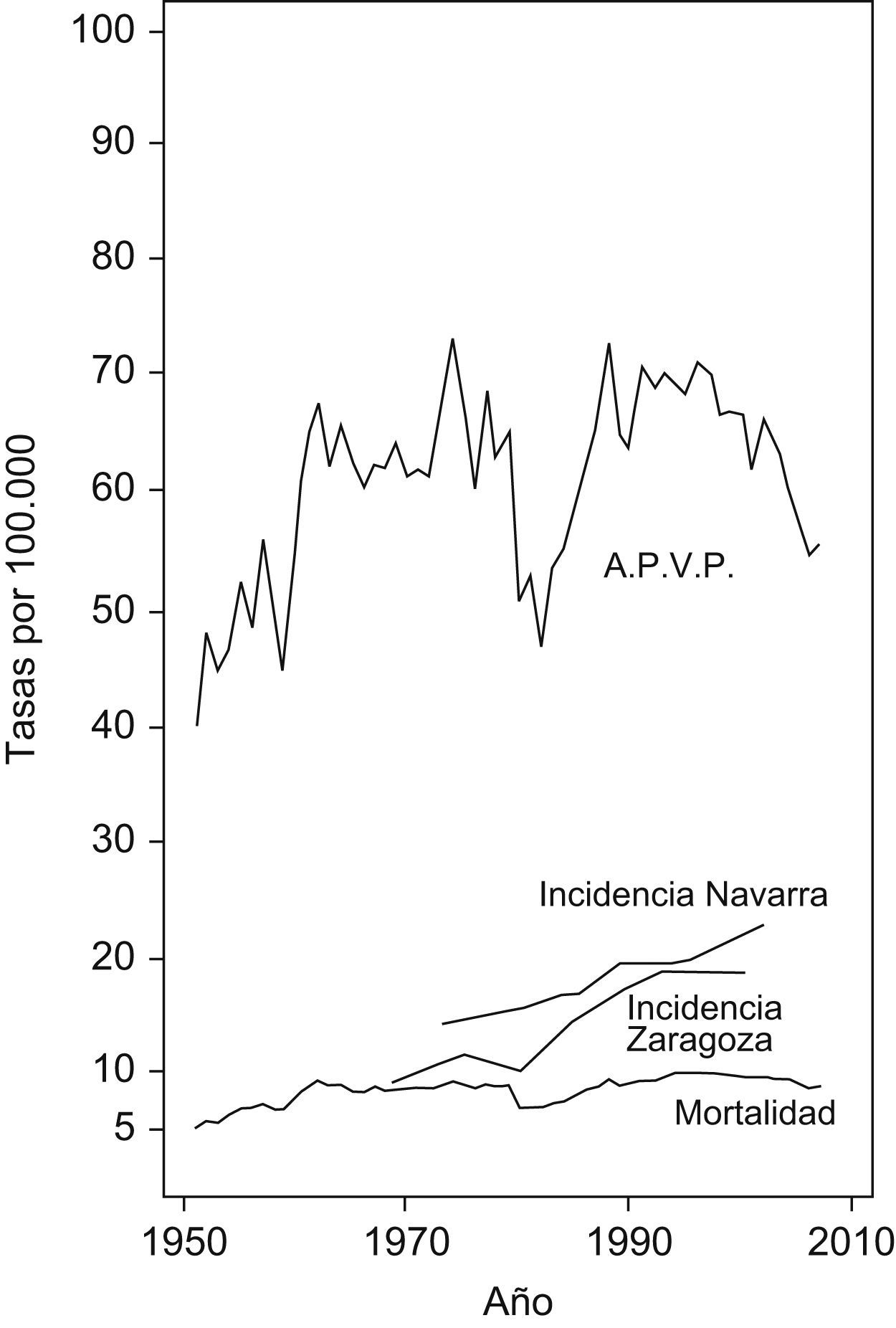
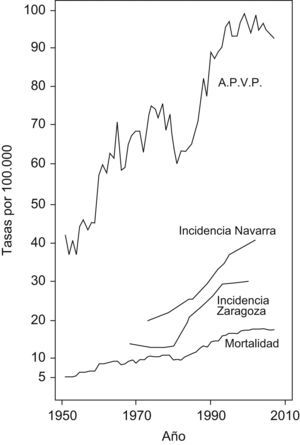
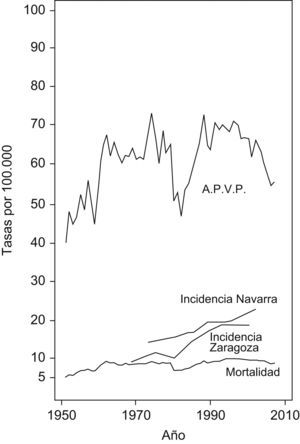
ResultadosEn las figuras 1 y 2 se muestran las tasas de incidencia, mortalidad y APVP anuales ajustadas a la población mundial por cáncer colorrectal por 100.000 habitantes en varones y mujeres, respectivamente.
Las tasas de incidencia aumentan en los registros de cáncer de Navarra y Zaragoza desde 1980 en ambos sexos aunque con pendiente más positiva en varones. Este aumento en la incidencia coincide en el resto de registros de cáncer españoles1,36–40.
Las tasas de mortalidad y APVP muestran representaciones gráficas con comportamientos similares en ambos sexos. Destaca el importante aumento experimentado desde 1951 hasta comienzos del nuevo milenio, tendencia creciente sólo interrumpida en el año 1980 donde se observa un marcado descenso en ambas tasas en varones y mujeres. Durante el período 1951–2000 se produce un incremento anual promedio en las tasas de mortalidad (del 4,70% en varones y del 1,75% en mujeres) y APVP (del 2,63% en varones y del 1,40% en mujeres). Sin embargo, desde este momento hasta 2007, las tasas se mantienen estables en varones, con una media de variación anual para la mortalidad del 0,12%, y para APVP del −0,50% y disminuyen en mujeres, con una media de disminución anual de mortalidad del 1,22 y del 2,50% para APVP.
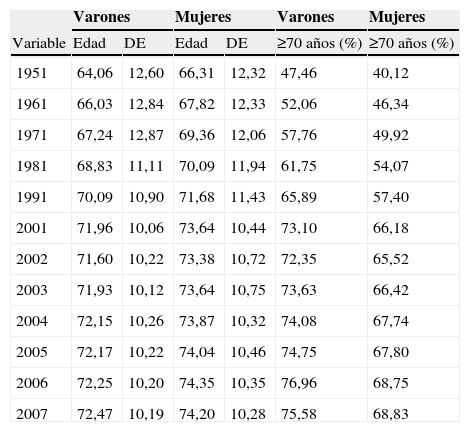
En la tabla 1 se exponen la edad media del fallecimiento, la desviación estándar y la proporción de muertes por cáncer colorrectal ocurridas a partir de los 70 años, cada 10 años, en el intervalo 1951–2001 y anualmente en el período 2001–2007. En ambos sexos y durante todo el período de estudio, ambas variables experimentan un continuo aumento.
Edad media del fallecimiento (años) y proporción del total de muertes ocurridas a partir de los 70 años por cáncer colorrectal. España, 1951–2007
| Varones | Mujeres | Varones | Mujeres | |||
| Variable | Edad | DE | Edad | DE | ≥70 años (%) | ≥70 años (%) |
| 1951 | 64,06 | 12,60 | 66,31 | 12,32 | 47,46 | 40,12 |
| 1961 | 66,03 | 12,84 | 67,82 | 12,33 | 52,06 | 46,34 |
| 1971 | 67,24 | 12,87 | 69,36 | 12,06 | 57,76 | 49,92 |
| 1981 | 68,83 | 11,11 | 70,09 | 11,94 | 61,75 | 54,07 |
| 1991 | 70,09 | 10,90 | 71,68 | 11,43 | 65,89 | 57,40 |
| 2001 | 71,96 | 10,06 | 73,64 | 10,44 | 73,10 | 66,18 |
| 2002 | 71,60 | 10,22 | 73,38 | 10,72 | 72,35 | 65,52 |
| 2003 | 71,93 | 10,12 | 73,64 | 10,75 | 73,63 | 66,42 |
| 2004 | 72,15 | 10,26 | 73,87 | 10,32 | 74,08 | 67,74 |
| 2005 | 72,17 | 10,22 | 74,04 | 10,46 | 74,75 | 67,80 |
| 2006 | 72,25 | 10,20 | 74,35 | 10,35 | 76,96 | 68,75 |
| 2007 | 72,47 | 10,19 | 74,20 | 10,28 | 75,58 | 68,83 |
DE: desviación estándar.
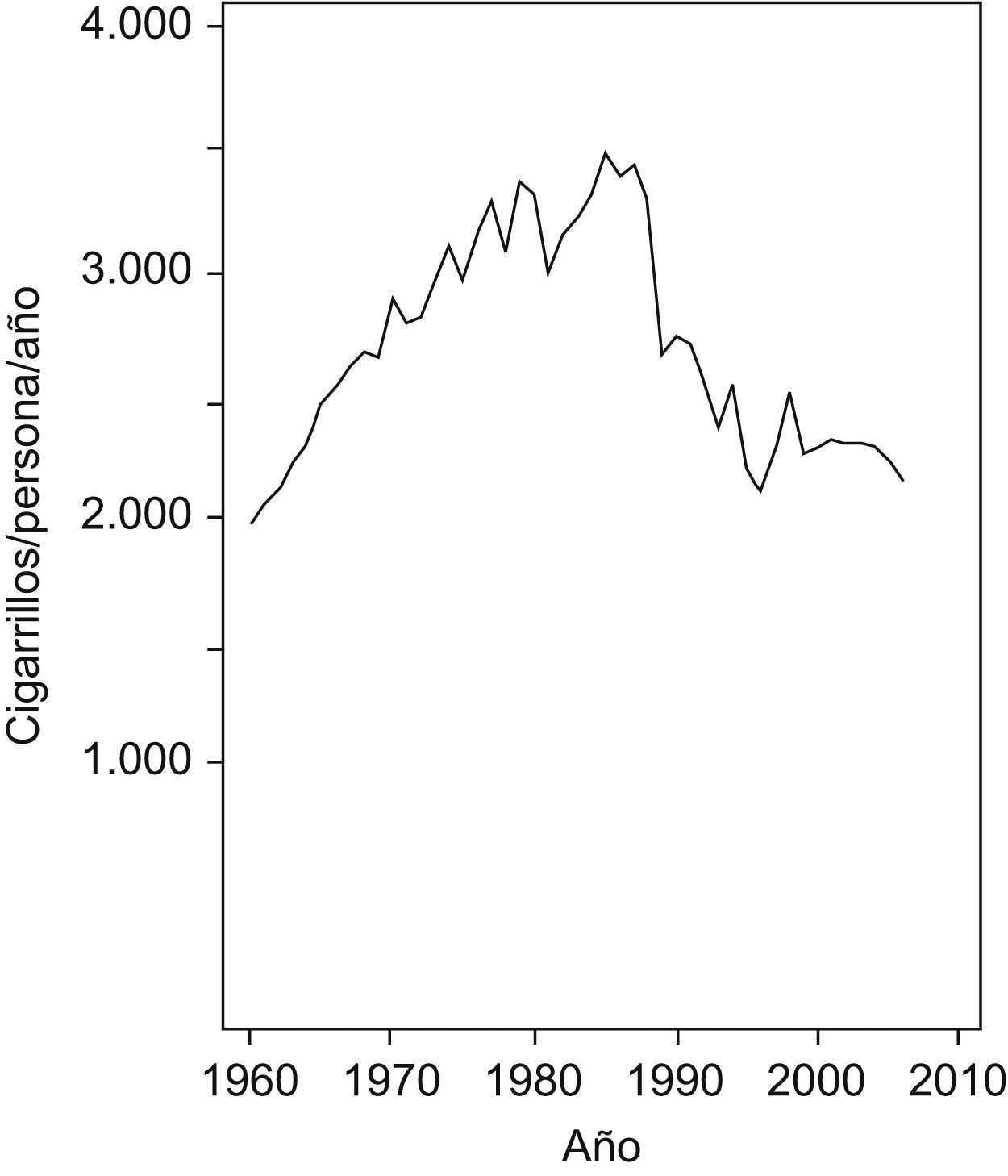
En la figura 3 se muestra la tendencia en el consumo de cigarrillos en el período 1960–2006, con un firme aumento hasta finales de la década de 1980 seguido de un importante descenso en los años inmediatamente posteriores y finalizado con una estabilización del consumo a partir de finales de la década de 1990.
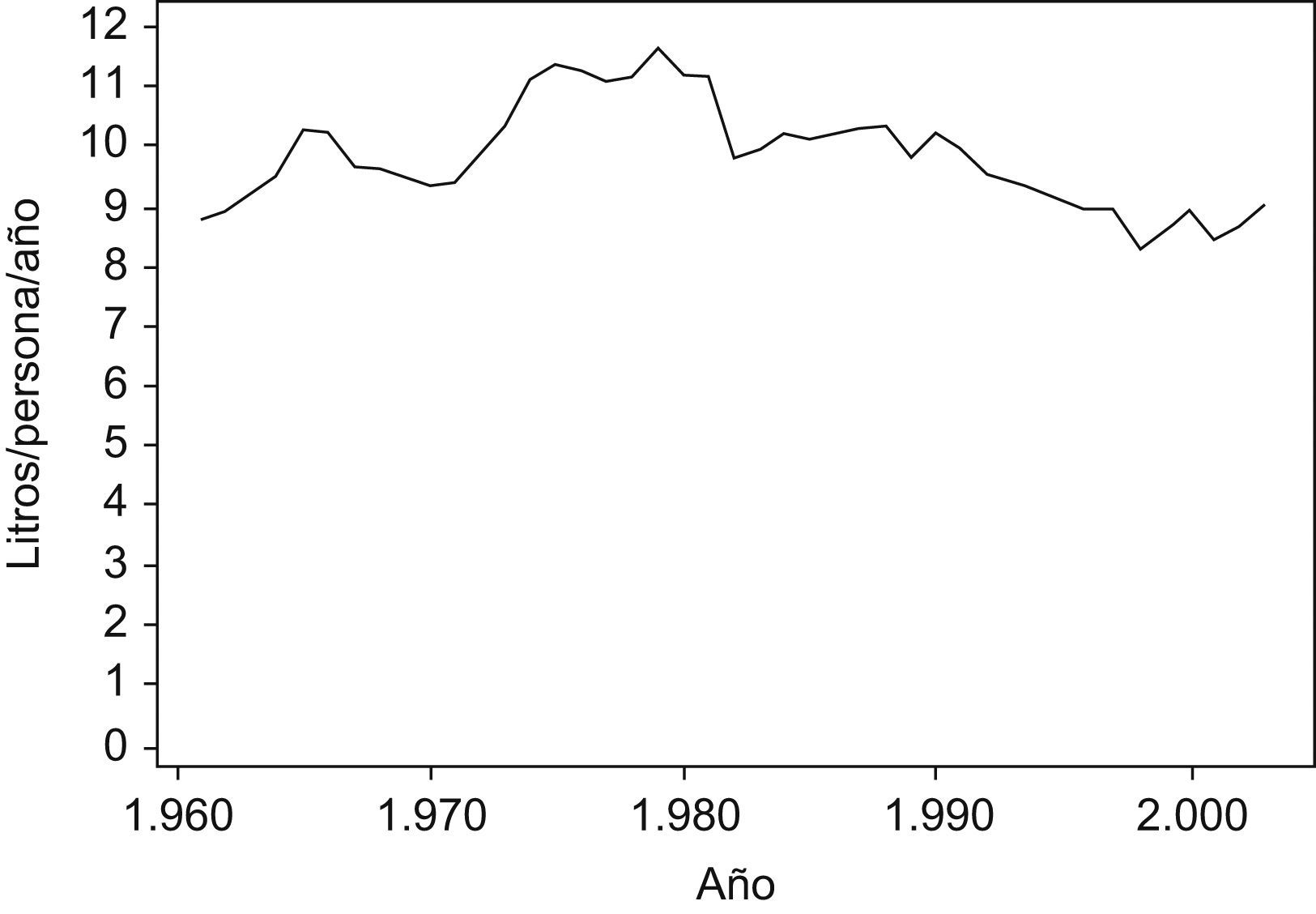
En la figura 4 se puede observar cómo evoluciona el consumo de alcohol. Destacan 3 intervalos distintos durante el período 1961–2003. Un primer intervalo, hasta comienzos de la década de 1980, de aumento constante del consumo, seguido de un intervalo de descenso, hasta finales de la década de 1990, para finalizar con un incremento del consumo en los últimos años.
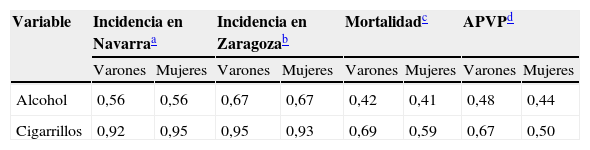
La tabla 2 muestra los coeficientes de correlación de Pearson establecidos entre las variables de estudio. En cuanto al consumo de cigarrillos los coeficientes de correlación presentan valores positivos próximos a uno respecto a la incidencia en Navarra y Zaragoza y algo menores para la mortalidad y los APVP en ambos sexos. Para el consumo de alcohol los coeficientes en ambos sexos varían desde 0,41 a 0,67 y destacan los valores obtenidos en relación con la incidencia en Zaragoza.
Coeficientes de correlación de Pearson de consumo de alcohol y cigarrillos con tasas anuales ajustadas a la población mundial por 100.000 habitantes de incidencia (Navarra y Zaragoza), mortalidad y años potenciales de vida perdidos (España), en varones y mujeres, por cáncer colorrectal con un retardo de 15 años
| Variable | Incidencia en Navarraa | Incidencia en Zaragozab | Mortalidadc | APVPd | ||||
| Varones | Mujeres | Varones | Mujeres | Varones | Mujeres | Varones | Mujeres | |
| Alcohol | 0,56 | 0,56 | 0,67 | 0,67 | 0,42 | 0,41 | 0,48 | 0,44 |
| Cigarrillos | 0,92 | 0,95 | 0,95 | 0,93 | 0,69 | 0,59 | 0,67 | 0,50 |
APVP: años potenciales de vida perdidos.
Los consumos de alcohol y cigarrillos en el período 1961–1987 se correlacionan con la incidencia del período de 1976–2002. Observaciones = 26.
Los consumos de alcohol y cigarrillos en el período de 1961–1985 se correlacionan con la incidencia del período de 1976–2000. Observaciones = 25.
A través de los indicadores analizados en este estudio se pretende incidir en la importancia del cáncer colorrectal como causa de muerte en función de su frecuencia y de la edad a la que se produce el fallecimiento.
El aumento en las tasas de incidencia indica que cada año el número de personas diagnosticadas en España de cáncer colorrectal es mayor en ambos sexos. Del mismo modo, el aumento en las tasas de mortalidad en ambos sexos en el período 1951–2000 refleja un mayor número de fallecidos por esta causa. Tras este período, la mortalidad se estabiliza en varones y desciende ligeramente en mujeres.
El incremento en la edad media del fallecimiento, así como de la proporción de personas fallecidas de “70 o más años” del total de fallecidos durante todo el período de estudio, en ambos sexos, haría esperar un descenso de las tasas de APVP que no se corresponde con la realidad. Se observa un aumento importante en las tasas de APVP en el período 1951–2000, seguido de un descenso en las mujeres y una tendencia constante en varones en los últimos años.
Teniendo en cuenta que es necesario un período de inducción de 10-15 años para que cambios en la exposición a factores de riesgo y protección puedan modificar la incidencia y, en consecuencia, la mortalidad del tumor, y que en el caso del tabaco el período de inducción puede ser aún más prolongado, la evolución del consumo de alcohol y cigarrillos contribuye a explicar las tendencias de ambas tasas.
Las diferencias entre las tasas de incidencia y de mortalidad podrían atribuirse al aumento de la supervivencia para el cáncer colorrectal reseñado en los registros de cáncer durante el período 1985–199960–62. Este aumento fue común en muchos países europeos debido, al menos en parte, a una mayor difusión de los protocolos específicos de cáncer in situ, a la quimioterapia adyuvante, a la radioterapia preoperatoria y al uso generalizado de la escisión mesorrectal para disminuir las recidivas locales en el cáncer rectal63–66. Los programas de cribado del cáncer colorrectal fueron poco frecuentes en España durante este período y, por tanto, es poco probable que hayan tenido un efecto importante sobre la supervivencia.
Las muertes por cáncer colorrectal durante el período de estudio principalmente se producen en personas mayores de 70 años y causan un aumento en la edad media del fallecimiento y en la proporción de personas fallecidas de “70 o más años”. Sin embargo, el aumento del número de muertes por cáncer colorrectal en España fue tan importante que incluso, y aunque en menor medida, se ha visto incrementado en personas menores de 70 años, lo que explica la tendencia en las tasas de APVP.
El marcado descenso de las tasas de mortalidad y APVP en 1980 coincide con el año de implantación en España de la octava revisión de la Clasificación Internacional de Enfermedades. Los cambios de codificación pueden modificar sustancialmente las tendencias de mortalidad por causas específicas en su año de aplicación67.
Se observa un importante contraste según el sexo en las distintas tasas calculadas, normalmente con valores superiores para los varones en comparación con las mujeres. En el caso de la incidencia, la explicación se puede encontrar en el efecto de una mayor exposición en varones a factores de riesgo relacionados con el estilo de vida como el tabaquismo y el consumo excesivo de alcohol, pero también a otros como la dieta, la vida sedentaria, el sobrepeso, la obesidad y la diabetes. En cuanto a la mortalidad y a los APVP, las diferencias son probablemente debidas a que el aumento de la supervivencia fue mayor en las mujeres, lo que explica, a su vez, la tendencia decreciente en las tasas de mortalidad y de APVP en este colectivo en los últimos años. Esta ventaja, en cuanto a la supervivencia en mujeres tanto para el cáncer colorrectal como respecto a otros tipos de cánceres en comparación con varones, se ha atribuido a diversos factores, como una menor edad en el momento del diagnóstico, mayor inquietud por el cuidado de su salud, factores hormonales y diferencias en la prevalencia de diferentes comorbilidades, en particular en aquellos casos en los que un determinado factor, por ejemplo el tabaquismo o el consumo abusivo de alcohol, se asocia con un mayor riesgo de incidencia o mortalidad por cáncer u otras enfermedades como las cardiovasculares, las respiratorias crónicas y las hepatopatías66.
Se estima que en varones de mediana edad la proporción de riesgo atribuible de cáncer de colon a 6 factores de riesgo, entre los que se incluye el hábito de fumar cigarrillos y el consumo excesivo de alcohol, es del 71%68. En un reciente estudio en el Reino Unido sobre el efecto de la modificación de 5 factores de riesgo conductuales, entre los que se incluía la reducción del consumo de tabaco y alcohol, los investigadores llegaron a la conclusión de que estas intervenciones explicaban la disminución de las tasas de cáncer colorrectal en la actualidad y en las proyecciones de futuro en este país3.
Si bien durante los últimos años en España se han implantado importantes medidas legislativas para luchar contra el tabaquismo, no cabe duda de que estas medidas han aparecido con un notable retraso. Por otra parte, varias sociedades científicas, entre éstas la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y la Sociedad Española de Epidemiología (SEE), han criticado duramente las limitaciones y la timidez de la legislación vigente, particularmente la que permite que los propietarios de establecimientos de hostelería sean los que decidan si en su local se puede fumar o no, o la carga impositiva que aumente su precio. Esto contrasta con las legislaciones mucho más restrictivas de otros países desarrollados de Europa, América y Oceanía.
En el caso del consumo de alcohol la situación es aún peor. Si bien se han conseguido avances en las restricciones de consumo por edades, aún no se ha promulgado una ley específica análoga a la del tabaco, en la que se recojan todas las medidas legislativas recomendadas por las sociedades científicas, en lo concerniente a las restricciones en horarios y licencias de venta, publicidad encubierta, carga impositiva y otras.
La evidencia científica ha demostrado que las medidas de prevención primaria, principalmente las medidas legislativas y educativas, son las más eficaces en la reducción de la incidencia de la enfermedad3,68. Además de esta eficacia, estas medidas son mucho más baratas que las medidas asistenciales, y evitan otros costes intangibles asociados al sufrimiento personal y familiar. Una vez dicho esto, la realidad es que en la población hay un número considerable de personas con pólipos adenomatosos y cáncer colorrectal en estadios iniciales, y por esto también es recomendable que se desarrollen e implanten programas nacionales de detección precoz. La evidencia científica indica que los programas de prevención secundaria (detección precoz) son eficaces cuando se aplican a toda la población en riesgo, en los llamados programas de ámbito nacional. Es el caso, en España, de los programas de detección precoz de cáncer de mama y de cáncer de cuello de útero. En España no hay un programa nacional de detección precoz de cáncer colorrectal, sino sólo iniciativas en algunos centros asistenciales. La eficacia de estos programas de detección precoz se ha evaluado y se ha revisado en diversos estudios69,70 y las autoridades sanitarias deberían considerar su implantación en España.
En definitiva, se deben salvaguardar las medidas legislativas y educativas en vigor en materia de consumo de alcohol y cigarrillos en España, e incluso poner en marcha medidas más enérgicas de forma urgente. El gobierno de España y las comunidades autónomas deberían destinar parte de su presupuesto a la aplicación de intervenciones que promuevan estilos de vida saludables en varones y mujeres de todas las edades junto con el desarrollo e implantación de programas nacionales de detección precoz del cáncer colorrectal, actividades complementarias, con el objetivo de reducir las tasas de incidencia, mortalidad y APVP en España.
Responsabilidades éticasNo fue necesario el uso de consentimiento informado en este estudio, ya que los datos analizados se obtuvieron de bases de datos públicas donde únicamente están disponibles datos grupales anónimos1,2,36-41,48-50.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEl Instituto de Salud Carlos III ha financiado este estudio parcialmente (subvención N.o 01/1033). Agencia de Evaluación de Nuevas Tecnologías.