El síndrome del intestino irritable (SII) es un trastorno funcional del intestino delgado y grueso que se caracteriza por dolor/malestar abdominal, meteorismo con distensión abdominal y alteración en las evacuaciones intestinales, con predominio de diarrea, estreñimiento o alternancia de estos signos, los cuales no pueden ser explicados por una anormalidad estructural o bioquímica1.
Se desconoce su etiopatogenia y su mecanismo fisiopatológico. Se han propuesto diferentes factores patogénicos responsables del mismo2; sin embargo, ninguno de ellos parece que explique de forma clara los verdaderos mecanismos que desencadenan el síndrome.
Diferentes estudios3,4 demuestran la activación del sistema inmune innato (linfocitos T [CD3+, CD4+ y CD8+] y mastocitos) y objetivan signos inflamatorios de bajo grado persistentes en la mucosa intestinal en pacientes con SII, en ausencia de signos macroscópicos de inflamación.
En distintas investigaciones3,5–7, se ha encontrado un desequilibrio en la regulación genética de la secreción de citocinas que favorecería la actividad inflamatoria, en virtud de una excesiva producción de citocinas proinflamatorias (IL-6 y TNF-α) y una baja secreción de citocinas antiinflamatorias (IL-10).
Nuestro grupo de investigación ha realizado sendas revisiones sistemáticas sobre el papel de los linfocitos y mastocitos8, así como de las citocinas9 en el SII, encontrando los mismos hallazgos.
En las enfermedades inflamatorias intestinales se espera encontrar una alteración en el nivel y perfil de las citocinas; sin embargo, en el SII, que, por definición, no tiene cambios estructurales, cualquier cambio en los niveles de citocinas sugieren inflamación o una posible respuesta inmune a nivel celular10.
Las mujeres con SII, comparadas con mujeres control, presentan altos niveles circulantes de TNF-α, lo que sugiere un papel prominente de las citocinas proinflamatorias en la fisiopatología de dicho síndrome. A su vez, los varones con SII exhiben niveles circulantes de IL-10 significativamente más bajos en comparación con varones control11. Lo que no está claro es si estas alteraciones en el perfil de las citocinas en pacientes con SII está genéticamente determinado o es adquirido.
Los referidos cambios en el perfil de las citocinas a nivel de los diferentes tejidos de la pared intestinal pueden promover cambios en la secreción, permeabilidad, motilidad y sensibilidad viscerales, que pueden ocasionar los síntomas del SII, particularmente el tipo con predominio de diarrea y dolor abdominal5.
Evidencias científicas actuales, cada vez más numerosas, sobre el SII ponen en relación aspectos psicológicos, inmunes y la microbiota intestinal. En este sentido, la Psiconeuroinmunología, que estudia la correlación entre el sistema nervioso central, el comportamiento y el sistema inmune12, podría explicar los mecanismos fisiopatológicos por los que coexisten frecuentemente síntomas intestinales y desórdenes psicológicos y psiquiátricos (depresión, somatización, ansiedad) en los pacientes con SII. Las posibles interacciones entre todos los factores implicados en este proceso (psicología, hipersensibilidad visceral, inmunología, sistema inmunológico intestinal, microbiota y probióticos) podrían entenderse y explicarse desde el ámbito de esta disciplina13.
En los pacientes con SII hay una alta prevalencia de comorbilidad psiquiátrica, particularmente ansiedad. Por otro lado, se ha demostrado que el estrés psicológico y la ansiedad pueden ocasionar un aumento significativo de la liberación de citocinas proinflamatorias, existiendo una asociación significativa entre el TNF-α y la ansiedad3.
En este orden de cosas, se ha encontrado que la depresión está asociada con un infiltrado inflamatorio, en particular de mastocitos, en la mucosa colónica de los pacientes con SII13. Todo esto parece indicar que los factores psicológicos pueden estar unidos causalmente al desarrollo de los síntomas del SII.
Por otro lado, la fuente más probable de los antígenos que desencadenarían la referida activación inmune serían las bacterias comensales (microbiota), las cuales podrían acceder e interactuar con el sistema inmune mucoso debido a un aumento de la permeabilidad intestinal, fenómeno que se ha descrito en pacientes con SII-D14. Así, se ha descrito una microbiota alterada en estos pacientes, con disminución de bifidobacterias y lactobacillus15.
En la 99 Conferencia de Dahlem sobre infección, inflamación y trastornos inflamatorios crónicos16, se habló de que es probable que el sistema nervioso central y las bacterias comensales del intestino se comuniquen entre sí. Se especuló que ello puede contribuir a la homeostasis que mantiene la estabilidad dentro de la microbiota intestinal y modular, potencialmente, algunas funciones cerebrales y la conducta. En esta misma conferencia, Bienenstock y Collins16, de la Universidad de McMaster, en Canadá, afirman que la microbiota intestinal puede modular también la función del sistema nervioso entérico (SNE) e influir en la percepción del dolor por mecanismos que implican al sistema inmune: las vías inmune y nerviosa están íntimamente implicadas en la percepción del dolor visceral, y la microbiota intestinal puede modular aquél.
Respecto a los trastornos psiquiátricos que se asocian al SII, es bien sabido que la alteración de la microbiota intestinal puede ocasionar un comportamiento de tipo ansioso17.
Por otro lado, los niveles de triptófano, substrato para la biosíntesis de la serotonina, están muy disminuidos en pacientes con síntomas graves del SII, en comparación con el de aquellos con síntomas menos graves y los controles. Los primeros tienen más del doble de probabilidades de sufrir depresión o ansiedad que los pacientes con síntomas de SII menos graves. Ello parece ser debido a un peor funcionamiento serotoninérgico en este síndrome18.
La serotonina es un neurotransmisor importante en el sistema nervioso central y entérico. En el intestino, regula la secreción, motilidad y sensibilidad; en el sistema nervioso central, modula el estado de ánimo, la cognición y el sueño. Los problemas neuropsiquiátricos han sido atribuidos a demasiada o a muy poca serotonina19.
La mayor parte de la serotonina (95%) en el organismo se encuentra en el tracto gastrointestinal (segundo cerebro). Curiosamente, los estudios han demostrado que los pacientes con SII tienen bajas concentraciones de serotonina20. En este sentido, la función de transporte de la serotonina está reducida en los pacientes con SII, posiblemente como resultado de la producción aumentada de interferón gamma (INF-γ), que induce la enzima indolamina 2-3 dioxigenasa (IDO), que es la que metaboliza el triptófano en serotonina21.
La serotonina es un importante modulador del eje cerebro-intestino. Un sistema serotoninérgico disfuncional puede proporcionar un posible vínculo entre el SII y su alta comorbilidad con trastornos psiquiátricos, en los que una deficiencia de serotonina a nivel central parece jugar un papel causal22.
Una reducción en el transporte de serotonina ocasiona un consumo intracelular y una degradación alterados de la misma, en las células epiteliales del intestino, con un aumento consecuente de la disponibilidad de este neurotransmisor dentro de la mucosa intestinal. Una disminución en el transporte de serotonina aumentaría notablemente la cantidad de serotonina disponible para sus receptores específicos. A su vez, un aumento de la serotonina unida a los receptores de 5-hidroxitriptamina (5-HT3) de las neuronas sensoriales del sistema nervioso entérico activaría los nervios sensoriales, transmitiéndose la información nociceptiva hasta el sistema nervioso central23,24.
Con todo lo dicho, diferentes autores23, entre los que nos incluimos25, consideran que el SII es un trastorno funcional con una base orgánica.
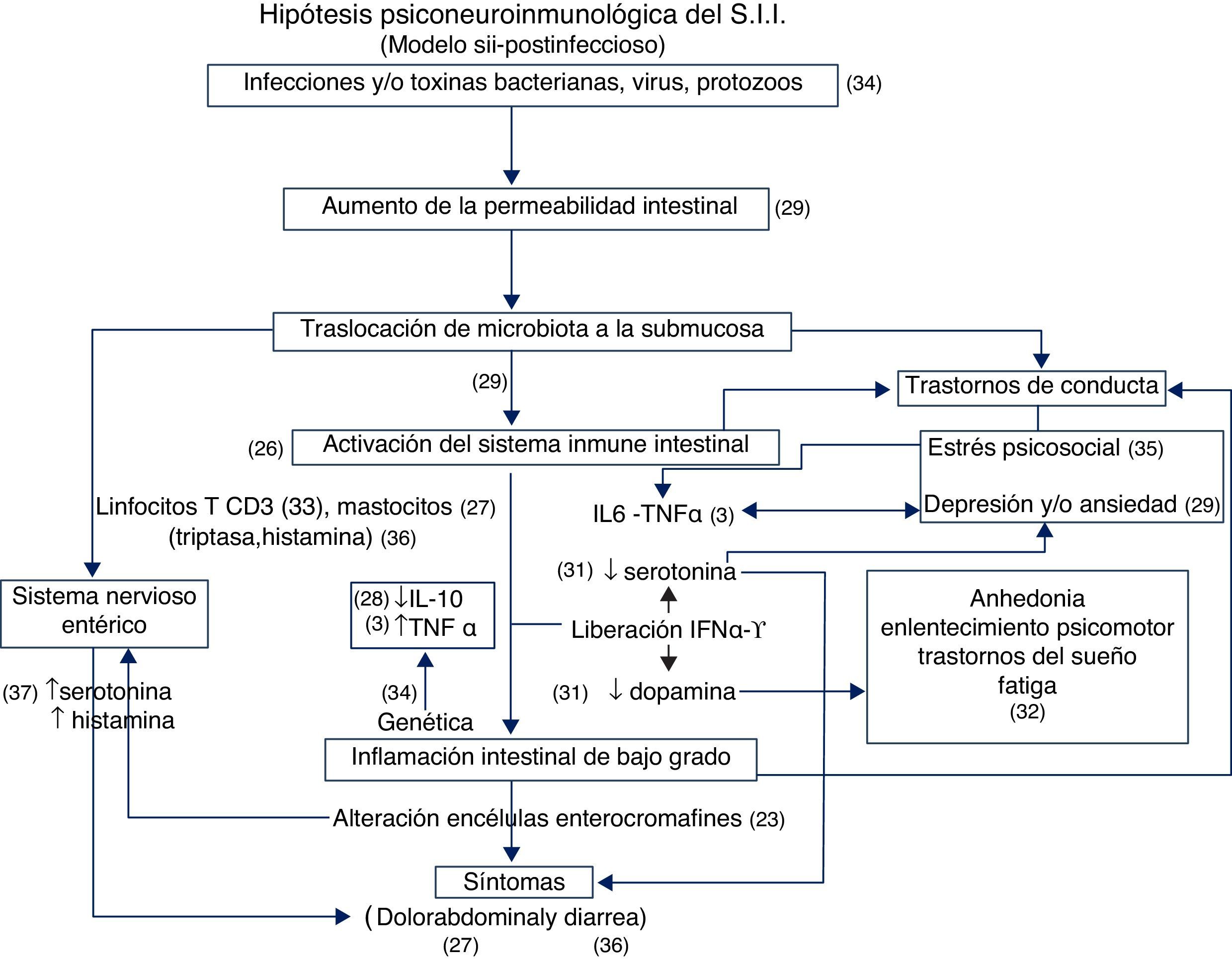
En la figura 1 se esquematiza el modelo psiconeuroinmunológico del SII, incluyendo las referencias bibliográficas.
Hipótesis psiconeuroinmunológica del SII (modelo SII-PI). PI: postinfeccioso.
Según el modelo psiconeuroinmunológico del SII, tras ciertas infecciones bacterianas —particularmente por Campylobacter jejuni, Shigella spp., Salmonella enteritidis—, toxinas bacterianas (E. coli enterotoxigénica), ciertos virus o protozoos (Giardias) se produciría un aumento de la permeabilidad intestinal, que facilitaría la traslocación de la microbiota a la submucosa. Esta última produciría la activación del sistema inmune intestinal, tanto a nivel celular (linfocitos T CD3 y mastocitos), así como liberación de citocinas inflamatorias (IL6 y TNF-α e interferón α y γ). El resultado de todo ello sería la aparición de inflamación intestinal de bajo grado que determinaría la aparición de los síntomas habituales del SII, en concreto, dolor abdominal y diarrea.
En el desencadenamiento de los síntomas jugarían también un papel importante la serotonina, liberada por las células enterocromafines del intestino, interactuando con los receptores 5-HT, y la histamina y triptasa, liberadas por la degranulación de los mastocitos.
Por otro lado, la microbiota, traslocada en la submucosa, y la misma activación del sistema inmune intestinal, pueden ser los responsables de los trastornos de conducta que manifiestan los pacientes con SII. A su vez, se ha demostrado que el estrés psicosocial y la ansiedad y depresión pueden determinar la liberación y activación de la IL-6 y el TNF-α. De forma recíproca, estas citocinas pueden desencadenar ansiedad y depresión, lo que justificaría la elevada comorbilidad psiquiátrica de estos pacientes.
Se ha demostrado que los IFN-α y γ ocasionan una disminución de los niveles de serotonina a nivel central, lo que se asocia a la aparición de ansiedad y depresión, así como una disminución de los niveles de dopamina, que puede explicar los síntomas neurovegatitivos que presentan estos pacientes, incluyendo anhedonia, enlentecimiento psicomotor, trastornos de sueño y fatiga que también presentan los enfermos con SII.
Finalmente, algunos casos de SII pueden tener una influencia genética, debido a la existencia de polimorfismos que determinan una elevada producción de TNF-α y baja de IL-10, citocina antiinflamatoria.