Las infecciones en los pacientes con cirrosis constituyen una complicación frecuente y con una considerable morbimortalidad. La traslocación bacteriana desempeña un papel relevante en la patogénesis de muchas de las infecciones en la cirrosis. A su vez las infecciones están implicadas en la patogenia de muchas de las descompensaciones de la cirrosis, tales como la hemorragia por varices esofágicas, la insuficiencia renal, las alteraciones hemodinámicas de la cirrosis o la encefalopatía hepática. La peritonitis bacteriana espontánea es, hoy en día, la infección mas frecuente en la cirrosis; su mortalidad ha descendido en las ultimas décadas debido a un diagnóstico precoz, el uso de antibioterapia adecuada y a la administración de albúmina. Sin embargo, en los últimos años se ha observado un aumento de infecciones por gérmenes multirresistentes, lo que se asocia a una mayor mortalidad. La profilaxis primaria con quinolonas es eficaz en la prevención de infecciones y se asocia con una menor mortalidad en una población seleccionada de pacientes con cirrosis hepática.
Infections in patients with cirrhosis are a common complication causing substantial morbidity and mortality. Bacterial translocation plays an important role in the pathogenesis of many infections in cirrhosis. In turn, infections are involved in the pathogenesis of many episodes of decompensated cirrhosis, such as esophageal variceal bleeding, renal insufficiency, the hemodynamic alterations of cirrhosis, and hepatic encephalopathy. Spontaneous bacterial peritonitis is currently the most frequent infection in cirrhosis. Mortality from this entity has recently decreased due to early diagnosis, the use of appropriate antibiotic therapy, and albumin administration. However, infections due to multiresistant microorganisms have recently increased, leading to greater mortality. Primary prophylaxis with quinolones is effective in preventing infections and is associated with lower mortality in a selected population of patients with liver cirrhosis.
Las infecciones bacterianas constituyen una causa significativa de morbimortalidad en los pacientes con cirrosis. Diferentes estudios prospectivos han estimado una incidencia de infecciones de 32–34% en pacientes cirróticos, ya sea al ingreso hospitalario o durante su hospitalización1. La tasa de infecciones aumenta todavía más en el contexto de la hemorragia digestiva, siendo entonces de más del 45%. Estudios poblacionales han demostrado que la cirrosis es un factor predisponente para el desarrollo de infecciones nosocomiales. En un estudio realizado sobre una población de 1,7 millones de pacientes dados de alta hospitalaria con el diagnóstico de cirrosis, 79.800 presentaron un proceso séptico durante su hospitalización, estimándose un riesgo relativo para desarrollar infecciones de 2,6 (IC95%: 19–3,3) en comparación a una población de similares características sin cirrosis2.
Las infecciones bacterianas en el contexto de la cirrosis se asocian con una mortalidad elevada (25–50%), superior a la de los pacientes cirróticos hospitalizados no infectados (mortalidad del 5–20%) y a la de los pacientes no cirróticos con sepsis (<5%)2. Por tanto, las infecciones bacterianas en la cirrosis constituyen un problema de considerable relevancia clínica, ya sea por su alta frecuencia como por la alta mortalidad asociada. El objetivo de esta revisión es poner de relieve la patogenia de las infecciones bacterianas en la cirrosis, su manejo clínico y las recomendaciones más recientes en el tratamiento de las distintas infecciones y su profilaxis.
Patogenia de las infecciones en la cirrosisAlteraciones del sistema inmuneLa alta incidencia de infecciones en la cirrosis se debe al menos en parte a un estado de inmunosupresión que presentan los pacientes con cirrosis. La inmunosupresión en la cirrosis es de origen multifactorial, interviniendo factores de la inmunidad humoral y celular3. Se han visto implicadas alteraciones en la capacidad bactericida de los macrófagos, disminución de los niveles séricos y en líquido ascítico (LA) del complemento necesarios para la opsonización de las bacterias y fundamentalmente una alteración del sistema retículo-endotelial (SRE). El SRE constituye el principal mecanismo defensivo contra las bacteriemias y otras infecciones adquiridas por vía hematógena. La mayoría de la actividad del SRE se encuentra en el hígado, donde las células de Kupffer constituyen el principal componente de este sistema. En la cirrosis, existe una alteración funcional del SRE probablemente debido a la existencia de shunts portosistémicos que circunvalan el hígado, escapando así la sangre portal de la acción del SRE. Otro mecanismo implicado en la disfunción del SRE es una alteración intrínseca de la actividad fagocítica de las células de Kupffer. La incapacidad de aclaramiento del SRE no afecta únicamente a las bacterias viables sino también a sus productos bacterianos como la endotoxina o el ADN bacteriano. Estos productos bacterianos se están describiendo en la actualidad como unos de los principales responsables de la respuesta inflamatoria crónica y de las alteraciones hemodinámicas observadas en la cirrosis.
Traslocación bacterianaEl otro gran factor fisiopatogénico implicado en el desarrollo de muchas de las infecciones bacterianas de la cirrosis es la traslocación bacteriana (TB), que se define como el paso de bacterias viables desde la luz intestinal hacia los ganglios linfáticos mesentéricos (GLM) y hacia otros órganos y medios biológicos extraintestinales tales como el LA o el líquido pleural. El hecho de que la gran mayoría de las infecciones en los pacientes cirróticos sean causadas por enterobacterias Gram negativas (Escherichia coli y Klebsiella pneumoniae), enterococos y estreptococos1, refuerza la hipótesis de la TB como uno de los mecanismos fundamentales en el desarrollo de infecciones en pacientes cirróticos, especialmente en la peritonitis bacteriana espontánea (PBE). La TB o la traslocación de productos bacterianos es un hecho relativamente frecuente en la cirrosis con ascitis, que se ha descrito en un 50–60% en modelos experimentales y en un 30–40% en pacientes con cirrosis4. El sobrecrecimiento bacteriano intestinal (SBI), el aumento de la permeabilidad intestinal y las alteraciones inmunitarias de la cirrosis son los tres pilares en la patogénesis de la TB, si bien hay dudas de que el segundo de ellos sea en realidad un epifenómeno, o una alteración que tenga consecuencias patogénicas en el desarrollo de las infecciones. Es importante conocer la patogenia de la TB y de las alteraciones inmunitarias de la cirrosis para un mejor manejo clínico de las infecciones en pacientes cirróticos, sus consecuencias y su profilaxis.
Sobrecrecimiento bacteriano intestinal: estudios experimentales han demostrado que las ratas cirróticas con ascitis y TB presentan una tasa de SBI mayor que la de los animales sin TB. Además, en ratas con ausencia de SBI (recuento bacteriano menor de 2 desviaciones estándar de la media del recuento bacteriano en ratas control) la TB ocurre raramente (0–11%) y es comparable a la observada en ratas control. Sin embargo, el hecho que la TB no aparezca en todas las ratas con SBI sugiere que otros factores aparte de la SBI intervienen en la patogénesis de la TB. Estudios desarrollados en pacientes con cirrosis han demostrado que el SBI es más frecuente en pacientes cirróticos que en pacientes control, especialmente en aquellos pacientes con un mayor grado de insuficiencia hepática y en aquellos con antecedentes de PBE. El SBI se debe principalmente a un enlentecimiento del tránsito intestinal, si bien depende también de otros factores como la acidez gástrica, factores intestinales inmunológicos y de las secreciones pancreatobiliares.
Aumento de la permeabilidad intestinal: la barrera intestinal está formada por un componente mucinoso secretado por las células epiteliales intestinales y por el epitelio intestinal per se, que forma una capa con uniones intercelulares (tight junctions) que permiten el paso selectivo de sustancias. En los pacientes con cirrosis se mantiene la estructura sellada de las «tight junctions», con aparición de un incremento de los espacios intercelulares, lo que sugiere que son alteraciones funcionales y no estructurales las que condicionan un incremento de la permeabilidad en algunos pacientes4. La mucina secretada por las células epiteliales (3l/día) forma una gruesa capa de glicoproteínas que impiden el contacto directo de las bacterias con las microvellosidades celulares. Las secreciones mucosas intestinales contienen IgA, que se une a las bacterias impidiendo la adherencia y colonización en el epitelio intestinal; además, la IgA también neutraliza toxinas y otros productos bacterianos. También las secreciones biliares juegan un papel en la prevención de la TB inhibiendo el SBI, ejerciendo un efecto trófico sobre la mucosa intestinal y neutralizando endotoxinas; en definitiva, dificultando la TB. En la cirrosis existen alteraciones estructurales y funcionales en la mucosa intestinal que aumentan la permeabilidad intestinal a bacterias y a sus productos bacterianos como la endotoxina. Estudios funcionales sobre el epitelio han demostrado un aumento de la permeabilidad intestinal en pacientes con cirrosis, especialmente en aquellos con sepsis. El daño oxidativo de la mucosa intestinal, así como la endotoxemia, los niveles elevados de óxido nítrico (ON) y las citocinas proinflamatorias probablemente juegan un papel en el aumento de la permeabilidad intestinal. Sin embargo, el aumento de la permeabilidad por sí sola no parece ser un factor determinante en la patogenia de la TB. La corrección de únicamente el SBI, sin interferir en la permeabilidad intestinal consigue disminuir la tasa de TB en ratas cirróticas. Este hecho parece sugerir que el SBI es más importante que el aumento de la permeabilidad intestinal como factor promotor de la TB.
Alteraciones inmunitarias locales: el intestino es un componente relevante del sistema inmunológico, que contiene prácticamente todas las células implicadas en la respuesta inmune. El tejido linfoide asociado al intestino, que es el tejido inmune más grande del organismo, contiene 4 compartimentos linfoides: placas de Peyer, linfocitos de la lámina propia, linfocitos intraepiteliales y los ganglios linfáticos mesentéricos (GLM), que intervienen en la respuesta inmune adaptativa y en la respuesta inmune innata. Hasta la fecha existen pocos estudios que se centren en las alteraciones inmunológicas de la barrera intestinal que favorezcan la TB. Se ha demostrado, sin embargo, una alteración de la capacidad proliferativa y de la síntesis de interferón-gamma por parte de los linfocitos intraepiteliales en ratones cirróticos y su correlación con la tasa de TB4. Los fenómenos asociados a la cirrosis que se asocian a su vez con una alteración del sistema inmune son especialmente relevantes en la patogenia de la TB así como también en las consecuencias clínicas de la respuesta inflamatoria asociada a la TB y a las infecciones.
Dado que la TB es un factor clave para el desarrollo de infecciones bacterianas y otras complicaciones de la cirrosis, se han realizado varios estudios para encontrar un marcador indirecto de translocación en humanos. Albillos et al5 demostraron que los pacientes cirróticos con niveles elevados de proteína transportadora de lipopolisacárido (LBP) presentaban una respuesta inflamatoria más marcada, mayores niveles de citocinas inflamatorias, una mayor vasodilatación periférica y mayor grado de circulación hiperdinámica que los pacientes con niveles semejantes a los controles. Estas alteraciones inmunológicas y hemodinámicas, así como los niveles séricos elevados de LBP, revierten tras realizar una descontaminación intestinal selectiva (DIS), sugiriendo el papel del LBP como marcador indirecto de TB. Otro de los marcadores de TB establecidos es la presencia de fragmentos de ADN bacteriano (ADNbact) tanto en plasma como en LA, que se detectan en aproximadamente el 35% de los pacientes con ascitis6. Los pacientes con presencia de ADNbact presentan una respuesta inflamatoria similar a la de los pacientes con PBE y su presencia se asocia a una mayor vasodilatación periférica, menores resistencias vasculares sistémicas y una mayor disfunción endotelial intrahepática posprandial7,8. Por lo tanto, la presencia de TB estimada, ya sea por los niveles de LBP o la presencia de ADNbact, se asocia con una mayor respuesta inflamatoria, un mayor deterioro hemodinámico y un peor pronóstico. Los datos que relacionan las evidencias moleculares de TB con los parámetros citados y el desarrollo de infecciones son más confusos. Tanto la detección de TB mediante cultivo de GLM en cirrosis, como de forma indirecta mediante la determinación de LBP y de ADNbact dan cifras similares, en torno al 35% de los casos, por lo que podemos suponer que esta cifra refleja, en realidad, el porcentaje de pacientes con cirrosis y ascitis con episodios de TB.
Consecuencias clínicas de la infección bacteriana en pacientes cirróticosEn los pacientes cirróticos con ascitis, la traslocación de productos bacterianos (endotoxina y ADNbact) estimulan de forma mantenida el sistema inmune, provocando una cascada inflamatoria y un aumento de las citocinas proinflamatorias, como el TNF-α, y la activación de la óxido nítrico sintasa inducible en la circulación esplácnica y sistémica4. Esta activación continua del sistema inmune explica en parte la gran respuesta inflamatoria que presentan los pacientes cirróticos descompensados ante las infecciones en comparación con la respuesta en pacientes no cirróticos. Las lipoproteínas de alta densidad, en particular la apolipoproteína A1, parecen jugar un papel importante en la neutralización de productos bacterianos como la endotoxina. La insuficiencia hepatocelular asociada a la cirrosis conlleva un déficit en la síntesis de lipoproteínas. En un estudio reciente, Tsai et al demostraron cómo los pacientes cirróticos con niveles bajos de apolipoproteína A1 que ingresaban en la UCI por una sepsis grave presentaron un peor pronóstico y una mayor mortalidad que los pacientes cirróticos con niveles normales de apolipoproteína A19. Además, en modelos experimentales la administración de lipoproteínas de alta densidad atenuó la activación de citocinas inflamatorias mediadas por endotoxina y mejoró la hemodinámica sistémica y hepática en ratas cirróticas con sepsis10. Sin embargo, todavía no se dispone de estudios clínicos que evalúen la utilidad de la administración de lipoproteínas de alta densidad en pacientes cirróticos con sepsis. De momento, es recomendable insistir en una adecuada nutrición de los pacientes cirróticos durante su hospitalización, ya que los pacientes cirróticos presentan ya de por sí un cierto grado de malnutrición, ya sea por una escasa ingesta calórica o por un catabolismo aumentado.
Sepsis graveLa cirrosis supone un factor pronóstico independiente de mortalidad en el contexto de la sepsis2. La sepsis se define como la presencia de una infección bacteriana confirmada por cultivo microbiológico junto con los parámetros que definen un síndrome de respuesta inflamatoria sistémica (SRIS). El SRIS se define como la presencia de 2 o más de los siguientes factores: temperatura >38°C o <36°C, una frecuencia cardíaca >90lpm, una frecuencia respiratoria >20rpm o una PaCO2 <4,3KPa; recuento de leucocitos >12×109/L o109/L o la presencia de más de 10% de formas inmaduras. La presencia de SRIS independiente de la presencia de infección bacteriana se ha asociado a un peor pronóstico de los pacientes cirróticos hospitalizados y a un mayor riesgo de desarrollar complicaciones derivadas de la hipertensión portal, como el síndrome hepatorrenal, encefalopatía hepática o hemorragia por varices esofágicas. Sin embargo, un número considerable de pacientes cirróticos no infectados cumplen criterios de SRIS por las características clínicas propias de la cirrosis, tales como la leucopenia secundaria al hiperesplenismo, la frecuencia cardíaca basal elevada en el contexto de la circulación hiperdinámica, la hiperventilación secundaria a encefalopatía o la hipotermia. De hecho, la traslocación de productos bacterianos, tales como ADNbact o endotoxina, en pacientes cirróticos provoca una respuesta inflamatoria sistémica que puede ser igual a la de los pacientes sépticos7. Por consiguiente, es difícil de estimar la gravedad de la respuesta inflamatoria asociada a la infección en pacientes cirróticos e incluso diagnosticar las infecciones por los criterios clínicos de SIRS. Es posible que deban redefinirse los criterios SRIS en pacientes con cirrosis.
Los pacientes cirróticos con sepsis grave presentan un mayor riesgo de desarrollar fallo hepático en el contexto de lo que se denomina acute on chronic liver failure. Esta entidad se define como un deterioro agudo de la función hepática (en 2 semanas) caracterizado por unos niveles de bilirrubina de más de 5mg/dl, encefalopatía o deterioro de la función renal, lo que conlleva una alta mortalidad. En consecuencia, el diagnóstico y tratamiento precoz de las infecciones en pacientes cirróticos con mala función hepática (Child B o C) es necesario para la prevención de este tipo de complicaciones con elevada mortalidad.
En los últimos años varios estudios han constatado que el shock séptico se asocia frecuentemente con una insuficiencia suprarrenal relativa en la población general. Los pacientes con shock séptico e insuficiencia suprarrenal relativa presentan un peor pronóstico, una mayor resistencia a sustancias vasoconstrictoras y una mayor incidencia de shock refractario. Recientemente, 2 estudios han evaluado la presencia de insuficiencia suprarrenal relativa en pacientes cirróticos con shock séptico11,12. La prevalencia estimada de esta complicación es bastante alta (entre 51–68%). Esta complicación se asocia con una mayor inestabilidad hemodinámica, una mayor gravedad de la sepsis, fallo renal y mortalidad hospitalaria. La administración de hidrocortisona parece asociarse a una mayor tasa de resolución del shock séptico y, por tanto, a un mejor pronóstico. Sin embargo, estos resultados deben ser confirmados en ensayos clínicos aleatorizados.
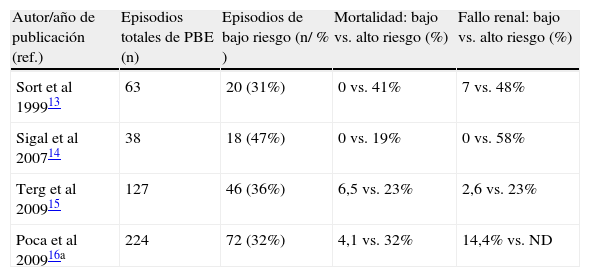
Insuficiencia renalLa insuficiencia renal ocurre en aproximadamente un tercio de los pacientes con PBE o en infecciones de otro origen. La insuficiencia renal es un factor predictivo independiente de mortalidad en los pacientes cirróticos infectados. En el contexto de una infección se produce un respuesta inflamatoria con liberación de citocinas y ON, que conducen a un aumento de la vasodilatación sistémica y de la hipovolemia efectiva en los pacientes con cirrosis. La hipovolemia efectiva desencadena una activación de sistemas compensadores como el sistema renina-angiotensina-aldosterona que conducen a una vasoconstricción renal y al desarrollo de fallo renal (fig. 1). En un estudio ya clásico, Sort et al demostraron que la administración de seroalbúmina a dosis de 1,5g/kg de peso en el día 1 y de 1g/kg de peso en el día 3 de una PBE combinada con el tratamiento antibiótico habitual, se asociaba a una menor incidencia de fracaso renal (10 vs. 33%) y a una menor mortalidad que la observada en pacientes tratados únicamente con antibióticos (6 vs. 29%)13. Sin embargo, en un análisis post hoc se observó que la administración de albúmina reducía la mortalidad de manera significativa solo en aquellos «pacientes de alto riesgo» definidos como aquellos con unos niveles de creatinina ≥1mg/dl y/o unos niveles séricos de bilirrubina ≥4mg/dl. Recientemente, 3 estudios retrospectivos han evaluado la mortalidad y la tasa de insuficiencia renal en «pacientes de bajo riesgo» no tratados con albúmina14–16. En estos tres estudios la tasa de mortalidad e insuficiencia renal en el grupo de bajo riesgo fue claramente inferior en comparación con los pacientes de alto riesgo (tabla 1). Por tanto, los resultados de estos estudios sugieren que la administración de albúmina solo es beneficiosa en un subgrupo de pacientes con alteración de la función renal (creatinina ≥1,0mg/dl) y /o unos niveles elevados de bilirrubina (≥4mg/dl) al diagnóstico de la PBE. Cuestiones como la dosis minima de albúmina y si su administración es útil en el contexto de otras infecciones distintas de la PBE en pacientes cirróticos están todavía por determinar.
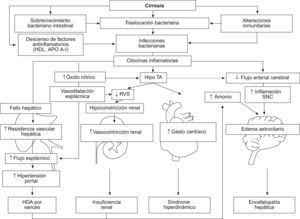
Mecanismos implicados en el desarrollo de las infecciones bacterianas, sepsis y complicaciones sistémicas. En la cirrosis avanzada hay un aumento de la traslocación de bacterias desde el intestino que juega un papel importante en la patogénesis de las infecciones. La respuesta inflamatoria asociada a las infecciones conlleva distintas alteraciones hemodinámicas y sistémicas que pueden conducir a un agravamiento de las complicaciones de la cirrosis (fallo hepático, hemorragia digestiva por varices, fallo renal, síndrome hiperdinámico y encefalopatía hepática).
Tasa de insuficiencia renal y mortalidad en pacientes hospitalizados con peritonitis bacteriana espontánea, no tratados con albúmina, según su riesgo de presentar complicaciones
| Autor/año de publicación (ref.) | Episodios totales de PBE (n) | Episodios de bajo riesgo (n/ % ) | Mortalidad: bajo vs. alto riesgo (%) | Fallo renal: bajo vs. alto riesgo (%) |
| Sort et al 199913 | 63 | 20 (31%) | 0 vs. 41% | 7 vs. 48% |
| Sigal et al 200714 | 38 | 18 (47%) | 0 vs. 19% | 0 vs. 58% |
| Terg et al 200915 | 127 | 46 (36%) | 6,5 vs. 23% | 2,6 vs. 23% |
| Poca et al 200916a | 224 | 72 (32%) | 4,1 vs. 32% | 14,4% vs. ND |
ND: datos no disponibles; PBE: peritonitis bacteriana espontánea.
Existe una clara evidencia en la literatura médica de que la hemorragia digestiva por varices esofágicas se asocia a un riesgo elevado de desarrollar infecciones en los pacientes cirróticos17. Sin embargo, las infecciones también se asocian a una mayor tasa de recidiva precoz de la hemorragia, a una mayor tasa de fracaso en el control inicial de la hemorragia y a un mayor requerimiento transfusional. En un estudio realizado en China, 120 pacientes cirróticos con hemorragia por varices esofágicas fueron aleatorizados a recibir tratamiento antibiótico profiláctico (n=59) o tratamiento antibiótico sólo si presentaban una infección bacteriana (tratamiento a demanda) (n=61). La tasa de recidiva hemorrágica fue claramente superior en los pacientes con tratamiento a demanda en comparación con los pacientes con tratamiento antibiótico profiláctico (39 vs. 14%; p<0,01 respectivamente)18. La endotoxina y otros productos bacterianos como el ADNbact liberados al torrente circulatorio durante las hemorragias pueden contribuir a aumentar la hipertensión portal, ya sea por aumento de la resistencia vascular hepática mediada por la endotelina19 o aumentando el flujo esplácnico, dificultando así el control del episodio de sangrado4. Por tanto, existe un riesgo mayor de hemorragia digestiva en pacientes cirróticos infectados, por lo que se debe de tener en cuenta la aparición de esta complicación en el transcurso de las infecciones. El uso de antibióticos profilácticos es necesario en todos los pacientes cirróticos que ingresan por una hemorragia digestiva para reducir la tasa de resangrado18, las infecciones y la mortalidad.
Alteraciones en la coagulaciónLos pacientes cirróticos descompensados, especialmente aquellos con una infección activa, presentan alteraciones significativas en los test de coagulación. Las alteraciones más significativas de la coagulación en relación a la sepsis se deben principalmente a la presencia de niveles elevados de sustancias heparinoides y a la inhibición de la agregación plaquetaria a través de la liberación de ON. Las sustancias heparinoides endógenas son heteropolisacáridos que pertenecen a la familia de los mucopolisacáridos, que inhiben el factor X y probablemente otros factores en la superficie del endotelio vascular. El aumento de la producción del activador del plasminógeno tisular en los pacientes cirróticos empeora todavía más las alteraciones de la coagulación, pudiendo desarrollarse un estado de coagulación intravascular acelerada e hiperfibrinolisis20. En consecuencia, es importante identificar las alteraciones de la coagulación en los pacientes sépticos y tratarlas cuando se produzca un sangrado, haciendo especial énfasis en el tratamiento de la hiperfibrinolisis con acido aminocaproico, la cual se presenta hasta en un 30% de los pacientes cirróticos.
Encefalopatía hepáticaLas infecciones bacterianas pueden desencadenar o empeorar episodios de encefalopatía hepática. Los mecanismos por los que se cree que las infecciones intervienen en la patogenia de la encefalopatía son el aumento de la oxidación celular, el efecto directo de las citocinas en las células endoteliales del cerebro y astrocitos, la reducción del flujo sanguíneo cerebral y la modulación del efecto cerebral de la hiperamonemia21 (fig. 1). Por lo que desde el punto de vista de la práctica clínica diaria, se recomienda descartar una infección sistémica concomitante ante un episodio de encefalopatía hepática que no responde al tratamiento convencional.
Nuevas cuestiones en el tratamiento de las infecciones bacterianas en la cirrosisDiagnóstico precoz de la peritonitis bacteriana espontáneaLa PBE es la infección más frecuente en los pacientes cirróticos, siendo su prevalencia del 10–30% en pacientes hospitalizados. El diagnóstico de la PBE se basa en el recuento manual de polimorfonucleares (PMN) en el LA. Se considera que un paciente presenta una PBE cuando el recuento de PMN es superior a 250PMN/mm3. Sin embargo, el recuento manual de PMN depende de un operador y su determinación no es inmediata. En los últimos años ha crecido el interés en el diagnóstico rápido de la PBE mediante el uso de tiras reactivas, lo que permite teóricamente el diagnóstico a la cabecera del paciente. Recientemente, se ha publicado una revisión sobre el tema, la cual muestra una tasa de falsos negativos de entre el 0–50%, siendo de hasta el 55% en la serie más larga de pacientes22. Por tanto, no se recomienda el uso de las actuales tiras reactivas, diseñadas para orina y no para ascitis, para el diagnóstico de la PBE y el recuento celular continúa siendo el test diagnóstico estándar para la PBE. Es posible que la futura disponibilidad de nuevos modelos de tiras reactivas diseñadas para ascitis demuestre una mejor eficacia en el diagnóstico precoz de la PBE. En los últimos años, se han evaluado los niveles de lactoferrina en LA como test diagnósticos de PBE23 pero no hay datos suficientes en la literatura como para recomendar su uso rutinario.
Aparición de infecciones por gérmenes multirresistentesEl tratamiento antibiótico empírico estándar de la PBE se basa principalmente en el uso de cefalosporinas de tercera generación, ya que cubren los gérmenes que se aíslan más frecuentemente en la PBE (enterobacterias y estreptococos)24. Otros antibióticos como la amoxicilina-clavulánico también son eficaces en el tratamiento de la PBE. Sin embargo, en los últimos años ha habido importantes cambios en la epidemiología y en el perfil de resistencias a antibióticos de los gérmenes que causan la PBE; especialmente se ha observado un incremento de infecciones por bacilos gram negativos (BGN) con betalactamasas de espectro ampliado en infecciones nosocomiales. Son varios los mecanismos de resistencia bacteriana a antibióticos, entre los que se encuentra la producción de enzimas inactivadoras de antimicrobianos, y de éstas las más ampliamente estudiadas han sido las β-lactamasas, las que inactivan el anillo β-lactámico de penicilinas y cefalosporinas. La sustitución de uno o varios aminoácidos en estas enzimas bacterianas dío origen a las betalactamasas de espectro ampliado. Esta modificación les permitió ampliar su actividad sobre todo frente a los antibióticos β-lactámicos, con excepción de los carbapenémicos. Un estudio reciente realizado en el Hospital Clínic de Barcelona, evaluó prospectivamente todas las infecciones bacterianas en pacientes cirróticos ingresados de 2005–2007. Un total de 224 pacientes presentaron 500 infecciones bacterianas, de las cuales la PBE (n=126) fue la más frecuente. Un 25% de los episodios de PBE fueron de origen nosocomial; donde se aislaron con más frecuencia gérmenes multirresistentes (25 vs. 3%, p<0,002). Por tanto, la resolución de la infección con tratamiento empírico fue significativamente menor en episodios de PBE de origen nosocomial (26 vs. 76%). Otros estudios recientes han mostrado que la eficacia del tratamiento empírico estandarizado para la PBE de origen nosocomial está disminuyendo, con el consiguiente aumento de la mortalidad25–32 (tabla 2).
Estudios que han evaluado la prevalencia de las PBE por gérmenes resistentes al tratamiento convencional
| Autor (año)/ref. | Episodios de PBE (n) | BGN/CGP (n) | % éxito con tratamiento empírico convencional (global) | BLEA n/(% de BGN) | Pronóstico PBE por gérmenes multirresistentes | Factores riesgo |
| Fernández et al (2002)1 | 138 | 43/11 | 92% | 2 (3%) | ND | ND |
| Singh et al (2003)32 | 61 | 17/20 | 81% | 4 (23%) | Mortalidad 30 dias: 57% | Uso previo de antibióticos |
| Bert et al (2003)25 | 95 | 35/42 | 76% (52% en nosocomiales) | 18 (51%) | ND | Infección nosocomial |
| Song et al (2006)26 | 106 | 84/22 | 65% (37% en nosocomiales) | 18 (21%) | ND | Infección nosocomial |
| Angeloni et al (2008)27 | 38 | 5/4 | 59% | 4 (80%) | ND | ND |
| Umgelter et al (2009)28 | 101 | 21/20 | 80% | 0 | Mortalidad 67%* | ND |
| Song et al (2009)29 | 1.026 | 368/ND | 76% | 32 (8%) | Mortalidad 30 días: 40% | Hospitalización |
| Exposición previa a antibióticos | ||||||
| Yakar et al (2009)30 | 218 | 34/42 | 59% | 5 (15%) | ND | ND |
| Acevedo et al (2009)33a | 126 | ND | 44% en nosocomiales | 8 | ND | Hospitalización reciente |
| Exposición previa a antibióticos | ||||||
| Profilaxis con norfloxacino | ||||||
| Cheong et al (2009)31 | 236 | 172/54 | 74% (68% en nosocomiales) | 28 (16%) | Mortalidad 30 dias: 52% | Infección nosocomial |
| Tratamiento previo con cefalosporinas |
BGN: bacilos gram negativos; BLEA: bacterias con betalactamasas de espectro ampliado; CGP: cocos gram positivos; ND: datos no disponibles; PBE: peritonitis bacteriana espontánea.
Otro factor que influye actualmente en el tratamiento de las infecciones bacterianas en la cirrosis es el aumento de episodios de sepsis por gérmenes gram positivos, especialmente por Staphylococcus aureus meticilín-resistentes. Algunos autores recomiendan tratamiento con vancomicina en los casos en los que la PBE no se resuelva a las 48h de iniciar tratamiento empírico estándar o en casos de infecciones de origen nosocomial33.
A la vista de estos resultados, algunos expertos recomiendan un cambio en el tratamiento empírico de las PBE nosocomiales, sustituyendo las cefalosporinas o la amoxicilina-clavulánico por antibióticos de amplio espectro, como carbapenémicos y, dependiendo del patrón local de resistencias bacterianas, cabría añadir un glicopéptido. Sin embargo, la mayoría de estos estudios han sido realizados en un solo centro, y la variabilidad de la flora patógena implicada en las infecciones de cada centro debe ser tenida en cuenta. Por tanto, se necesitan estudios multicéntricos, con mayor número de pacientes que confirmen estos resultados. Actualmente se está llevando a cabo un estudio multicéntrico de tratamiento de PBE que permitirá conocer con detalle la bacteriología de estos episodios en distintos centros hospitalarios.
Peritonitis bacteriana secundariaLa peritonitis bacteriana secundaria (PBS) es una entidad poco frecuente en comparación con la PBE y, por tanto, menos documentada en la literatura médica. La incidencia de esta complicación en la cirrosis se estima alrededor de 4,5–10%1,34. El diagnóstico diferencial con la PBE y su elevada mortalidad son los 2 aspectos más importantes en esta patología, ya que el tratamiento quirúrgico es el tratamiento de elección en la PBS pero nunca en la PBE. Además, la laparotomía implica una mayor morbimortalidad en pacientes cirróticos, por lo que se debe asegurar al máximo el diagnóstico de PBS antes de indicar una intervención quirúrgica urgente a un paciente cirrótico. El diagnóstico de la PBS se basa en los criterios de Runyon en LA (glucose <50mg/l, proteínas totales >10g/l y LDH(LA)/LDH(suero) >1), los cuales tienen una alta sensibilidad pero una baja especificidad (del 45%). Recientemente, Soriano et al34 han publicado un estudio retrospectivo sobre el diagnóstico y manejo clínico de la PBS en 24 pacientes. En este trabajo, la presencia de los criterios de Runyon y/o el cultivo polimicrobiano en LA se asoció con una sensibilidad del 95,6% y una especificidad del 88,6% para el diagnóstico de PBS.
Las técnicas de imagen como la TAC abdominal son cruciales para confirmar el diagnóstico y planificar el tratamiento quirúrgico de la perforación intestinal. La mortalidad de la PBS es más elevada que la de la PBE, siendo del 53–66% según las series. La mortalidad de la PBS en cirróticos parece ser menor si el paciente es intervenido quirúrgicamente, independientemente del grado de insuficiencia hepática y si la intervención se realiza de forma precoz tras el diagnóstico.
Tratamiento de otras infecciones en la cirrosisInfecciones urinarias: las infecciones urinarias constituyen la segunda causa de infecciones en pacientes cirróticos, después de la PBE. En la cirrosis existen factores predisponentes para su desarrollo como la presencia frecuente de sondas vesicales y la ascitis o el sexo femenino. Las infecciones urinarias suelen ser oligoasintomáticas, y la bacteriuria sola se observa hasta en un 40% de los casos. Los microorganismos más frecuentes son las enterobacterias y los enterococos si hay manipulación de la vía urinaria. El tratamiento empírico se basa en el uso de cefalosporinas de tercera generación y amoxicilina-clavulánico en pacientes portadores de sonda vesical (cobertura del enterococo). Al igual que en la PBE, estudios recientes han demostrado un aumento de infecciones urinarias nosocomiales por gérmenes multirresistentes, lo que se acompaña de un descenso en la tasa de curación con el tratamiento empírico estándar33. Por consiguiente, algunos autores recomiendan una cobertura antibiótica con carbapenémicos y glicopéptidos en aquellos pacientes con sepsis grave, SIRS o shock séptico de foco urinario.
Neumonías: las neumonías adquiridas en la comunidad en pacientes cirróticos están producidas por los mismos gérmenes que en la población general (Streptococcus pneumoniae, Haemophylus, Legionella y Klebsiella). Por tanto, el tratamiento empírico es el mismo que en la población general, que incluye el uso de una cefalosporina de tercera generación o amoxicilina-clavulánico combinada con un macrólido o levofloxacino en monoterapia. Las neumonías de origen nosocomial se asocian, en los pacientes cirróticos, con factores predisponentes como la encefalopatía hepática, la intubación orotraqueal, el taponamiento esofágico o la endoscopia digestiva durante la hemorragia digestiva. Algunos autores recomiendan la intubación orotraqueal previa a la realización de una endoscopia digestiva alta urgente en el contexto una hemorragia por varices y encefalopatía hepática. La intubación profiláctica en pacientes no encefalopáticos se asocia, sin embargo, con una mayor tasa de neumonías por broncoaspiración y a una mayor mortalidad35. Los gérmenes más frecuentemente aislados son los Staphyloccus spp. y las Pseudomona spp. por lo que se recomienda cobertura con antibióticos antipseudomónicos y glicopéptidos si existen antecedentes de intubación orotraqueal.
Empiema pleural espontáneo: el empiema pleural espontáneo es una complicación infecciosa del hidrotórax hepático. Muchos autores sugieren que el mecanismo patogénico de esta infección es igual al de la PBE, donde la traslocación de gérmenes de origen intestinal juega un papel fundamental en la colonización y posterior infección del líquido pleural. Los gérmenes más frecuentemente aislados son los mismos que los de la PBE (S. pneumoniae y Enterobacterias). Su diagnostico se basa en un recuento de PMN: >500PMN/mm3 en liquido pleural o >250PMN/mm3 si se acompaña de un cultivo positivo del liquido pleural. Los factores de riesgo para desarrollar un empiema pleural son el grado de insuficiencia hepática estimado por la clasificación de Child-Pugh, presencia de proteínas bajas en líquido pleural e historia previa de PBE. El tratamiento empírico consiste, al igual que en la PBE, en el uso de cefalosporinas de tercera generación y/o amoxicilina-clavulánico.
Infecciones de partes blandas: las celulitis, o infecciones de tejidos blandos, son relativamente frecuentes en pacientes con cirrosis. Los factores de riesgo asociados a este tipo de infecciones son una escasa higiene corporal, la presencia de heridas cutáneas y el edema en extremidades inferiores. Un estudio reciente evaluó retrospectivamente el pronóstico de las infecciones de tejidos blandos en una cohorte de 118 episodios, observando una mortalidad global del 22%. Los factores que se asociaron con un mal pronóstico en el análisis multivariado fueron el estadío C de Child-Pugh y la aparición de bullas hemorrágicas en la piel. Los autores de este estudio recomiendan evaluación quirúrgica inmediata y tratamiento antibiótico de amplio espectro en aquellos pacientes con mala función hepática (Child C) y/o aparición de bullas hemorrágicas en la piel36. El tratamiento antibiótico empírico recomendado se basa en el uso de amoxicilina-clavulánico en monoterapia o una cefalosporina de tercera generación más cloxacilina. En infecciones de origen nosocomial se recomienda ampliar la cobertura contra Pseudomonas spp. y Staphyloccus spp.
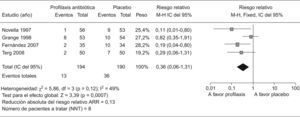
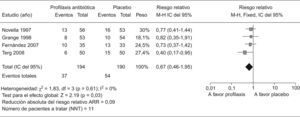
Nuevas cuestiones en la profilaxis de las infecciones bacterianas en la cirrosisDescontaminación intestinal selectivaComo ya hemos comentado, la flora intestinal parece ser la fuente principal de donde se origina la PBE y otras infecciones por gérmenes gram negativos en la cirrosis. Por tanto, la profilaxis antibiótica de las infecciones en los cirróticos se basa en la administración oral de antibióticos poco o no absorbibles, que reduzcan la concentración de BGN en la flora intestinal sin afectar a los gérmenes gram positivos o anaerobios. A este procedimiento se le denomina DIS. La administración prolongada de norfloxacino produce una marcada reducción de los BGN en la flora fecal de pacientes cirróticos sin afectar a los Gram positivos ni anaerobios, aunque este procedimiento puede modificar las concentraciones respectivas de los mismos en la luz intestinal. Por otra parte, el uso prolongado de la DIS con norfloxacino se asocia con el desarrollo de infecciones por gérmenes resistentes a las quinolonas1. Según los criterios aceptados actualmente, la profilaxis con norfloxacino se debe restringir a aquellos pacientes con alto riesgo de recidiva de PBE o con hemorragia digestiva24. Sin embargo, no está bien definido el uso de la profilaxis antibiótica en pacientes cirróticos con ascitis que no han presentado todavía una PBE (profilaxis primaria). El riesgo de desarrollar PBE en estos pacientes depende fundamentalmente de la concentración de proteínas en LA. La probabilidad de presentar PBE en pacientes con proteínas en LA por debajo de 1g/dl es de aproximadamente un 20% al año, mientras que la tasa de PBE en pacientes con un nivel de proteínas en LA ≥de 1g/dl es prácticamente del 0%37. Hasta la fecha, 4 estudios han evaluado la profilaxis primaria mediante la administración diaria de quinolonas en pacientes cirróticos con ascitis y proteínas bajas en LA38–41. En todos los estudios, la media de proteínas en LA de los pacientes incluidos fue menor de 1,5g/dl. Si analizamos en conjunto los 4 estudios, los pacientes que recibieron profilaxis antibiótica muestran una reducción del riesgo relativo de sufrir un primer episodio de PBE del 66% (RR 0.36; p<,001 IC, 0,20–0,65) (fig. 2). La incidencia global de PBE durante los periodos de seguimiento en los grupos tratados con profilaxis antibiótica es del 6% con respecto al 19% de los grupos tratados con placebo. La reducción absoluta del riesgo relativo de sufrir un primer episodio de PBE es del 13% y el número de pacientes a tratar para evitar un episodio de PBE es de 8. En cuanto a la mortalidad global de los pacientes con profilaxis primaria con respecto a los grupos con placebo es significativamente menor (19 vs. 28% respectivamente, p=0,03), con una disminución del riesgo relativo de mortalidad del 33% (RR 0,67; p=0,03 IC95%: 0,46–0,96) (fig. 3). La reducción absoluta del riesgo relativo de mortalidad global es de 9% con un número de pacientes a tratar para evitar un fallecimiento de 11. En definitiva, la profilaxis primaria mediante la DIS con quinolonas en una población seleccionada de pacientes cirróticos con alto riesgo de presentar PBE es beneficiosa, ya que se asocia con una disminución de la morbimortalidad.
La aparición de gérmenes resistentes a quinolonas en pacientes con profilaxis primaria ha pasado de ser un hecho excepcional a ser un evento relativamente frecuente en la actualidad. Los estudios iniciales sugerían que el riesgo de desarrollar una PBE u otra infección por BGN resistentes a quinolonas en pacientes con profilaxis antibiótica con norfloxacino era bajo, ya que la mayoría de los gérmenes aislados en la recurrencia de la PBE eran cocos gram positivos42. En este sentido, estudios en cultivos celulares han demostrado que el norfloxacino inhibe la capacidad de adherencia a las células epiteliales de las cepas de E. coli, independientemente de su sensibilidad a dicho antibiótico43. Sin embargo, estudios más recientes han observado un aumento considerable de las PBE por BGN resistentes a quinolonas (26–45% de las PBE con cultivo positivo)28. En estos estudios, los pacientes con tratamiento profiláctico con norfloxacino también presentaron episodios de PBE por gérmenes resistentes a trimetoprim-sulfametoxazol, por lo que dicho antibiótico no es útil como alternativa al norfloxacino.
Otras alternativas profilácticasProcinéticos: el SBI se debe en parte a un enlentecimiento del peristaltismo secundario a la activación del sistema simpático que presentan los pacientes cirróticos con ascitis. De hecho, estudios experimentales han demostrado cómo el propranolol disminuye la tasa de TB mediante un acortamiento del tiempo de tránsito intestinal44. En los últimos años, han aparecido estudios que han demostrado una menor tasa de PBE en el grupo de pacientes cirróticos respondedores a propranolol, definida esta respuesta como un descenso del gradiente de presión portal ≤12mmHg o un descenso del gradiente de presión portal ≥20% con respecto al basal45. Por tanto, una alternativa para disminuir la tasa de infecciones en pacientes cirróticos es el uso de betabloqueantes no selectivos cuando estén indicados.
Probióticos: los probióticos, específicamente el Lactobacillus, han demostrado su eficacia en corregir el SBI, estabilizar la función de la barrera intestinal y disminuir la TB en modelos experimentales de fallo hepático agudo. Sin embargo, la administración de Lactobaccillus en la dieta de ratas con cirrosis e hipertensión portal no se asoció con un descenso en la tasa de TB o infecciones del LA46; incluso en uno de los estudios se objetivó la traslocación del propio Lactobacillus a los GLM en un 24% de las ratas tratadas. Hasta la fecha, no se recomienda el uso de probióticos en pacientes cirróticos. Se necesitan más estudios que evalúen la eficacia de los probióticos y de los prebióticos en la profilaxis de las infecciones en pacientes cirróticos.
Otras medidas: la secreción ácida gástrica juega un papel importante en la descontaminación bacteriana del estomago y del intestino delgado. Los inhibidores de la bomba de protones (IBP) al eliminar la barrera ácida permiten la colonización de bacterias ingeridas por vía oral en el estómago y en el intestino delgado. Existen numerosos estudios que evidencian el exceso de prescripción de IBP en atención primaria y hospitalaria47. En estos estudios, hasta el 54% de las prescripciones de IBP fueron inapropiadas o con una indicación no correcta. Se ha demostrado que la administración de IBP se asocia, en pacientes no cirróticos, a un incremento de riesgo de desarrollo de neumonías nosocomiales48 Recientemente, un estudio retrospectivo observó un mayor uso de IBP en pacientes ingresados por PBE (69%) con respecto a una cohorte de pacientes cirróticos con ascitis ingresados por otros motivos (31%)49. Por tanto, se recomienda una prescripción racional de IBP en pacientes cirróticos, de cara a prevenir futuras complicaciones infecciosas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.