INTRODUCCION
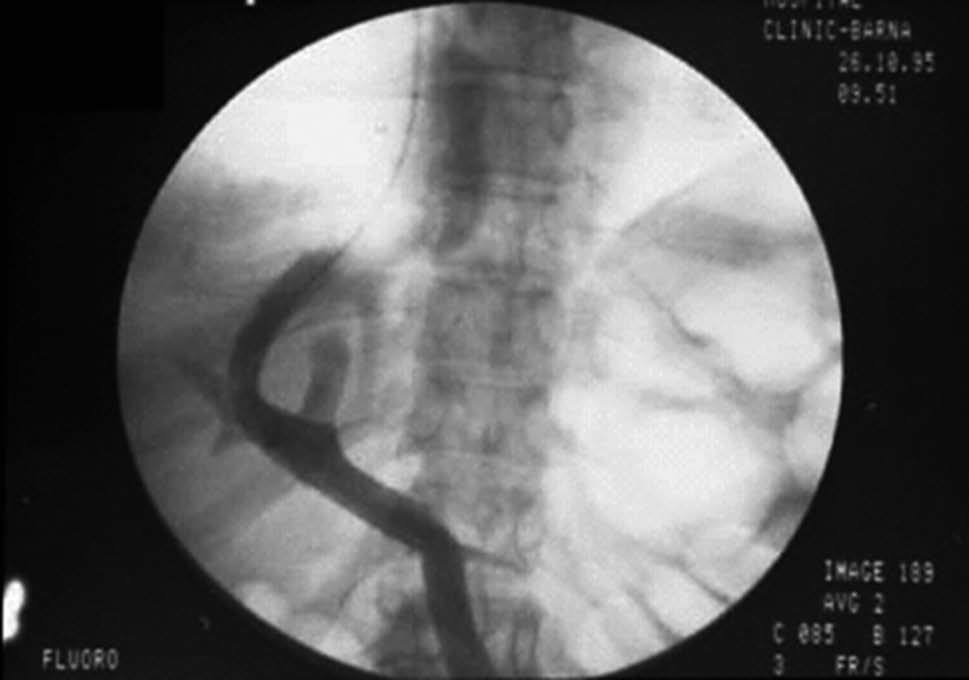
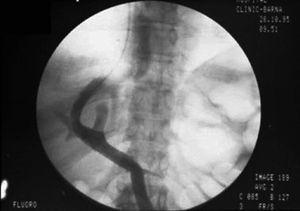
La derivación portosistémica, percutánea e intrahepática (DPPI), generalmente conocida por la abreviatura TIPS, acrónimo de las iniciales de su denominación anglosajona (transjugular intrahepatic portosystemic shunt) consiste en la creación de una comunicación de diámetro prefijado por métodos de radiología intervencionista entre la vena porta y la vena cava a través del parénquima hepático durante el cateterismo de las venas suprahepáticas (fig. 1)1,2.
Fig. 1. Inyección intraportal de contraste yodado que muestra su paso a través de una derivación portosistémica, percutánea e intrahepática.
TÉCNICA
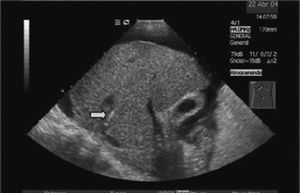
La DPPI se inicia con la colocación, bajo anestesia local, de un introductor vascular mediante la técnica de Seldinger en una vena periférica, usualmente la vena yugular interna derecha. En caso de alteraciones anatómicas o trombosis de ésta, también se han utilizado la vena yugular derecha externa, la vena yugular interna izquierda e incluso la vena femoral. Una vez cateterizada la vena suprahepática se punciona el parénquima hepático en dirección hacia la vena porta3. En nuestra unidad se utiliza la ultrasonografía (US) en tiempo real como técnica de apoyo para seleccionar la vena suprahepática situada en un plano de aproximación más adecuado a la rama portal que se va a puncionar. Posteriormente, la US ayuda a dirigir la trayectoria de la aguja de punción desde la vena suprahepática hasta la vena porta (fig. 2). Creemos que la utilización de la US disminuye la incidencia de complicaciones derivadas directamente del procedimiento de punción. Una vez logrado el acceso a la vena porta se dilata el trayecto parenquimatoso y las paredes vasculares de entrada a la vena porta y vena suprahepática con un balón de angioplastia. Finalmente, tras la dilatación del trayecto, se coloca una prótesis metálica de longitud y diámetro variable, con el fin de evitar que se colapse o trombose la comunicación portosistémica que se ha establecido en el área intraparenquimatosa. La prótesis debe recubrir todo el trayecto intraparenquimatoso, extendiéndose ligeramente hacia el tronco portal. Inicialmente, se recomendaba extender sólo un poco la prótesis hacia la vena suprahepática. Sin embargo, la alta incidencia de estenosis en la vena suprahepática ha propiciado que actualmente se extienda la prótesis recubriendo total o parcialmente la vena suprahepática4,5. Una vez liberada la prótesis, se procede a su dilatación con un balón de angioplastia.
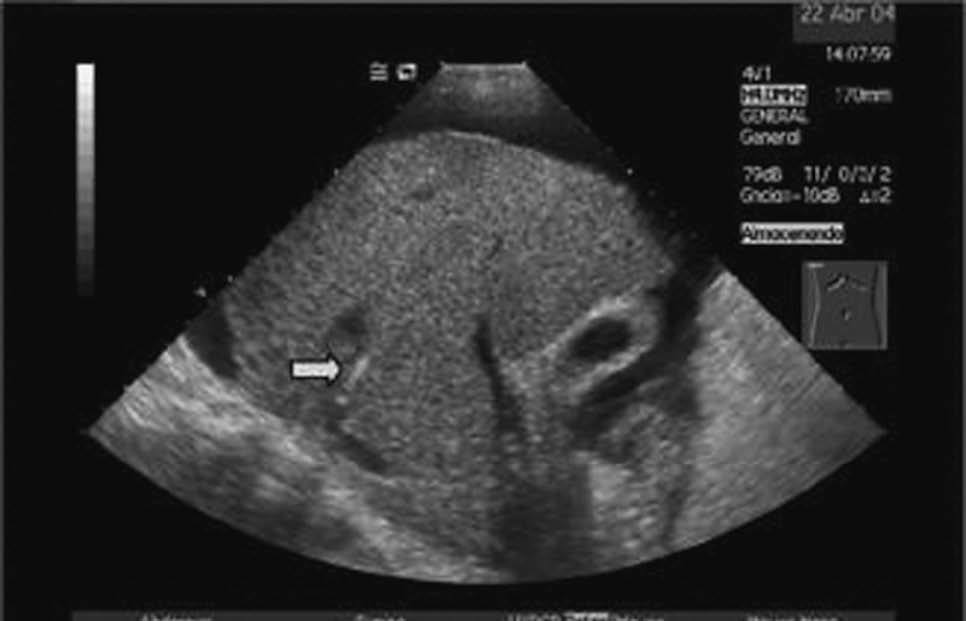
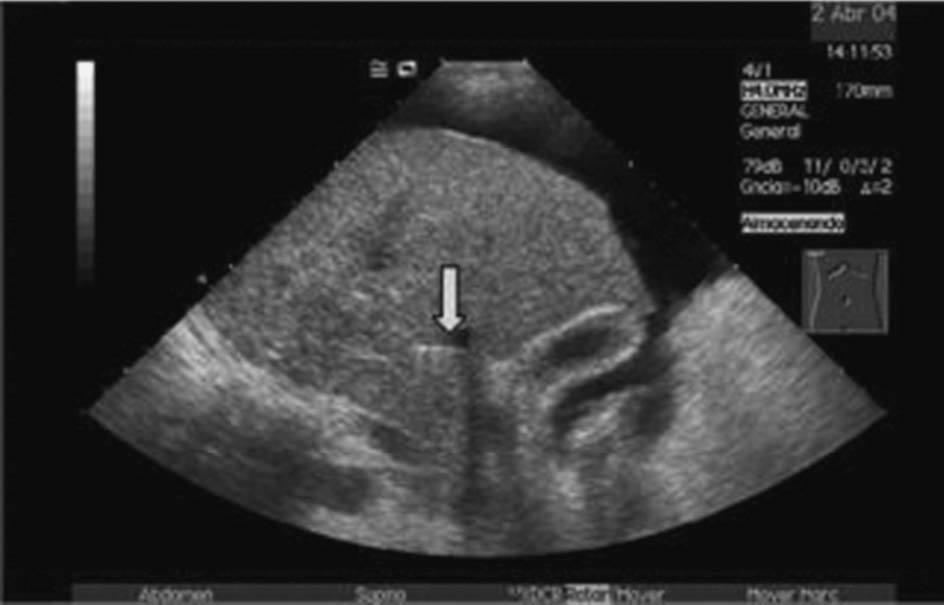
Fig. 2. Imagen ecográfica que muestra la aguja de biopsia en la vena suprahepática (A, flecha) y posteriormente (B) ya introducida en la rama portal (flecha). Por cortesía de la Dra. Gilabert.
La punción del parénquima hepático, en especial la punción de la pared de la vena y su posterior dilatación, son los momentos más dolorosos para el paciente. Ésta es la razón fundamental por la que algunos grupos realizan el procedimiento bajo anestesia general. Sin embargo, en la mayoría de centros, entre ellos el nuestro, todo el procedimiento anteriormente descrito se realiza con anestesia local y analgesia-sedación consciente. Con ello, la técnica se tolera bien y los pacientes se recuperan rápidamente del procedimiento.
Aunque algunos grupos han preconizado la utilización de anticoagulación para evitar la trombosis de la prótesis, no hay ningún estudio controlado que haya demostrado la utilidad de esta práctica6,7. Además, como veremos más adelante, la introducción de las nuevas prótesis recubiertas con su menor incidencia de disfunción hace que esta práctica sea innecesaria. Dada la existencia de sepsis post-DPPI la mayor parte de grupos administran antibioterapia profiláctica, que incluye en su espectro de acción estafilococos y bacilos gramnegativos.
Inmediatamente después de la realización de la DPPI, se produce un notable descenso del gradiente de presión portal y del flujo sanguíneo a través de las colaterales portosistémicas y, por ende, de las varices esofagogástricas8. Estos efectos hemodinámicas son los responsables de la elevada eficacia de la DPPI en el tratamiento de las complicaciones derivadas de la hipertensión portal y específicamente de la hemorragia por rotura de varices esofágicas2,9-11 y de la ascitis refractaria12,13. Algunos estudios clínicos prospectivos han demostrado que la protección total frente al riesgo de hemorragia por varices tan sólo se consigue cuando el gradiente de presión portocava se reduce a cifras iguales o inferiores a 12 mmHg1. Por ello, la mayoría de autores consideran que al realizar la DPPI el objetivo debe ser obtener un gradiente inferior a 12 mmHg. Las prótesis utilizadas pueden tener un diámetro nominal de 8, 10 o 12 mm (sólo 8 y 10 mm en las prótesis recubiertas de politetrafluoroetileno expandido [e-PTFE]). En nuestra unidad utilizamos habitualmente las prótesis de 10 mm de diámetro. Inicialmente, la prótesis se puede dilatar con un balón de angioplastia de 8 mm. Tras ello, si el gradiente portocava es todavía superior a 12 mmHg la prótesis deberá dilatarse hasta 10 mm. Si a pesar de ello no se logra reducir el gradiente, la colocación de otra prótesis paralela entre otra vena suprahepática y la rama portal del lóbulo hepático opuesto14, la sobredilatación con un balón de 12 mm o bien la administración de fármacos vasoconstrictores del territorio esplácnico5 podrían ser alternativas útiles para lograr un descenso adicional del gradiente de presión portal. En otras ocasiones, la embolización de las colaterales gastroesofágicas podrá ser una buena alternativa adyuvante para detener o prevenir la recidiva hemorrágica.
Una vez se ha conseguido reducir el gradiente de presión portal por debajo de 12 mmHg, la protección frente al desarrollo de complicaciones de la hipertensión portal es prácticamente total1. Sin embargo, si se produce la estenosis u oclusión de la DPPI, el gradiente de presión portal aumenta de nuevo reapareciendo el riesgo de presentar complicaciones. Este hecho es muy frecuente con la utilización de prótesis no recubiertas, y la probabilidad anual de presentar disfunción de la DPPI es superior al 60% al año de seguimiento1,5,15. La disfunción puede detectarse clínicamente por la reaparición de las manifestaciones secundarias a la hipertensión portal. Ello implica un riesgo para el paciente (p. ej., recidiva hemorrágica) y, por ello, se han utilizado varias estrategias para su detección precoz. Una de estas estrategias es la cateterización repetida de la DPPI con medición de presiones. Esta prueba, que es el patrón de referencia para detectar la disfunción, es altamente sensible y específica, pero invasiva y costosa. Recientemente, hemos descrito la utilidad de parámetros obtenidos fácilmente durante la US-Doppler para detectar la disfunción de la DPPI. El hallazgo de una velocidad de flujo portal inferior a 28 cm/s, un flujo portal en las ramas intrahepáticas portales hepatopetal y/o la presencia de ascitis en pacientes en los que ésta había desaparecido previamente tiene una sensibilidad superior al 90% y una especificidad aproximadamente del 50% detectando una disfunción de la DPPI15. La capacidad de estos parámetros para detectar una disfunción era similar, independientemente de que las prótesis utilizadas fueran recubiertas o no15.
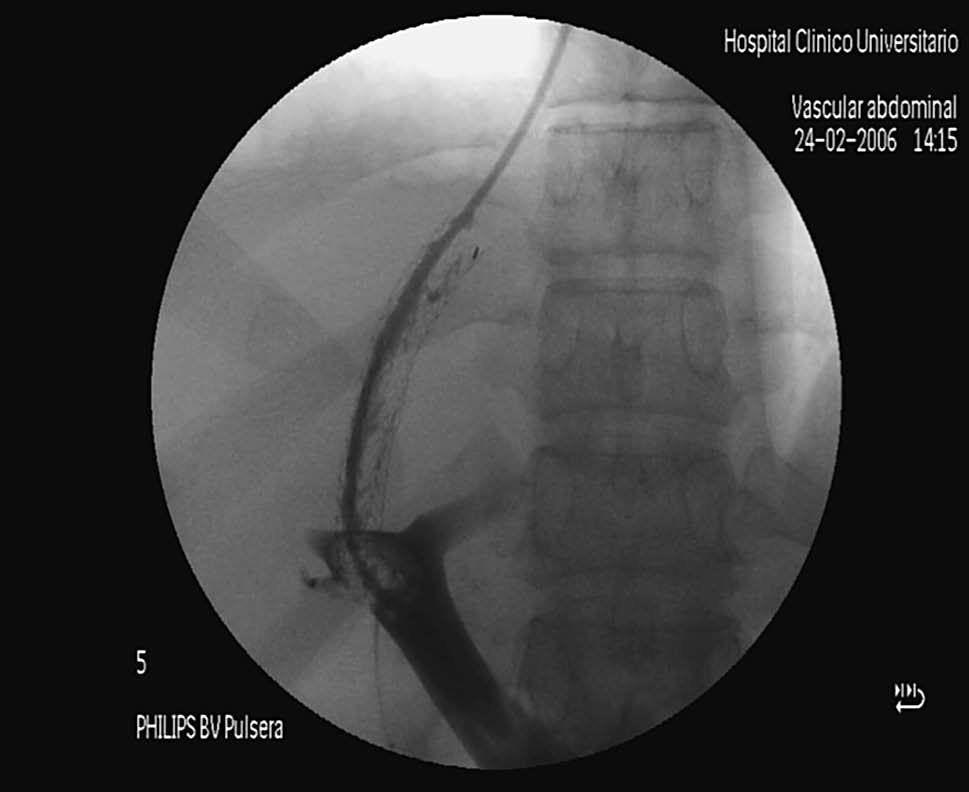
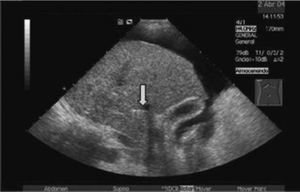
A pesar de este seguimiento próximo, todavía un número considerable de pacientes presentarán nuevamente complicaciones de la hipertensión portal, lo que disminuye la eficacia clínica de la DPPI. Cuando la disfunción se produce en las primeras semanas usualmente es secundaria a una trombosis (fig. 3). Con mayor frecuencia la disfunción ocurre más tardíamente (a los 6-12 meses tras su colocación), debido a que la malla metálica que forma la prótesis se recubre progresivamente por fibras colágenas revestidas por una capa única de células endoteliales, formando una «seudoíntima». Esta cobertura es muy efectiva, ya que previene la trombosis, que es extraordinariamente infrecuente después de las primeras semanas. Sin embargo, esta seudoíntima puede proliferar estrechando la prótesis hasta su total oclusión16.
Fig. 3. Imagen de obstrucción total de derivación portosistémica, percutánea e intrahepática por trombosis de ésta.
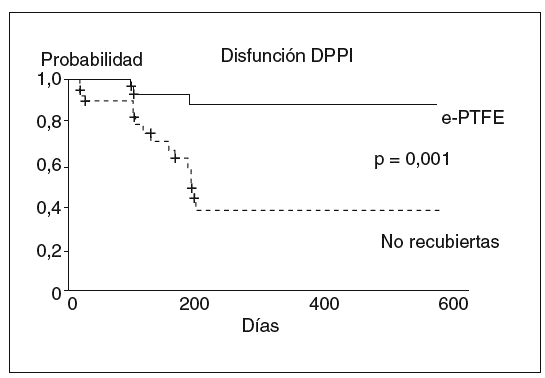
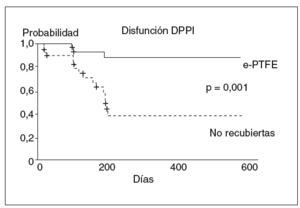
La utilización de prótesis de Dacron® no mejora la incidencia de disfunción17,18. Ello parece deberse al alto poder trombogénico de este material. Sin embargo, la utilización de prótesis recubiertas con e-PTFE (fig. 4) ha mostrado ser útil para disminuir la incidencia de disfunción, al evitar el desarrollo de la hiperplasia de la seudoíntima19,20. Un reciente estudio prospectivo y aleatorizado21, que compara la utilización de prótesis no recubiertas frente a las prótesis recubiertas con PTFE, ha demostrado claramente que el uso de prótesis recubiertas de PTFE disminuye la tasa de disfunción de la DPPI (fig. 5), el número de recidivas clínicas y el número de reintervenciones necesarias para mantener la permeabilidad de la DPPI en el seguimiento. Esta mayor eficacia no se acompaña de un aumento en la incidencia de complicaciones asociadas a la DPPI ni tampoco de la incidencia de encefalopatía hepática. Así, aunque en algunas series iniciales retrospectivas y no controladas se había sugerido una mayor incidencia de encefalopatía hepática con el uso de las prótesis PTFE frente a las no recubiertas22, estos datos no han sido confirmados23-25. En realidad, el único estudio prospectivo y aleatorizado publicado hasta la actualidad, que compara las prótesis de PTFE frente a las prótesis no recubiertas, mostró incluso una tendencia a una menor incidencia de encefalopatía hepática en el grupo tratado con prótesis de PTFE21. Esta menor incidencia de encefalopatía llega a ser significativa al prolongar el seguimiento de los pacientes26. Esta menor incidencia de encefalopatía se ha atribuido al menor número de complicaciones que presentan los pacientes tratados con prótesis recubiertas, como la hemorragia variceal, la recidiva de la ascitis con requerimientos de diuréticos y la posibilidad de desarrollar peritonitis bacteriana espontánea, etc. Todas estas situaciones pueden actuar como desencadenantes de encefalopatía. Además, habitualmente cuando aparece una disfunción de la DPPI se adoptan medidas dirigidas a restablecer la permeabilidad de la prótesis, lo que hace desaparecer el riesgo complicaciones de la hipertensión portal pero reaparecer el riesgo de encefalopatía21. La influencia que puede tener el uso de las prótesis recubiertas sobre la supervivencia no está clara. El estudio controlado y aleatorizado de Bureau et al21 mostró una tendencia no significativa favorable a las prótesis recubiertas. Esta mejoría sí que fue significativa en un estudio de dos cohortes de pacientes tratados con prótesis recubiertas y no recubiertas, respectivamente27.
Fig. 4. Imagen de prótesis recubierta de politetrafluoroetileno (Viator®).
Fig. 5. Probabilidad actuarial de presentar disfunción en pacientes con hipertensión portal tratados con prótesis recubiertas de politetrafluoroetileno y prótesis no recubiertas. DPPI: derivación portosistémica, percutánea e intrahepática; e-PTFE: prótesis recubiertas de politetrafluoroetileno expandido.
Todos los datos anteriormente expuestos nos llevan a considerar las prótesis recubiertas con e-PTFE con preferencia respecto a las no recubiertas en el manejo de las complicaciones de la hipertensión portal. El mayor problema de estas prótesis es su elevado precio. No obstante, si bien no hay estudios de coste-eficacia que hayan comparado ambas alternativas, es posible que el menor número de ingresos por recidivas clínicas, así como el menor número de exploraciones para corregir las disfunciones, pueda equilibrar la diferencia de coste entre ambos procedimientos.
Otra situación en la que la utilización de prótesis recubiertas parece ofrecer una clara ventaja sobre el uso de las prótesis convencionales es en el tratamiento del síndrome de Budd-Chiari. Un reciente estudio de dos cohortes de pacientes con este síndrome, uno de ellos tratados con prótesis recubiertas de PTFE y otro con prótesis no recubiertas, mostró que la probabilidad de disfunción de la DPPI era claramente inferior en el grupo que recibió prótesis recubiertas, y ello se asociaba con un menor número de reintervenciones para mantener la permeabilidad28.
Actualmente las indicaciones aceptadas para la realización de una DPPI son el tratamiento de episodios agudos de hemorragia por varices esofágicas que no pueden ser controladas con tratamiento farmacológico y endoscópico (esclerosis o ligadura endoscópica de las varices) y en los pacientes en que la hemorragia recidiva en dos o más ocasiones, a pesar de haber sido instaurado un tratamiento farmacológico y escleroterápico para la prevención de la recidiva29. La DPPI es también muy eficaz en el control de la ascitis refractaria; sin embargo, también conlleva una alta incidencia de encefalopatía. Por ello, se aconseja reservar la DPPI para los pacientes en quienes la ascitis esté tabicada o no toleren las paracentesis evacuadoras repetidas con administración de seroalbúmina y presenten una función hepática relativamente conservada30. No obstante, es muy posible que con la introducción de las nuevas prótesis recubiertas de e-PTFE en los próximos años se amplíen las indicaciones de la DPPI en el tratamiento de las complicaciones de la hipertensión portal.