El dolor torácico no cardíaco (DTNC) representa frecuentemente un problema diagnóstico y terapéutico complejo. Dado que la enfermedad por reflujo gastroesofágico (ERGE) es la causa más frecuente de DTNC, se ha propuesto la estrategia clínica de tratar con doble dosis de inhibidores de la bomba de protones (IBP) a todos los pacientes con DTNC, y reservar el estudio funcional únicamente para los pacientes que no respondan al tratamiento antisecretor. El objetivo del presente estudio es aportar evidencias de la utilidad clínica del test con doble dosis de pantoprazol en pacientes con DTNC.
Pacientes y métodosEstudio de rendimiento diagnóstico con diseño de cohortes en pacientes con DTNC remitidos por el Servicio de Cardiología. A todos los pacientes se les realizó endoscopia digestiva alta, manometría esofágica y pHmetría esofágica de 24h antes del test de IBP con pantoprazol 40mg cada 12h durante un mes. Antes y después del tratamiento se evaluó la severidad (intensidad y frecuencia) del dolor torácico, la calidad de vida y la ansiedad y depresión mediante cuestionarios. El diagnóstico de ERGE se basó en la pHmetría de 24h y se estableció por el criterio del porcentaje total de tiempo con un pH<4 superior al 4,2% Se consideró respondedor al test de IBP si la mejoría del dolor torácico después de un mes de tratamiento con IBP fue >50% respecto a la puntuación basal.
ResultadosSe incluyeron 30 pacientes consecutivos (17hombres/13mujeres) con una media de edad de 49años. Presentaban ERGE 20 de los 30 pacientes con DTNC (67%; IC95%: 47-83%). Fueron respondedores al tratamiento con IBP 13 de los 30 (43%) pacientes con DTNC: 11 de los 20 (55%) pacientes del grupo ERGE-positivo y 2 de los 10 (20%) del grupo ERGE-negativo. La sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión del test de IBP fue del 55, del 80, del 85, del 47 y del 63%, respectivamente.
El grupo ERGE-positivo con respecto al grupo ERGE-negativo presentó una reducción significativa del dolor torácico postratamiento con pantoprazol (p=0,003) y una mejoría en la ansiedad y depresión que no alcanzó la significación estadística. La calidad de vida no se vio afectada.
ConclusionesEn el DTNC, el test de IBP con pantoprazol tiene una baja sensibilidad para el diagnóstico de la ERGE y cuestiona reservar el estudio funcional únicamente para los pacientes que no respondan al tratamiento antisecretor. El estudio funcional permitiría un diagnóstico inicial más preciso y ofrecer un tratamiento dirigido más adecuado a todos los pacientes con DTNC.
Noncardiac chest pain (NCCP) often represents a diagnostic and therapeutic challenge. Given that gastroesophageal reflux disease (GERD) is the most common cause of NCCP, initial treatment with proton-pump inhibitors (PPI) has been proposed for all patients (PPI testing), reserving esophageal function testing solely for non-responders. The aim of the present study was to provide evidence on the clinical utility of PPI testing with high-dose pantoprazole in patients with NCCP.
Patients and methodsWe carried out a study of diagnostic performance with a cohort design in patients with NCCP, who had been assessed by the Cardiology Service. All patients underwent upper endoscopy, esophageal manometry, and 24h esophageal pH monitoring before PPI testing with pantoprazole 40mg every 12h for 1month. Before and after treatment, we assessed the severity (intensity and frequency) of chest pain, quality of life, and anxiety and depression by means of specific questionnaires. The diagnosis of GERD was based on a pathological finding of esophageal pH monitoring. A positive response to PPI testing was defined as an improvement in chest pain >50% compared with the baseline score after 1month of PPI therapy.
ResultsWe included 30 consecutive patients (17men/13women) with a mean age of 49years. Of these 30 patients, 20 with NCCP had GERD (67%, 95%CI: 47%-83%). A positive response to PPI therapy was observed in 13 of the 30 (43%) patients with NCCP: 11 of the 20 (55%) patients in the GERD-positive group and 2 of the 10 (20%) in the GERD-negative group. The sensitivity, specificity, positive predictive value, negative predictive value, and accuracy of PPI testing was 55%, 80%, 85%, 47% and 63%, respectively. A significant reduction in chest pain after pantoprazole therapy (P=.003) and a slight non significant improvement in anxiety and depression was achieved in the GERD-positive group as compared to the GERD-negative group.
ConclusionsIn NCCP, PPI testing with pantoprazole has a low sensitivity for the diagnosis of GERD, placing in doubt the strategy of reserving functional study to non-responders to antisecretory therapy. Esophageal function testing and accurate diagnosis would allow appropriate targeted therapy for all patients with NCCP.
Los pacientes con dolor torácico no cardíaco (DTNC) representan frecuentemente un problema diagnóstico y terapéutico complejo. Estudios poblacionales han estimado una prevalencia del DTNC en torno al 13%1, y en España en torno al 10%2. Estudios complementarios adicionales pueden establecer el diagnóstico de la causa del dolor torácico, incluyendo enfermedad por reflujo gastroesofágico (ERGE), trastornos motores esofágicos, hipersensibilidad esofágica, alteraciones musculoesqueléticas o trastornos psiquiátricos. No obstante, es importante destacar que en muchos casos no se puede identificar la causa exacta del dolor torácico, y por tanto no se consigue llegar a un diagnóstico etiológico definitivo3. Ante este escenario, el DTNC está asociado con un elevado coste económico como resultado del elevado número de visitas al médico y a las unidades de urgencias, así como con del absentismo laboral4. Además, el DTNC tiene un impacto negativo en la calidad de vida de los pacientes5.
Dado que la ERGE es la causa más frecuente de DTNC, es una práctica clínica habitual tratar de entrada con doble dosis de inhibidores de la bomba de protones (IBP) (ensayo terapéutico, también llamado test de IBP) a los pacientes con DTNC6, y reservar el estudio funcional únicamente para los pacientes que no respondan al tratamiento antisecretor6. De hecho, siguiendo esta aproximación se han realizado estudios con distintos IBP, incluyendo omeprazol7, lansoprazol8,9 y rabeprazol10, aunque el diferente diseño y procedimiento de estos estudios hace difícil poder llegar a estandarizar las dosis de IBP y la duración del tratamiento. Por otro lado, los resultados de 2 metaanálisis recientes sugieren que el test de IBP es una herramienta adecuada para identificar el DTNC relacionado con la ERGE, con una sensibilidad del 80% y una especificidad del 74%11,12. En línea a lo mencionado, estos metaanálisis no están exentos de controversia, dado que incluían ensayos clínicos heterogéneos, con tamaño muestral pequeño y evaluaban diferentes IBP y distintas dosis. Además, los criterios utilizados para definir ERGE o evaluar la respuesta al test de IBP eran diferentes entre estudios. Todo ello no permite alcanzar conclusiones definitivas y robustas, y cuestiona la utilidad del ensayo terapéutico de IBP en pacientes con DTNC6.
Por lo tanto, el objetivo de este estudio es aportar evidencias sobre la sensibilidad y la especificidad de la respuesta al tratamiento con doble dosis de IBP (ensayo terapéutico) en pacientes con DTNC diagnosticados de ERGE mediante pHmetría esofágica de 24h. Además, se ha estimado la prevalencia de ERGE en pacientes con DTNC en nuestro medio y el impacto del tratamiento con doble dosis de IBP en la comorbilidad que acompaña al dolor torácico no cardíaco (calidad de vida, y ansiedad y depresión).
Pacientes y métodosDiseño del estudioEstudio de rendimiento diagnóstico con diseño de cohortes, unicéntrico, de pacientes en primera visita en el Servicio de Digestivo por dolor torácico no cardíaco y remitidos por el Servicio de Cardiología del mismo hospital.
El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica del centro. Todos los pacientes dieron su consentimiento informado por escrito antes de proceder con las exploraciones contempladas en el protocolo. Este estudio se realizó de acuerdo a lo establecido en la Declaración de Helsinki y a la Ley orgánica 15/1999 de protección de datos de carácter personal.
Población a estudioLos pacientes incluidos en este estudio fueron referidos por el Servicio de Cardiología después de que se les realizara una evaluación cardíaca exhaustiva que incluía: anamnesis adecuada, exploración física, ECG basal de 12 derivaciones, analítica de control en la que se evidenciara normalidad de las enzimas cardíacas, y una prueba ergométrica graduada que no mostrara cambios de isquemia con el esfuerzo.
Criterios de inclusión: pacientes de ambos sexos, de 18años o mayores, con dolor torácico no cardíaco con una frecuencia de al menos una vez a la semana en el último mes, y en primera visita en el Servicio de Digestivo.
Criterios de exclusión: pacientes con historia de úlcera péptica o cirugía gastrointestinal; en tratamiento con IBP o anti-H2 por lo menos 10días antes de iniciar el estudio digestivo; enfermedad pulmonar, renal, hematológica o hepática grave o cualquier otra comorbilidad subyacente grave; rechazo a participar en el estudio (o a la realización de las pruebas digestivas contempladas en el protocolo [endoscopia digestiva alta, manometría esofágica, pHmetría esofágica de 24h o a la toma de los IBP por el tiempo pautado], o a rellenar los cuestionarios entregados).
Se recogió la siguiente información: cuestionarios (de características sociodemográficas e historia clínica; de puntuación de síntomas; de calidad de vida, y de ansiedad y depresión) y estudio digestivo (endoscopia digestiva alta; manometría esofágica y pHmetría esofágica de 24h).
Estudio basal (pretratamiento)- 1)
Cuestionario estandarizado de características sociodemográficas e historia clínica. Todos los pacientes cumplimentaron el cuestionario antes de ser atendidos en la primera visita. Referente a las características sociodemográficas se recogía la siguiente información: edad, sexo, talla, peso, índice de masa corporal, hábito tabáquico y alcohólico. Referente a la historia médica se recogía: presencia de síntomas típicos del reflujo (pirosis y regurgitación) y tiempo de evolución del dolor torácico. El especialista del Servicio de Digestivo que visitó al paciente en primera visita cotejó la información del cuestionario.
- 2)
Cuestionario de puntuación de dolor torácico7. El dolor torácico se evaluó mediante la puntuación de su intensidad y de su frecuencia. La intensidad del dolor se puntuó mediante una de las siguientes 5 categorías: 1: ausente (sin síntomas); 2: leve (fácilmente tolerado y que dura pocos minutos); 3: moderado (causa alguna molestia pero no interfiere con las actividades de la vida diaria); 4: severo (causa mucho malestar e interfiere con las actividades habituales de la vida diaria), y 5: incapacitante (insoportable y que interfiere de forma considerable con las actividades habituales de la vida diaria). La frecuencia del dolor se puntuó mediante una de las siguientes 4 categorías: 1: ninguna; 2: pocas veces (1-3 veces al mes); 3: frecuente (al menos una vez a la semana), y 4: muy frecuente (al menos una vez al día). La puntuación del dolor torácico se obtuvo multiplicando la intensidad por la frecuencia. La puntuación máxima que se podía obtener es de 20, lo que indica la máxima gravedad posible.
- 3)
Cuestionario de calidad de vida: Cuestionario de Salud SF-36, versión validada al español13. Este cuestionario comprende 36 ítems y las siguientes escalas: función física, rol físico, dolor corporal, salud general, vitalidad, función social, rol emocional, salud mental e ítem de transición de salud. Las escalas del SF-36 están ordenadas de forma que a mayor puntuación, mejor es el estado de salud.
- 4)
Cuestionario de Ansiedad y Depresión Hospitalaria (HAD) validado al español14. Este cuestionario autoadministrado consta de 14 ítems, integrado por 2 subescalas de 7 ítems: una de ansiedad y otra de depresión. La intensidad o frecuencia del ítem se evalúa en una escala de Likert de 4 puntos (rango 0-3). Ambas subescalas tiene los mismos puntos de corte: 0-7: normal; 8-10: dudoso; 11: problema clínico.
- 5)
Endoscopia digestiva alta. Para evaluar las anormalidades de la mucosa del esófago, a todos los pacientes incluidos en el estudio se les realizó este procedimiento con un gastroscopio Pentax, en ayunas de al menos 8h en la Unidad de Endoscopias. La porción distal del esófago fue evaluada cuidadosamente para determinar la presencia de daño en la mucosa, que se evaluó según la clasificación de Los Ángeles para la esofagitis por reflujo15.
- 6)
Manometría esofágica y pHmetría de 24h. Se realizó una manometría esofágica de acuerdo a las guías establecidas, antes de realizar el estudio de monitorización de pH. La manometría esofágica fue realizada utilizando un equipo sistema de perfusión de agua, con una sonda de 4,5mm de diámetro y 4 canales separados 5cm entre cada uno de ellos (Dentsleeve Esophageal LES sleeve catheter; Medtronics, Minneapolis, EE.UU.). La prueba se realizó con el paciente en decúbito supino y sirvió para localizar el borde superior del esfínter esofágico inferior (EEI). El estudio de monitorización de pH se realizó de forma ambulatoria, con una sonda con un electrodo de pH de antimonio en la parte distal, que se pasó a través del orificio nasal y se localizó a 5cm por encima del borde superior del EEI (Digitrapper MKIII; Medtronics, Minneapolis, EE.UU.). Los pacientes fueron instruidos para que registrasen en un folio previamente estructurado las horas de las comidas, de cambios de posición y tipo de síntomas. A los pacientes se les indicó que realizasen sus actividades de forma rutinaria y que mantuvieran el mismo tipo de dieta. Antes de cada estudio, los electrodos y el sistema fueron calibrados en soluciones a pH de 1 y a pH de 7, de forma estandarizada previamente.
Basado en la pHmetría esofágica de 24h, se definió que un paciente presentaba o no presentaba una ERGE (ERGE-positivo y ERGE-negativo). ERGE-positivo se definió como el porcentaje total de tiempo con un pH<4 de más de 4,2%16. El análisis de los datos registrados se llevó a cabo utilizando un software estándar (Gastrotrac™, versión 4.3. Alpine Biomed Co., Dinamarca).
Ensayo terapéutico: tratamiento con inhibidor de la bomba de protonesUna vez finalizada la evaluación basal, todos los pacientes iniciaron el tratamiento con pantoprazol 80mg/día: 40mg en ayunas por la mañana antes del desayuno y 40mg en la noche antes de la cena durante un mes. No se informó a los pacientes de la presencia de ERGE (ERGE-positivo o ERGE-negativo) con el objetivo de mantenerlos cegados hasta el final del estudio.
Estudio de seguimiento (postratamiento)Esta visita se realizó al mes de iniciar el tratamiento con IBP, y se recogió la siguiente información siguiendo el mismo procedimiento que en la evaluación basal:
- 1)
Cuestionario de puntuación de dolor torácico7. Basado en las puntuaciones de este cuestionario, se definió como respondedor al tratamiento con pantoprazol el paciente que presentara una reducción >50% en la puntuación de los síntomas al final del tratamiento con respecto al basal.
- 2)
Cuestionario de calidad de vida: cuestionario de Salud SF-36, versión validada al español13.
- 3)
Cuestionario de Ansiedad y Depresión Hospitalaria (HAD) validado al español14.
Dado el carácter exploratorio de este estudio, no se realizó un cálculo formal del tamaño muestral que permitiera conocer la sensibilidad y la especificidad del ensayo terapéutico (test de IBP) como prueba de diagnóstico de ERGE frente a la pHmetría esofágica de 24h. El tamaño muestral quedó definido por el número de pacientes consecutivos que acudieron en primera visita al servicio de digestivo, remitidos por el servicio de cardiología de nuestro hospital durante un periodo de 12meses.
Se realizó un análisis descriptivo de las variables del estudio. Las variables continuas fueron descritas como media y desviación estándar (DE) o mediana y rango (mínimo-máximo), y las variables categóricas como frecuencias absolutas y porcentajes. Se calculó la prevalencia de ERGE en pacientes con DTNC, y la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo del ensayo terapéutico (dosis altas con IBP) como prueba de diagnóstico de ERGE frente la pHmetría esofágica de 24h. También se calcularon los intervalos de confianza del 95% (IC95%). Asimismo, se utilizaron para estudiar la relación entre variables la prueba de Fisher (o de chi-cuadrado) para variables nominales, y la prueba de U de Mann-Whitney para variables ordinales y para variables continuas no gaussianas. Además, también se exploró el cambio entre final de tratamiento y basal en el mismo grupo para variables continuas mediante la prueba de t de Wilcoxon. Un valor de p≤0,05 se considerará estadísticamente significativo. El análisis de datos se realizó con el programa SPSS versión 21.0 (SPSS Inc., Chicago, Illinois, EE.UU.).
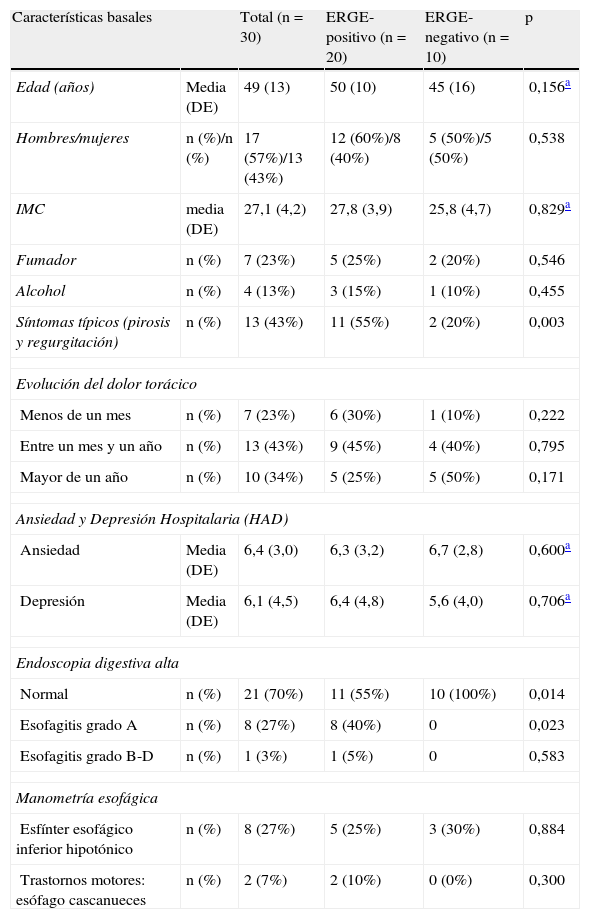
ResultadosCaracterísticas basalesEntre octubre de 2011 y septiembre de 2012, un total de 30 pacientes consecutivos con DTNC fueron incluidos en este estudio: 17 hombres y 13 mujeres con una media (DE) de edad de 49 (13) años. En la tabla 1 se presenta las características basales de la población estudiada, estratificada por el diagnóstico de ERGE mediante pHmetría esofágica de 24h. En el momento basal no se observaron diferencias entre los grupos ERGE-positivo y ERGE-negativo con respecto a la edad, sexo, IMC, hábito tabáquico, consumo de alcohol, puntuación de ansiedad y depresión, síntomas (dolor torácico) (tabla 2), y calidad de vida (tabla 3). En cambio, la proporción de síntomas típicos de ERGE (pirosis y/o regurgitación) y los hallazgos endoscópicos (esofagitis) fue mayor en el grupo de pacientes con DTNC y ERGE-positivo que en el grupo de pacientes con DTNC y ERGE-negativo. Además, el tiempo de evolución del dolor torácico fue menor en el grupo de pacientes con DTNC y ERGE-positivo que en el grupo con DTNC y ERGE-negativo.
Características basales
| Características basales | Total (n=30) | ERGE-positivo (n=20) | ERGE-negativo (n=10) | p | |
| Edad (años) | Media (DE) | 49 (13) | 50 (10) | 45 (16) | 0,156a |
| Hombres/mujeres | n (%)/n (%) | 17 (57%)/13 (43%) | 12 (60%)/8 (40%) | 5 (50%)/5 (50%) | 0,538 |
| IMC | media (DE) | 27,1 (4,2) | 27,8 (3,9) | 25,8 (4,7) | 0,829a |
| Fumador | n (%) | 7 (23%) | 5 (25%) | 2 (20%) | 0,546 |
| Alcohol | n (%) | 4 (13%) | 3 (15%) | 1 (10%) | 0,455 |
| Síntomas típicos (pirosis y regurgitación) | n (%) | 13 (43%) | 11 (55%) | 2 (20%) | 0,003 |
| Evolución del dolor torácico | |||||
| Menos de un mes | n (%) | 7 (23%) | 6 (30%) | 1 (10%) | 0,222 |
| Entre un mes y un año | n (%) | 13 (43%) | 9 (45%) | 4 (40%) | 0,795 |
| Mayor de un año | n (%) | 10 (34%) | 5 (25%) | 5 (50%) | 0,171 |
| Ansiedad y Depresión Hospitalaria (HAD) | |||||
| Ansiedad | Media (DE) | 6,4 (3,0) | 6,3 (3,2) | 6,7 (2,8) | 0,600a |
| Depresión | Media (DE) | 6,1 (4,5) | 6,4 (4,8) | 5,6 (4,0) | 0,706a |
| Endoscopia digestiva alta | |||||
| Normal | n (%) | 21 (70%) | 11 (55%) | 10 (100%) | 0,014 |
| Esofagitis grado A | n (%) | 8 (27%) | 8 (40%) | 0 | 0,023 |
| Esofagitis grado B-D | n (%) | 1 (3%) | 1 (5%) | 0 | 0,583 |
| Manometría esofágica | |||||
| Esfínter esofágico inferior hipotónico | n (%) | 8 (27%) | 5 (25%) | 3 (30%) | 0,884 |
| Trastornos motores: esófago cascanueces | n (%) | 2 (7%) | 2 (10%) | 0 (0%) | 0,300 |
Prueba de la χ2.
Prueba exacta de Fischer.
Cuestionario de dolor torácico pre y postratamiento con pantoprazol
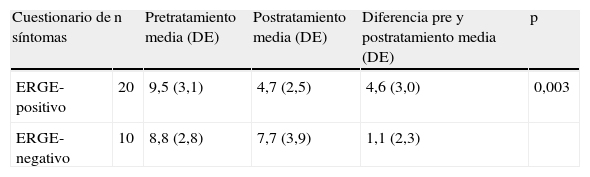
| Cuestionario de síntomas | n | Pretratamiento media (DE) | Postratamiento media (DE) | Diferencia pre y postratamiento media (DE) | p |
| ERGE-positivo | 20 | 9,5 (3,1) | 4,7 (2,5) | 4,6 (3,0) | 0,003 |
| ERGE-negativo | 10 | 8,8 (2,8) | 7,7 (3,9) | 1,1 (2,3) |
| ERGE-positivo n=20 | ERGE-negativo n=10 | ||||
| Pretratamiento | Postratamiento | Pretratamiento | Postratamiento | ||
| Intensidad | |||||
| Ausente | n (%) | 0 (0%) | 4 (20%) | 0 (0%) | 0 (0%) |
| Leve | n (%) | 1 (5%) | 9 (45%) | 1 (10%) | 4 (40%) |
| Moderado | n (%) | 11 (55%) | 5 (25%) | 5 (50%) | 3 (30%) |
| Severo | n (%) | 6 (30%) | 2 (10%) | 3 (30%) | 2 (20%) |
| Incapacitante | n (%) | 2 (10%) | 0 (0%) | 1 (10%) | 1 (10%) |
| Frecuencia | |||||
| Ninguna | n (%) | 0 (0%) | 2 (10%) | 0 (0%) | 0 (0%) |
| Pocas veces | n (%) | 8 (40%) | 15 (75%) | 4 (40%) | 6 (60%) |
| Frecuente | n (%) | 9 (45%) | 3 (15%) | 6 (60%) | 3 (30%) |
| Muy frecuente | n (%) | 3 (15%) | 0 (0%) | 0 (0%) | 1 (10%) |
Prueba T de Wilcoxon.
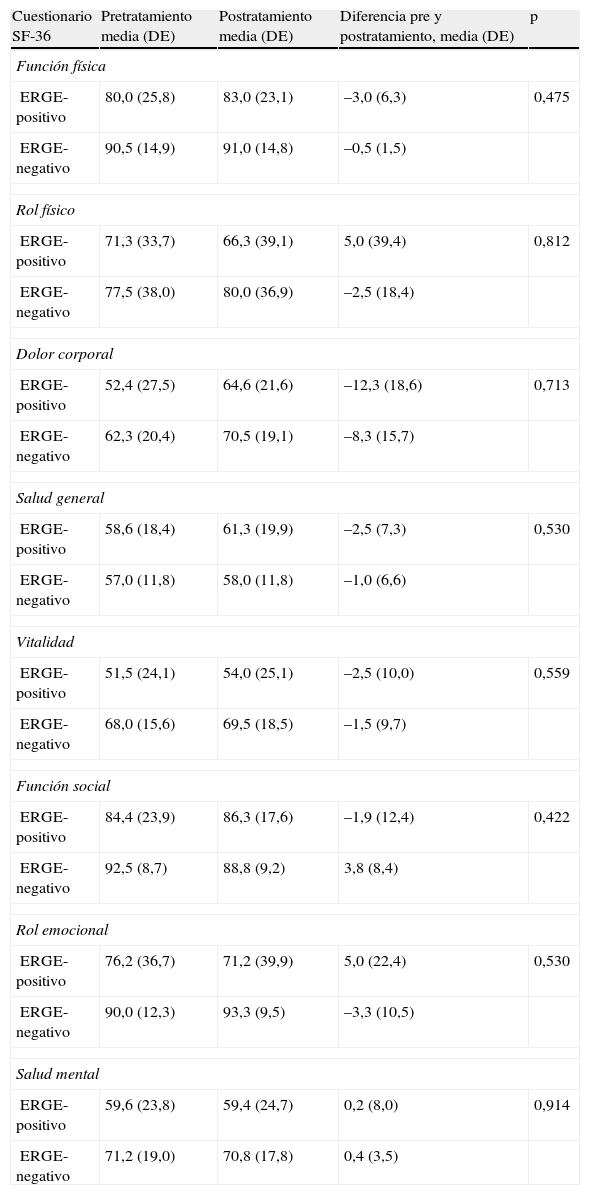
Efecto del tratamiento con pantoprazol en la calidad de vida evaluada mediante el SF-36
| Cuestionario SF-36 | Pretratamiento media (DE) | Postratamiento media (DE) | Diferencia pre y postratamiento, media (DE) | p |
| Función física | ||||
| ERGE-positivo | 80,0 (25,8) | 83,0 (23,1) | –3,0 (6,3) | 0,475 |
| ERGE-negativo | 90,5 (14,9) | 91,0 (14,8) | –0,5 (1,5) | |
| Rol físico | ||||
| ERGE-positivo | 71,3 (33,7) | 66,3 (39,1) | 5,0 (39,4) | 0,812 |
| ERGE-negativo | 77,5 (38,0) | 80,0 (36,9) | –2,5 (18,4) | |
| Dolor corporal | ||||
| ERGE-positivo | 52,4 (27,5) | 64,6 (21,6) | –12,3 (18,6) | 0,713 |
| ERGE-negativo | 62,3 (20,4) | 70,5 (19,1) | –8,3 (15,7) | |
| Salud general | ||||
| ERGE-positivo | 58,6 (18,4) | 61,3 (19,9) | –2,5 (7,3) | 0,530 |
| ERGE-negativo | 57,0 (11,8) | 58,0 (11,8) | –1,0 (6,6) | |
| Vitalidad | ||||
| ERGE-positivo | 51,5 (24,1) | 54,0 (25,1) | –2,5 (10,0) | 0,559 |
| ERGE-negativo | 68,0 (15,6) | 69,5 (18,5) | –1,5 (9,7) | |
| Función social | ||||
| ERGE-positivo | 84,4 (23,9) | 86,3 (17,6) | –1,9 (12,4) | 0,422 |
| ERGE-negativo | 92,5 (8,7) | 88,8 (9,2) | 3,8 (8,4) | |
| Rol emocional | ||||
| ERGE-positivo | 76,2 (36,7) | 71,2 (39,9) | 5,0 (22,4) | 0,530 |
| ERGE-negativo | 90,0 (12,3) | 93,3 (9,5) | –3,3 (10,5) | |
| Salud mental | ||||
| ERGE-positivo | 59,6 (23,8) | 59,4 (24,7) | 0,2 (8,0) | 0,914 |
| ERGE-negativo | 71,2 (19,0) | 70,8 (17,8) | 0,4 (3,5) | |
Prueba T de Wilcoxon.
Basado en la pHmetría esofágica de 24h, la prevalencia de ERGE en pacientes con DTNC fue del 67% (20/30; IC95%: 47-83%).
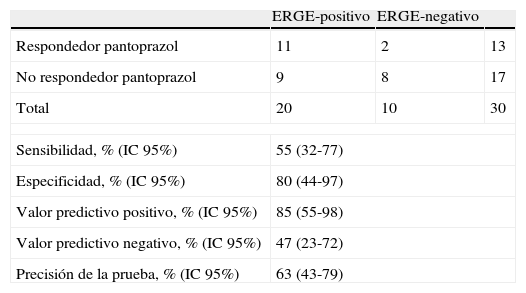
La tabla 4 muestra la sensibilidad, especificidad y los valores predictivos del ensayo terapéutico (Test de IBP) como prueba de diagnóstico de ERGE frente la pHmetría esofágica de 24h.
Valor predictivo de la respuesta de los síntomas mayor del 50% al tratamiento
| ERGE-positivo | ERGE-negativo | ||
| Respondedor pantoprazol | 11 | 2 | 13 |
| No respondedor pantoprazol | 9 | 8 | 17 |
| Total | 20 | 10 | 30 |
| Sensibilidad, % (IC95%) | 55 (32-77) | ||
| Especificidad, % (IC95%) | 80 (44-97) | ||
| Valor predictivo positivo, % (IC95%) | 85 (55-98) | ||
| Valor predictivo negativo, % (IC95%) | 47 (23-72) | ||
| Precisión de la prueba, % (IC95%) | 63 (43-79) | ||
Se consideró respondedor al tratamiento con pantoprazol el paciente que mejoró en >50% la puntuación de los síntomas al final del tratamiento respecto al basal.
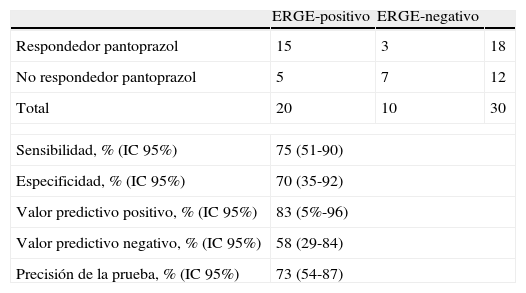
Trece de los 30 (43%) pacientes con DTNC respondieron al tratamiento con pantoprazol (mejoría >50% en la puntuación de los síntomas al final del tratamiento respecto al basal): 11 (55%) pacientes del grupo ERGE-positivo y 2 (20%) del grupo ERGE-negativo, p=0,068. En un análisis post hoc, se evaluó respondedor como aquel paciente con una mejoría >30% en la puntuación de los síntomas al final del tratamiento respecto al basal. Entonces, 18 (60%) pacientes respondieron al tratamiento: 15 (75%) pacientes del grupo ERGE-positivo y 3 (30%) del grupo ERGE-negativo, p=0,018 (tabla 5).
Valor predictivo de la respuesta de los síntomas mayor del 30% al tratamiento
| ERGE-positivo | ERGE-negativo | ||
| Respondedor pantoprazol | 15 | 3 | 18 |
| No respondedor pantoprazol | 5 | 7 | 12 |
| Total | 20 | 10 | 30 |
| Sensibilidad, % (IC95%) | 75 (51-90) | ||
| Especificidad, % (IC95%) | 70 (35-92) | ||
| Valor predictivo positivo, % (IC95%) | 83 (5%-96) | ||
| Valor predictivo negativo, % (IC95%) | 58 (29-84) | ||
| Precisión de la prueba, % (IC95%) | 73 (54-87) | ||
Se consideró respondedor al tratamiento con pantoprazol el paciente que mejoró en >30% la puntuación de los síntomas al final del tratamiento respecto al basal.
En la tabla 2 se presenta las puntuaciones medias de dolor torácico pre- y postratamiento con pantoprazol (cuestionario de puntuación de síntomas, dolor torácico). El grupo de pacientes ERGE-positivo presentaron una reducción clínica y estadísticamente significativa en las puntuaciones de la sintomatología respecto al grupo ERGE-negativo tratado con pantoprazol.
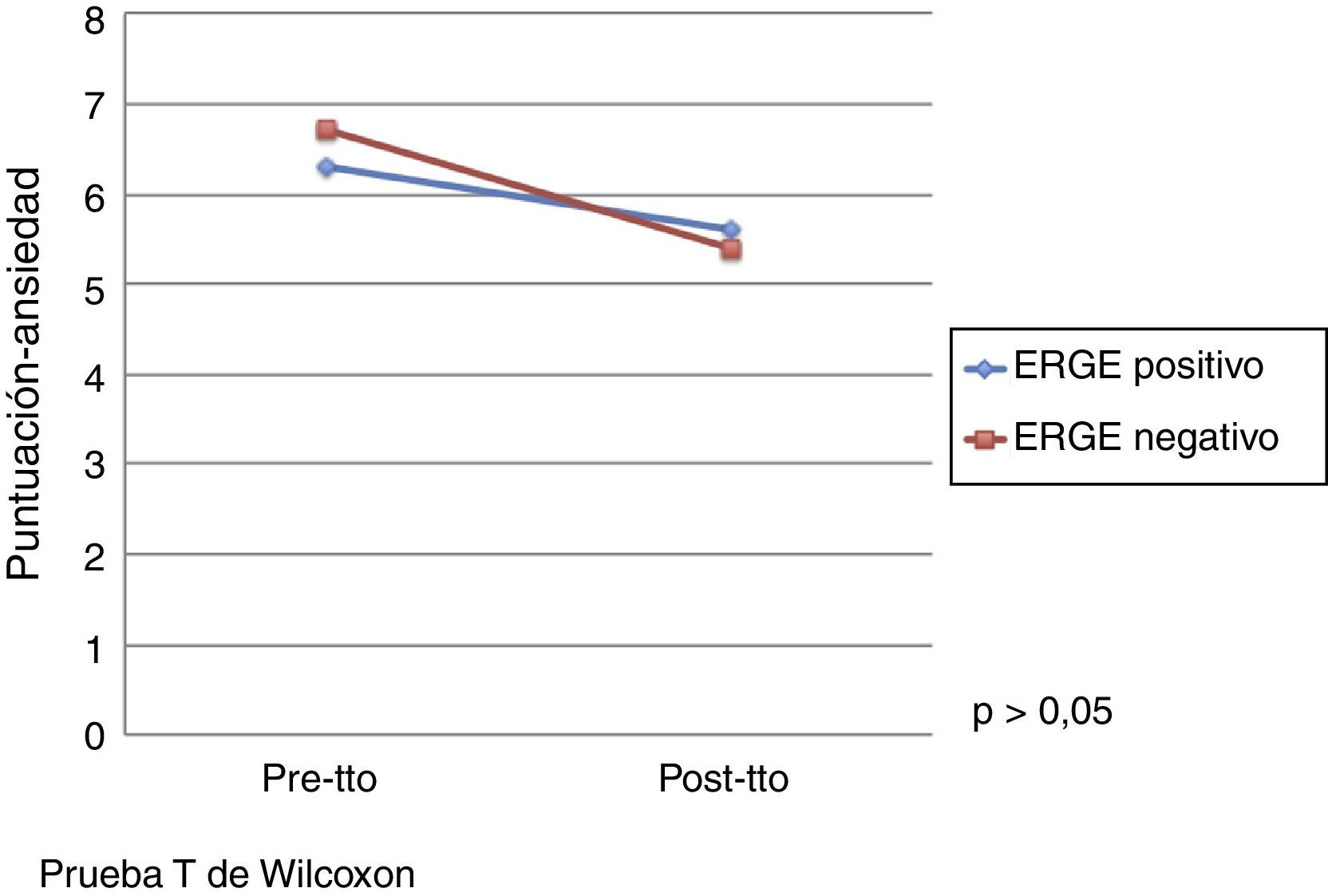
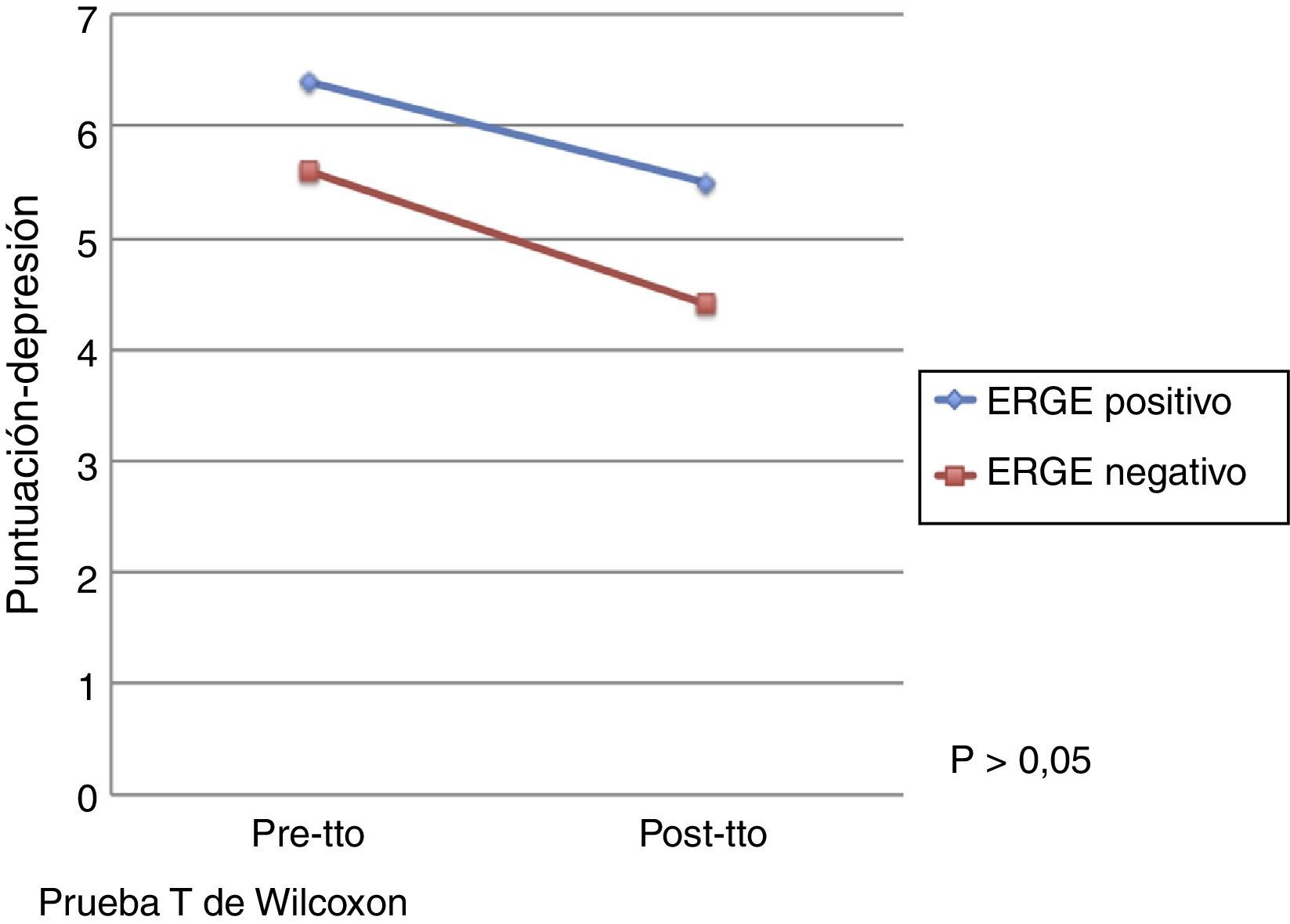
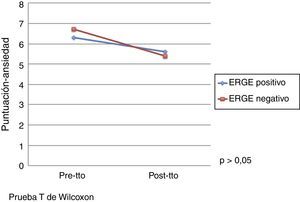
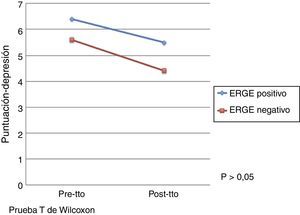
El efecto del tratamiento con pantoprazol en la calidad de vida evaluada por el cuestionario de Salud SF-36 se presenta en la tabla 3. Por otro lado, no se observó un efecto significativo del tratamiento con pantoprazol en ansiedad y depresión evaluado mediante el cuestionario de Ansiedad y Depresión Hospitalaria. No obstante, se observó una mejoría en las puntuaciones de las escalas de ansiedad y depresión después del tratamiento en ambos grupos de tratamiento (figs. 1 y 2).
Nuestros resultados indican que el test de IBP con pantoprazol en el diagnóstico de ERGE en pacientes con DTNC tuvo una sensibilidad del 55%, una especificidad del 80% y una precisión de la prueba del 63%. A nuestro conocimiento, este es el primer estudio en que se utiliza pantoprazol en el test de IBP para el diagnóstico de ERGE en pacientes con DTNC. Se utilizó una posología de pantoprazol de 40mg cada 12h durante un mes. La decisión de tratar durante un mes se basó de acuerdo al criterio de inclusión de que todos los pacientes tenían que haber presentado dolor torácico al menos una vez a la semana en el último mes. Se consideró que este período de tratamiento (un mes) sería suficiente para una valoración adecuada de la respuesta sintomática al tratamiento antisecretor. Aunque no se disponía de información sobre el rendimiento diagnóstico de ERGE del test de IBP utilizando pantoprazol en el DTNC, este IBP se seleccionó porque es ampliamente utilizado en los servicios de cardiología, y en particular en los últimos años, a raíz de la publicación de los datos de seguridad del uso combinado de IBP y antiagregantes (clopidogrel)17.
El ensayo terapéutico con pantoprazol 80mg/día consiguió una mejoría del dolor torácico significativamente superior en el grupo de pacientes con ERGE comparado con el grupo de pacientes sin ERGE. Estos resultados apoyarían la relación causal de la ERGE en el DTNC. Sin embargo, solo un 55% de los pacientes del grupo de DTNC y ERGE se consideraron respondedores al test de IBP, al conseguir este tratamiento una reducción >50% en la puntuación de los síntomas del dolor al final del tratamiento con respecto al basal. Este porcentaje de respondedores solo se incrementaría en un 20% (es decir, 75% de respondedores), si se hubiera aceptado como respondedor una reducción >30% en la puntuación de los síntomas del dolor al final del tratamiento con respecto al basal. Si bien, estos resultados en global apoyarían la relación causal de la ERGE en el DTNC tal como se ha comentado, también ponen de manifiesto que al menos una cuarta parte de los pacientes con ERGE y DTNC tendrían una respuesta negativa en el test de IBP. De hecho, el dolor torácico no mejoró (respuesta negativa al tratamiento con pantoprazol) en 9 de los 20 (45%) pacientes con DTNC y ERGE. Una respuesta negativa al tratamiento antisecretor con IBP en los pacientes con DTNC y ERGE podría atribuirse a un bloqueo insuficiente de la secreción gástrica de ácido. Aunque no se realizó una pHmetría de control durante o al finalizar el mes de tratamiento, estudios previos18,19 han demostrado que dosis similares de pantoprazol consiguen un bloqueo adecuado del ácido. Alternativamente, esta respuesta negativa a IBP también podría explicarse porque otros tipos de reflujo gastroesofágico como el reflujo débilmente ácido o el no ácido también tienen un papel importante en el origen del dolor torácico. Otra posible explicación a este menor porcentaje de respuesta clínica podría estar en que solo el 45% de pacientes con DTNC y ERGE tenían esofagitis. Es conocido que los pacientes con ERGE erosiva tienen una mayor respuesta a los IBP que los pacientes con ERGE no erosiva. En otros estudios, en los que la presencia de esofagitis en pacientes con DTNC fue mayor que en nuestro estudio, la respuesta a IBP osciló entre el 69% y el 75% de los pacientes con DTNC y ERGE7,10. Otra causa de falta de respuesta podría ser la presencia de un trastorno motor esofágico asociado. De hecho, en nuestro estudio dos pacientes con ERGE y DTNC presentaron esófago de cascanueces, sin embargo ambos pacientes tuvieron una respuesta positiva a los IBP. La manometría no identificó otros trastornos motores esofágicos primarios en nuestro estudio.
Ante esta importante respuesta negativa al test de IBP en pacientes con DTNC y ERGE, la pHmetría con impedancia podría clarificar el papel del reflujo débilmente ácido o no ácido y establecer el diagnóstico de certeza en estos pacientes. Por otro lado, nuestros resultados también indican que hay un subgrupo pacientes con DTNC sin ERGE y respuesta positiva al test de IBP. Concretamente esto ocurrió en 2 de los 10 pacientes (20%) con DTNC sin ERGE, lo que representa uno de cada 5 pacientes. Esta respuesta positiva al tratamiento con IBP sin ERGE podría ser explicada por el efecto que tiene el tratamiento antisecretor en pacientes con hipersensibilidad esofágica o por el efecto placebo en pacientes con pirosis funcional. Es importante mencionar que aunque las características basales de estos dos pacientes fueron similares a las del resto del grupo, estos dos pacientes sin ERGE «respondedores al test de IBP» presentaban un esfínter esofágico inferior (EEI) hipotónico, mientras que este diagnóstico (EEI hipotónico) solo estuvo presente en 1 de los 8 pacientes con DTNC y sin ERGE «no respondedores al test de IBP». En este sentido, los datos disponibles en la actualidad avalan que la pHmetría con impedancia permitiría establecer en estos pacientes el papel del reflujo débilmente ácido o no ácido20 y permitiría diferenciar entre hipersensibilidad del esófago (pacientes que se beneficiaría del potente tratamiento antisecretor) o pirosis funcional (pacientes que no se beneficiaría del potente tratamiento antisecretor, es decir, el tratamiento con IBP es ineficaz). Del mismo modo, la manometría esofágica de alta resolución, que permite detectar espasmos esofágicos segmentarios21, podría ayudar a identificar otras posibles etiologías.
Nosotros llevamos a cabo el test de IBP en todos los pacientes con DTNC con o sin ERGE, los pacientes sin ERGE sirvieron como grupo control, con el objetivo de neutralizar el efecto del tratamiento con placebo. En estudios previos, la sensibilidad del test de IBP varía entre 69% y el 92%, y la especificidad entre el 67% y el 86%. En estos estudios se utilizaron diferentes IBP como el omeprazol, lansoprazol y rabeprazol. Las dosis utilizadas de omeprazol variaban entre 60mg a 80mg al día7,22, de lansoprazol entre 30mg y 90mg al día8,9 y 40mg al día para rabeprazol10,23. En este estudio utilizamos como punto de corte un tiempo de más de 4,2% (porcentaje de tiempo total con un pH<4) para definir pacientes con ERGE, se ha elegido este punto de corte para comparar con más homogeneidad y con la misma metodología usada en los diferentes trabajos que han servido para comparar este estudio. La sensibilidad observada del test de IBP en nuestro estudio (comparada con la de otros estudios previos) está condicionada por el criterio utilizado para diagnosticar la ERGE, por las características de la población estudiada (criterios de inclusión y exclusión) y por el criterio utilizado de valoración de la respuesta al tratamiento con IBP. De hecho, la estimación de la prevalencia de ERGE en pacientes con DTNC está condicionada también por los mismos factores. Esto explicaría la diferencia entre estudios. En nuestro estudio la prevalencia fue del 67%. En estudios previos esta prevalencia oscila entre el 30% y el 67% (25-27). La prevalencia estimada de ERGE en nuestro estudio fue similar a la reportada por investigadores asiáticos, quienes también utilizaron para definir ERGE la pHmetría pero mediante el sistema bravo. Aunque esta última técnica permite registros de pHmetría de hasta 48h24, no hay evidencias de que un registro de pH más prolongado sea superior a la pHmetría convencional de 24h en el diagnóstico de ERGE en pacientes con DTNC. Por el contrario, la prevalencia de nuestro estudio fue muy superior a la reportada por Fang et al25, quien reportó una prevalencia de ERGE en pacientes con DTNC del 30%. Una posible explicación a esta diferencia podría estar en que Fang et al.25, solo incluyeron pacientes con examen endoscópico normal y, por tanto, únicamente se estudiaron pacientes con ERGE sintomática no erosiva. Por otro lado, el 55% de pacientes con DTNC y ERGE de nuestro estudio presentaban síntomas típicos de ERGE (pirosis y/o regurgitación). Este porcentaje es menor al reportado en los estudios de Fass et al.7 y de Kim et al.23, que fue del 74 y del 69%, respectivamente. No obstante, la presencia de síntomas típicos de ERGE no predijo una mejor respuesta al tratamiento antisecretor ni en nuestro estudio ni en los estudios antes mencionados. Asimismo, en nuestro estudio el 60% de pacientes con ERGE-positivo fueron mujeres, porcentaje mucho menor al reportado en el estudio de Fass et al.7, donde el 96% de sus pacientes con DTNC y ERGE eran mujeres. Si bien el DTNC es más frecuente en mujeres26, las evidencias sobre la prevalencia (del 28 hasta el 96%) de ERGE en mujeres con DTNC son limitadas1,12. Esto hace difícil asociar el sexo femenino a un mayor porcentaje de respuesta, a pesar de que el umbral de percepción, por ejemplo a la distensión con balón rectal, es menor en mujeres27. Igualmente, en nuestro estudio se incluyeron pacientes con al menos un episodio de dolor torácico a la semana. En otros estudios7,9,10 se incluyeron pacientes con episodios más frecuentes de dolor torácico, al menos 3 episodios de dolor torácico a la semana. Al ser más frecuentes los episodios de dolor torácico, se puede evaluar mejor si hay un cambio en las puntuaciones del cuestionario del dolor con el tratamiento. Esto también puede afectar los resultados. También se ha reportado que la utilización del índice de síntomas positivo como criterio adicional al porcentaje de tiempo total de exposición ácida podría predecir una mejor respuesta al tratamiento con IBP28. Sin embargo, el criterio de la frecuencia de episodios de dolor torácico de al menos una vez a la semana —muchos pacientes de nuestro estudio tuvieron una baja frecuencia de episodios de dolor torácico— impidió calcular y analizar el valor de los índices sintomáticos en nuestro estudio.
Antes de obtener una conclusión deberían considerarse ciertas limitaciones. El tamaño muestral (este estudio fue planteado como exploratorio) y el tipo de población estudiada (tal como se ha discutido) pueden infraestimar o sobreestimar los resultados obtenidos, y su generalización. No obstante, a nuestro conocimiento, este es el primer estudio que aporta evidencias sobre el rendimiento diagnóstico del test de IBP utilizando pantoprazol. Además, es bien conocido que la esofagitis eosinofílica no siempre se asocia a hallazgos endoscópicos macroscópicos. En el presente estudio no se realizaron biopsias de esófago para estudio de esofagitis eosinofílica en ningún caso, y no podemos descartar con seguridad esta posibilidad. Sin embargo, ninguno de nuestros pacientes presentaba las características (varones jóvenes con historia de alergias) asociadas a infiltración eosinofílica del esófago en pacientes con dolor torácico, descritas en un estudio reciente29.
En conclusión, en pacientes con dolor torácico no cardíaco el test con IBP utilizando doble dosis de pantoprazol tiene una baja sensibilidad para el diagnóstico de la ERGE. Esta baja sensibilidad estimada del test de IBP cuestiona reservar el estudio funcional únicamente para los pacientes que no respondan al tratamiento antisecretor. El estudio funcional utilizando las nuevas tecnologías permitiría un diagnóstico más preciso, conocer mejor los mecanismos fisiopatológicos y ofrecer un tratamiento dirigido más adecuado a todos los pacientes con DTNC.
FinanciaciónEste trabajo no ha recibido financiación.
Conflicto de interesesLos autores no declaran ningún conflicto de intereses relacionado con este trabajo.
Agradecemos al Dr. Jesús Villoria, bioestadístico, Medicxact S.L., sus consejos técnicos sobre el diseño del estudio.