Editado por: Dr. Mariano de la Figuera von Wichmann
(Clínica Olivé Gumà, Barcelona, Spain)
Prof. Dr. Elena Segura-Grau
(Tondela Viseu Hospital Center, Viseu, Portugal)
Última actualización: Diciembre 2024
Más datosDesde atención primaria trabajamos en la prevención y tratamiento del riesgo cardiovascular de nuestros pacientes. La exploración física, el electrocardiograma y la analítica son los parámetros clásicos y continúan siendo la forma más eficiente de estimar la presencia y control de factores de riesgo cardiovascular y de lesión de órgano diana, de cara a optimizar la estratificación del riesgo cardiovascular. El uso de la ecografía por el médico de atención primaria para completar la información clínica es una realidad que ayuda a afianzar la sospecha diagnóstica, monitorizar la evolución clínica e, incluso, decidir el mejor plan terapéutico. Este trabajo propone establecer las bases del uso de la ecografía para el diagnóstico de ateromatosis carotídea/femoral, el uso de la ecocardioscopia, el despistaje de aneurisma de aorta abdominal, la valoración de la esteatosis hepática y el estudio del riñón en el paciente con enfermedad renal crónica.
From primary care we work on the prevention and treatment of cardiovascular risk in our patients. The physical examination, the electrocardiogram and the analysis are the classic parameters and continue being the most efficient way to estimate the presence and control of cardiovascular factors and target organ damage, to optimize the cardiovascular risk stratification. The use of ultrasound by the primary care doctor to complete the clinical information is a reality that helps to strengthen the diagnostic suspicion, monitorize the clinical evolution and even decide the best therapeutic plan. This work proposes to establish the bases for the use of ultrasound for the diagnosis of carotid/femoral atheromatosis, the use of echocardioscopy, screening for abdominal aortic aneurysm, the assessment of hepatic steatosis and the study of the kidney in patients with chronic kidney disease.
La enfermedad cardiovascular (ECV), de la que la ateroesclerosis es la principal responsable, causa 4 millones de muertes anuales en Europa1. En España, las ECV constituyen la segunda causa de muerte y, a pesar de haberse producido un progresivo descenso de la mortalidad por esta afección, la morbilidad continúa incrementándose. Esto hace pensar que se necesita un mayor control de todos los factores de riesgo cardiovascular (RCV), nuevos y emergentes2.
Todas las guías actuales de prevención recomiendan evaluar el riesgo total de desarrollar ECV en cierto periodo de tiempo. Para esto, clásicamente, las guías europeas empleaban el Systematic Coronary Risk Evaluation (SCORE), calculándose el riesgo acumulado de un paciente de presentar un primer evento cardiovascular mortal en 10 años. Posteriormente, se ha descrito que este modelo subestima la carga total de ECV, al tener solo en cuenta los eventos mortales. Por ello, en 2021 se publicó el proyecto SCORE2, elaborándose un modelo para predecir el riesgo de evento cardiovascular, mortal y no mortal, en los próximos 10 años, en la población europea actual, mejorando la identificación de aquellas personas con mayor riesgo con respecto a escalas previas3.
Además, en el sistema SCORE2, la población≥70 años tiene poca representación, ya que existe una sobrestimación del RCV en estos al aplicarlo, evidenciando tratamientos innecesarios en personas mayores, lo que genera más riesgos que los beneficios aportados. Para solventar este problema, se desarrolló un modelo ajustado a esta población que calcula el RCV global en los próximos 5-10 años: el SCORE2-OP4.
A pesar de la indudable utilidad de los sistemas de estratificación, estos no son capaces de detectar adecuadamente el riesgo de desarrollar complicaciones cardiovasculares hasta en un 30% de los casos de los pacientes clasificados como RCV bajo o intermedio. Esto se debe a que no tienen en cuenta ciertos condicionantes que podrían aumentar el RCV, como sería, por ejemplo, la detección de daño cardiovascular subclínico mediante técnicas no invasivas. Estos condicionantes podrían reasignar el riesgo en pacientes asintomáticos, considerándolos modificadores del RCV en la evaluación de pacientes sin enfermedad cardiovascular5.
Por ser una técnica versátil, disponible y costo-efectiva, actualmente al alcance del médico de atención primaria, la ecografía se sitúa por delante de otras pruebas de imagen no invasivas en la detección del daño cardiovascular subclínico. Los principales modificadores del RCV mediante ecografía se obtienen con la ecocardiografía, la ecografía carotídea/femoral y la del aneurisma de aorta abdominal (AAA). Otras aplicaciones de esta técnica serían la enfermedad renal crónica y la esteatosis hepática, factores que comportan un RCV incrementado, aunque su contribución a la reestratificación de los pacientes está menos estudiada6.
Ateroesclerosis carotídeaIndicacionesLa ecografía carotídea ha demostrado utilidad a la hora de detectar fases iniciales de ateroesclerosis en pacientes con factores de RCV, pudiendo actuar como modificador en aquellos con RCV bajo o intermedio, permitiendo que los pacientes se beneficien de una correcta prevención primaria. Con el fin de reestratificar, no tendría sentido realizarla en aquellos pacientes con ECV ya establecida, o si no se espera que los resultados modifiquen nuestra actitud terapéutica7. Datos de los estudios Framingham8, MESA9 y ARIC10 muestran que la detección de placas carotídeas mejora la clasificación en un 7-10% de la población.
Técnica de exploración y hallazgos normalesPara esta ecografía necesitaremos una sonda lineal de alta frecuencia, y los modos B, Doppler color (DC) y pulsado (DP). Colocaremos al paciente en decúbito supino, con cabeza hiperextendida y giro de 45° hacia el lado contralateral al explorado. Iniciamos en corte transversal, perpendicular al eje del cuello, en modo B. El plano correcto debe incluir vena yugular, arteria carótida común (ACC) y tiroides. Desplazamos la sonda cranealmente a lo largo del eje de la ACC hasta la máxima porción visible de la arteria carótida interna (ACI). En el mismo punto de inicio de la exploración giramos el transductor 90° para corte longitudinal, en paralelo al eje del cuello, pudiendo obtener proyecciones de este plano de forma anterior, lateral o posterior, en función de la anatomía del paciente. Exploramos la ACC longitudinalmente hasta su bifurcación, y seguiremos el trayecto de la ACI hasta el ángulo mandibular. Debemos incluir en la exploración la arteria vertebral, a mayor profundidad que la ACC, desde su origen hasta el ángulo mandibular. Ambos barridos deben repetirse usando DC (vídeo 1).
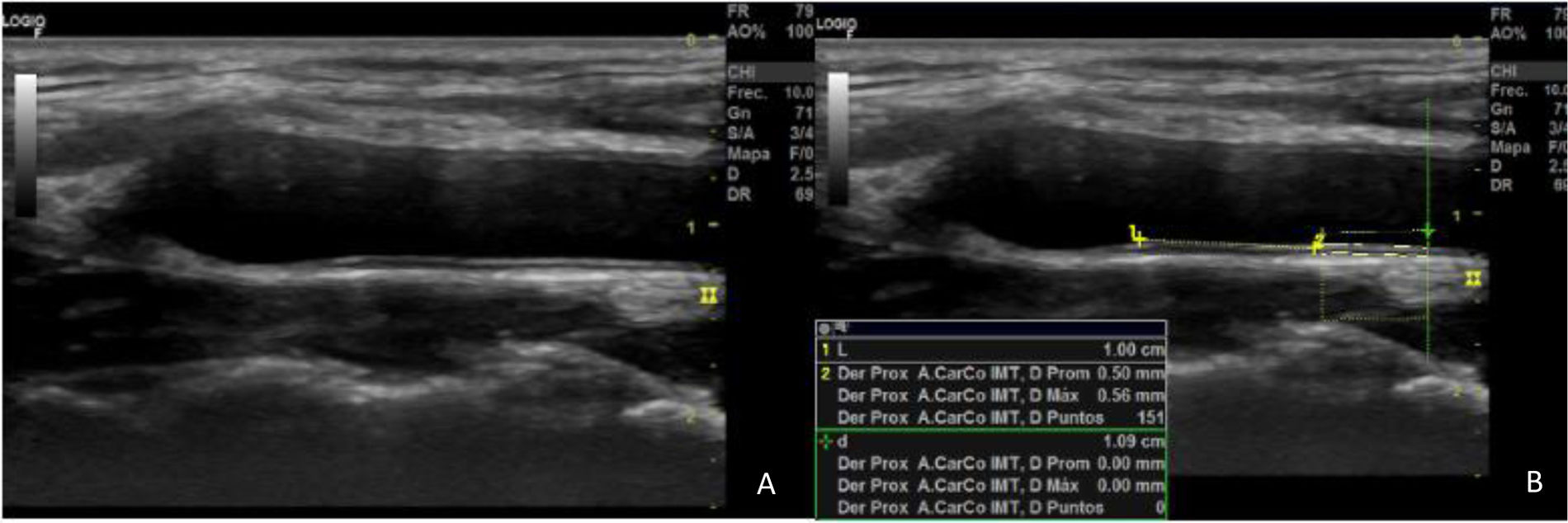
Diferentes métodos se han empleado para evaluar el RCV mediante ecografía carotídea. El consenso europeo de Mannheim de 2004-200611 estableció los signos de ateroesclerosis que podemos valorar mediante ecografía. Estimar el grosor íntima-media (GIM) de la ACC ha sido clásicamente un factor predictor de ECV, al estar sustentada por la literatura su relación con la tasa de eventos cardiovasculares. Se consideran patológicos valores medios por encima de 0,9mm12 (fig. 1). En la actualidad, si bien se asume que un GIM patológico confiere un riesgo adicional, no reestratifica el RCV ya que su presencia no se asocia a cambios en la incidencia de eventos cardiovasculares (mortales o no mortales)2,13.
La ecografía carotídea también permite describir la existencia de estenosis arterial significativa, siendo este grado de estenosis el factor que más se relaciona con la aparición de ictus, y el punto crítico de un probable tratamiento quirúrgico vascular. Desarrollamos a continuación la técnica, si bien estos estudios suelen estar realizados en el ámbito de la atención hospitalaria. Debemos localizar en el plano longitudinal la zona de máxima estenosis, buscando zonas de «aliasing» (turbulencias) con DC y, posteriormente, aplicamos DP para cuantificar la velocidad máxima que experimenta el flujo sanguíneo antes de la estenosis, en el punto crítico y posterior a la misma. Es muy importante orientar el caliper paralelo al flujo, con un ángulo de insonación≤60°. Los parámetros principales estandarizados (tabla 1) que se van a utilizar para la cuantificación serán velocidad pico sistólico (VPS) y velocidad diastólica final en ACI y la ratio ACI/ACC14.
Criterios de estenosis carotídea de la Sociedad Americana de Radiología
| Estenosis, % | VPS ACI, cm/s | VDF ACI, cm/s | ACI/ACC |
|---|---|---|---|
| <50 | <125 | <40 | <2,0 |
| 50-69 | 125-230 | 40-100 | 2,0-4,0 |
| ≥70 | >230 | >100 | >4,0 |
Fuente: Grant et al.14.
La placa de ateroma se define como cualquier engrosamiento focal que invada la luz en cualquier segmento de la arteria carotídea al menos 0,5mm, o un engrosamiento mayor del 50% del GIM circundante (placa tipo protuberante), o, en el caso de ateroesclerosis difusa, cuando GIM≥1,5mm en cualquier segmento (placa tipo difusa)11. El consenso estadounidense de 2020 de la ASE15 propone diferentes métodos de cuantificación de la placa carotídea con técnicas bidimensionales utilizando ecografía en modo B. Clasifican a los pacientes en 3 grados, en función de la presencia de placas y la altura máxima de las mismas: i, placa protuberante con altura máxima<1,5mm; ii, placa protuberante o engrosamiento difuso GIM 1,5-2,4mm; iii, placa protuberante o engrosamiento difuso≥2,5mm. Además, utiliza esta clasificación para proponer un esquema de estratificación del RCV: riesgo bajo, grado 0-i; riesgo intermedio, grado ii, y alto riesgo, grado iii.
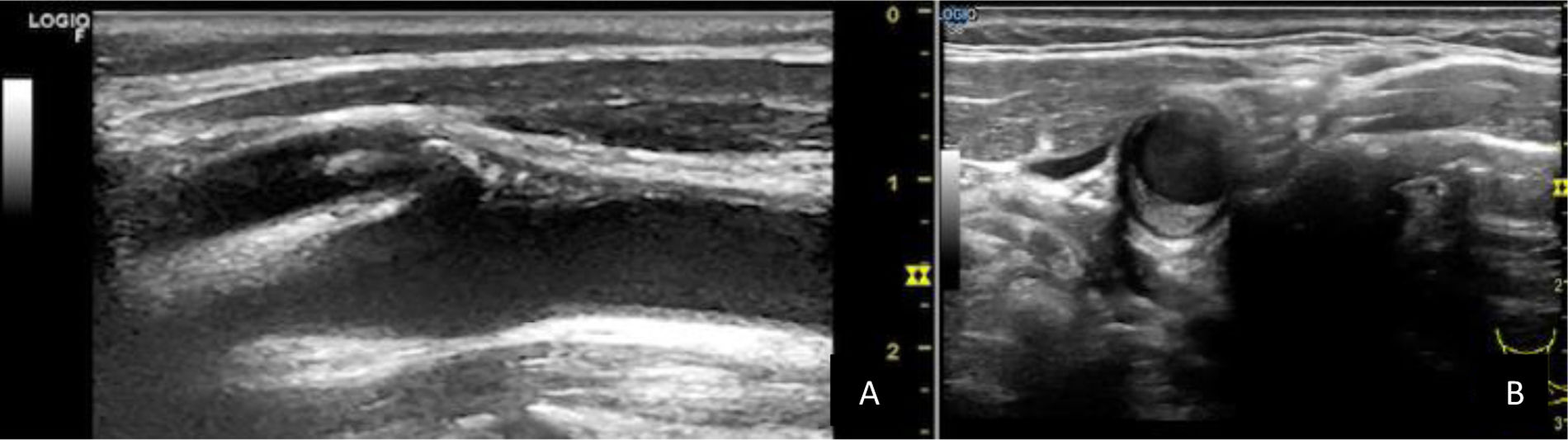
Además del número y la localización de las placas, se debe realizar una descripción cualitativa de las mismas. Valorar la ecogenicidad, distinguiendo entre placas ecolucentes o hipoecogénicas (más oscuras, más ricas en lípidos) y ecogénicas o hiperecogénicas (más brillantes, predominando el tejido fibroso y calcio), la textura, diferenciando entre homogéneas o heterogéneas, y la superficie, regulares o irregulares. En general, aquellas placas carotídeas ecolucentes e irregulares se relacionan con un mayor riesgo de eventos vasculares cerebrales16 (fig. 2; vídeo 2).
Ateroesclerosis femoralIndicacionesLa formación de placas a nivel de la arteria femoral es considerado marcador de enfermedad ateroesclerótica subclínica. Algunos estudios han objetivado que los cambios ateroescleróticos ocurren de manera más precoz en las arterias femorales que en otros lechos vasculares17. Según las guías de prevención de RCV, la presencia de placa significativa (estenosis>50%) en el árbol de la arteria femoral reestratifica a RCV muy alto. La detección de arteriopatía periférica supone un equivalente para la obstrucción del árbol coronario o de otros territorios.
Técnica de exploración y hallazgos normalesAntes de la realización de ultrasonidos a nivel femoral, es importante llevar a cabo una adecuada exploración física que incluya la detección de pulsos de los miembros inferiores, la auscultación de posibles soplos y la realización del índice tobillo-brazo5. La presencia de un índice tobillo-brazo patológico indica la existencia de lesión vascular, por lo que en estos pacientes no serían necesarios los ultrasonidos con el objetivo de reestratificar, pues ya serían pacientes con RCV muy alto.
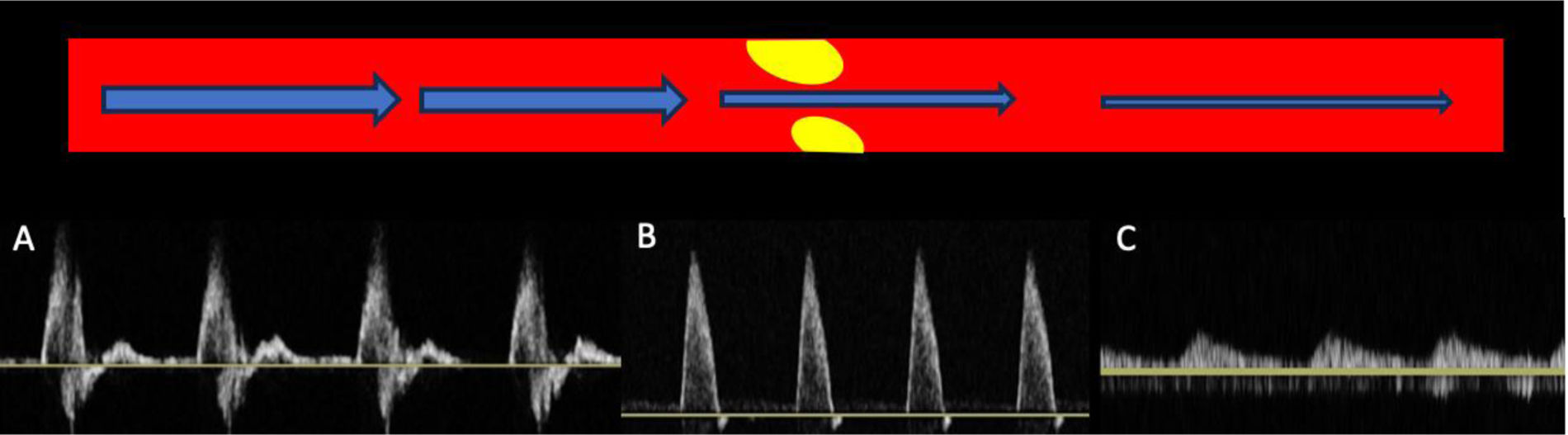
Para realizar una ecografía a nivel femoral, colocamos al paciente en decúbito supino con la extremidad en abducción, situando la sonda lineal a nivel del triángulo de Scarpa, con escasa presión y profundidad, utilizando un solo foco. Realizaremos cortes transversales de la arteria femoral común, de craneal a caudal, hasta llegar a la bifurcación en la arteria femoral y la arteria femoral profunda, identificando la presencia, o no, de placas (vídeo 3). Posteriormente pasaremos a cortes longitudinales, repitiendo cada barrido con DC y DP. Al igual que en el área carotídea, debemos hacer los ajustes pertinentes tanto en uno como en otro modo (ganancia, escala de velocidad y tamaño de la caja adecuados). En una arteria sana, el registro en DP a este nivel es de morfología trifásica (alta resistencia) y es normal que la VPS disminuya progresivamente al descender desde las arterias iliacas hasta las arterias en el tercio distal de la extremidad.
Hallazgos patológicosEl estudio de la severidad de la estenosis a este nivel se sospecha con el DC y se confirma y clasifica con DP en corte longitudinal. La morfología de la onda, junto con la ratio de VPS (VPS estenosis máxima/VPS preestenosis), la presencia de circulación colateral, la ausencia de flujo, etc., permiten determinar el porcentaje de la estenosis. Una ratio≥2,4 se corresponde con un grado de estenosis≥50%, mientras que una ratio≥4 se relaciona con un porcentaje de estenosis≥80%18, con una sensibilidad y una especificidad que ronda el 90% en ambos casos. Estos estudios presentan cierta complejidad, siendo nuestro cometido como médicos de atención primaria saber detectar la presencia de placa y evaluar la presencia de arteriopatía mediante los cambios en la morfología de la onda. Encontrar una onda con morfología monofásica debe hacernos pensar en la presencia de arteriopatía en este lugar y/o en territorio proximal (fig. 3).
Hallazgos en la ecocardioscopiaIndicacionesLa ecocardiografía clínica aplicada al RCV representa, junto con el electrocardiograma, una prueba complementaria importante para evaluar el daño subclínico a nivel cardiaco. Se centra en detectar cambios en la forma del ventrículo izquierdo (VI) en pacientes con HTA prolongada o infratratada, y está considerada como más precisa que el electrocardiograma a la hora de diagnosticar hipertrofia del VI (HVI)19. También proporciona información sobre la geometría del VI, el volumen de la aurícula izquierda (AI), las dimensiones de la raíz aórtica y la función sistólica y diastólica del VI, entre otras. No está claro si el uso de otros parámetros distintos del aumento de la masa del VI y la dilatación de la AI pueden ayudar a reestratificar el RCV20.
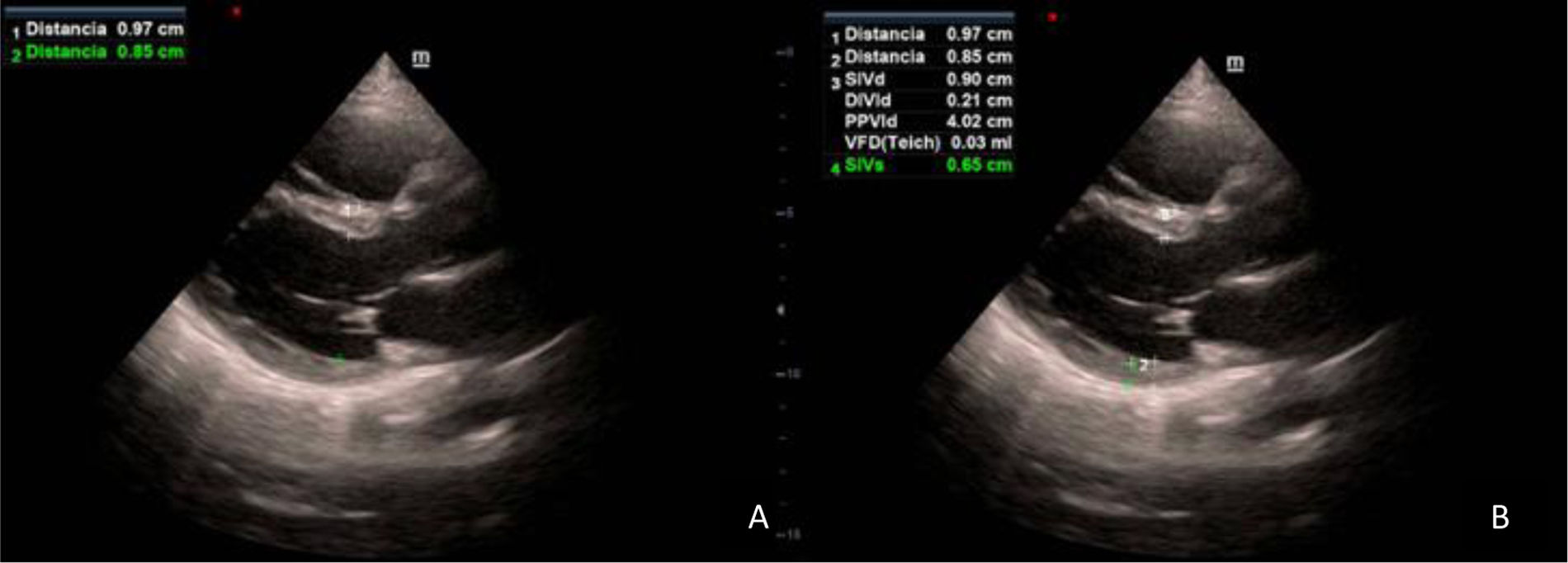
Diagnóstico de la hipertrofia ventricular izquierdaTécnica de exploración y hallazgos normalesLas mediciones del VI se recomienda realizarlas en el eje largo paraesternal, que lo obtenemos colocando la sonda sectorial entre el 2.o-3.er espacio intercostal izquierdo, con la marca de la sonda apuntando al hombro derecho. Mediremos los espesores de la pared septal y la pared posterior (fig. 4A), situándonos perpendiculares al borde libre de los velos de la válvula mitral, al final de la diástole19,21. Con estas mediciones lineales, y con la medición del diámetro telediastólico del VI (fig. 4B), el equipo calcula automáticamente la masa ventricular izquierda (MVI) utilizando la fórmula del cubo de Devereux19. La MVI clásicamente se ha ajustado por superficie corporal, aunque en las últimas recomendaciones se prefiere el ajuste por altura corporal, para individuos que se desvían del peso corporal normal20.
Hallazgos patológicosLos límites superiores de referencia de MVI normal en mediciones lineales son: 95g/m2 en mujeres y 115g/m2 en hombres21. Según las guías, el índice de MVI sería el parámetro para medir la existencia, o no, de HVI que más ha demostrado relación con la morbimortalidad cardiovascular y, por tanto, principal factor reestratificador (lesión subclínica o no de órgano diana) (vídeo 4).
Las guías ESH 202320 recomiendan la reducción de las cifras tensionales, ya que esto puede llevar a la regresión de la HVI, lo que supone una reducción de las complicaciones cardiovasculares y la mortalidad. Radica ahí la importancia de detectar cuanto antes esta remodelación cardiaca, con el objetivo de optimizar el tratamiento de nuestros pacientes.
Función del ventrículo izquierdoUna alteración no solo en las dimensiones, sino en la funcionalidad del VI, comporta un RCV adicional, si bien los grandes estudios de RCV no se han centrado en cuantificarlo de manera tan exhaustiva. Tanto la función sistólica como la diastólica del VI resultan parámetros muy importantes que el médico de atención primaria debe conocer a la hora de enfocar el tratamiento del paciente, si bien la técnica es más compleja y los requerimientos técnicos no siempre están al alcance de este. Sin embargo, sí puede hacernos sospechar una disfunción diastólica la presencia de HVI o dilatación de la AI.
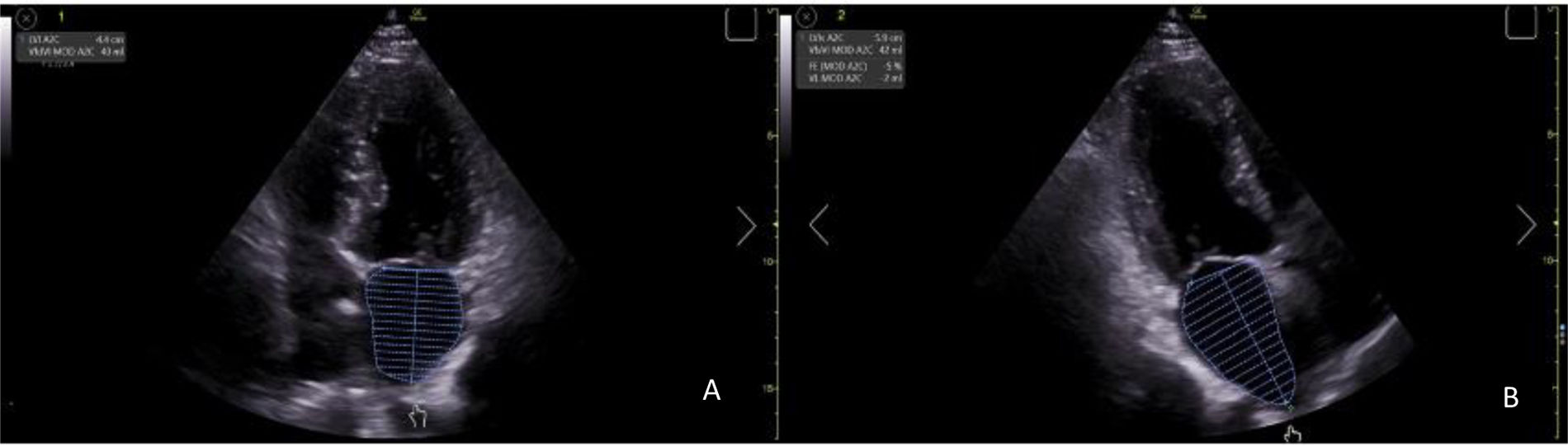
Técnica de exploración. Hallazgos normales y patológicosPara calcular la fracción de eyección (FE), primero debemos obtener los volúmenes fin de sístole (VFS) y fin de diástole (VFD), a partir del plano apical 4 y 2 cámaras, colocando la sonda en el 5.o espacio intercostal, con la muesca dirigida hacia el flanco izquierdo, obteniendo un corte axial. El equipo emplea el método biplano de discos, siguiendo la regla de Simpson modificada, y una vez calculados estos parámetros, obtiene la FE mediante la fórmula: FE=(VFD−VFS)/VFD21. Las últimas guías sobre insuficiencia cardiaca de la ESC22 clasifican como insuficiencia cardiaca con FE reducida cuando≤40%, levemente reducida cuando está entre 41-49% y preservada si≥50%.
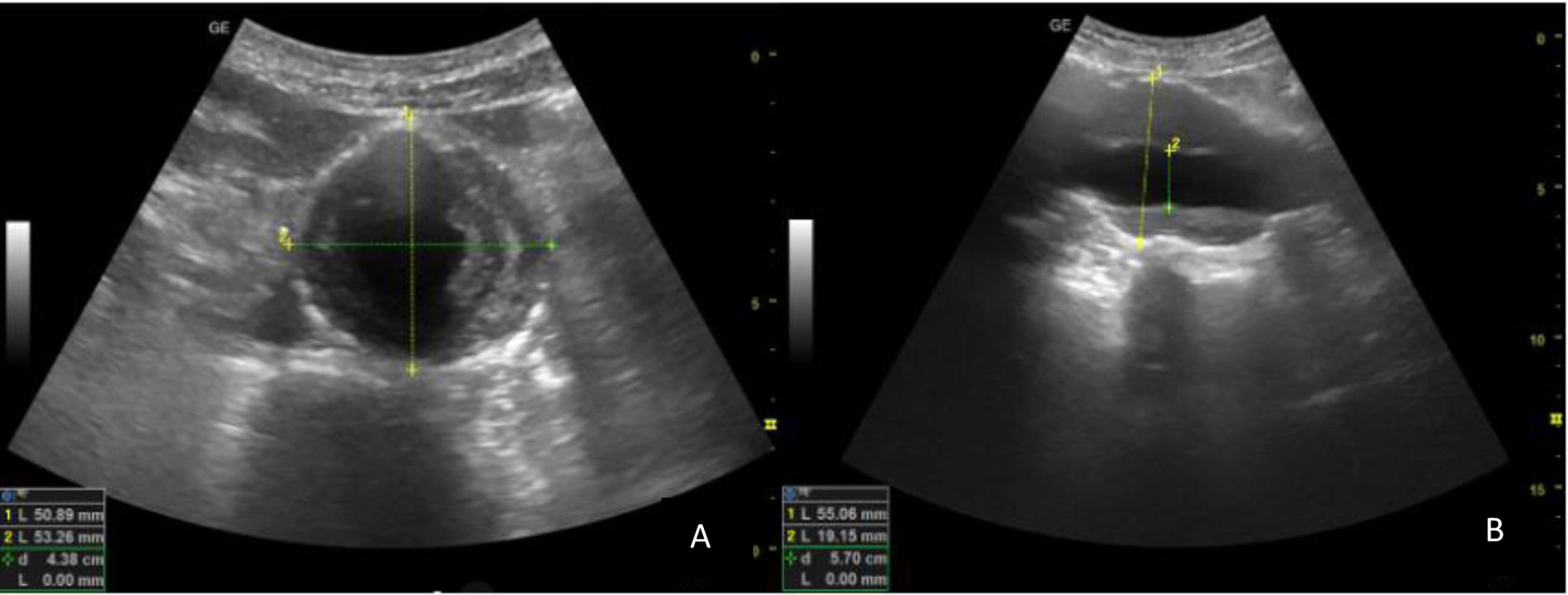
Dimensiones de la aurícula izquierdaTécnica de exploración. Hallazgos normales y patológicosOtro parámetro que comporta un riesgo adicional sería la dilatación de la AI. Estudios demuestran que la dimensión de la AI es paralela a los cambios en la MVI, lo que evidencia el posible mecanismo por el cual los cambios en la HVI se asocian con un riesgo de desarrollar fibrilación auricular19, otro gran factor asociado a RCV. Para la evaluación ecocardiográfica del tamaño de la AI, por un lado, tendríamos el diámetro anteroposterior, medido en sístole en el eje largo paraesternal, trazando una línea perpendicular al eje largo de la raíz aórtica, a nivel de los senos aórticos. Pero esta medida no debe ser la única utilizada, pues la AI puede crecer en otro eje. El área de la AI es otro parámetro que valorar y se obtiene al final de la sístole, desde el plano apical 4 cámaras21. El volumen de la AI debe ser medido utilizando el algoritmo de sumatorio de discos, a partir del área en los planos apical 4 y 2 cámaras (fig. 5). El límite superior de la normalidad para el volumen de AI es de 34ml/m2 para ambos géneros23. Se considera el parámetro más fiable para estimar las dimensiones de la AI.
Dimensiones de la aortaTécnica de exploración. Hallazgos normales y patológicosLa HTA crónica puede asociarse con enfermedad aórtica, por lo tanto, cualquier ecocardioscopia dirigida a evaluar enfermedad de órgano diana debe incluir su evaluación. Tanto la raíz aórtica (a nivel de los senos de Valsalva, de 29-45mm) como la aorta ascendente proximal (22-36mm) se miden en el eje largo paraesternal, además de una porción de la aorta torácica descendente (20-30mm). Para evaluar el cayado aórtico (22-36mm), lo obtenemos desde la ventana supraesternal, colocando la sonda sobre la horquilla esternal, con la marca orientada hacia el hombro izquierdo24.
Aneurisma de aorta abdominalEl AAA es una dilatación patológica de la aorta abdominal, con una medida de su diámetro anteroposterior≥3cm. En 2019, Bravo-Merino et al.25 llevaron a cabo un estudio que confirmó un aumento en la prevalencia de AAA. En España se situaría entre 3-5%, pudiendo duplicarse en la población de alto riesgo. Su origen es multifactorial, asociándose su aparición y progresión a numerosos factores de riesgo, destacando la arterioesclerosis y el tabaquismo. La principal complicación es la rotura, considerada una urgencia quirúrgica.
IndicacionesEn una revisión sistemática de Cochrane26 hubo evidencia de una reducción significativa en la mortalidad por AAA en hombres de entre 65 a 79 años que se someten a exámenes de detección por ultrasonido. Esto se ha visto sustentado en otros estudios posteriores, obteniéndose una reducción de la mortalidad de en torno al 50% en varones mayores de 65 años que se someten a cribado, demostrando ser una medida costo-eficiente27.
La ecografía abdominal es considerada un buen método diagnóstico y de cribado de AAA, pero también para la vigilancia posterior. Presenta una sensibilidad diagnóstica de un 96% y una especificidad del 100%28. La sensibilidad y la especificidad son muy buenas con la técnica en manos del médico de atención primaria, habiéndose obtenido coeficientes de correlación muy altos (0,88) con los estudios efectuados por cirujanos vasculares25. Los intervalos de seguimiento varían según los protocolos y vendrían establecidos según el último diámetro explorado. Un aneurisma con un diámetro de 3-3,9cm precisa un seguimiento cada 3 años; de 4-4,9cm, un seguimiento anual, y cuando el diámetro es≥5cm, se realizaría seguimiento cada 6 meses29,30.
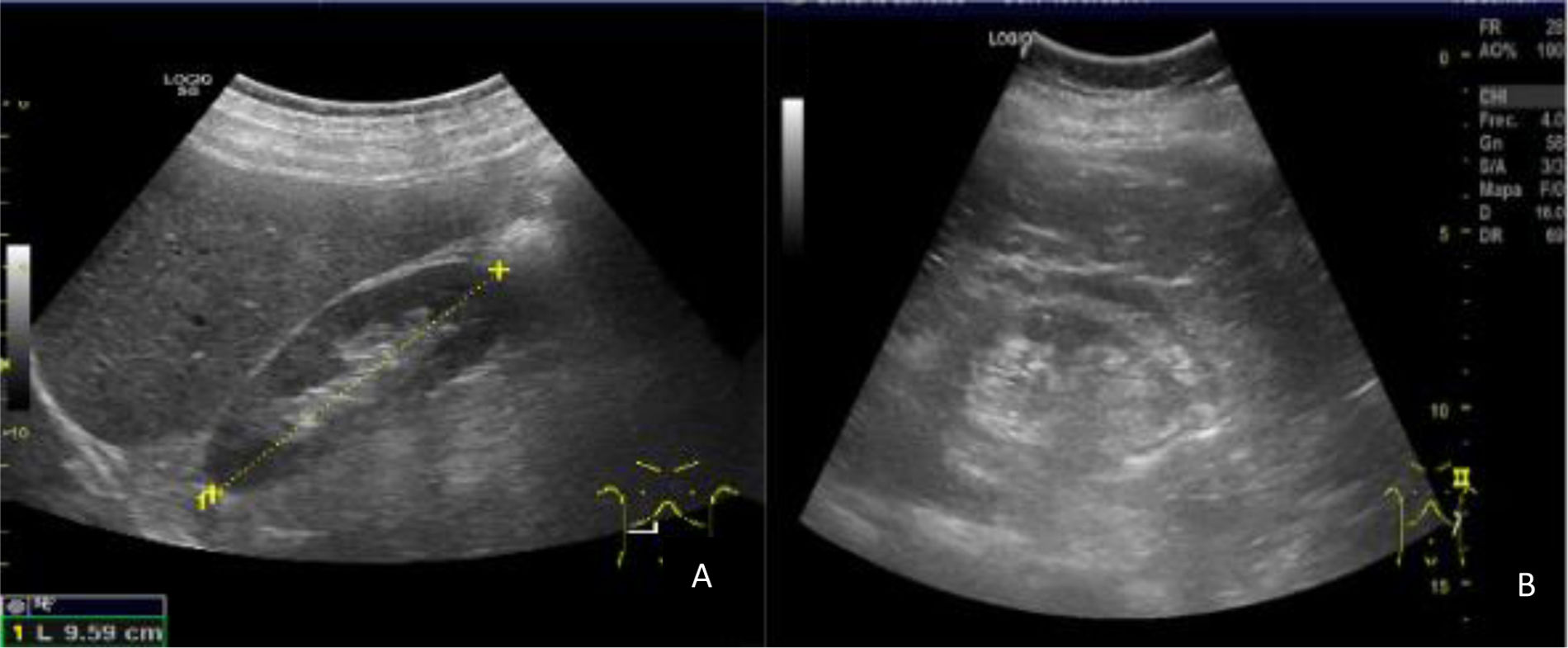
Técnica de exploración. Hallazgos normales y patológicosPara su exploración se emplea una sonda convex de baja frecuencia. Realizamos un barrido transversal en modo B, asegurando una proyección completamente perpendicular al vaso, desde el epigastrio en dirección caudal hasta la primera porción de las arterias iliacas comunes. En el 95% de las ocasiones encontramos el AAA por debajo de la salida de las arterias renales, por ello centraremos nuestro estudio en esta área (1cm aproximadamente por debajo de la salida de la arteria mesentérica superior en el corte longitudinal). Tomamos mediciones tanto del diámetro anteroposterior como del trasverso a nivel de la aorta suprarrenal, infrarrenal (donde son más frecuentes) y antes de la bifurcación, colocando el cursor de pared externa a pared externa. Antes de las mediciones, se debe observar que la presión que ejercemos sobre el transductor es la adecuada, para evitar errores de medición a la baja. Debemos confirmar las medidas a partir de un corte longitudinal, girando el transductor 90° desde el corte trasversal, con la muesca en dirección craneal. Es necesario ser cuidadosos para no efectuar cortes sesgados y dirigir nuestras medidas siempre perpendiculares al eje del vaso, que no siempre es paralelo al eje del abdomen (fig. 6). Se define aorta normal cuando el diámetro es≤2,5cm, ectasia de 26 a 29mm y aneurisma si es≥3cm (vídeo 5).
Lesión subclínica renalIndicacionesLa presencia de enfermedad renal crónica secundaria a factores de RCV implica daño de órgano diana y, por lo tanto, estratificación como alto o muy alto RCV. La ecografía puede complementar la detección de este modificador de riesgo.
Técnica de exploración y hallazgos normalesLa exploración ecográfica la realizaremos con el paciente en decúbito supino y utilizaremos una sonda convex, de baja frecuencia. Podemos usar un abordaje subcostal o intercostal, a nivel de la línea axilar anterior, usando el hígado y el bazo como ventanas acústicas, y realizando barridos longitudinales y transversos.
Hallazgos patológicosEn la exploración ecográfica de enfermedad renal crónica podemos encontrar31:
- -
Disminución del tamaño renal. Los valores normales, en plano longitudinal, oscilan entre 9-13cm. Tamaños<9cm se consideran anormales, o una diferencia>1,5cm entre ambos riñones.
- -
Adelgazamiento de la corteza renal, pues un espesor de parénquima<1cm indica cronicidad. Se considera anormal un espesor de corteza<7mm, o el conjunto de corteza y médula<12mm (fig. 7B).
- -
Aumento de la ecogenicidad del parénquima, en comparación con la ecogenicidad esplénica/hepática, indicando esclerosis y fibrosis renal. Esto puede acabar derivando en una mala diferenciación ecográfica entre cortical y seno.
- -
En fases más avanzadas, existiría una desestructuración renal.
La aplicación de la ecografía en el daño renal es mucho más amplia, sobre todo en lo que se refiere al diagnóstico de estenosis de la arteria renal. Resultan técnicas complejas, no siendo objeto por tanto de este artículo, al considerar que quedarían fuera del ámbito de la atención primaria.
Esteatosis hepáticaIndicacionesLa enfermedad hepática grasa no alcohólica ha sido descrita como factor independiente de RCV, considerándose una verdadera enfermedad metabólica, por lo cual ha pasado a denominarse metabolic associated fatty liver disease (MAFLD). La Asociación Americana del Corazón ha publicado recientemente un documento que afirma que la primera causa de muerte en pacientes que padecen MAFLD es la enfermedad ateroesclerótica. Por eso, insiste en la detección precoz de esta enfermedad, su prevención y tratamiento32.
La ecografía clínica ha demostrado sensibilidad y especificidad elevadas (84,8 y 93,6%, respectivamente) en la detección de MAFLD moderada-severa, en comparación con otras pruebas de imagen33.
Técnica de exploración. Hallazgos normales y patológicosPara la ecografía hepática utilizaremos una sonda convex. A nivel del hipocondrio derecho realizaremos un barrido longitudinal y transversal del órgano. En la esteatosis va a existir un aumento de la ecogenicidad del parénquima hepático por la infiltración grasa, en comparación con la ecogenicidad de la corteza renal. Esto provoca una atenuación sónica posterior, dificultando la valoración de las partes más profundas del hígado. En función de estas características, diferenciamos 3 grados34:
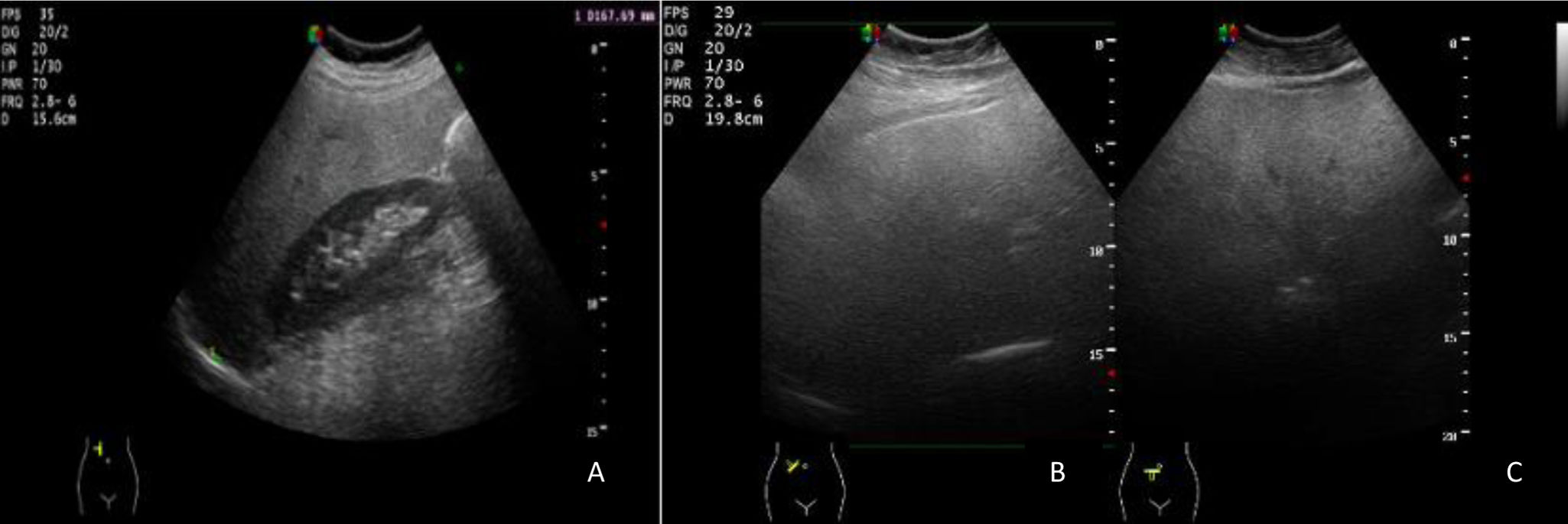
I o leve: discreto aumento difuso de la ecogenicidad, con atenuación del ultrasonido en segmentos posteriores, pero con normal valoración del diafragma y bordes de los vasos intrahepáticos (fig. 8A).
A: corte longitudinal en línea axilar anterior. Aumento de ecogenicidad hepática respecto a cortical renal. Esteatosis leve. B y C: corte oblicuo subcostal en hipocondrio derecho y epigastrio. Atenuación del ultrasonido en regiones posteriores con nula definición del diafragma y los vasos: esteatosis severa.
II o moderado: moderado aumento difuso de la ecogenicidad, atenuación mayor que dificulta la valoración del diafragma y los vasos intrahepáticos.
III o severa: elevado grado de ecogenicidad, lo que prácticamente impide la visualización del diafragma y de la porción posterior del lóbulo hepático derecho, así como de los vasos intrahepáticos (fig. 8B y C).
ConclusionesLas guías de práctica clínica recomiendan la estratificación del RCV individualizado de cada uno de nuestros pacientes, determinando la probabilidad de que presenten un evento cardiovascular, proponiendo diferentes sistemas de estratificación que los clasifiquen desde bajo hasta muy alto riesgo. El manejo de aquellos pacientes clasificados inicialmente como RCV bajo o intermedio puede verse modificado al reestratificar su riesgo en función de la potencial enfermedad subclínica que pueda presentar en una exploración ecográfica.
La dotación de equipos y la capacitación del médico de atención primaria para poder realizar un manejo óptimo de este perfil de paciente con el uso de la ecografía clínica es ya una realidad en algunas regiones de nuestro país. Con el presente artículo no pretendemos defender el cribado de lesión subclínica de órgano diana a todos nuestros pacientes con RCV, cuestión que resultaría inabordable en la estructura actual de la atención primaria. Consideramos que la búsqueda de esta lesión subclínica con ecografía puede ser de utilidad sobre todo en aquellos con RCV intermedio, en los que identificar las lesiones de órganos diana modificaría el manejo clínico, teniendo un impacto positivo en el pronóstico.
FinanciaciónNinguna.
Consideraciones éticasNinguna.
Vídeo 1. Corte transversal laterocervical derecho. Se observa lóbulo tiroideo derecho en corte transversal, arteria carótida común y vena yugular interna. Ascendiendo hacia craneal se observa abombamiento carotídeo (región de bulbo carotídeo) y posteriormente bifurcación carotídea. Arteria carótida interna, generalmente más medial y profunda, y carótida externa, más superficial y externa.
Vídeo 2. Corte longitudinal de carótida común, bulbo carotídeo, carótida interna (más profunda) y externa (más superficial). Se observan placas hiperecogénicas algo heterogéneas en bulbo carotídeo y origen de la carótida externa, así como una pequeña en carótida interna.
Vídeo 3. Corte transversal a nivel inguinal en la extremidad inferior derecha. Se observan 2 estructuras vasculares: la medial (derecha de la imagen), de mayor tamaño, ovoidea, corresponde a la vena femoral común; la más lateral (derecha de la pantalla) corresponde a la arteria femoral común. En el barrido hacia craneal se observa cómo la arteria femoral común se bifurca en femoral profunda (más posterior) y arteria femoral superficial (más anterior). Puede observarse la doble línea que conforma el complejo íntima-media arterial.
Vídeo 4. Corte paraesternal longitudinal (eje largo) donde se aprecia un engrosamiento de las paredes ventriculares: septo interventricular y en menor medida pared posterior, en paciente con hipertensión arterial e hipertrofia ventricular izquierda.
Vídeo 5. Corte longitudinal en epigastrio donde se observa arteria aorta abdominal que muestra una dilatación tubular homogénea, en un nivel supra e infrarrenal, ya que se prolonga más allá del centímetro de la salida de la arteria mesentérica superior (imagen vascular que discurre paralela a la aorta en un plano más anterior). Corresponde a aneurisma de aorta abdominal.