Presentamos el caso de un paciente de 53 años con enfermedad de Crohn en tratamiento con azatioprina al que se le diagnosticó de hiperplasia nodular regenerativa secundaria a este tratamiento tras detectar alteraciones analíticas en el perfil hepático y signos ecográficos y endoscópicos de hipertensión portal. El diagnóstico se estableció mediante biopsia hepática, que mostró las alteraciones de la arquitectura hepática características de esta entidad. La evolución al suspender al tratamiento fue buena, resolviéndose completamente las alteraciones analíticas al cabo de un año.
En este artículo se realiza una descripción de la incidencia y las principales características clínicas de este efecto adverso a los fármacos tiopurínicos.
We report the case of a 53-year-old man with Crohn's disease who developed azathioprine-induced nodular regenerative hyperplasia of the liver. The diagnosis was suspected when abnormalities in liver function tests were observed and transabdominal ultrasonography and upper gastrointestinal endoscopy showed signs of portal hypertension. The final diagnosis was established by liver biopsy, showing the characteristic alterations in liver architecture. Outcome was favorable after treatment discontinuation, with complete normalization of liver function tests within a year.
The present article describes the incidence and the main clinical characteristics of this adverse effect to thiopurines.
El tratamiento con azatioprina, fármaco inmunosupresor de la familia de las tiopurinas, está indicado en pacientes con enfermedad inflamatoria intestinal fundamentalmente para el mantenimiento de la remisión, aunque también son indicaciones la enfermedad fistulizante, la profilaxis pos-cirugía y el tratamiento de las manifestaciones extraintestinales1. Los efectos secundarios de este fármaco son frecuentes y pueden ser causa de suspensión del tratamiento hasta en un 15% de pacientes2. Actualmente se clasifican en alérgicos o idiosincrásicos y en dosis-dependientes. La hepatotoxicidad se observa hasta en un 3,3% de los pacientes tratados con tiopurinas y habitualmente se clasifica en tres síndromes fundamentales: síndrome de hipersensibilidad, reacción colestásica idiosincrásica y la hepatotoxicidad dosis-dependiente secundaria a lesión endotelial, que englobaría la hiperplasia nodular regenerativa, la enfermedad veno-oclusiva y la peliosis hepática2,3.
Caso clínicoSe trata de un varón de 53 años diagnosticado de enfermedad de Crohn en 2002 mediante colonoscopia y tránsito gastrointestinal. Presentaba una localización ileocólica (L3), con patrón fistulizante (B3) por fístula interna-enteroentérica y sin afectación perianal. Tras el diagnóstico se instauró tratamiento con mesalazina (500mg cada 8 horas) y azatioprina (75mg diarios), consiguiendo buen control clínico y analítico.
En diciembre de 2006 acudió a la consulta monográfica de Enfermedad Inflamatoria Intestinal del Hospital Universitario de La Princesa por un cuadro de diarrea de dos años de evolución (3 deposiciones diarias semilíquidas), dolor abdominal acompañado de vómitos ocasionales, pérdida de 5kg de peso y artralgias frecuentes en las manos. Inició tratamiento con esteroides (0,8mg/kg/día) por brote moderado de enfermedad de Crohn, con mejoría clínica, y se ajustó la dosis de azatioprina a 2,5mg/kg/día (200mg diarios).
A los 7 meses del aumento de la dosis de azatioprina se detectó en un análisis de control una alteración del perfil hepático, con patrón de la colestasis, con los siguientes datos analíticos: AST 57 U/l (4-32), ALT 31 U/l (5-31), FA 159 U/l (35-104), GGT 180 U/l (7-32), bilirrubina total 1,19mg/dl (0,2-1,3). Esta alteración se confirmó en la revisión realizada unas semanas después (AST 113 U/l, ALT 61 U/l, FA 284 U/l, GGT 462 U/l, bilirrubina total 2,2mg/dl). La albúmina y la actividad de protrombina eran normales, pero destacaba una plaquetopenia de 79.000/mm3 (115.000-450.000). Las serologías víricas, los parámetros de autoinmunidad, los niveles de alfa-1 antitripsina y el metabolismo del hierro y el cobre fueron normales. Se le realizó una ecografía abdominal, en la que se observaron datos de hipertensión portal (bazo de 15cm de eje mayor y porta de 14mm de diámetro) y de hepatopatía crónica (tamaño normal, bordes ligeramente nodulares y ecoestructura en grano grueso y heterogenea). En la endoscopia digestiva alta, se observaron varices esofágicas pequeñas. Por último, se le realizó una colangiorresonancia magnética para descartar posibles anomalías estructurales de la vía biliar u otras alteraciones del parénquima hepático, objetivándose únicamente los datos de hipertensión portal previamente descritos en la ecografía abdominal.
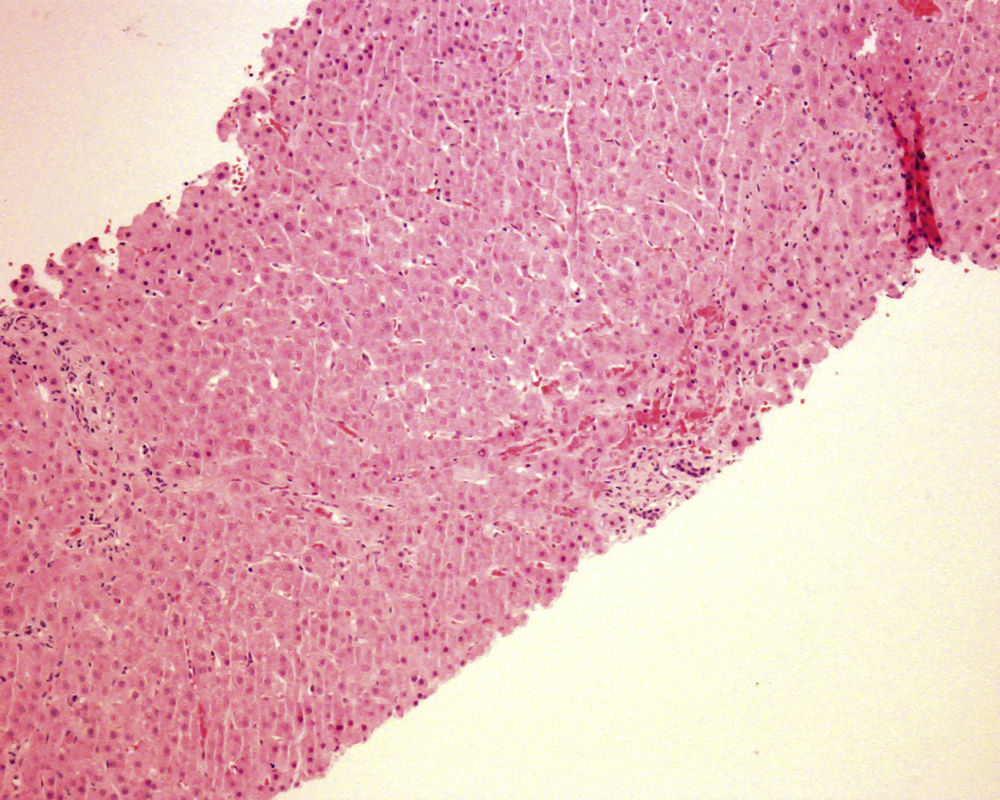
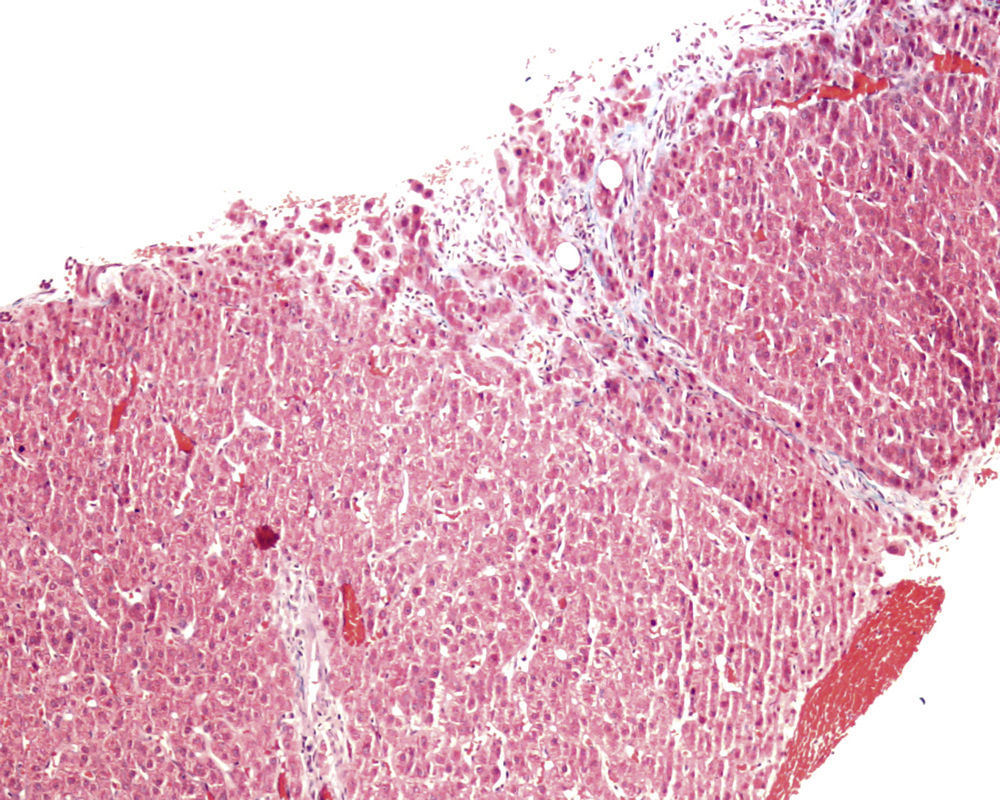
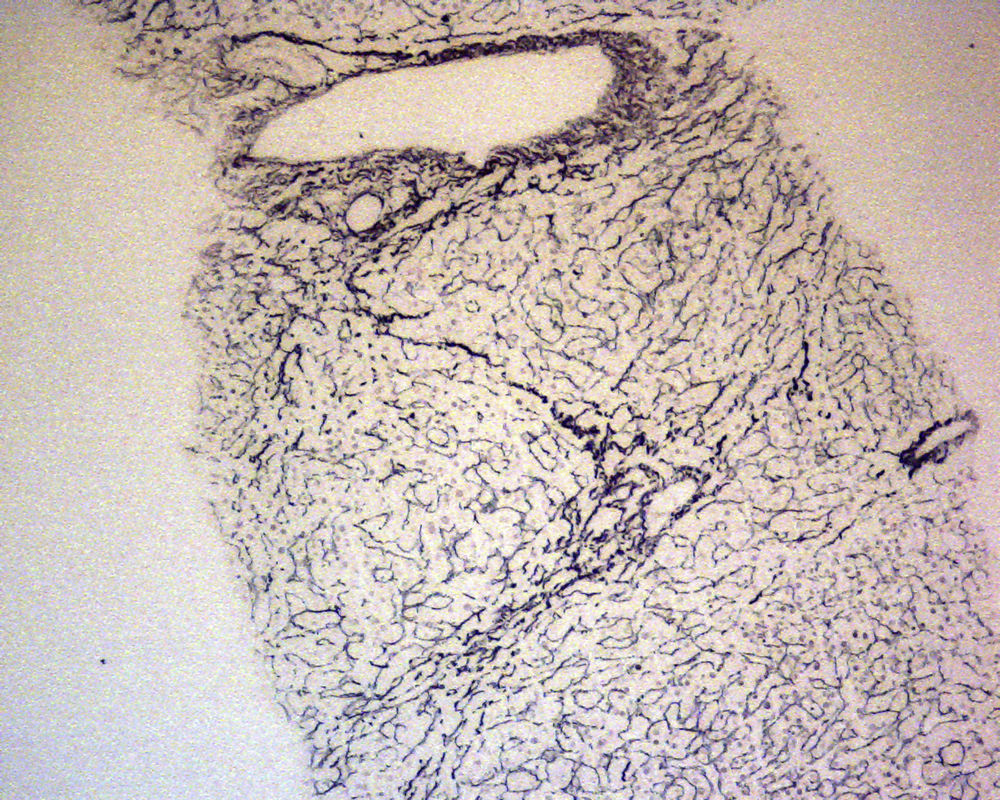
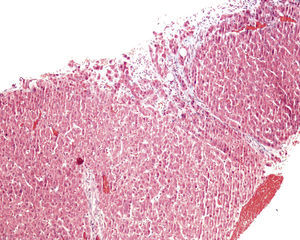
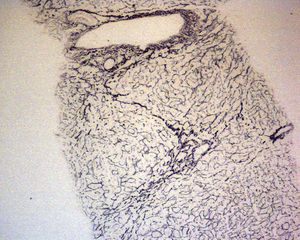
En ese momento se suspendió el tratamiento con azatioprina y se realizó una biopsia hepática. El estudio anatomopatológico identificó una moderada alteración arquitectural, con fibrosis portal y sinusoidal irregular, nódulos de regeneración formados por hepatocitos ligeramente aumentados de tamaño, dispuestos en trabéculas engrosadas, muy evidentes con la tinción de reticulina (fig. 1), y ligeras alteraciones vasculares como la congestión sinusoidal (fig. 2) o la fibrosis perivenular (fig. 3). Asimismo se identificaron zonas de atrofia hepatocitaria. Estos hallazgos eran compatibles con el diagnóstico de hiperplasia nodular regenerativa.
En controles analíticos sucesivos se objetivó una mejoría progresiva de las cifras de aminotransferasas, enzimas de colestasis y bilirrubina, así como el aumento de las plaquetas, que se produjo de forma lenta y progresiva, hasta la normalización de las mismas un año después de haber suspendido el tratamiento con azatioprina. Se realizó una ecografía abdominal de control, evidenciándose la desaparición de los signos de hipertensión portal (porta de 12mm, bazo de 11,5cm).
DiscusiónLa mercaptopurina y su profármaco, la azatioprina, son inmunomoduladores que actúan por medio de sus metabolitos activos, los nucleótidos de la 6-tioguanina. Alcanzan su máxima eficacia aproximadamente a los 3 meses y se usan habitualmente para tratar pacientes con enfermedad de Crohn o colitis ulcerosa que son corticodependientes, para mantener la remisión sin esteroides.
La incidencia de efectos adversos debidos a estos fármacos es del 15%, y motivan la suspensión del tratamiento en aproximadamente el 10% de los pacientes1. Los efectos secundarios de las tiopurinas se clasifican en idiosincrásicos y en dosis-dependientes; dentro de los primeros, se encuentran las reacciones de hipersensibilidad en forma de rash, fiebre o artralgias, la pancreatitis aguda y algunos casos de toxicidad hepática. Dentro de los segundos encontramos la mielosupresión y algunos casos de hepatotoxicidad2. Se han descrito hepatitis agudas tanto de predominio hepatocelular como colestásicas durante la terapia con azatioprina/mercaptopurina, con una prevalencia del 3,3% y una incidencia anual del 1,4%2. Como sucede con otros fármacos, el daño hepático por tiopurinas ocurre con mayor frecuencia en los primeros meses de tratamiento y puede ser asintomático o manifestarse con síntomas inespecíficos como náuseas, cefalea, astenia o dolor abdominal, que generalmente ceden al reducir la dosis o suspender el fármaco3.
En la mayoría de los casos, las elevaciones leves de aminotransferasas se normalizan espontáneamente durante el seguimiento, incluso manteniendo la misma dosis de tiopurina. Cuando la alteración del perfil hepático es moderada se puede intentar reducir la dosis del fármaco al 50%, y si no se confirma mejoría o existe una ictericia clínicamente evidente se debe suspender el tratamiento, siendo muy inusual que no se resuelva el cuadro tras la retirada del fármaco2,4.
Existen varias formas de hepatotoxicidad por tiopurinas, que se clasifican en tres síndromes fundamentales: síndrome de hipersensibilidad, en el que los signos y síntomas de hepatotoxicidad ocurren en las primeras 2-3 semanas de tratamiento; reacción colestásica idiosincrásica, en la que aumentan de forma llamativa la bilirrubina y la fosfatasa alcalina junto a una moderada elevación de aminotransferasas (histológicamente la colestasis se acompaña de un grado variable de necrosis hepatocelular). El tercer síndrome sería la hepatotoxicidad dosis-dependiente secundaria a lesión endotelial, que engloba la hiperplasia nodular regenerativa, la enfermedad veno-oclusiva y la peliosis hepática2,5.
La hiperplasia nodular regenerativa es un tipo de lesión dosis dependiente caracterizada por el daño de las células endoteliales de los sinusoides y las vénulas hepáticas, que deriva en la oclusión no trombótica de los vasos y la posterior aparición de fibrosis e hipertensión portal. Actualmente corresponde a una variante histológica de la hipertensión portal idiopática6. Suele aparecer entre los 3 meses y los 3 años de tratamiento con tiopurinas2,5 y la patogénesis exacta es desconocida, aunque parece estar relacionada con la depleción de glutatión por el uso de azatioprina, mercaptopurina y sobre todo con los 6-tioguanina2,7-10. La hiperplasia nodular regenerativa puede producir hipertensión portal no cirrótica con aparición de varices esofágicas, esplenomegalia y ascitis, y esto puede ocurrir incluso sin observarse alteraciones analíticas en el perfil hepático7,11,12, por lo tanto se debe considerar la realización de biopsia hepática en todos los pacientes con signos de hipertensión portal de origen incierto que estén tomando tiopurinas, aunque no presenten alteraciones analíticas. En nuestro caso se indicó la biopsia hepática tanto por los datos de hipertensión portal como por la persistencia de las alteraciones analíticas.
La evolución de la hiperplasia nodular regenerativa al suspender los fármacos tiopurínicos es habitualmente buena, con normalización de las alteraciones analíticas y regresión de los signos de hipertensión portal, aunque la evidencia es muy escasa acerca de la historia natural2. Algunos autores han demostrado que las alteraciones de las enzimas hepáticas mejoran al suspender el tratamiento con tiopurínicos13-15. Sin embargo, también hay casos descritos en la literatura en los que no se produce dicha mejoría con la suspensión de las tioguaninas15.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| Edad al diagnóstico (A) |
| A1- ≤16 años |
| A2- 17-40 años |
| A3- >40 años |
| Localización (L) |
| L1- Ileon terminal |
| L2- Colon |
| L3- Ileocólica |
| L4- Tracto digestivo alto |
| L1+L4 (tracto digestivo alto+ileon terminal) |
| L2+L4 (tracto digestivo alto+colon) |
| L3+L4 (tracto digestivo alto+ileocólica) |
| Patrón clínico (B) |
| B1- No estenosante, no fistulizante, o inflamatorio |
| B2- Estenosante |
| B3- Fistulizante (si no se explicita B3p, es que no se trata de fístulas perianales) |
| B1p (inflamatorio con enfermedad perianal asociada) |
| B2p (estenosante con enfermedad perianal asociada) |
| B3p (fistulizante con enfermedad perianal asociada) |