La leishmaniasis tegumentaria (LT) es causada por parásitos del género Leishmania y transmitida por especies de flebótomos, insectos pertenecientes al orden Diptera, familia Psychodidae. El objetivo de este trabajo fue analizar la presencia de casos de LT y su variación temporal entre 1985 y 2019, las formas clínicas, la ubicación de las lesiones en los pacientes y la presencia de flebótomos en la localidad de Colonia Santa Rosa, del norte de Argentina. Los pacientes se diagnosticaron mediante frotis e intradermorreacción de Montenegro. Se colocaron trampas CDC en 14 sitios en el horario de 19 a 7. Se diagnosticaron 120 casos de LT y la prevalencia global fue del 0,75% (≈16.000 habitantes). Los pacientes presentaron formas cutáneas simples y múltiples (88,79%) y mucocutáneas (10,83%). Las lesiones cutáneas fueron más frecuentes en extremidades inferiores. Del total de flebótomos, Nyssomyia neivai fue la especie predominante (95%), y, en menor proporción, estuvieron presentes Migonemyia migonei (1,9%), complejo cortelezzii (1,3%) y Evandromyia sallesi (0,09%). La persistente ocurrencia de casos y la presencia de flebótomos en la citada localidad nos sugiere la transmisión endémica en la zona. Esto señala la necesidad de planificar medidas preventivas y de control de la LT en el norte de Argentina.
Tegumentary leishmaniasis (TL) is caused by parasites of the genus Leishmania and transmitted by the sandfly species, insects belonging to the order Diptera, family Psychodidae. Historically, the most endemic area of TL in Argentina has been the northern region. The aim of this work was to analyze the presence and temporal variation of TL cases reported between 1985 and 2019 in Colonia Santa Rosa locality, northern Argentina. Furthermore, its clinical forms were characterized and sandflies were captured. Patients were diagnosed by smear and the Montenegro skin test. For sampling, CDC light traps were placed at 14 sites from 7pm to 7am. The correlation between vegetation cover and sandfly abundance was also studied. One hundred and twenty TL cases were diagnosed and the overall prevalence was 0.75% (≈16 000 inhabitants). Patients presented simple and multiple cutaneous leishmaniasis (88.79%) and the mucocutaneous form (10.83%). Skin lesions were more frequent on the lower extremities (46.73%). Of the total number of sandflies, Nyssomyia neivai (95%) was the predominant species followed by Migonemyia migonei (1.9%), cortelezzii complex (1.3%) and Evandromyia sallesi (0.09%). The persistent occurrence of cases and the presence of sandflies in the locality suggest the existence of endemic transmission in the area. This highlights the need to design prevention and control measures for TL in northern Argentina.
Las leishmaniasis son un grupo de enfermedades que actualmente son endémicas en 98 países, con una incidencia anual de 2 millones de casos en el mundo, especialmente en áreas tropicales y subtropicales16,35. Este conjunto de enfermedades es causado por parásitos protozoarios intracelulares del género Leishmania (Kinetoplastida: Trypanosomatidae), que se transmiten a los humanos por la picadura de flebótomos hembra de la subfamilia Phlebotominae (Diptera: Psichodidae)34. Las leishmaniasis incluyen dos cuadros clínicos principales denominados leishmaniasis visceral y leishmaniasis tegumentaria (LT)35.
La LT es una enfermedad zoonótica y su transmisión ocurre casi exclusivamente en ambientes silvestres, por lo que los hombres en edad productiva que trabajan en actividades rurales o de desmonte suelen ser los más afectados41,43. Sin embargo, los ciclos de transmisión parecen estar adaptándose a ambientes peridomésticos y el área de transmisión se está extendiendo hacia zonas antes consideradas no endémicas como resultado de la urbanización y la deforestación no controlada, con animales domésticos como reservorios potenciales24,46,47. Además, las dificultades económicas, los desastres naturales, el avance de la frontera agrícola, la explotación maderera y el turismo hacen que las poblaciones susceptibles migren a áreas endémicas de LT, donde la alta exposición y el riesgo de infección desencadenan brotes o epidemias8,9,35.
En América, la LT es un término que se refiere a un amplio espectro de manifestaciones clínicas cutáneas, como la leishmaniasis cutánea simple y la leishmaniasis cutánea múltiple, caracterizadas por la presencia de una o más lesiones ulcerativas que se desarrollan en el sitio de picadura del vector. La úlcera característica es generalmente redondeada, indolora, con bordes bien definidos, regulares, elevados e indurados35. Por otra parte, la leishmaniasis cutánea difusa se caracteriza por la presencia de nódulos no ulcerativos múltiples, con abundantes parásitos, y se asemeja a la lepra35.
La leishmaniasis mucocutánea (LMC) consiste en la hiperinflamación de mucosas que puede desarrollarse meses o años después de que aparezca una úlcera cutánea, e, incluso después de su cicatrización20. Aunque puede haber LMC sin que existan antecedentes de LT, normalmente los parásitos hacen metástasis desde lesiones cutáneas hasta la mucosa nasal. La evolución de esta forma clínica puede provocar la destrucción del tabique nasal y el compromiso grave del paladar, la faringe y la laringe, lo que puede conllevar la deformación y mutilación del paciente y el surgimiento de dificultades para la alimentación, la respiración y la fonación36.
En América, la presencia de casos de LT se extiende desde el sur de los Estados Unidos hasta el norte de Argentina. Cerca de 95% de los casos de LT ocurren en América, el Mediterráneo y Asia. Por su parte, la LMC tiene lugar, principalmente, en la región de América, con Bolivia, Brasil y Perú entre los países más afectados28,29. En América, se registraron 940.396 casos de LT y LMC, con un promedio anual de 55.317 casos, entre los años 2001 y 2017. Particularmente en 2017 se reportaron 49.959 casos de LT, de los cuales el 41,3% pertenecieron a la región andina, el 35,9% al Cono Sur, el 20,8% a Centroamérica y el resto de los casos se registraron en México y el Caribe29.
En Argentina, la LT es endémica en un área que abarca nueve provincias y cuatro ecorregiones. Desde la década 1980-1989 se ha venido notando un incremento de la frecuencia, intensidad y distribución de los brotes y epidemias. En la provincia de Salta, la LT se distribuye en varios departamentos; particularmente Orán presenta zonas hiperendémicas y constituye la región más afectada de Argentina14,19,39,42,44. Las especies de Leishmania responsables de causar LT en Argentina son Leishmania (Viannia) braziliensis, Leishmania (Viannia) guyanensis, Leishmania (Viannia) panamensis y Leishmania (Leishmania) amazonensis; la primera es la de mayor prevalencia en el país10,21–23.
En cuanto a los flebótomos, las primeras capturas en la provincia de Salta datan de 1926 y 1927, en San Martín del Tabacal y en la localidad de Embarcación, correspondientes a los departamentos de Orán y General José de San Martín, respectivamente. En ese momento solo se encontraron ejemplares de Migonemyia migonei25,26,30. Más recientemente, varios estudios entomológicos reportaron la presencia de las especies Nyssomyia neivai, Mg. migonei, complejo cortelezzii, Evandromyia sallesi, Psathyromyia shannoni s.l., Psathyromyia punctigeniculata, Mycropygomyia quinquefer, Brumptomyia sp. y Lutzomyialongipalpis1,3,4,6,19,32,40. Se sospecha que las especies Ny. neivai, Mg. migonei y el complejo cortelezzii son vectores de L. (V.) braziliensis en el norte de Argentina29,31,34; mientras que Lu. longipalpis y Mg. migonei actúan como vectores de Leishmania (Leishmania) infantum en las zonas del mismo país en las que la leishmaniasis visceral está presente2,3,39.
Aunque numerosas localidades del norte de Argentina reportan casos de LT, algunas de manera esporádica, se desconoce si en dichas áreas hay transmisión endémica o si los casos reportados son producto de la migración, fenómeno en el que las personas se desplazan a las zonas endémicas y vuelven infectados a su ciudad de origen. Es por ello que el objetivo del presente trabajo fue analizar la presencia de casos de LT y su variación temporal, y la distribución y abundancia de las especies de flebótomos en la localidad de Colonia Santa Rosa, ubicada en el departamento de Orán, provincia de Salta. Se analizaron la frecuencia de los diferentes cuadros clínicos, su distribución por edad y su localización en el cuerpo de los pacientes. Con esto se pretende actualizar el conocimiento necesario para mejorar el diseño de medidas preventivas y de control en la región.
Materiales y métodosÁrea y población de estudioLa localidad de Colonia Santa Rosa se encuentra al noroeste de la provincia de Salta, en el departamento de Orán (23° 23’ 35.42” S, 64° 25’ 33.07”) (fig. 1). Presenta un clima subtropical húmedo y diversos tipos de ambientes, como los urbanos, los periurbanos, los silvestres, los de vegetación secundaria y las áreas rurales.
Se realizó un estudio epidemiológico descriptivo y retrospectivo en tiempo-espacio-persona. La población de estudio incluyó casos de pacientes diagnosticados en el Instituto de Investigaciones de Enfermedades Tropicales de la Universidad Nacional de Salta, Argentina. Se utilizó una base sin los datos personales de los pacientes, que incluye el registro de casos desde 1985 hasta 2019. El criterio de inclusión de los casos consideró: a) pacientes residentes en Colonia Santa Rosa al momento del diagnóstico; b) pacientes con una o más úlceras compatibles con LC o LMC; y c) pacientes con resultado positivo por frotis y/o intradermorreacción de Montenegro (IRM)6,18.
Los datos demográficos de los censos 1991, 2001 y 2010 por edad y sexo de Colonia Santa Rosa se obtuvieron de la Dirección de Estadísticas y Censos de la Provincia de Salta. Los tamaños poblacionales para el resto de los años se interpolaron mediante regresión lineal y se estimó la población para el año de la mitad del período de estudio de esta localidad.
Se estimaron las prevalencias por año (Pa: casos/año dividido población/año) y general (Pt: casos totales dividido el tamaño de la población para la mitad del período de estudio, estratificadas por grupos etarios y sexo). También se analizaron los cuadros clínicos y la ubicación de las lesiones.
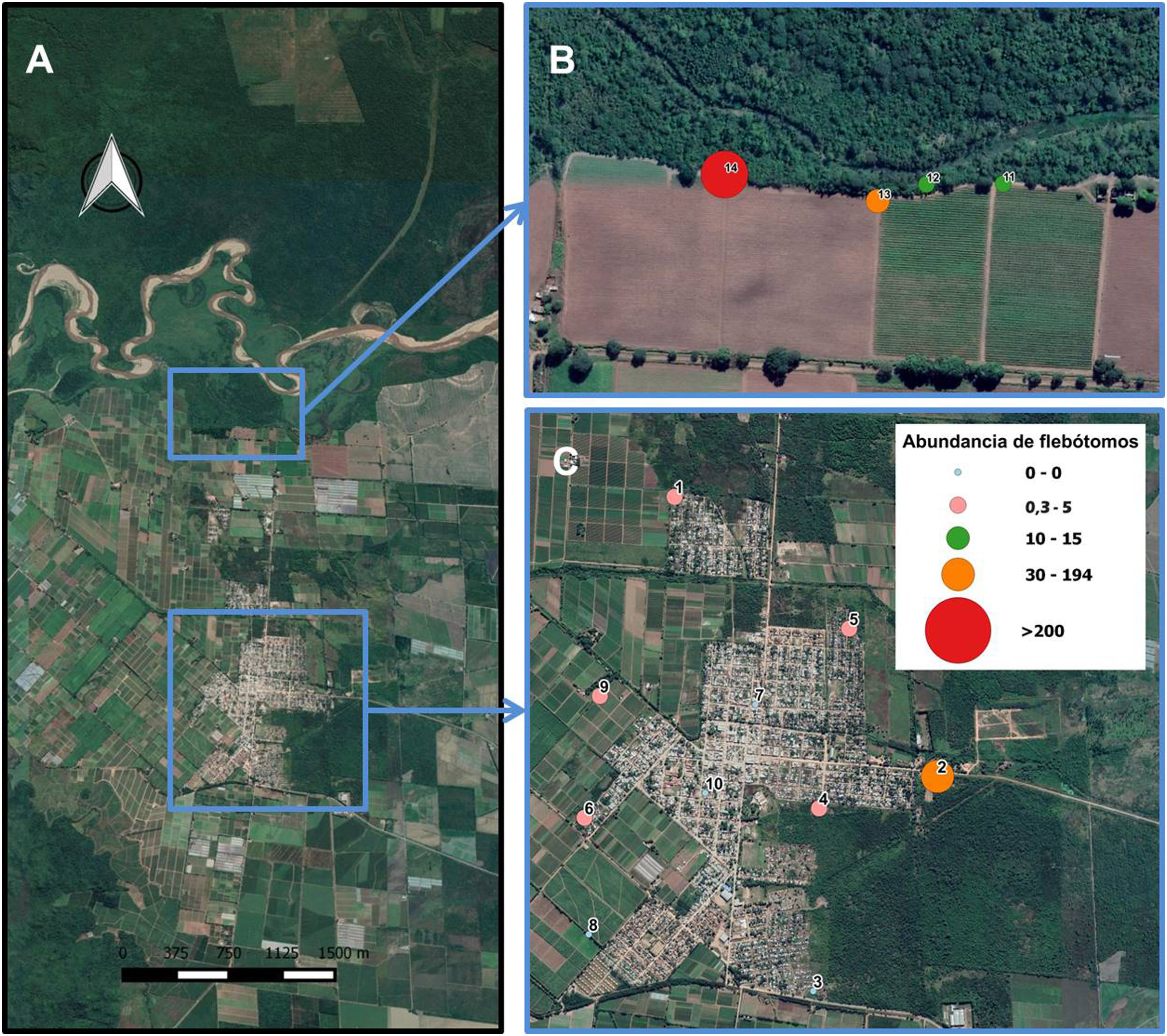
Muestreo entomológico e identificación de especiesLos muestreos se realizaron durante 4 noches (en las que no hubo precipitaciones) entre los días 27 y 30 de enero de 2016, utilizando trampas CDC colocadas entre las 19:00 y las 7:00 horas42. Las trampas se colocaron una noche en el borde de vegetación colindante a un área rural (sitios 11 a 14) y 3 noches distribuidas en la ciudad (sitios 1 a 10). Los sitios en el área urbana incluyeron casas o vegetación, tanto en el centro como en los bordes de la ciudad. Los sitios fueron seleccionados de tal modo que cubriesen lo más homogéneamente posible la ciudad, según la accesibilidad y la predisposición para participar del estudio de los propietarios de las viviendas o terrenos. Los ejemplares se conservaron en tubos eppendorf con alcohol 70% hasta su clarificación, montaje y posterior caracterización taxonómica4,6.
Los especímenes se identificaron siguiendo la clave de Galati (2003)12 mediante la observación de cibarios –espermatecas (en el caso de las hembras) y cibarios– genitalias (en el caso de los machos). Además, se calculó la proporción relativa de especies como el número de flebótomos de una especie dada sobre el total de ejemplares capturados.
Análisis estadísticoUtilizando el software Quantum GIS se construyeron mapas temáticos con símbolos graduados para representar la distribución y abundancia de las distintas especies de flebótomos (por sitio/noche). Las comparaciones de abundancia de flebótomos (por especie/sitio/noche) y de prevalencia de casos de LT por edad y sexo se realizaron usando la prueba de Chi cuadrado. Se consideró la existencia de diferencias estadísticamente significativas cuando p < 0,05 para un nivel de confianza del 95%.
Aspectos éticosEl trabajo contó con la aprobación de la Comisión Asesora de Docencia e Investigación del Hospital San Vicente de Paul, departamento de Orán, provincia de Salta.
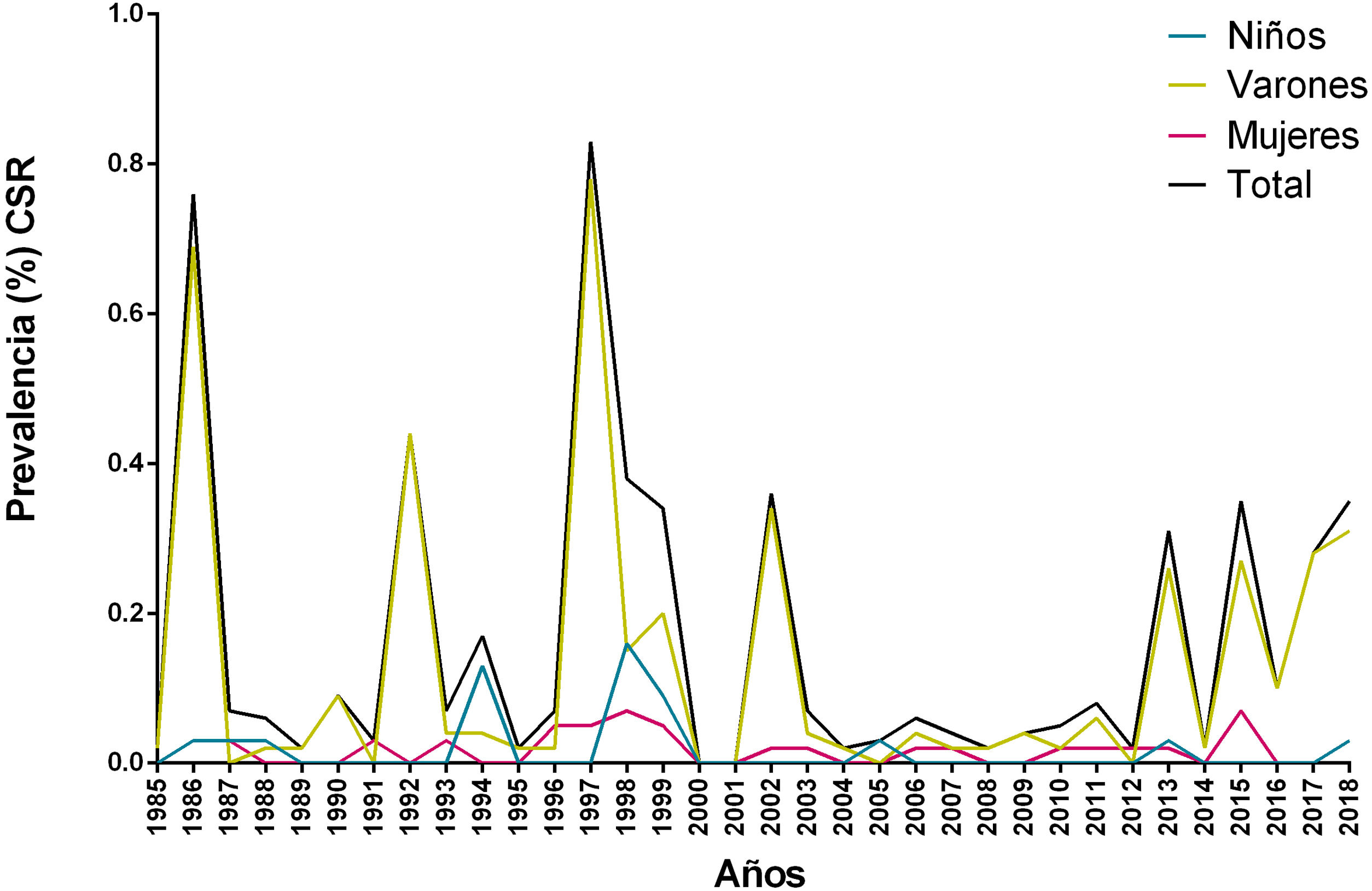
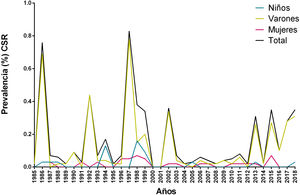
ResultadosEntre 1985 y 2019 se diagnosticó un total de 120 casos de LT y la prevalencia global fue del 0,75%, mientras que la prevalencia por año varió entre 0 y 0,83%, con un promedio de 0,16% y una desviación estándar de 0,21%. Los mayores picos de prevalencia se dieron en los años 1986 (0,76%) y 1997 (0,83%) (fig. 2). La prevalencia de LT fue más elevada en varones adultos mayores de 64 años (2,94%) seguida por la de varones de entre 15 y 64 años (1,38%); en ambos casos, los valores fueron mayores que los observados en las mujeres (tabla 1).
Prevalencia de leishmaniasis tegumentaria en Colonia Santa Rosa, por edad y sexo
| Sexo | Edad (años) | Casos | Población | Prevalencia * 100 habitantes |
|---|---|---|---|---|
| Varones | 0-14 | 14 | 3300 | 0,42 |
| 15-64 | 64 | 4637 | 1,38 | |
| >64 | 9 | 306 | 2,94 | |
| Total | 90 | 8243 | 1,09 | |
| Mujeres | 0-14 | 4 | 3220 | 0,12 |
| 15-64 | 25 | 4302 | 0,58 | |
| >64 | 0 | 250 | 0 | |
| Total | 30 | 7772 | 0,39 | |
| Total | 0-14 | 18 | 6520 | 0,28 |
| 15-64 | 89 | 8939 | 1 | |
| >64 | 9 | 556 | 1,62 | |
| Total | 120 | 16015 | 0,75 |
La estimación del tamaño poblacional (para el año de la mitad del período de estudio) se realizó mediante extrapolación usando los datos de los años 1981, 1991, 2001 y 2010.
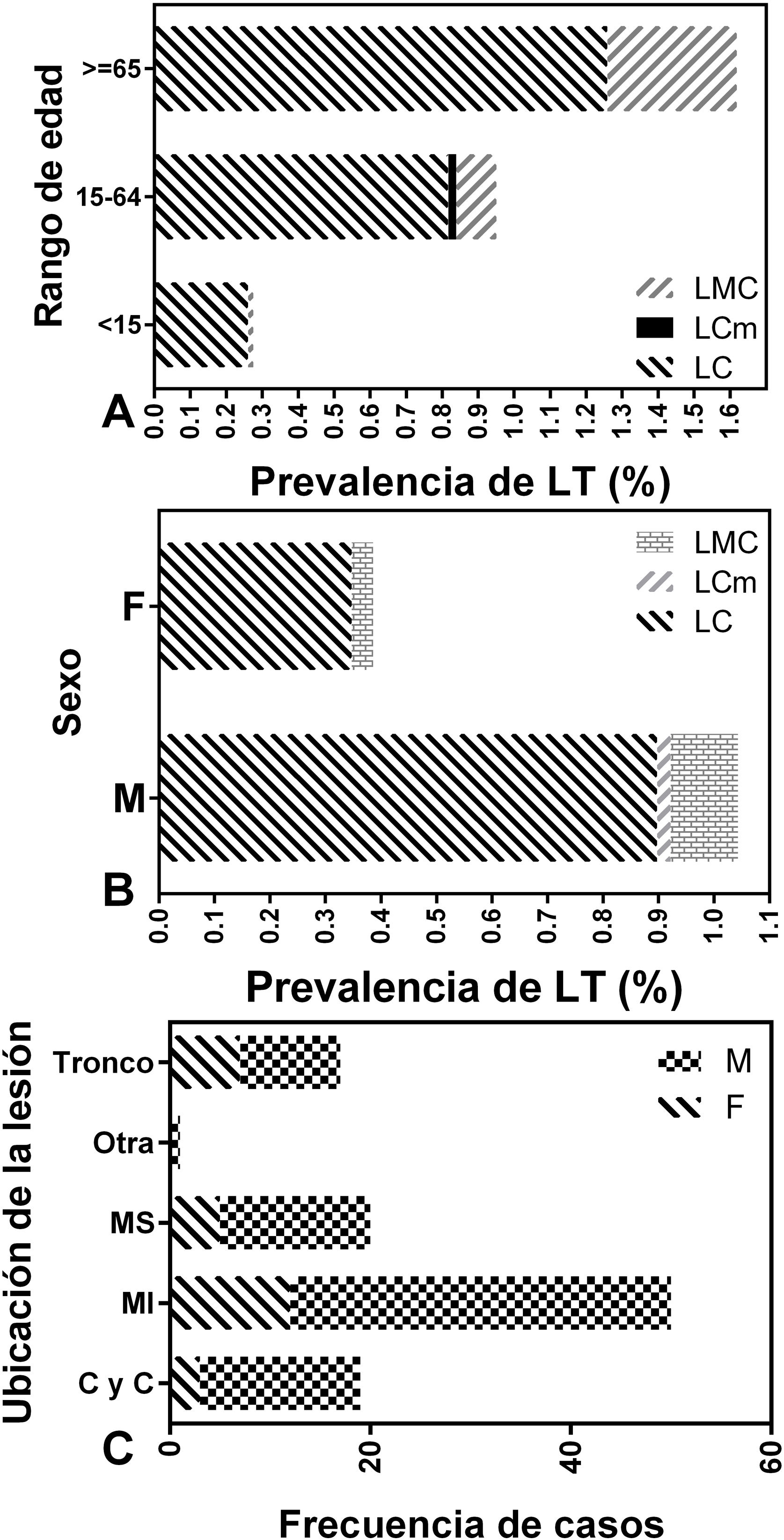
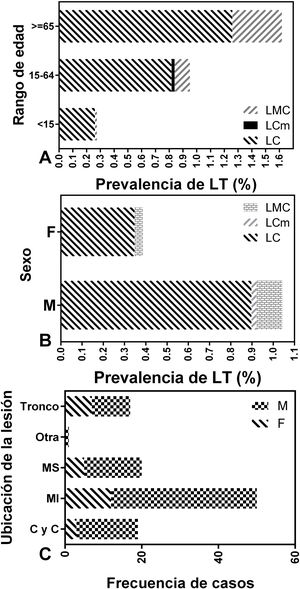
La forma clínica predominante en los pacientes de la localidad de Colonia Santa Rosa fue la LC en todos los grupos etarios y en ambos sexos. El 88,79% de los casos padecieron formas cutáneas simples y múltiples, mientras que la forma mucocutánea apareció en un 10,83% de los pacientes. La presencia de LMC fue mayor en varones de entre 15 y 64 años y la prevalencia de LC fue superior en el mismo segmento etario y en adultos mayores (65 años o más) respecto de los menores de 15 años (p<0,0001; fig. 3A). La prevalencia de LC fue mayor en varones que en mujeres (p<0,0001; fig. 3B).
Por otro lado, la ubicación predominante de las lesiones fue en los miembros inferiores (MI=46,73%) seguido de los miembros superiores (MS=18,69%) y, finalmente, en la cabeza y cuello (17,76%) y en el tronco (15,89%). Estas frecuencias no variaron según el sexo de los pacientes (p=0,47) (fig. 3C).
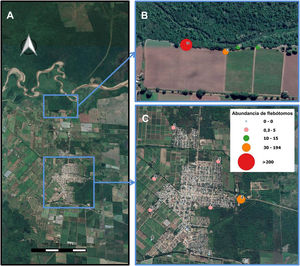
Se capturó un total de 436 flebótomos (12,82 flebótomos/noche/sitio), de los cuales 115 correspondieron a los sitios ubicados en la ciudad (fig. 4) y 321 al borde de vegetación en el área rural (fig. 4). El porcentaje de especies referido al total de flebótomos capturados fue el siguiente: Ny. neivai (95%), Mg. migonei (1,9%), complejo cortelezzii (1,3%), Ev. sallesi (0,09%) y sin identificar (sp: 1,3%); dichas frecuencias implican diferencias significativas (p<0,0001). Estos insectos estuvieron presentes en 6 de los 8 sitios de muestreo ubicados al borde de la ciudad y no se capturaron ejemplares en los sitios de muestreo centrales (fig. 4). En cuanto a las capturas en el borde de vegetación colindante al área rural, la especie mayoritaria también fue Ny. neivai.
Abundancia de flebótomos por noche de captura-trampa y su distribución espacial en Colonia Santa Rosa. A) Colonia Santa Rosa, los recuadros azules muestras la ubicación de los sitios de estudio. B) Sitios (11,12, 13 y 14) ubicados sobre un borde de vegetación colindante con un área rural. C) Sitios de muestreo ubicados en la ciudad. El color de la figura solo puede apreciarse en la versión electrónica de la revista.
En el presente trabajo se realizó una descripción epidemiológica de los casos de LT que tuvieron lugar en la localidad de Colonia Santa Rosa, provincia de Salta, entre los años 1985 y 2019. Se ha señalado que desde la ocurrencia de la primera epidemia de LT en el norte de Argentina en 1985-1987, la incidencia de las leishmaniasis ha aumentado significativamente en el país40; en el mismo sentido, el número de sitios con reporte de transmisión de LT ha crecido notoriamente14,15,41,43–45.
Históricamente, la LT ha sido considerada una enfermedad laboral, ya que por lo común, el grupo más afectado es el de varones en edad laboralmente activa, y se ha determinado que la infección es contraída, sobre todo, en áreas silvestres o rurales tras llevar a cabo trabajo de campo (como desmonte o cosecha), actividades recreacionales o de supervivencia (caza o pesca)13,47. Esto se debe a que las alteraciones antrópicas disminuyen la diversidad biológica y elimina a los hospedadores (no reservorios) que podrían generar un efecto de dilución de la infección. De esta manera, la probabilidad de contacto vector-reservorio se incrementa, lo que implica un aumento de la prevalencia de la infección, tanto en vectores como en reservorios y, en consecuencia, un mayor riesgo de transmisión a humanos5,17–19. El análisis de casos de la localidad Colonia Santa Rosa coincide con lo expuesto, ya que se observó una mayor prevalencia en pacientes mayores de 14 años respecto de la de niños, como así también una mayor prevalencia en varones que en mujeres (p<0,05).
La LC fue la forma clínica más frecuente, aunque también se reportaron casos de LMC. Estos cuadros clínicos y el predominio de lesiones en miembros inferiores son compatibles con la infección por L. (V.) braziliensis que, de hecho, es la especie típicamente aislada en la región estudiada21–23. Los primeros estudios sobre LMC en Salta reportaron proporciones de 2,6% y 3,9% con respecto al total de casos de LT10,45; sin embargo, en este trabajo se determinó una proporción del 10,8%, que concuerda con un estudio que abarcó un mayor número de casos y que reportó una proporción de LMC del 7% en el departamento de Orán18. Cabe destacar que esa proporción de casos de LMC es semejante también a la de Bolivia (10,1%) y Perú (8,2%)29.
La prevalencia global de LT fue del 0,75%, un poco superior a la prevalencia del 0,17% que se calculó para el año 2009 en la localidad de Hipólito Yrigoyen15. Sin embargo, estos valores de prevalencia parecen ser inferiores a los encontrados en 1990 en las localidades de Pichanal (5,3%), Embarcación (3,1%) y General Mosconi (3,2%)44. En las áreas rurales, las viviendas se encuentran emplazadas entre la vegetación silvestre residual y, por lo tanto, los flebótomos pueden colonizar el peri- e intradomicilio42.
Por su parte, la fauna flebotomínea de Colonia Santa Rosa fue más abundante en la vegetación del área rural, por lo cual la mayoría de los casos podrían ocurrir en zonas rurales o silvestres. Sin embargo, también se capturaron flebótomos en el área urbana, con una mayor abundancia en la periferia y sin presencia de estos en el centro de la ciudad. Este patrón de distribución es coincidente con el reportado en estudios entomológicos realizados en otras localidades del departamento de Orán; dichos estudios han propuesto la existencia de transmisión de leishmaniasis en los barrios periféricos, lo que explicaría la creciente prevalencia de infección en mujeres y en menores de 14 años4,6,14,15,40.
Una de las posibilidades es que los flebótomos lleguen a los barrios periféricos de las localidades mediante dispersión, con una dinámica metapoblacional del tipo fuente-sumidero, en la que dichos insectos mantienen poblaciones estables en la vegetación silvestre colindante5. El riesgo de transmisión de la LT se debería al hecho de que los flebótomos se infectarían en la vegetación silvestre residual al alimentarse de reservorios silvestres y luego, por dispersión, llegarían infectados a los barrios periféricos14. Es importante destacar que, de acuerdo con informes previos, la dispersión de los flebótomos es de aproximadamente 500 metros, por lo cual se deberían considerar intervenciones preventivas que incluyan el área de potencial diseminación de los vectores en los barrios periféricos colindantes a la vegetación silvestre11,29.
La especie dominante fue Ny. neivai, la que representó el 95% de los ejemplares recolectados. Esta especie suele ser la de mayor abundancia en los bordes de vegetación silvestre primaria o secundaria y en la cercanía de áreas modificadas antrópicamente19,33,40. Ny.neivai es la especie principalmente sospechada de transmitir L. (V.) braziliensis en Argentina y, en particular, en los departamentos de Orán y San Martín, en el norte de Salta, ya que suele encontrarse como especie mayoritaria o incluso como especie única en los sitios donde ocurren brotes de LT43.
Se han encontrado ejemplares del complejo cortelezzii infectados naturalmente por L. (V.) braziliensis en la provincia de Chaco, Argentina, por lo que dicho complejo también es considerado posible vector de LT37. Asimismo, se demostró que su abundancia en determinadas zonas endémicas es significativamente mayor que la de Ny. neivai37,38. En nuestra área de estudio, la abundancia del complejo cortelezzii y de Ev. sallesi fue menor que la de Ny. neivai, lo que sugiere que no actúan allí como principales vectores de LT.
A su vez, estudios realizados en Brasil han propuesto a Mg. migonei como vector de L. (L.) infantum en lugares donde hay ausencia de Lu. longipalpis7. En Argentina, M. migonei fue propuesto como vector putativo de L. (L.) infantum y, además, se lo encontró infectado naturalmente por esta especie de parásito27,39. Sobre la base de este hallazgo, la presencia de Mg. migonei en nuestras áreas de estudio pone en evidencia la necesidad de una vigilancia entomológica y epidemiológica de la leishmaniasis visceral en la región.
En este contexto, según la Organización Panamericana de la Salud, la distribución de la LT y el riesgo de su transmisión se pueden estratificar en zonas con transmisión y zonas sin transmisión y, dentro de esta última, el espacio geográfico se puede categorizar como vulnerable y no vulnerable29. En nuestra área de estudio se reportan casos frecuentemente, pero, hasta el momento, no se habían analizado las características epidemiológicas de aquellos y tampoco se habían llevado a cabo estudios entomológicos de flebótomos. Los resultados de este trabajo muestran que la transmisión en la localidad de Colonia Santa Rosa es sostenida a lo largo de los años y, además, reportamos la presencia de especies de flebótomos sospechadas de transmitir LT en el norte de Argentina. A partir de esta información se puede confirmar que la localidad de Colonia Santa Rosa debe ser incluida en el estrato de zonas con transmisión endémica29.
Una limitación del presente trabajo es el hecho de que hemos tenido que estimar los tamaños poblacionales con escasa información demográfica (años 1981, 1991, 2001 y 2010) y realizando extrapolaciones para los años de los que carecíamos de datos. Por ello puede existir algún grado mínimo de subestimación o sobreestimación de las prevalencias. Por otra parte, la IRM era recomendada como prueba diagnóstica por el Ministerio de Salud de la Nación, pero recientemente, dejó de serlo; sin embargo, el último manual de la OPS y un estudio de Krolewiecki et al. (2017) plantean que la IRM es una prueba inmunológica que puede ser de gran utilidad como complemento diagnóstico. Asimismo, el esfuerzo de captura de flebótomos fue limitado, lo cual puede hacer que otras especies presentes en la localidad no hayan sido detectadas. Del mismo modo, un escaso esfuerzo de captura puede dar resultados de ausencia de flebótomos, aun si existían poblaciones en el sitio de muestreo. Más allá de esto, consideramos que las especies de flebótomos que hemos capturado evidencian el riesgo de transmisión en el lugar.
Finalmente, en el presente trabajo se realiza una caracterización clínica y entomológica de una localidad del norte de Salta que no había sido estudiada antes respecto de la LT y sus posibles vectores. Los resultados demuestran que las características clínicas y epidemiológicas de los casos coinciden con los patrones de la leishmaniasis causada por L. (V.) braziliensis, tal como se reportó previamente en localidades vecinas. La confirmación de la presencia de flebótomos, tanto en los barrios periféricos como en el área rural de la localidad de Colonia Santa Rosa, subraya la necesidad de planificar medidas preventivas y de control para mitigar la incidencia de esta enfermedad que afecta principalmente a poblaciones pobres del norte de Salta.
FinanciaciónEste estudio fue financiado por el CIUNSa mediante el proyecto N̊2352, PMD N̊ 2697/0 y por el FONCyT mediante el PICT 4213-2016.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a todo el personal técnico del Instituto de Investigaciones de Enfermedades Tropicales de la Sede Orán de la Universidad Nacional de Salta.