INSUFICIENCIA RENAL EN EL PACIENTE TRASPLANTADO
La insuficiencia renal (IR) es una complicación frecuente en los pacientes con hepatopatía crónica en espera de trasplante hepático, especialmente en aquéllos con cirrosis en estadios terminales. Esta eventualidad también es relativamente frecuente en los pacientes sometidos a un trasplante hepático y va a complicar el manejo del enfermo, sobre todo si se requiere tratamiento sustitutivo renal en este período tan crítico del postoperatorio. La disfunción renal, en relación con el proceso del trasplante, puede presentarse en el período pretrasplante, en el período peri y postoperatorio inmediato y a largo plazo; sus causas y consideraciones serán diferentes1. Esta revisión va a centrarse en el manejo de la inmunodepresión en el trasplantado hepático que desarrolla IR en el postoperatorio inmediato.
La IR aguda es una complicación bien conocida en el postoperatorio inmediato del trasplante hepático, y su incidencia oscila entre el 12 y el 51% según los diferentes criterios utilizados para definirla en las distintas series2-7. Las causas de este fallo renal no suelen ser únicas, sino multifactoriales:
Pacientes trasplantados con una IR previa de cualquier etiología, como hipertensión arterial, diabetes mellitus, enfermedad hepatorrenal, crioglobulinemia o cualquier afección renal primaria.
Inestabilidad hemodinámica intraoperatoria, pues el riñón es un órgano especialmente sensible a las hipotensiones intraoperatorias y a los fármacos vasoactivos utilizados para corregirlas.
Acto quirúrgico dificultoso, prolongado y que requiera de múltiples transfusiones de hemoderivados.
Toxicidad medicamentosa, fundamentalmente por el uso de inhibidores de la calcineurina (ciclosporina y tacrolimus), que son la piedra angular de la inmunodepresión de inducción en los trasplantes de órganos. Más adelante comentaremos los mecanismos por los que estos fármacos producen nefrotoxicidad.
Disfunción del injerto hepático, que en caso de ser importante también va a provocar un deterioro progresivo de la función renal.
La mortalidad global de los pacientes que desarrollan IR aguda después de un trasplante hepático es muy alta (entre el 44 y el 50%)3,4. MaCauley et al5 observaron que la mortalidad de los pacientes que requerían hemodiálisis era del 35%, y que ascendía al 60% en los que requerían hemodiafiltración venovenosa continua. Estas cifras pueden ser aún mayores si la IR se acompaña de una mala función del injerto hepático6. Ante estos pobres resultados, indudablemente es importante diseñar unas estrategias generales para minimizar la incidencia de IR aguda en el postoperatorio inmediato del trasplantado, como serían: a) seleccionar mejores donantes y receptores con buena función renal, cuestión que escapa de los equipos de trasplantes, que tienen que optimizar el uso de los donantes que hay y trasplantar a aquellos receptores que más lo necesiten; b) evitar, en lo posible, la inestabilidad hemodinámica intraoperatoria, lo que no siempre se conseguirá, pero dependerá de que los equipos de anestesia prevean los acontecimientos hemodinámicos que se vayan produciendo durante la intervención, y c) evitar o reducir fármacos nefrotóxicos como los inhibidores de la calcineurina (ICN)5-7, para lo cual habrá que cambiar los diferentes protocolos de inmunodepresión de inducción, cuestión que desarollaremos a lo largo de esta revisión.
MECANISMOS DE NEFROTOXICIDAD AGUDA DE LOS INHIBIDORES DE LA CALCINEURINA
La ciclosporina y el tacrolimus son fármacos estructuralmente diferentes, pero con un mecanismo de acción muy parecido. Ambos inhiben la calcineurina, lo que da lugar a una alteración en la expresión de varios genes críticos en la activación de los linfocitos T, incluidos los de la interleucina 2. Su eficacia y nefrotoxicidad, tan similares, probablemente radican en su efecto inhibidor de la calcineurina.
La patogenia de la IR aguda asociada a ciclosporina y tacrolimus parece estar en relación con su potente efecto vasoconstrictor renal agudo, sobre todo en la arteriola aferente, que provoca un aumento de la resistencia vascular renal y, en consecuencia, una disminución de la perfusión renal, acompañada de una disminución del filtrado glomerular.
Esta toxicidad renal de los ICN tiene una serie de características. Depende de la dosis, por lo que la reducción de la dosis de ICN suele acompañarse, generalmente, de una mejoría de la función renal. Debido a lo anterior suele ser reversible, si bien, si no se corrige tempranamente, puede evolucionar hacia la IR crónica. Clínicamente se caracteriza por una oliguria acompañada de una baja fracción de excreción de sodio en orina, en ausencia de diuréticos distales. El sedimento urinario suele ser normal.
La prevalencia de los distintos tipos de nefrotoxicidad aguda se ha considerado muy similar entre la ciclosporina y el tacrolimus8. Sin embargo, recientemente se han publicado 2 estudios que comparan la hemodinámica renal en riñones de individuos sanos y en riñones trasplantados tras la toma de ciclosporina y tacrolimus. En ambas publicaciones se ha apreciado una nefrotoxicidad aguda (en términos de vasoconstricción renal e hipoperfusión cortical grave) mayor con el uso de ciclosporina que con tacrolimus9,10. Estas diferencias pueden ser importantes a la hora de diseñar un protocolo de inducción de protección renal, sobre todo al tratar con múltiples fármacos a enfermos que, además, en muchos casos ya llegan a la intervención con un cierto grado de disfunción renal previa (síndrome hepatorrenal).
PAUTAS DE INMUNODEPRESIÓN DE INDUCCIÓN EN PACIENTES CON INSUFICIENCIA RENAL AGUDA
Como hemos mencionado, los fármacos de más complejo manejo en el paciente que desarrolla IR aguda en el postoperatorio inmediato van a ser los ICN, de ahí que todas las posibles pautas de inducción de «protección renal» van a ir orientadas a la disminución de estos fármacos, al retraso en su introducción e incluso a la posibilidad de usar protocolos sin ICN. Esto último, si bien resulta atractivo y existe experiencia al respecto en el trasplante renal, es hoy por hoy casi anecdótico en el trasplante hepático, al estar basadas las pautas alternativas en la utilización de sirolimus (tabla I).
Actualmente no existen estudios prospectivos, aleatorizados, controlados y comparativos que demuestren cuál es la pauta que mejores resultados obtiene en este tipo de enfermos. La mayoría de los estudios son retrospectivos o piloto no comparativos, por lo que nos basaremos, fundamentalmente, en los resultados de estos últimos.
Dosis bajas de inhibidores de la calcineurina
En nuestro centro realizamos un estudio prospectivo piloto para el tratamiento de la IR aguda durante la primera semana postrasplante hepático11. En este estudio se incluyó a 25 enfermos de un total de 121 trasplantados entre enero 1999 y junio 2001, lo que supone un 21%. Cuando se diagnosticó la IR aguda (creatinina sérica > 2 mg/dl, aclaramiento de creatinina < 50 ml/min y/u oligoanuria refractaria a pesar de tratamiento intensivo correcto), se redujo la dosis de tacrolimus para mantener cifras entre 4 y 5 ng/ml, se mantuvo la dosis de esteroides y se administraron 2 dosis de basiliximab de 20 mg el día 0 (día del diagnóstico) y a los 4 días de la primera dosis. Si existía oligoanuria refractaria se aplicó tempranamente la técnica de hemodiafiltración venovenosa continua. Las concentraciones de tacrolimus se fueron incrementando progresivamente (hasta 8-12 ng/ml) cuando la creatinina bajó de 1,3 mg/dl y la diuresis fue eficaz.
A los 3 meses de seguimiento, 20 pacientes (80%) normalizaron su función renal. Esta mejoría de la función renal se observó sobre todo el día 5 de la administración de basiliximab. La creatinina media fue menor de 1,5 mg/dl a los 3 meses en este grupo. La incidencia de rechazos agudos fue del 28%, todos con biopsia hepática y corticosensibles. En 6 enfermos (24%) fue necesaria la hemodiafiltración venovenosa continua. La mortalidad fue del 20% (5 enfermos) debido a fallo multiorgánico e infección grave. No se observaron efectos adversos por la administración conjunta de tacrolimus y basiliximab.
Otra posibilidad, de la que hay muy pocas experiencias publicadas, sería el uso de valores bajos de ICN (50%) combinados con micofenolato mofetil (MMF) y esteroides. Quizá uno de los inconvenientes de esta pauta es el mayor retraso de la recuperación de la función renal, al ser más difícil una bajada rápida del ICN, pues el efecto inmunodepresor del MMF, aun administrado por vía venosa, es más tardío que el de los anti-CD25.
Introducción tardía de inhibidores de la calcineurina
La introducción tardía de los ICN apoyándose en anti-CD25, con/sin MMF, ha sido recientemente una de las pautas más usadas en el abordaje de la IR aguda pre y postrasplante. Las primeras experiencias de retraso en la introducción de los ICN, utilizando daclizumab, en el trasplante hepático, en pacientes sin IR, fueron desalentadoras. Hirose et al12 publicaron su experiencia, incluyendo un estudio piloto que tuvo que interrumpirse por los resultados tan desastrosos obtenidos. En este estudio se incluyó a 7 pacientes en quienes la inmunodepresión de inducción fue daclizumab (1 mg/kg en 5 dosis, con un intervalo de 2 semanas entre dosis), 3 g/día de MMF y esteroides. Los ICN se introdujeron a media de 36 días postrasplante. Presentaron rechazo agudo todos los pacientes, de los que 4 (57%) fueron corticorresistentes y requirieron OKT3. Sin embargo, en este mismo estudio, y fuera del estudio piloto, se presentó un protocolo similar en 17 pacientes con IR aguda en el que los ICN se introdujeron en la primera semana postrasplante. En este caso, la incidencia de rechazo agudo fue aceptable (35%), y más fácil de tratar. De ahí que se concluyera que en aquellos protocolos en que se retrase la administración de los ICN con el uso de anti-CD25 sería aconsejable no demorar su uso más de una semana, pues el anti-CD25 no sería una inmunodepresion suficiente.
Emre et al13 evaluaron la eficacia y seguridad del daclizumab en la prevención del rechazo agudo en 25 enfermos con deterioro de la función renal postrasplante hepático. A los pacientes con un valor de creatinina sérica mayor de 2 mg/dl se les sometió a un protocolo de inmunodepresión consistente en daclizumab a dosid de 1 mg/kg, 2 g de MMF y esteroides. El tacrolimus se instauró cuando mejoró la función renal (mejoría > 25% de las cifras de creatinina basal). El grupo de daclizumab se comparó con 2 grupos históricos también con IR, 56 pacientes tratados con OKT3 y 48 tratados con dosis bajas de tacrolimus. La recuperación de la función renal fue más rápida en el grupo con daclizumab, y el tacrolimus pudo introducirse a los 3,5 días postrasplante. También en este grupo hubo una menor incidencia de infecciones y un menor requerimiento de tratamiento sustitutivo renal que en los otros 2 grupos.
En nuestro centro está en marcha un nuevo protocolo de protección renal en trasplante hepático con IR, cuyos resultados preliminares se han presentado recientemente14. La pauta consiste en el retraso de la introducción de tacrolimus hasta el día 5 postrasplante, momento en que se introduce a niveles entre 6 y 8 ng/ml; la utilización de 2 dosis de daclizumab de 1 mg/kg los días 0 y 5-7 postrasplante, dosis decrecientes de esteroides y 2 g/día de MMF si a partir de la semana no se obtienen los valores de ICN deseados. El MMF se retirará paulatinamente (en el primer mes), cuando los valores de tacrolimus sean apropiados y la función renal se considere normal. Se ha incluido a 12 enfermos (creatinina sérica > 1,5 mg/dl y oligoanuria refractaria); 4 de ellos habían sido tratados previamente con terlipresina por síndrome hepatorrenal y 6 tuvieron necesidad de hemodiafiltración venovenosa continua. De los 12, recuperaron la función renal y sobrevivieron a los 3 meses 11 pacientes (92%). Uno falleció por fallo multiorgánico, aspergilosis pulmonar invasiva y mala función del injerto a los 28 días. La incidencia de rechazo agudo fue del 25%, todos sensibles a bolos de esteroides.
Yoshida et al15, en un estudio propectivo, aleatorizado, multicéntrico y abierto en trasplantes hepáticos, pero en pacientes sin IR, evaluaron la eficacia y seguridad en 70 pacientes de un protocolo de inducción con daclizumab, MMF a dosis de 2 g/día, esteroides e introducción tardía de tacrolimus (a los 4-6 dias postrasplante, valores de 4-8 ng/ml) comparándolo con otro grupo de 74 enfermos con tacrolimus desde el inicio (10-15 ng/ml) y esteroides. No hubo diferencia significativa en la supervivencia de los pacientes e injertos. La incidencia de rechazo agudo fue baja en ambos grupos (24%). La función renal durante el primer mes, en términos de filtrado glomerular, fue significativamente mejor en el grupo con retraso en la introducción de tacrolimus. Por tanto, la introducción tardía de ICN dentro de la primera semana postrasplante, si nos apoyamos en anti-CD25 y MMF es segura, no entraña una mayor incidencia de rechazo agudo y tiene un efecto beneficioso inicial sobre la función renal. Estas conclusiones, aunque en trasplantados hepáticos sin IR aguda, podrían extrapolarse a la población con IR, que en principio podría tener incluso una incidencia menor de rechazo agudo.
Pautas sin inhibidores de la calcineurina
Estas pautas, que se basan en la combinación de MMF, sirolimus, esteroides con o sin anti-CD25, y sin utilizar ICN, se están ensayando actualmente en el trasplante renal, con unos resultados relativamente buenos, aunque aún se encuentran en una etapa preliminar16. En el riñón se ha demostrado que mejora la función renal, a corto y largo plazo, sin incrementar significativamente el rechazo agudo17. Chang et al18 publicaron una pequeña serie de 12 trasplantes hepáticos con IR aguda, donde consiguieron retrasar la introducción de ICN hasta el día 28, gracias al uso de sirolimus. Sin embargo, no consiguieron que ningún enfermo estuviese libre de ICN, ya que la incidencia de rechazo agudo fue del 50%, aunque, excepto uno, todos fueron corticosensibles. Los autores concluyeron que sería interesante realizar un estudio comparativo de esta pauta con una estándar en trasplantados hepáticos con IR aguda. No obstante, todos los intentos de utilizar pautas sin ICN y basadas en sirolimus durante los primeros 6 meses postrasplante se han visto dificultadas al emitir una advertencia la casa farmacéutica de sirolimus, que no indica su uso en el trasplante hepático por haberse detectado una mayor incidencia de trombosis arterial con el uso de este fármaco. Sin embargo, a partir de los 6 meses postrasplante si podría utilizarse, sobre todo en los pacientes con nefrotoxicidad crónica por ICN.
Resultados de la Encuesta Nacional de Inmunodepresión en Trasplante Hepático con Insuficiencia Renal Aguda en el postrasplante inmediato
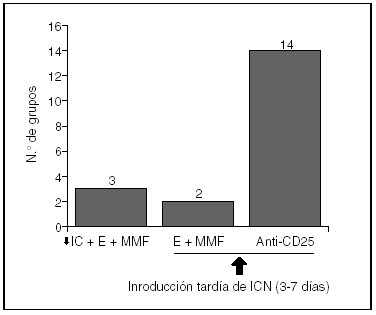
En este mismo suplemento Pons et al publican los resultados de esta encuesta sobre inmunodepresión en España, en la que han participado 19 unidades de trasplante hepático (fig. 1). En resumen, en lo que respecta a los protocolos más usados en caso de IR aguda en el curso del trasplante: a) 14 de los 19 equipos modifican su inmunodepresión usando anti-CD25 (daclizumab o basiliximab) e introduciendo los ICN entre los 3-7 días. De estas 14 unidades que usan anti-CD25, 10 lo asocian a MMF y esteroides, una sólo a esteroides y las 2 restantes realizan otras asociaciones; b) 2 unidades utilizan MMF y esteroides, para introducir los ICN entre los 3-7 días, y c) 3 usan dosis bajas de ICN asociados a MMF y esteroides. Por lo que se puede apreciar, la mayoría de los grupos españoles utilizan, en la IR aguda del trasplantado hepático, anti-CD25 asociado a MMF y esteroides, para retrasar entre 3 y 7 días el uso de ICN.
Fig. 1. Resultados de la Encuesta Nacional sobre el uso de Inmunodepresión de Inducción en el Trasplante Hepático con Insuficiencia renal Aguda. ICN: inhibidores de la calcineurina (ciclosporina/tacrolimus); E: esteroides; MMF: micofenolato mofetil; anti-CD25: basiliximab o daclizumab; ↓: disminución
CONCLUSIONES
La IR aguda postrasplante hepático es un factor de mal pronóstico y está gravada con una mortalidad muy elevada. La selección del donante, del receptor y del tratamiento intra y postoperatorio va a ser crucial en el tratamiento de estos enfermos críticos. Por ello, la optimización del uso de los ICN, principal sustancia nefrotóxica en el postoperatorio inmediato, puede tener un impacto importante a la hora de disminuir la incidencia de IR y permitir la recuperación temprana de la función renal en este período. La mayoría de los protocolos se basan en la reducción o introducción tardía de los ICN, apoyándose en la utilización de MMF con o sin anti-CD25 (basilximab o daclizumab). Recientemente también se está ensayando la timoglobulina, con intención de retrasar aún más el uso de los ICN.
Con estas pautas se ha conseguido una incidencia de rechazo agudo similar a la de los protocolos estándar utilizados (20-30%) y una recuperación de la función renal en más del 80% de los pacientes,y sin incrementar la incidencia de infecciones ni efectos adversos. No obstante, aún queda por saber si, a largo plazo, existe un efecto negativo sobre la reinfección del virus C de la hepatitis en los trasplantados por dicho virus al usar la combinación de anticuerpos monoclonales quiméricos-humanizados y MMF.