INTRODUCCIÓN
El carcinoma hepatocelular (CHC) es la quinta neoplasia más frecuente en el mundo, con una incidencia anual de más de 500.000 nuevos casos al año, y la tercera causa de muerte por neoplasia1 . Este tumor presenta una incidencia variable dependiendo del área geográfica que refleja los diferentes factores de riesgo que existen en ellas. Así, la incidencia es elevada en países en vías de desarrollo como el Sudeste Asiático y el África Subsahariana (50100 casos/105 habitantes), intermedia en Japón (20 ca-sos/105 habitantes) y países europeos del área mediterránea (10-12 casos/105 habitantes), y más baja, con menos de 5 casos/105 habitantes, en el Norte de Europa y Estados Unidos2 . Sin embargo, actualmente existe un aumento de la incidencia en estas zonas3 . Hasta hace pocos años, el diagnóstico de este tumor se realizaba en fases avanzadas, cuando el paciente presentaba síntomas relacionados con el tumor y éste había alcanzado gran tamaño, lo que impedía la aplicación de un tratamiento con finalidad curativa; por tanto, el pronóstico a corto plazo era malo. Sin embargo, en los últimos años la introducción de la ecografía, los avances en las técnicas de imagen y la inclusión de los pacientes con un riesgo elevado en un programa de seguimiento intencionado han permitido el diagnóstico de este tumor en un estadio más inicial, en el que es posible la aplicación de un tratamiento con intención curativa.
FACTORES DE RIESGOA pesar de desconocerse todavía con precisión los mecanismos oncogénicos de este tumor, el CHC es una de las pocas neoplasias cuyos factores etiológicos se conocen. Este tumor se desarrolla en el 80% de los casos en hígados con cirrosis hepática causada en la mayoría de los casos por los virus de la hepatitis C o B o por la ingesta de alcohol. En estos pacientes la incidencia anual oscila entre un 2 y un 8%4 , con una incidencia acumulada a los 5 años del 20% en los pacientes compensados. Además, en un 15-20% de los pacientes que ingresan por hemorragia digestiva alta por varices y/o peritonitis bacteriana es-pontánea5,6 se constata la existencia de un CHC, y esta neoplasia es actualmente la principal causa de muerte en los pacientes cirróticos7-9 .
Virus de la hepatitis BÉste es el factor etiológico más extendido en el mundo, aunque su prevalencia es baja en los países occidentales. Los pacientes portadores del virus de la hepatitis B presentan un riesgo 100 veces mayor de desarrollar un CHC que los no portadores10 . En nuestro medio el tumor se desarrolla en los pacientes con cirrosis establecida, y la incidencia anual se cifra en el 2-6,6%11 y en pacientes no cirróticos es del 0,4-0,6%10 . En cambio, en zonas en vías de desarrollo como África y el sudeste asiático, donde esta infección se adquiere en edades tempranas y coincide con otros factores oncogénicos como la ingesta de aflatoxina a partir de alimentos contaminados12 , el CHC aparece en adultos jóvenes no cirróticos en hasta un 40% de los casos13 .
Virus de la hepatitis CÉste es el factor etiológico fundamental en países occidentales y Japón14,15 , con una incidencia anual del 3-7,16 . En pacientes con cirrosis hepática alcanza una incidencia acumulada a los 5 años del 15-20%4 , mientras que son anecdóticos los casos en pacientes no cirróticos.
HemocromatosisSe ha demostrado que la incidencia anual en los pacientes con hemocromatosis es del 5% al año, y también se han comunicado casos de CHC en los que no se hallan en fase de cirrosis17,18 .
Otros factoresOtras causas de cirrosis, como la secundaria a la ingesta de alcohol y el déficit de alfa-1-antitripsina, también presentan una incidencia elevada de CHC. En cambio, es muy baja en la cirrosis de origen autoimmunitario, la cirrosis biliar primaria y la enfermedad de Wilson4 . La esteatohepatitis no alcohólica se ha identificado como causa de cirrosis19 y se han descrito casos de CHC en estos pacien-20,21 , pero hasta el momento no existen estudios con un número elevado de pacientes ni con un tiempo de seguimiento suficiente para establecer el riesgo de CHC en ellos. Los pacientes con cirrosis hepática no presentan un riesgo homogéneo de desarrollar esta neoplasia, sino que se han identificado subgrupos con mayor riesgo, como serían los pacientes del sexo masculino, edad avanzada y con concentración elevada de alfafetoproteína (AFP) plasmática. Otros factores, como la presencia de nódulos de macrorregenación, displasia de célula pequeña o grande o marcadores de proliferación celular (PCNA, o antígeno nuclear de proliferación celular, y AgNOR, o antígeno de las regiones de organización nucleolar), precisan de más estudios confirmatorios4 .
PROGRAMA DE VIGILANCIATal como se ha mencionado, los pacientes cirróticos constituyen la población diana en la que existe el riesgo de desarrollar un CHC. Este tumor cumple los criterios convencionales para iniciar un programa de diagnóstico temprano coste-efectivo22 . En primer lugar, es muy frecuente en los pacientes con cirrosis hepática (es discutible la realización de este programa en los pacientes sin cirrosis hepática, en quienes la incidencia anual es menor del 1%). Además, este tumor provoca una elevada morbimortalidad, las pruebas empleadas presentan una eficacia diagnóstica buena y la población las acepta debido a su nula invasividad. Finalmente, el tratamiento en los estadios iniciales puede ser curativo, que en definitiva es el objetivo principal de un programa de seguimiento intencionado. Sin embargo, hasta el momento únicamente se ha demostrado que existe una disminución de la mortalidad en estudios teóricos o de cohortes observacionales23-25 , pero no en estudios controlados y aleatorizados. Este tipo de investigación no es factible por el elevado número de pacientes necesarios y sobre todo porque actualmente las pruebas de seguimiento se practican de forma sistemática en los pacientes cirróticos. Conviene destacar que, para que este tipo de programa sea coste-efectivo, debe realizarse en los pacientes que, en caso de ser diagnosticados de este tumor, podrán beneficiarse de la aplicación de un tratamiento curativo. Esto excluye a los pacientes cirróticos en estadio Child-Pugh C, en los que no será posible la realización de un trasplante hepático, al igual que los pacientes con una enfermedad grave asociada; la exclusión por edad avanzada resulta más controvertida4 . Las pruebas utilizadas en el seguimiento de estos pacientes son la determinación de las concentraciones plasmáticas de AFP y la ecografía de abdomen cada 6 meses4 . La determinación de las concentraciones plasmáticas de AFP, marcador tumoral muy específico del CHC, continúa realizándose a pesar de haberse demostrado que no es una buena herramienta para el seguimiento y diagnóstico temprano. Posee una sensibilidad baja, del 39-64%, especificidad del 76-91% y un valor predictivo positivo del 9-32%26 . Este marcador raramente se encuentra elevado en tumores de pequeño tamaño, que son el objetivo de los programas de detección temprano. Por otra parte, sus concentraciones plasmáticas pueden oscilar coincidiendo con períodos de inflamación o se encuentran elevadas de forma mantenida en pacientes con cirrosis hepática de origen viral4 . De esta forma, si consideramos patológico un valor superior a 20 ng/ml, hasta un 40% de los CHC no se detectarán; si aumentamos el valor de corte, la sensibilidad irá disminuyendo y, por tanto, un mayor número de CHC pasarán inadvertidos27 , ya que, como se ha indicado previamente, muchos CHC en estadio inicial presentan valores dentro de la normalidad. Por el contrario, si disminuimos este punto de corte aumentaremos el número de falsos positivos, con un elevado coste en pruebas complementarias para confirmar el diagnóstico. A pesar de haberse demostrado que no es útil como herramienta de seguimiento y diagnóstico temprano, si lo es para identificar a sujetos de riesgo elevado y como herramienta para establecer un diagnóstico no invasivo junto a las pruebas radiológicas 4 . Se han identificado otros marcadores serológicos, como la desgammacarboxiprotrombina o el PIVKA-II (antagonista II de la proteína inducida por la ausencia de vitamina K) 28-30 , las fracciones de AFP (L3) 31-34 , la alfafucosida- 35,36 y el glipicano 3 37 . Ninguno ha demostrado ser útil como herramienta de diagnóstico temprano y, por tanto, no se recomienda su utilización en la práctica clínica. El más estudiado es el PIVKA-II aunque, al igual que la AFP, es capaz de identificar tumores en fase avanzada y no detectar tumores en estadios iniciales. La ecografía de abdomen es mejor que la AFP como herramienta para el seguimiento de estos pacientes, con un bajo coste y nula invasividad. Otras pruebas radiológicas, como la tomografía computarizada (TC) espiral o la resonancia magnética (RM), no se recomiendan como herramientas para el seguimiento por su mayor coste e invasividad. La ecografía posee una sensibilidad del 85% y una especificidad alrededor del 98%, con un valor predictivo positivo de más del 70%. Sin embargo, tiene limitaciones, ya que es una prueba que depende del observador, por lo que es importante que la realice un radiólogo experto 4 . Además, la exploración puede ser difícil en determinadas áreas hepáticas o bien en pacientes obesos. A pesar de todo, hasta un 85% de los nódulos menores de 3 cm puede diagnosticarse mediante ecografía 38 . La periodicidad en que debe realizarse el seguimiento es de 6 meses según las recomendaciones establecidas en el año 2000 en la conferencia de la European Association for the Study of the Liver (EASL) sobre el CHC celebrada Barcelona 4 . Se ha propuesto este intervalo teniendo en cuenta los datos existentes en la bibliografía sobre cinética tumoral que demuestran que el tiempo que transcurre desde que un tumor es indetectable hasta que adquiere un tamaño de 2 cm es de aproximadamente 4-12 meses 39,40 . Es importante que las herramientas utilizadas para el seguimiento y posteriormente para el diagnóstico de este tumor sean eficaces para diferenciar los distintos tipos de nódulos que pueden aparecer en los pacientes cirróticos y que el programa sea coste-efectivo. En los pacientes cirróticos, las principales lesiones focales hepáticas que plantean el diagnóstico diferencial con el CHC son el nódulo de regeneración y la displasia de bajo grado, que son lesiones frecuentes, generalmente de un tamaño inferior a 5 mm y con un riesgo mínimo de malignización; las displasias de alto grado, que son menos frecuentes pero un tercio maligniza 41,42 . Otras lesiones con las que debe realizarse diagnóstico diferencial son los hemangiomas atípicos, los tumores benignos (adenoma hepático e hiperplasia nodular focal) y tumores malignos como el colangiocarcinoma.
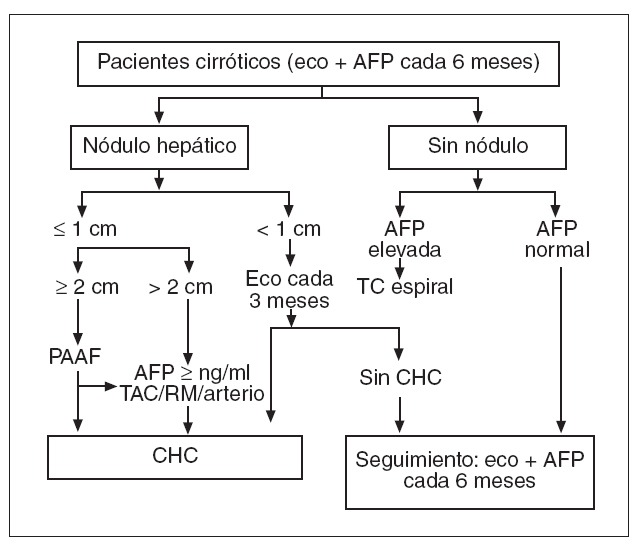
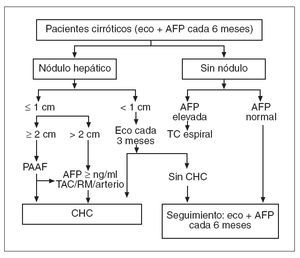
Fig. 1. Esquema del programa de vigilancia y estrategia diagnóstica en los pacientes cirróticos. Eco: ecografía; AFP: alfafetoproteína; PAAF: punción aspiración con aguja fina; TC: tomografía computarizada; RM: resonancia magnética; arterio: arteriografía; CHC: carcinoma hepatocelular. (Tomada de Bruix et al4, con permiso de la European Association for the Study of the Liver.)
TABLA I. Criterios diagnósticos del carcinoma hepatocelular
DIAGNÓSTICO
Tras detectar en la ecografía un nódulo (hipoecoico generalmente, aunque puede mostrar otros patrones, como iso, hiper o heterogéneo) la actitud posterior dependerá del tamaño de la lesión, tal como se acordó en el año 2000 en la conferencia de la EASL sobre el CHC celebrada en Barcelona4 (fig. 1). Si la lesión detectada es menor de 1 cm, en un 50% de los casos no se tratará de un CHC y desaparecerá durante el seguimiento43 . Por otra parte, con un tamaño tan pequeño el diagnóstico citohistológico es muy difícil, por lo que está indicado un seguimiento más estricto cada 3 meses4 . En el caso de que el nódulo detectado mida de 1 a 2 cm deberá realizarse un diagnóstico citohistológico por punción. Sin embargo, hay que tener en cuenta que una punción negativa no excluye la malignidad, puesto que en un 40% de los casos puede tratarse de un falso negativo44 . Si el nódulo es mayor de 2 cm se podrá realizar un diagnóstico, sin necesidad de una punción, mediante los criterios no invasivos (tabla I) definidos en el año 2000 en la conferencia de la EASL sobre CHC, que tienen en cuenta características radiológicas y los valores de AFP4 . Entre ellos se incluyen un criterio radiológico (presencia de una lesión focal mayor de 2 cm coincidente en 2 pruebas de imagen que muestre hipervascularización en la fase arterial con un lavado rápido en la fase venosa) y el criterio combinado: presencia de una lesión focal hipervascular mayor de 2 cm en la fase arterial y con un lavado rápido en la fase venosa junto a concentraciones de AFP superiores a 400 ng/ml. Las pruebas radiológicas que deben tenerse en cuenta son la ecografía, la TC dinámica, la RM y/o la arteriografía4 . Hay que destacar que estos criterios no invasivos únicamente podrán aplicarse en pacientes cirróticos, en quienes este tumor presenta una elevada prevalencia, y que será necesaria la punción en el caso de pacientes sin cirrosis hepática, es decir, en hígados sanos, donde estas lesiones hipervasculares pueden corresponder a otros tumores benignos o malignos45 . Estos criterios no invasivos del CHC pueden aplicarse en lesiones mayores de 2 cm debido a la elevada precisión diagnóstica de las pruebas radiológicas44,45 en lesiones de este tamaño. Los nódulos de menor tamaño, aunque sean hipervasculares, pueden no tener ningún significado patológico. Por otra parte, el CHC es un tumor que va adquiriendo su vascularización arterial durante el crecimiento, es decir, a medida que aumenta de tamaño, por lo que tumores de pequeño tamaño en un estado muy inicial de su evolución no presentan hipervascularización arterial46 . El CHC es un tumor que pasa por diferentes fases durante el crecimiento. Actualmente se desconoce el intervalo de tiempo entre el inicio de la enfermedad neoplásica y su detección mediante programas de vigilancia. La hepatocarcinogenia es un proceso que va paso a paso desde los nódulos displásicos al carcinoma in situ. Esta entidad se reconoce como un nódulo con patrón celular bien diferenciado que contiene conductillos biliares y venas portales, presenta un margen mal definido, no ha invadido ninguna estructura y tiene generalmente un tamaño inferior a 46-48 . Sin embargo, incluso en tumores de este tamaño se han observado características de invasividad local, en forma de satelitosis en el 10% de los pacientes o invasión vascular microscópica en un 25% de los casos48 . En la actualidad diferenciar estos tumores que presentan invasividad es prácticamente imposible mediante pruebas radiológicas, aunque generalmente los tumores en estados más iniciales serán hipovasculares. A partir de los 3 cm la mayoría de los tumores pierde su grado de diferenciación. En caso de detectarse unos valores de AFP elevados durante el seguimiento, la actitud a seguir posteriormente no está muy bien definida, ya que, como se ha indicado previamente, muchos pacientes presentan concentraciones oscilantes de AFP. Lo que probablemente tenga más valor son las concentraciones ascendentes progresivas. En el caso de que se encuentren valores elevados de AFP se recomienda la realización de una TC dinámica o RM con el fin de detectar lesiones que no hayan podido verse mediante la ecografía4 . Hay que destacar que los valores elevados de AFP indican un mayor riesgo de desarrollar un CHC, pero no una mayor velocidad de crecimiento; por ello, el seguimiento se realizará con la misma periodicidad de 6 meses4 .
DIAGNÓSTICO DE EXTENSIÓNUna vez diagnosticado el CHC, es importante realizar una correcta estadificación para confirmar que se trata de un CHC inicial que podrá beneficiarse de un tratamiento con intención curativa. La ecografía es una herramienta muy útil para la detección de un nódulo hepático, pero no es tan eficaz para descartar nódulos adicionales, aunque posiblemente en un futuro próximo podrá aumentarse su sensibilidad debido a la utilización de nuevos contrastes. Por tanto, las técnicas utilizadas para definir la extensión tumoral son la TC espiral o la RM hepática49 . Debe señalarse que, si bien la precisión diagnóstica para detectar nódulos adicionales superiores a 2 cm es similar con la TC y la RM, un estudio reciente ha demostrado que la RM hepática de última generación con técnica angiográfica es superior a la TC en la detección de nódulos adicionales de 1-2 cm de tamaño50 , por lo que actualmente se recomienda su utilización para la estadificación de tumores en estadio inicial que pueden beneficiarse de un tratamiento curativo. En los restantes casos, es suficiente la realización de una TC. Como ya se ha indicado, no se recomienda la realización sistemática de la arteriografía por su mayor invasividad4 . Tampoco se recomienda la realización de una TC con lipiodol por su baja especificidad diagnóstica. No se realizan de forma rutinaria otras pruebas para descartar afectación extrahepática (TC de tórax y gammagrafía ósea) al ser infrecuente la presencia de M1 en tumores de pequeño tamaño y pacientes asintomáticos, aunque suelen realizarse si el paciente se incluye en lista de trasplante hepático (TH) o en investigaciones terapéuticas prospectivas.
TRATAMIENTOA pesar de la aplicación de un programa de seguimiento intencionado, un 40-80% de los tumores son únicos en el momento del diagnóstico y sólo la mitad de ellos podrá beneficiarse de un tratamiento curativo51 . En un 20-60% de los casos el tumor es multinodular en el momento del diagnóstico14,24 , como resultado de metástasis intrahepáticas o bien tumores sincrónicos. La definición de tumores en estadio inicial se ha modificado a lo largo de los años. Actualmente se consideran como tales los tumores únicos de hasta 5 cm, o bien la presencia de hasta 3 tumores con un tamaño de 3 cm o menor, cada uno sin evidencia de extensión vascular ni afectación extrahepática en pacientes asintomáticos4 . En este tipo de tumores se pueden aplicar tratamientos con intención curativa, como el trasplante hepático, la resección quirúrgica o los tratamientos percutáneos, que incluyen la inyección intratumoral de alcohol etílico y la radio-frecuencia entre los más utilizados y estudiados. Con estos tratamientos la supervivencia puede alcanzar el 5075% a los 5 años49 . La resección quirúrgica se reserva para los tumores únicos en los que se ha descartado la presencia de hipertensión portal significativa (gradiente de presión portal < 10 mmHg mediante un estudio hemodinámico, o bien cuando no se han observado varices esofágicas en la endoscopia digestiva o la cifra de plaquetas es mayor de 100.000 mm3 sin evidencia de esplenomegalia)52 . En nuestro medio únicamente un 5% de los pacientes puede beneficiarse de este tratamiento, con el que se alcanza una supervivencia del 70% en los mejores candidatos53 . Sin embargo, el principal problema es la elevada tasa de recidiva, que puede alcanzar el 50% a los 3 años54 , sin que hasta el momento ningún tratamiento se haya demostrado eficaz para su prevención55 . La recidiva puede producirse por tumores sincrónicos o bien por diseminación tumoral54 . En este último caso los predictores de recidiva son la presencia de invasión vascular microscópica o satelitosis en la pieza de la resección56 . El trasplante hepático está indicado en los pacientes con cirrosis descompensada y tumores de 5 cm o menores, o bien 3 tumores de 3 cm o menores cada uno, y en los pacientes compensados con hipertensión portal significativa. En estos casos la supervivencia es similar a la de los pacientes cirróticos sin tumor; alcanza el 70% a los 5 años, con una tasa de recidiva inferior al 15%38 . Sin embargo, el mayor inconveniente del trasplante hepático es la escasez de donantes, lo que provoca un aumento del tiempo de espera que favorece la progresión tumoral y la exclusión de la lista y, por tanto, que disminuya la supervivencia según intención de tratamiento53 . Esta tasa de exclusión puede alcanzar el 20% dependiendo del tiempo de espera38,53 . Pueden adoptarse diversas medidas para solventar este problema, como el trasplante hepático de donante vivo, el tratamiento adyuvante en lista de espera, la utilización de órganos marginales o el establecimiento de políticas de priorización en la lista38 . Finalmente, si el paciente no puede ser tributario de resección o trasplante se realizará tratamiento percutáneo. Los más utilizados son la inyección intratumoral de alcohol etílico y la radiofrecuencia. Con estos tratamientos se alcanzan supervivencias del 50-60% a los 5 años en los mejores candidatos, es decir, los pacientes con Child-Pugh A y tumores de pequeño tamaño, en los que se ha alcanzado una respuesta completa inicial49,57 . El principal problema, al igual que en la resección quirúrgica, es la elevada tasa de recidiva, que alcanza el 50% a los 3 años56 . En más de un 50% de los casos, en el momento del diagnóstico los tumores sobrepasan los criterios para ser considerados iniciales y, por tanto, no puede aplicarse un tratamiento con finalidad curativa38 . En estos casos, si el tumor no produce síntomas y no presenta extensión extra-hepática ni afectación vascular tumoral, podrá recurrirse a la quimioembolización arterial. Hasta el momento éste es el único tratamiento que ha mostrado un beneficio en la supervivencia en estos tumores no iniciales58 . Cuando existen síntomas relacionados con el tumor, extensión vascular tumoral o bien contraindicaciones para este tratamiento, no se ha demostrado que otros tratamientos, como el antiestrogénico, la radioterapia o la quimioterapia intrarterial, produzcan un beneficio en la supervivencia, por lo que deben investigarse nuevos tratamientos dentro de estudios controlados y aleatorizados58 . Finalmente, en los pacientes que se diagnostican en un estadio terminal (constituyen aproximadamente un 2025% de los casos), únicamente deberá aplicarse tratamiento sintomático56 .
PERSPECTIVAS DE FUTUROLos avances en las pruebas radiológicas han permitido una mejor detección y caracterización de las lesiones y, por tanto, que un mayor número de pacientes puedan beneficiarse de tratamientos con intención curativa. Sin embargo, en el futuro debe esperarse que el mejor conocimiento de los mecanismos moleculares que determinan la aparición y progresión de la neoplasia permita predecir fiablemente el riesgo oncogénico y aplicar tratamientos con finalidad preventiva.
Correspondencia: Dr. J. Bruix . Servicio de Oncología Hepática. Unidad de Hepatología. Hospital Clínic. Universitat de Barcelona. IDIBAPS. Villarroel, 170. 08036 Barcelona. España. Correo electrónico: bruix@ub.edu
Recibido el 29-10-2004; aceptado para su publicación el 4-11-2004.