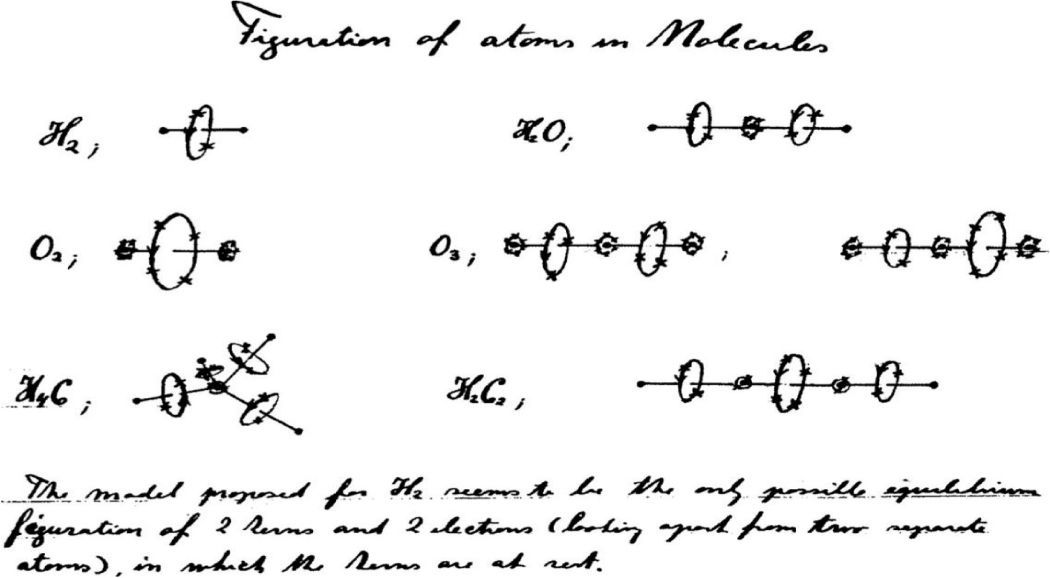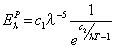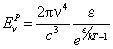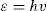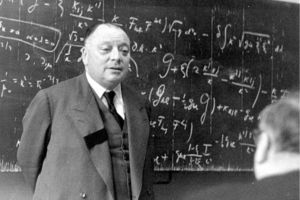Some relevant historical aspects of quantum theory are covered (starting with Max Planck, Niels Bohr atomic model and the proposition of electron spin). Quantum Mechanics, as proposed by Werner Heisenberg (Matrix Mechanics) and Erwin Schrödinger (Wave Mechanics) is introduced, as well as the methodology represented by Hylleraas and Dirac, and developed lately by Hartree, Fock and Roothaan. Immediately all applications of Quantum Mechanics to chemistry systems are boarded though the figures of that scientific campus, as Heitler and London; Slater and Pauling (all by valence bond model); Hund y Mulliken (by molecular orbital model), and several others methodologies as those by Hückel, Pariser, Parr and Pople, Ballhausen Ligand Field Theory, and Coulson, and by Density Functional Theory. A final conclusion is attained with Woodward and Hoffmann rules, and the 2013 Nobel Prize given to Karplus, Levitt and Warshel.
Se recorren algunos aspectos históricos relevantes de la teoría cuántica (se inicia con algo de Max Planck, el modelo atómico de Niels Bohr y el descubrimiento del espín). Se continúa con la aportación de la mecánica cuántica de Werner Heisenberg (Mecánica Matricial) y Erwin Schrödinger (Mecánica Ondulatoria), así como de la metodología de cálculo, en principio representada por Hylleraas y por Dirac, y desarrollada posteriormente por Hartree, Fock y Roothaan. Inmediatamente se aborda todo lo que condujo a partir de entonces a la aplicación en química de la mecánica cuántica, a través de figuras como Heitler y London; Slater y Pauling (con la teoría de unión-valencia); Hund y Mulliken (con la teoría de orbitales moleculares) y varios métodos ulteriores, representados por los de Hückel, de Pariser, Parr y Pople, la Teoría del Campo Ligante de Ballhausen, la de Coulson, y por la teoría de funcionales de la densidad. También se tocan las reglas de Woodward y Hoffmann, así como el premio Nobel de Química 2013, otorgado a Karplus, Levitt y Warshel.
La teoría cuántica nace en diciembre de 1900, después de que Max Planck encuentra la ecuación de la energía de la radiación emitida para la longitud de onda λ por un cuerpo negro caliente (en octubre):
Propone para su explicación que la interacción de la radiación con la materia ocurre por paquetes energéticos, es decir, que no se da en cualquier cantidad, sino solo por múltiplos de un “cuanto” o paquete de energía, ε, proporcional a la frecuencia de la radiación. Si dejamos ahora la energía emitida escrita en términos de frecuencia v:
donde
h se conoce desde entonces como “constante de Planck” y tiene un valor minúsculo de 6.626 × 10-34 J s.Pero eso estaba todavía muy lejos de la química. Hubo que esperar a 1913 cuando el danés Niels Bohr (1913a, ver la figura 1) aplica la cuantización de Planck al átomo de> hidrógeno. Terminó con ello el fallido modelo planetario de Rutherford según el cual los electrones giran en radios de cualquier tamaño alrededor del núcleo, lo que provocaría de acuerdo con la electrodinámica clásica que el electrón emitiera energía y acabara por caer en espiral sobre el núcleo. Con ello el hidrógeno se convirtió en el primer elemento químico que recibió una tratamiento cuántico que negó la electrodinámica clásica, al decir Bohr que habría órbitas estables solo cuando la cantidad de movimiento angular fuese un múltiplo entero de la constante de Planck sobre 2π. Con ello Bohr predijo acertadamente todas las líneas de emisión de este átomo.
Bohr, que era fisico, tenía, sin embargo, grandes conocimientos de química, lo que demostró desde 1913, en su tercer artículo sobre la constitución de átomos y moléculas (Bohr, 1913b, ver la figura 2). Y habría de convencer a los químicos cuando en 1923 (Bohr, 1923) fue el primero en proponer que la periodicidad en las propiedades de los elementos se podía explicar mediante la estructura electrónica del átomo, y se guió de su conocimiento químico para proponer una “tabla periódica electrónica”.
Diagramas hechos por Bohr sobre algunas moléculas, tales como H2, con los dos electrones girando en un círculo entre los dos núcleos; O2, (bajo el H2), con círculos con cuatro electrones entre los dos kernel (enlaces dobles, por lo tanto); O3, con enlaces de tres electrones (como la de la figura central, o a la derecha con un enlace doble, de cuatro electrones, y otro sencillo, con dos), metano y acetileno.
Después de un periodo de cierta oscuridad, lo más valioso fue la demostración, vía la emisión de rayos-X, de que el número atómico crecía paulatinamente desde el hidrógeno (Z = 1) hasta el uranio (Z = 92) (Moseley, 1913). La luz empezó a salir desde la complementación del efecto fotoeléctrico por Einstein (1917) con su postulación de la naturaleza dual de los fotones, al asignar una cantidad de movimiento a los mismos. Unos años después (De Broglie, 1924), extendió ese modelo a las partículas materiales. Adicionalmente, fue presentado el espín, por Samuel Goudsmit (ver la figura 3) y George Uhlenbeck (1925) y el principio de exclusión por Wolfgang Pauli (1925, figura 4). Vale la pena citar la importancia ulterior de las técnicas basadas en el espín para la determinación de la estructura química de las sustancias, a través de la Resonancia Magnética Nuclear (NMR) y la Paramagnética Electrónica (EPR).
En el campo aledaño a Leiden, Holanda, un conjunto de estudiantes de física, rodeando a su maestro, Paul Ehrenfest (cuarto de izquierda a derecha): Dieke, Goudsmit, Tinbergen, Kronig y Fermi. Vale la pena la nota de que Tinbergen cambió luego de la física a la economía y alcanzó el primer Premio Nobel en esa disciplina en 19.9. Entre el resto solamente Fermi obtuvo el de física ya que inexplicablemente nunca se lo otorgaron a Goudsmit y Uhlenbeck.
Wolfgang Pauli dando cátedra. Este físico habría de jugar un papel preponderante en el concepto del espín. Primero con la predicción del cuarto número cuántico y su principio de exclusión (1925), y, posteriormente, con el principio de antisimetría (1940). Obtuvo el Premio Nobel de Física en 19.5.
Luego vendría la presentación de la mecánica matricial, por Werner Heisenberg (1925, figura 5), y la mecánica ondulatoria, por Erwin Schrödinger (1926, figura 6), que acabaron siendo equivalentes, y que acabaron constituyendo el fundamento de la desde entonces conocida como mecánica cuántica.
Reunión en el Instituto de Niels Bohr en Copenhague en 1933. En la primera fila tenemos a Niels Henrik David Bohr; Paul Adrien Maurice Dirac; Werner Heisenberg; Paul Ehrenfest; Max Delbruck y Lise Meitner. Esta última, quien recibiría el sobrenombre de “la Marie Curie alemana” por Albert Einstein, fue la descubridora del protoactinio y de la fsión nuclear (aunque no fue reconocida con el Nobel). Años después, en 19.8. fue refugiada en el mismo Instituto de Bohr por la persecución judía de los nazis en Alemania, de donde tuvo que salir auxiliada por Dick Coster, quien le proporciona el pase para cruzar la frontera hacia los Países Bajos.
Erwin Schrödinger, el creador de la mecánica ondulatoria, que después fue aplicada a la química como las teorías de enlace-valencia (Heitler y London, 1927; Slater, 1930a; 1931 y 1932; y Pauling, 1928; 1931a y b) y de orbitales moleculares (Hund, 1927a, b y c; y Mulliken, 1928a y b; 1929b; 1932.
El estudio de la molécula neutra más simple, la del H2, por medio de la ecuación de Schrödinger condujo a Heitler y London (1927, ver la figura 7) a la presentación de un primer método de cálculo mecánico cuántico de las moléculas, que desde entonces lleva el nombre de unión-valencia o enlace-valencia.>
a) Walter Heitler, y b) Fritz W. London. Colaboradores en la solución de la ecuación de Schrödinger para el H2. Llegaron a la conclusión de que la mejor descripción es la de una onda “deslocalizada”, en la que el electrón 1 y el 2 lo mismo están centrados en el átomo A que en el átomo B. Concluyeron también que la inclusión de términos iónicos en la función de onda (donde ambos electrones estén descritos en la cercanía del átomo A o del B) conducía a mejores resultados. Por más irracional que pareciese, un molécula homo-nuclear tenía 0.24 de contribución iónica frente a 1.0.de contribución covalente “deslocalizada”.
Este mismo método fue luego extendido de manera casi simultánea por John Clarke Slater (1930a, 1931; 1932, ver figura 8a) y Linus Pauling (1931a y b, ver figura 8b), quienes incluyeron la hibridación como forma de obtener mejores funciones de onda, más aptas para enlazar con los átomos vecinos. Años después, Pauling (1939) imprimió el libro donde plasmó todas sus aportaciones sobre el enlace químico.
Otro paso adelante fue haber concebido el concepto de «carga nuclear efectiva», por Slater (1930b). Y qué decir del concepto de «electronegatividad» de Pauling (1932a y b). En esta revista han aparecido dos trabajos donde se resalta la obra de Pauling (Chamizo, 1994; González-Vergara y Rosas-Bravo, 2002).
Por otra parte, el método de orbitales moleculares provino de Hund (1927 a, b y c, ver también Kutzelnigg, 1996 y la figura 9a) y Robert S. Mulliken (1928 a y b; 1929, figura 9b).
Hacia el inicio de la mecánica ondulatoria, Egil A. Hylleraas (1928, ver la figura 10), científico noruego, llevó a cabo los primeros cálculos del átomo de helio.>
Dirac (1929, figura 11) fue otro de los grandes iniciadores de la mecánica cuántica, con su ecuación relativista y la propuesta de la existencia de las antipartículas (como el positrón), cuyo descubrimiento lo llevó a alcanzar el Premio Nobel de Física en 1933, compartido con Erwin Schrödinger. En su libro (Dirac, 1929, p. 714) nos habla del impacto de la mecánica cuantica sobre lo conocido en fisica y química: Las leyes subyacentes necesarias para la teoría matemática de una buena parte de la fisica y de toda la química son entonces completamente conocidas, y la dificultad es solo que las aplicaciones exactas de esas leyes nos conducen a ecuaciones mecánico-cuánticas que son demasiado complejas como para ser solubles.
La metodología de resolución de la ecuación de Schrö-dinger a través de la combinación lineal de orbitales atómicos se dio gracias a Douglas Hartree (1928, en la aproximación de electrones independientes, en primer lugar) y a Vladimir Fock (1930, quien incluyó el intercambio) complementados posteriormente por Clemens C. J. Roothaan (1951). La foto de los tres puede verse en la figura 12.
A partir de este momento, empezaron a obtenerse múltiples métodos para aproximar la solución de la ecuación de Schrödinger para moléculas. Lo primero que se logró fue el estudio de los electrones pi, con el método de Hückel (1931, ver la figura 13).>
Robert G. Parr (figura 14) trabajó con el químico de Dupont Rudolph Pariser y publicaron también en 1953 un método para calcular moléculas con sistemas de electrones pi. Luego vino John Pople a complementar el método (se le conoció como PPP, por Pariser-Parr-Pople) y presentarlo como CNDO en 1965 (de cero traslape diferencial). John fue el coordinador del programa Gaussian, para el cálculo de moléculas con bases de funciones de gran calidad. Pople recibió el Premio Nobel de Química en 1998.
Otra idea genial de Parr fue la “Teoría de Funcionales de la Densidad”, concebida hacia 1968 y puesta en práctica junto a Weitao Yang and Chengteh Lee en 1988, uno de los artículos más citados en la literatura de la química teórica. Walter Kohn, el creador de la teoría, recibió el Nobel de Química en 1998, compartido con John Pople.
En Francia también se dieron muchas contribuciones por Alberte Pullman (ver la figura 15) y su marido Bernard, por Raymond Daudel (1974) y por Lionel Salem, quien se convirtió en un divulgador extraordinario (Salem, 1979).
En Gran Bretaña se dieron otras contribuciones, como la de Carl Ballhausen (1962) con el desarrollo de la teoría del campo de ligantes, y la de Charles A. Coulson (1952, 1973), un matemático aplicado a la teoría cuántica de la valencia.
En tanto, en los Estados Unidos se dieron las reglas de Woodward y Hoffmann (1971 ver la figura 16) y que son un conjunto de reglas en química orgánica que predicen la estereoquímica de las reacciones pericíclicas (éstas incluyen a las electrocíclicas, las cicloadiciones, y las sigmatrópicas), basándose en la simetría de los orbitales, y con ellas se predice si van a ocurrir por energía térmica o fotónica. Por este trabajo, en 1981 Hoffmann fue galardonado con el Premio Nobel de Química, compartido con Kenichi Fukui, quien desarrolló otras teorías de las reacciones químicas (con base en los orbitales moleculares más alto ocupado y más bajo desocupado), mientras que Woodward había muerto dos años antes, por lo que no era elegible para ganar el que hubiera sido su segundo Premio Nobel de Química.
Se ha señalado que el químico E. J. Corey considera que él es el responsable por las ideas que condujeron a las reglas de Woodward y Hoffmann, ya que dice se que las mencionó el 4 de mayo de 1964 a Woodward, y que injustamente éste rechazó darle el crédito respectivo en el descubrimiento. Lo indica en una memoria publicada en el 2004 en el Journal of Organic Chemistry. Hoffmann ha negado la existencia de esa reunión entre Woodward y Corey, y ha remarcado que lo sorprendente es que Corey no haya empleado su razonamiento respecto a la estéreo-especificidad de este tipo de reacciones electrocíclicas desde 1964 hasta 20 años después de la muerte de Woodward. Hoy Hoffmann es un connotado filósofo de la Química e inclusive un buen poeta.
Podemos concluir con el último Premio Nobel de Química, en 2013, otorgado a Martin Karplus, Michael Levitt y Arieh Warshel por su trabajo en química computacional para calcular sistemas químicos complejos.
Facultad de Química, Universidad Nacional Autónoma de México. Ciudad Universitaria, Avenida Universidad 3000, 04510 México, Distrito Federal, México.