El objetivo de este estudio es llevar a cabo la evaluación de la técnica de detección del ganglio centinela (GC) con tinción de azul de metileno «ex vivo» en el cáncer de colon, así como calcular la supraestadificación y su correlación con la evolución de la enfermedad.
MétodosEntre 2008 y 2011, 101 pacientes fueron operados de cáncer de colon con la detección del GC, estudiándose las micrometástasis. El seguimiento de los pacientes N0 fue mayor a un año en búsqueda de recidivas y si tenían relación con la aparición de dichas micrometástasis.
ResultadosEl índice de detección del GC fue de 92 casos (91%). Fue positivo para micrometástasis en 9 casos, con una supraestadificación del 14%. La incidencia de falsos negativos fue de 9 pacientes (10%). El seguimiento medio de los 74 pacientes N0 fue de 38 meses. Se observó recurrencia en 4 pacientes (7%) del grupo de pacientes con GC− (65 pacientes) y en 2 pacientes (22%) en el grupo con GC+ (9 pacientes, sin diferencias estadísticas significativas. Tampoco se observaron diferencias en términos de supervivencia entre los 2 grupos.
ConclusionesEl estudio del GC es una práctica reproducible sin aumento significativo del tiempo y de costes. Puede llegar a supraestadificar el 14% de pacientes que habían sido clasificados como N0 con técnica convencional. En el seguimiento de los pacientes N0 con GC+ parece haber una tendencia a un porcentaje mayor de recidivas, lo que podría llevar a cambios en las pautas de tratamiento adyuvante, aunque debemos tomarlo con cautela ya que la muestra es escasa.
The aim of this study is to evaluate the sentinel lymph node mapping (SLNM) with methylene blue staining “ex vivo” in colon cancer, as well as calculate the upstaging obtained by the determination of micrometastases and its correlation with the evolution of the disease.
MethodsBetween 2008 and 2011, 101 patients with colon cancer undergoing resection were studied prospectively with SLNM and detection of micrometastases. The correlation of SLN micrometastases with the disease evolution was evaluated in patients with a follow-up of more than one year.
ResultsThe SLNM rate was 92 cases (91%). Only SLN was positive for micrometastases in 9 cases, with a 14% upstaging. The incidence of false negatives was 9 patients (10%). Mean follow of N0 patients (n=74) was 38 months. The SLN- (negative) group (65 patients) had a recurrence rate of 4 patients (7%), whereas this rate was 2 patients (22%) in the group of SLN+(positive) (9 patients), but without significant differences. No differences in survival were observed.
ConclusionsSLNM is a reproducible technique without significant increase in time and costs. Upstaging was obtained in 14% of patients staged as N0 by conventional technique. At follow-up of N0 patients with SLN+there seems to be a higher rate of recurrence, which could change the guidelines of adjuvant treatment, but we must interpret the results it with caution because the sample is small.
El cáncer colorrectal es la segunda neoplasia maligna más frecuente en los países desarrollados y la segunda causa de muerte secundaria a proceso neoplásico. El tratamiento con intención curativa se basa en la resección quirúrgica, combinada o no con tratamiento adyuvante y, como en la mayoría de los tumores malignos, la estadificación tumoral en el momento del diagnóstico es el factor pronóstico más importante para predecir la supervivencia. Aunque la cirugía sola se considera curativa en pacientes con enfermedad localizada, la supervivencia decrece dramáticamente a aproximadamente el 25-35% en caso de existir afección ganglionar. La existencia de ganglios linfáticos afectados determina la administración de quimioterapia adyuvante a la cirugía, ya que ha demostrado mejorar la supervivencia en más de la tercera parte de esos pacientes1,2, alcanzando un 84% de supervivencia. Este beneficio no se ha observado en pacientes sin afección ganglionar por lo que no se indica el tratamiento adyuvante, siempre que no se asocie a características desfavorables del tumor primario (invasión perineural y vascular, muestreo inadecuado de ganglios linfáticos, obstrucción del tumor primario). Sin embargo, el 10-25%3 de los pacientes sin afectación ganglionar en el momento del diagnóstico desarrollarán progresión de su enfermedad y metástasis a distancia en los 5 años siguientes tras la realización de una cirugía con intención curativa. Estos resultados obligan a plantearse la posible inexactitud de los actuales métodos de estadificación, que pueden llevar a una infraestadificación. Considerando que en la estadificación de los pacientes analizamos preferentemente estos 3 aspectos tamaño del tumor (T), ganglios afectos (N), presencia de metástasis a distancia (M), es razonable asumir que la mayor probabilidad de error recae sobre el estudio ganglionar y que muchos de estos pacientes pudieran presentar micrometástasis ganglionares no detectadas con el examen histológico convencional. Este grupo de pacientes es la base para que algunos autores estimen que hay un porcentaje de infraestadificación del 10-20% en pacientes con cáncer colorrectal cuando se realiza un estudio histológico convencional del territorio ganglionar4. Ello lleva a buscar métodos que ayuden a obtener una correcta estadificación ganglionar5, mediante la realización de secciones seriadas de los ganglios6, así como técnicas de inmunohistoquímica con citoqueratina7 y, más recientemente, mediante técnicas de RT-PCR (técnica de reacción en cadena de la polimerasa con transcripción inversa), que permiten una mayor detección de micrometástasis (inferiores a 2mm). Sin embargo, su realización en todos los ganglios resecados puede ser impracticable en la clínica diaria, desde un punto de vista de coste tanto económico como de tiempo, y sería factible en un reducido grupo de ganglios. Estos linfonodos, representativos de todo el territorio ganglionar, serían los denominados ganglios centinelas8 (GC) y permitirían una estadificación más exacta de la lesión, con posible trascendencia en el tratamiento adyuvante requerido9.
El objetivo del presente estudio es llevar a cabo la evaluación de la técnica de tinción con azul de metileno «ex vivo» para la determinación del GC, así como calcular la supraestadificación obtenida con el estudio del GC y la correlación de dicha supraestadificación con la evolución de la enfermedad.
MétodosSe trata de un estudio clínico prospectivo que incluye a pacientes diagnosticados de neoplasia de colon (por encima de promontorio sacro según el enema opaco o bien a más de 15cm del margen anal según la fibrocolonoscopia) sin diseminación a distancia en el estudio de extensión, intervenidos en nuestro centro entre enero de 2008 y febrero de 2011. Todas las intervenciones realizadas siguieron los criterios oncológicos establecidos.
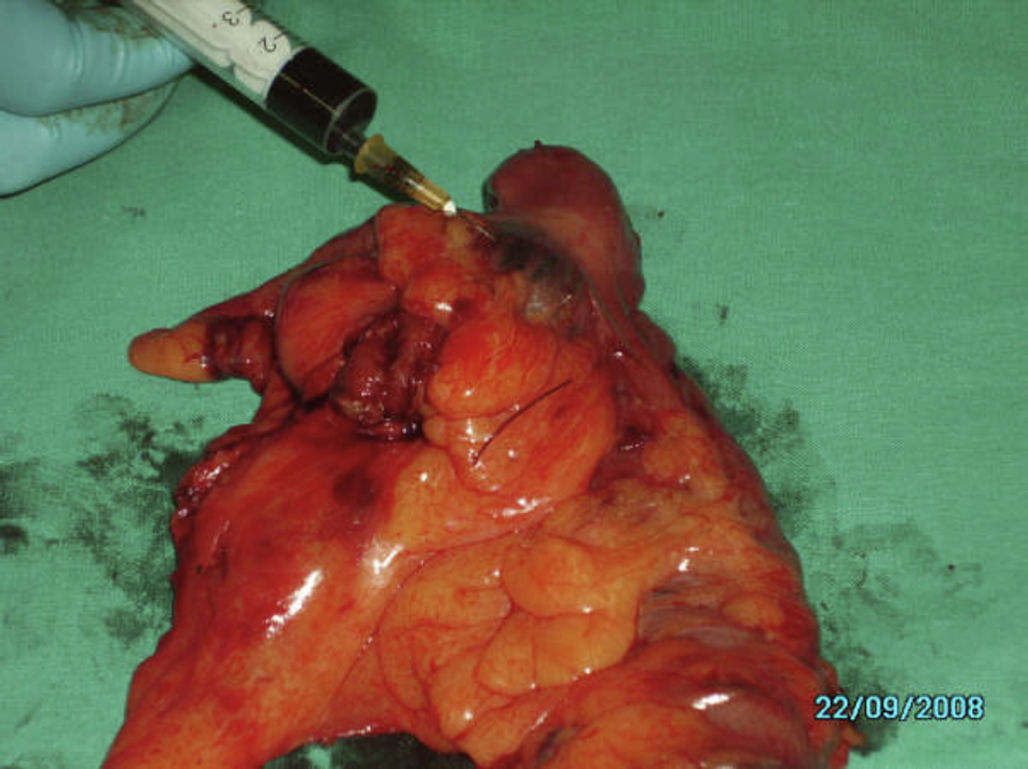
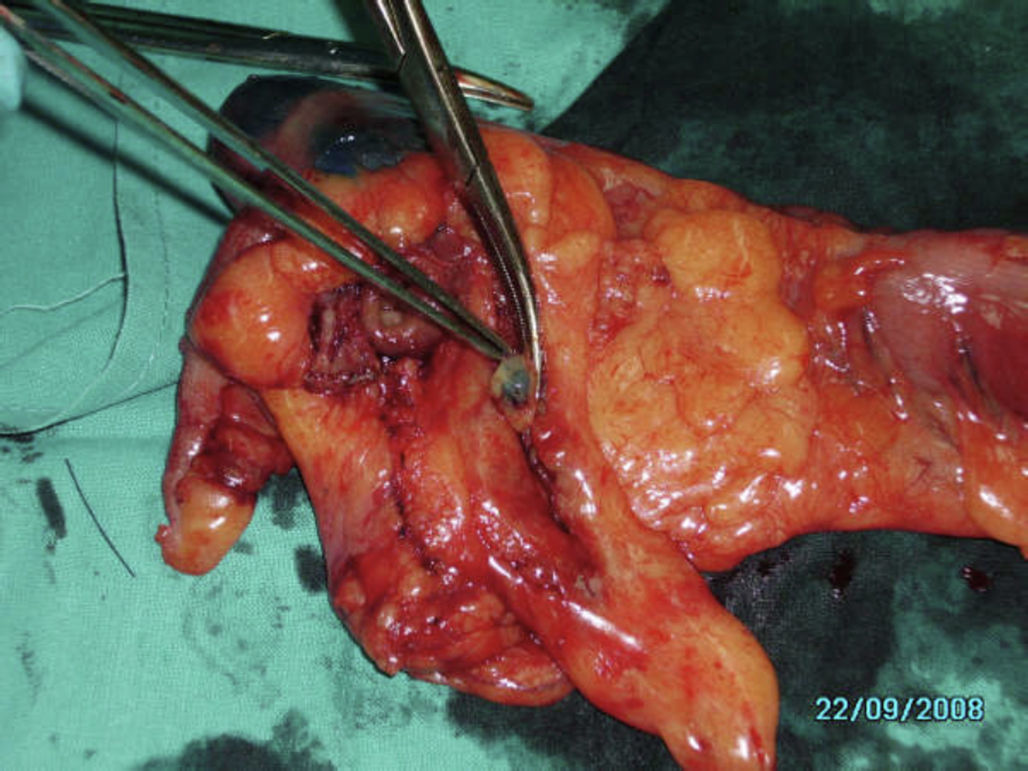
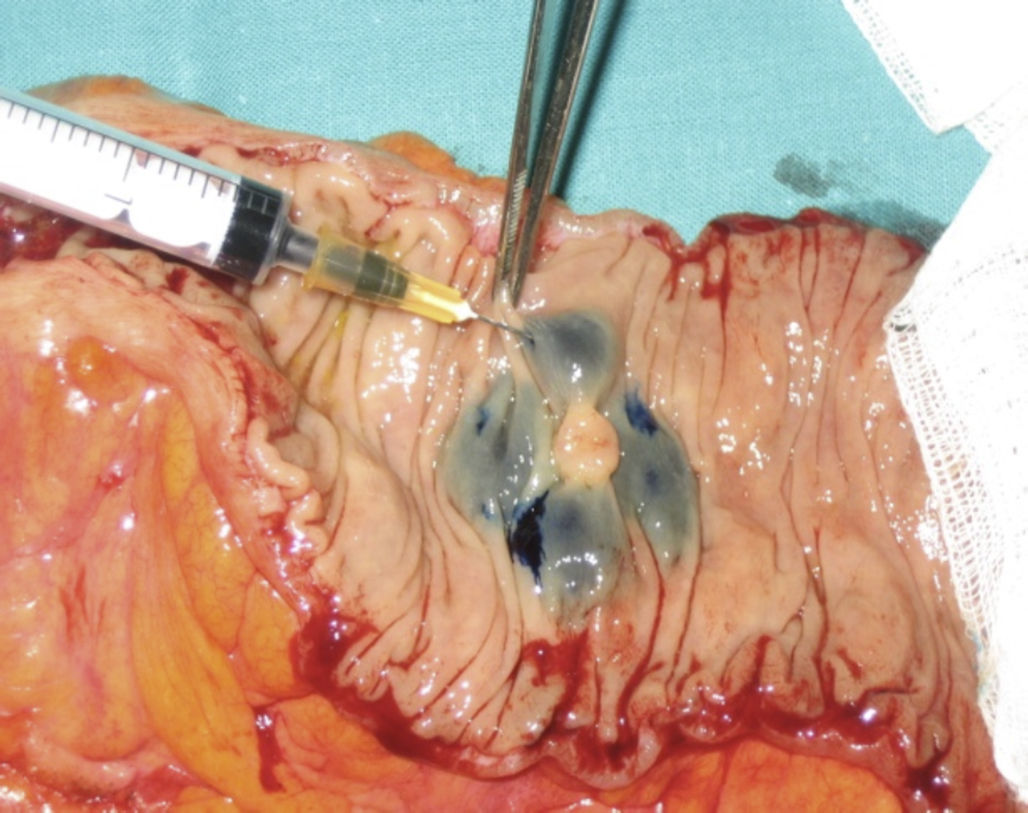
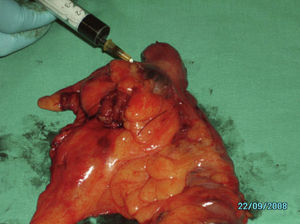
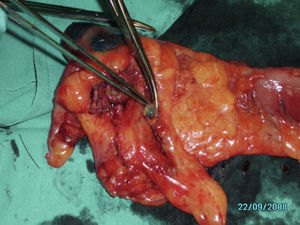
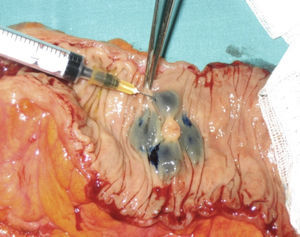
Una vez realizada la cirugía, se procedió al marcaje «ex vivo» de la lesión mediante la inoculación peritumoral a nivel subseroso de 2ml de azul de metileno distribuidos en 0,5ml en cada cuadrante (fig. 1). Tras la inoculación se procedió al masaje de los puntos de infiltración durante 5 min hasta visualizar los primeros ganglios, entre 1 y 4, que correspondieron a los GC (fig. 2). Cuando la lesión tumoral no fue palpable se procedió a la apertura de la pieza por el borde antimesentérico y la tinción se realizó mediante inoculación submucosa siguiendo el mismo proceso antes descrito (fig. 3).
Los ganglios teñidos con el marcador se consideraron los GC.
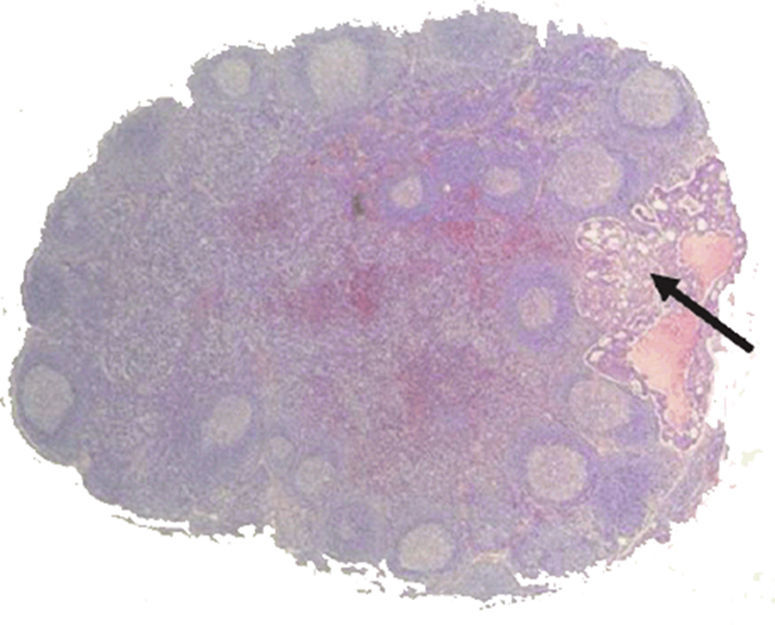
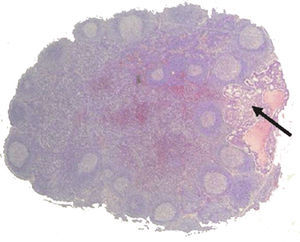
Se realizó un estudio anatomopatológico convencional de la pieza. En referencia a los GC, aquellos con un tamaño igual o inferior a 0,5cm se incluyeron en su totalidad; si el tamaño fue superior se cortaron en secciones de aproximadamente 3mm. Cada GC o sus secciones se incluyeron en bloques de parafina identificados según el procedimiento convencional. De cada bloque se cortaron secciones de 5 μs a 3 niveles; de cada nivel se tiñeron 2 secciones con hematoxilina y eosina y se reservó una tercera para el estudio inmunohistoquímico que se efectuó en caso de ser negativo el estudio convencional. El estudio inmunohistoquímico consistió en la identificación de citoqueratinas CAM 5.2 (Becton-Dickinson) a dilución 1/5 y tratamiento con pepsina, utilizando un autoteñidor Horizon, técnica, material e instrumental de uso estándar en el laboratorio de inmunohistoquímica del servicio de Anatomía Patológica. Se consideró micrometástasis el depósito de celulas tumorales inferior a 2mm (fig. 4).
El seguimiento de los pacientes se ha llevado a cabo según el protocolo de nuestro centro, consistente en controles trimestrales durante los 2 primeros años y cada 6 meses en los años siguientes.
Análisis estadísticoPara la descripción de las variables categóricas se utilizaron números absolutos y con porcentajes. A las variables cuantitativas se les dieron valores de media y mediana. Se realizó estudio uni- y multivariado de factores predictivos de la aparición de recidiva, así como un análisis de la mortalidad. Se utilizó la regresión de Cox para valorar la diferente influencia de factores predictivos (técnica quirúrgica utilizada, presencia o no de micrometástasis). Una p <0,05 se consideró estadísticamente significativa. Para realizar el análisis se utilizó el Statistical Package for the Social Sciences (SPSS, versión 17.0).
ResultadosEntre enero de 2007 y febrero de 2011 se intervino a 101 pacientes diagnosticados de adenocarcinoma de colon (56 hombres y 45 mujeres) con una edad media de 73 años y un IMC de 27,8. Se realizaron 39 colectomías derechas, 13 colectomías izquierdas, 37 sigmoidectomías y 7 resecciones anteriores altas. En el 85% de los casos se llevó a cabo un abordaje laparoscópico, con una tasa de conversión del 7,7%. El índice de morbilidad fue del 34%, con una estancia media de 7 días (mediana). La tasa de reoperación fue 5,8% (6 casos: un hemoperitoneo y 5 casos de dehiscencia) con una mortalidad de 2,3% (2 pacientes).
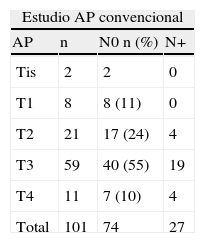
El tamaño medio de los tumores fue de 5,17cm, y en todos ellos los márgenes de resección estaban libres de afectación. La estadificación de las lesiones y estudio ganglionar convencional quedan reflejados en la tabla 1.
En cuanto al estudio ganglionar, se obtuvieron 1.482 ganglios en total. El número medio de ganglios obtenidos por intervención fue de 15. El número total de GC fue de 198 con un promedio de 2 GC por pieza. El índice de detección del GC fue del 91% (92 casos).
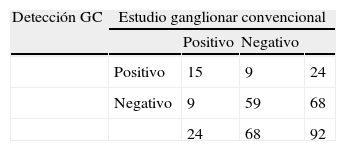
En la tabla 2 se observa la correlación entre el diagnóstico anatomopatológico convencional de los ganglios y los resultados del estudio de los GC.
En aquellos pacientes donde el estudio ganglionar convencional no objetivó afectación ganglionar (N0), el estudio del GC fue positivo para micrometástasis en 9 casos, representando un porcentaje de detección de GC y, en consecuencia, de supraestadificación del 14%.
En 8 de los 9 casos, la detección positiva se realizó mediante tinción con hematoxilina-eosina de un mayor número de secciones realizadas en el ganglio. En el caso restante se obtuvo mediante el estudio inmuhistoquímico10.
Por otra parte, la incidencia de falsos negativos (GC negativo con otros ganglios afectados en el estudio convencional) fue de 9 pacientes (10%).
A partir de estos resultados obtenemos un valor predictivo negativo de 86% (59/9+59) y un valor predictivo positivo del 62,5%.
Seguimiento clínicoDel total de los 101 pacientes incluidos en el estudio hemos conseguido un seguimiento medio de 38 meses en el 97% de ellos (3 pacientes perdidos en el seguimiento por cambio de domicilio). La mortalidad durante el seguimiento fue de 5% (5 pacientes), todos ellos por recidiva.
Hemos analizado el seguimiento de aquellos pacientes sin afectación ganglionar según el estudio convencional (74 pacientes), con el objetivo de comparar los resultados según presentaran afectación o no del GC (GC+ vs GC−). Todos ellos presentan un seguimiento superior a 20 meses y el seguimiento medio ha sido de 38 meses. El grupo de pacientes N0 según el estudio convencional y GC− (65 pacientes) presentan un índice de recurrencia del 7% (4 pacientes), mientras que este índice fue del 22,2% (2 pacientes) en el grupo de pacientes GC+ (9 pacientes). Las recidivas que se produjeron fueron 4 locales y 2 a distancia después de 20 meses desde la cirugía.
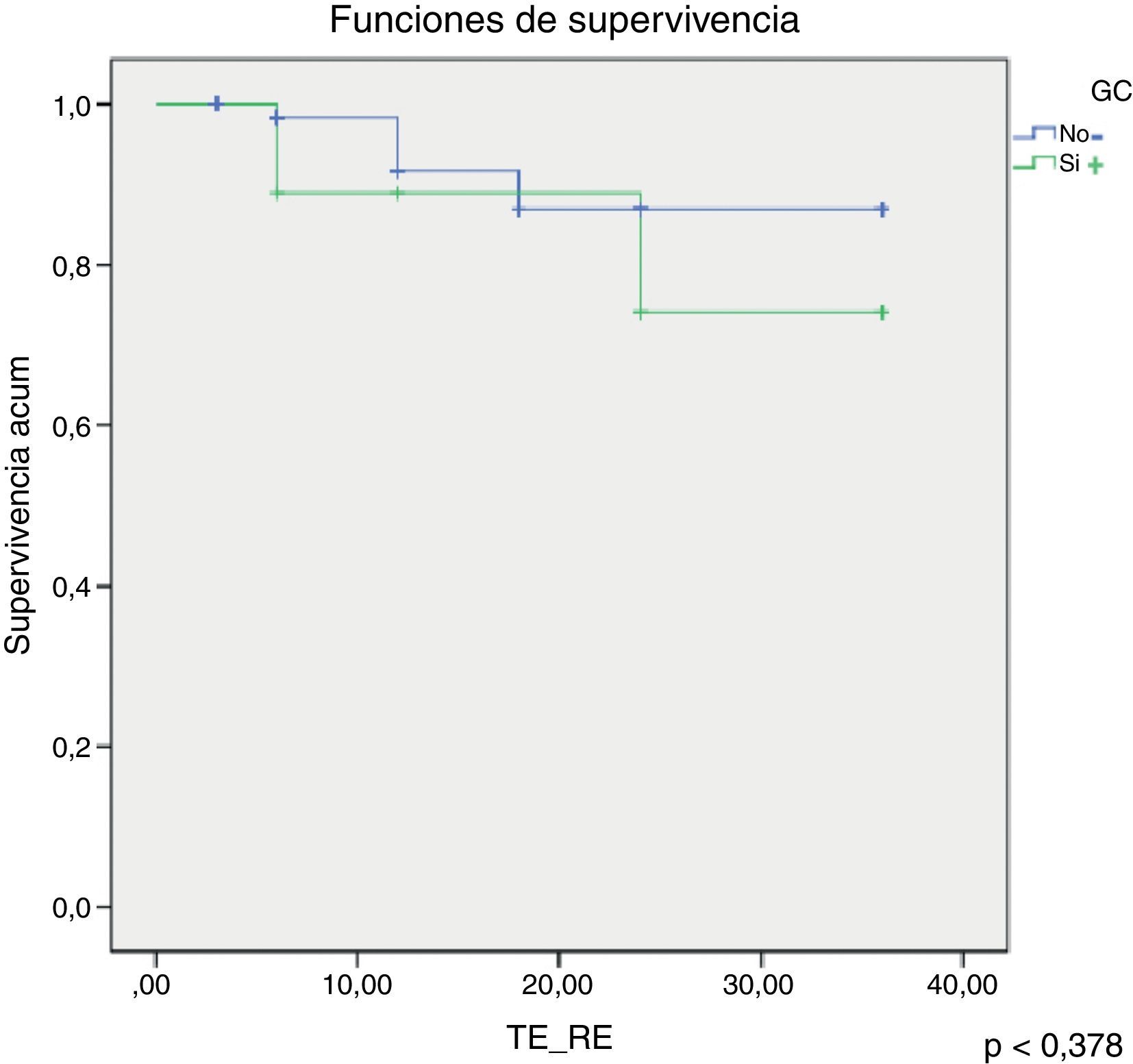
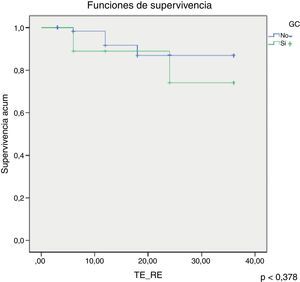
Se ha analizado la supervivencia de los pacientes aplicando la regresión de Cox con una tendencia a la mayor supervivencia de los pacientes con GC− (fig. 5) pero sin ser estadísticamente significativo (p<0,378).
DiscusiónDesde la introducción del GC en el cáncer colorrectal por Saha, diferentes autores han llevado a cabo su aplicación. La identificación de los GC en los diferentes estudios publicados oscila entre el 58 y el 100%11,12, alcanzándose un mayor porcentaje en las series con un mayor número de pacientes. Así mismo, la supraestadificación obtenida con el estudio de los GC es muy variable, oscilando entre el 6 y el 60% sin llegar a resultados concluyentes.
La justificación de la variabilidad en los resultados obtenidos puede estar en la heterogeneidad de las técnicas utilizadas tanto para la tinción (colorante, trazador) como para definir la positividad del GC (hematoxilina-eosina, IH, PCR)10–14.
Se ha descrito la utilización de diferentes sustancias para la tinción peritumoral, si bien la más frecuentemente utilizada es el azul de isosulfán que, por su coste elevado, en algunos centros como el nuestro se ha cambiado por azul de metileno, con obtención de resultados comparables. Por otra parte, algunos autores abogan por la utilización de trazador y su detección con sonda15. Estos 2 sistemas de detección pueden ser complementarios.
Algunos autores16 consideran que en pacientes con IMC elevados, con un mesocolon de mayor grosor, puede dificultarse la identificación de los ganglios teñidos mientras que la sonda puede ayudar a detectar el trazador y guiar la disección del GC. En nuestra serie no hemos objetivado diferencias significativas según el IMC del paciente, con la utilización de tinción como único método de detección.
Mientras la mayoría de autores llevan a cabo la determinación del ganglio «in vivo», otros autores realizan dicha determinación «ex vivo» una vez la pieza está extirpada. Las diferentes series publicadas presentan resultados comparables en cuanto a porcentaje de determinación del ganglio. Saha et al.4, en una serie de 240 casos, fueron quienes describieron la técnica «in vivo» con la inoculación de 1-2ml de azul de isosulfán (Lymphazurin®) al 1%, consiguiendo la detección de los GC en el 100% de los casos con un 89% de sensibilidad, un 100% de especificidad y un valor predictivo negativo del 93,5%. En cuanto al método «ex vivo», Wong et al.17 describieron la inoculación de 1ml de azul de isosulfán al 1%, consiguiendo identificar el GC en el 92,3% de los pacientes, con una media de 3 GC por paciente, y obtuvieron un 29% de sobreestadificación. El motivo que da soporte a la realización de estudios «ex vivo» es que el tumor se puede manipular y los linfonodos disecar para identificar los GC sin el riesgo de diseminación de células tumorales. Sin embargo, las determinaciones «in vivo» permiten la detección de ganglios aberrantes, fuera del territorio ganglionar esperable y, por consiguiente, ampliar la zona de resección. Otros estudios han llevado a cabo la detección del GC mediante ambos métodos18,19, obteniendo su identificación en un 94-100% de los casos.
En nuestro trabajo hemos optado por el uso de azul de metileno mediante la técnica «ex vivo» debido a que en nuestro centro utilizamos el abordaje laparoscópico en el 85% de la cirugía oncológica del colon. Aunque hay estudios que han descrito la detección del GC «in vivo» durante cirugía laparoscópica20, la punción por esta vía nos parece demasiado compleja al implicar una mayor manipulación del tumor, por lo que la hemos desestimado hasta el momento actual. Otra de las opciones planteadas es la inoculación endoscópica preoperatoria del trazador. Consideramos que sería la técnica más adecuada en los pacientes operados mediante cirugía laparoscópica, pero el protocolo «gast-track» utilizado en nuestro centro implica la no preparación mecánica preoperatoria del colon, lo que imposibilita el marcaje endoscópico. Nuestro grado de detección es del 90%, similar a lo publicado en la literatura.
Por otra parte, nuestro índice de falsos negativos es del 10%. Este hecho puede deberse a varios factores. En nuestra experiencia, el factor determinante ha sido la curva de aprendizaje, puesto que la mayoría de casos no detectados se situaron entre los primeros incluidos en el estudio. Tampoco hemos objetivado que la estadificación tumoral determinara un mayor porcentaje de error en la detección del GC (p < 0,8842).
En cuanto a cómo identificar las micrometástasis en el GC desde el punto de vista anatomopatológico, en nuestro caso la mayoría (8/9) han sido mediante el aumento de las secciones del ganglio, disminuyendo la importancia de la IH o PCR que otros trabajos destacan10–13.
El aspecto fundamental a considerar es la trascendencia clínica del estudio del GC. Saha et al.4, en un estudio multicéntrico retrospectivo sobre un total de 868 pacientes con CCR y seguimiento mínimo de 2 años, afirman que los pacientes estratificados con técnica de GC presentan significativamente una menor tasa de recurrencia neoplásica (7 vs 25%). Los autores atribuyen estos resultados a la administración de quimioterapia en el caso de presentar positividad en los GC. En nuestra serie hemos obtenido 9 GC positivos (con estudio convencional negativo), lo que supone una supraestadificación del 14%. Al analizar los resultados del seguimiento hemos objetivado que el índice de recidivas en el grupo de pacientes GC+ ha sido muy aproximado a aquellos pacientes con ganglios positivos en el estudio convencional, a diferencia de los resultados obtenidos por el grupo de pacientes GC−. Sin embargo, el número de la muestra no es suficientemente elevado para poder obtener diferencias estadísticamente significativas. Actualmente, nuestro protocolo no indica tratamiento quimioterápico en caso de positividad de GC, aunque en los últimos años comienza a considerarse la opción de la adyuvancia en estos pacientes21.
Tras la realizacion de nuestros primeros 100 pacientes aplicando la técnica del GC «ex vivo», podemos concluir que es una práctica reproducible sin aumento significativo del tiempo ni de los costes en el estudio ganglionar. Es una técnica que puede llegar a supraestadificar el 14% de pacientes que habían sido clasificados como N0 con técnica convencional, lo que podría llevar a cambios en las pautas de tratamiento adyuvante. Creemos que deberían realizarse estudios con mayor número de pacientes y, por tanto, multicéntricos, homogeneizando en lo posible la técnica utilizada, en términos de marcador utilizado, abordaje quirúrgico (laparoscopia vs laparotomía) y disección de los ganglios «in vivo» o «ex vivo».
FinanciaciónBeca MIA (Molt il·lustre administració) Fundación privada Hospital de la Santa Creu i Sant Pau. 2.a edición de becas para la investigación 2010. 2.° premio Staff Médico. Premios Ulysses a la investigación Grupo CTO 2010.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.