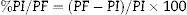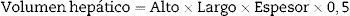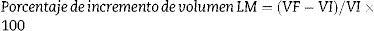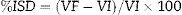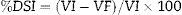La insuficiencia hepática postresección es una de las principales causas de muerte en el postoperatorio de una hepatectomía mayor. La técnica ALPPS aparece como una estrategia prometedora para evitarla, pero no existen estudios experimentales al respecto. El objetivo del trabajo es desarrollar un modelo experimental de ALPPS en ratas.
MétodoSe desarrolló un modelo experimental de ALPPS en 30 ratas Sprague Dawley. Se realizó la ligadura de la rama portal izquierda del lóbulo medio (LM), con lo cual se demarca el sector izquierdo (SILM) y derecho (SDLM); posteriormente se realizó la transección parenquimatosa por la línea isquémica. Se evaluaron el peso del animal, el volumen y peso del LM y de ambos. Sacrificio a los 3, 7 y 14 días (10 por grupo).
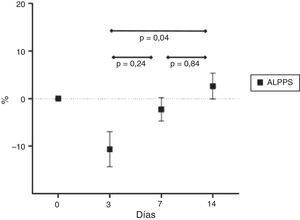
ResultadosNo se presentaron complicaciones hemorrágicas ni ascitis en el postoperatorio. El incremento del volumen del LM fue del 24,1; 86,9 y 120,4% a los 3, 7 y 14 días. El SDLM (no ligado) se incrementó un 34,4; 78,8 y 102,0% a 3, 7 y 14 días. El SILM disminuyó un 42,6; 64,8, y 79,3% en los días 3, 7 y 14.
ConclusiónLa realización del ALPPS fue posible en ratas, logrando los resultados esperados. Futuros estudios son necesarios para compararlo con la técnica de hepatectomía en 2 tiempos.
Liver failure migth be a cause of death after major hepatectomies. The ALPPS technique appears to be a promising strategy to avoid it, however no experimental studies supporting this procedure have been previously described. The aim was to develop an experimental model of ALPPS in rats.
MethodExperimental. A total of 30 Sprague Dawley rats were used. To develop the ALPPS procedure, ligation of the left portal branch of the middle lobe (LM) was performed. This demarcates the left side (SILM) from the right side (SDLM); parenchyma transection was performed following the demarcated line. The animal's weight, volume and weight of both LM were analyzed. Sacrifice at 3, 7 and 14 days after the procedure (10 per group) was performed.
ResultsNo bleeding or ascites were observed during the postoperative period. The LM increased by 24.1, 86.9 and 120.4% at 3, 7 and 14 days. The SDLM increased by 34.4, 78.8 and 102.0% at 3, 7 and 14 days. The SILM decreased 42.6, 64.8, and 79.3% at day 3, 7 and 14 days respectively.
ConclusionThe ALPPS procedure can be performed in rats, achieving the expected results. Comparison studies to 2 staged hepatectomy will be necessary.
La necesidad de realizar grandes resecciones hepáticas ha llevado a los diferentes grupos quirúrgicos a idear estrategias para disminuir el desarrollo de insuficiencia hepática postoperatoria. La hepatectomía en 2 tiempos con ligadura o embolización portal es un procedimiento universalmente aceptado, que se emplea en caso de que el futuro hígado remanente sea de reducido tamaño. En la primera etapa (primera cirugía) uno debe resecar los tumores existentes del lado que debemos hipertrofiar, realizando la ligadura o embolización portal contralateral. Luego de un período de 4-6 semanas, comprobada la hipertrofia del lado no embolizado, se completa la segunda etapa (segunda cirugía) y se realiza la resección del hígado con la oclusión portal1–5. De esta manera disminuimos la posibilidad de insuficiencia hepática por hígado pequeño6,7.
Sin embargo, esta técnica a veces no es suficiente para lograr la hipertrofia necesaria. Recientemente se ha desarrollado una nueva técnica para realizar las hepatectomías en 2 tiempos. En la misma, se agrega a la ligadura de la vena porta la transección del parénquima hepático entre el hígado a resecar y el futuro hígado remanente como parte del «primer tiempo». Luego se debe completar el «segundo tiempo» al cabo de 7 días8. Esta técnica se ha denominado con el acrónimo de ALPPS, surgido del inglés associating liver partition and portal vein ligation for staged hepatectomy9–11. El beneficio comunicado por la misma es la aparentemente mayor y más rápida hipertrofia del hígado comparada con la obtenida con la sola oclusión portal12. El entusiasmo por estos hallazgos ha llevado a diferentes grupos quirúrgicos a realizar esta práctica, sin tener evidencia científica básica que la respalde, incluyendo el nuestro. Las comunicaciones clínicas existentes han demostrado un aumento en la morbimortalidad del ALPPS respecto a la clásica hepatectomía en 2 tiempos9–11.
En el año 2000, el Medical Research Council (MRC) de Gran Bretaña estableció disposiciones para la evaluación de las intervenciones quirúrgicas complejas y el desarrollo de nuevos procedimientos. Las recomendaciones del MRC incluyen: el desarrollo y evaluación a través de fases iterativas, el uso de modelos experimentales en lugar de diseños observacionales cuando sea posible, la medición de los resultados, informar detalladamente las intervenciones para mejorar su reproducibilidad, la síntesis de la evidencia y lograr una aplicación más amplia13–15. Sin embargo, la necesidad de resolver problemas clínicos ha llevado a la innovación antes del desarrollo de modelos de estudio, como lo ocurrido en el caso del ALPPS.
El objetivo del presente trabajo es desarrollar una técnica de ALPPS en un modelo experimental en ratas, como paso inicial en la valoración fisiológica de los mecanismos de regeneración hepática envueltos en esta nueva técnica.
Materiales y métodosDiseño metodológicoSe configura como un estudio experimental controlado. Se utilizaron 30 ratas macho de la cepa Sprague Dawley a las cuales se aplicó la técnica de ALPPS. Se sacrificaron los animales en los días 3, 7 y 14, en un número de 10 por cada grupo de sacrificio. En dicho oportunidad se toman muestras de hígado para una futura evaluación histológica.
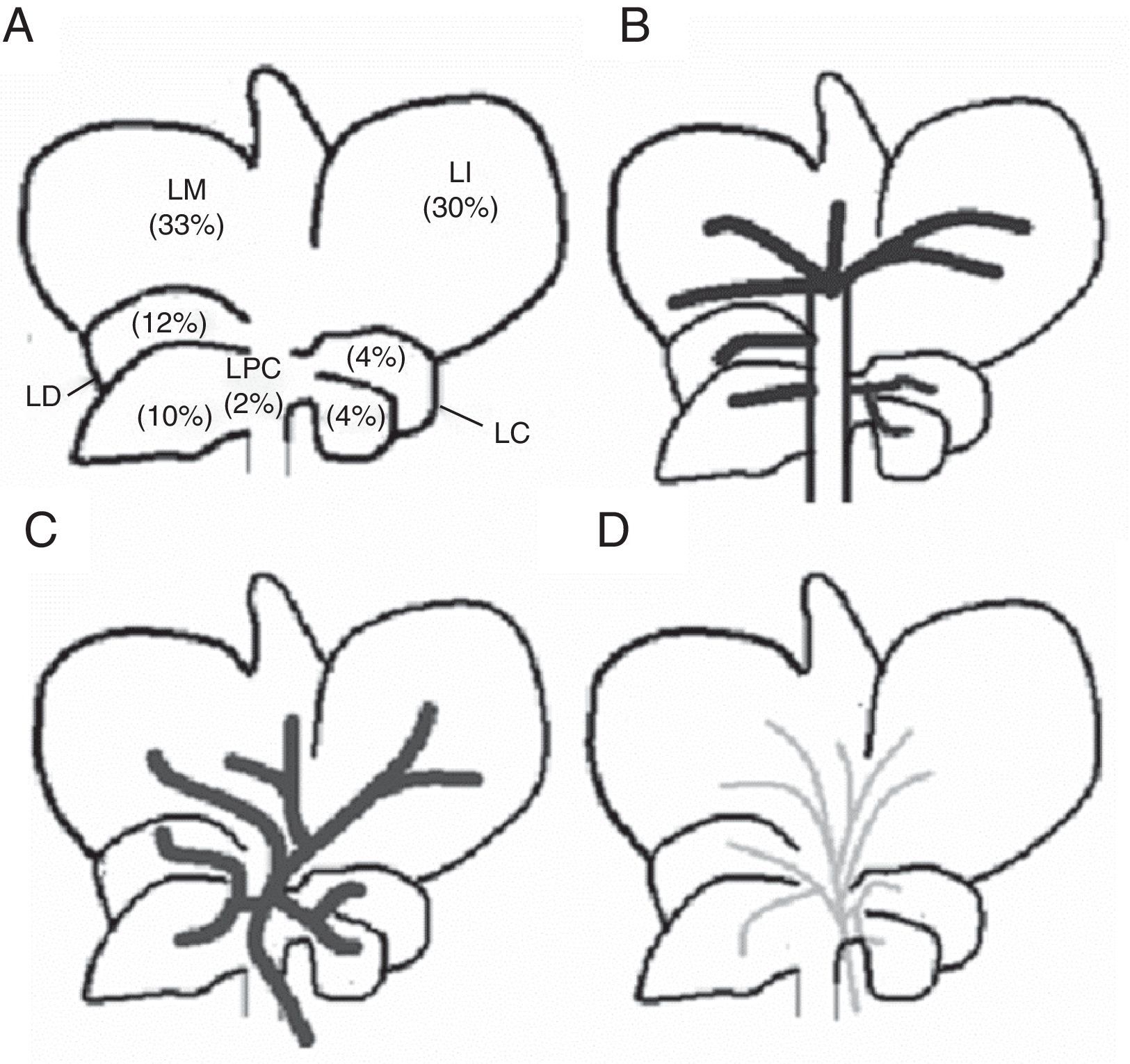
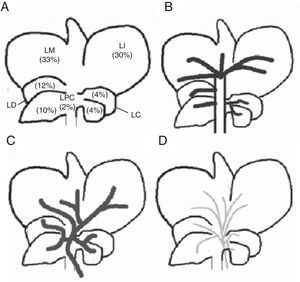
El hígado de la rata consta de 5 lóbulos: derecho, medio, izquierdo, caudado y paracava (fig. 1). Cada uno de ellos está irrigado por un pedículo portal propio y drenado por venas hepáticas propias. A su vez, el lóbulo medio consta de 2 ramas portales separadas: la rama derecha del lóbulo medio y la rama izquierda del lóbulo medio. Sobre esa base desarrollamos el modelo experimental de ALPPS, debiendo buscar la forma de convertir la anatomía hepática de la rata en una variante similar a la del hígado humano para así poder realizar la técnica de ALPPS16.
TécnicaEl modelo experimental desarrollado se corresponde con los estándares aceptados para manejo de animales de laboratorio del Comité Institucional para el Cuidado y Uso de Animales de Laboratorio (CICUAL). Para el desarrollo de la técnica se empleó un microscopio quirúrgico Carl Zeiss® 10x.
Todos lo animales fueron anestesiados con isoflorane y oxígeno (concentración de isuflorane de 1,5% y oxígeno a 0,5 l/min) utilizando un vaporizador HERLAM® Modelo Isovap 2000 (Laboratorios Herlam, Argentina). Para lograr la analgesia postoperatoria se administró morfina por vía subcutánea a razón de 2,5mg/kg.
Bajo condiciones de esterilidad se practicó la laparotomía por línea media, sección del ligamento falciforme. Expuesto el hígado, se disecó el pedículo del lóbulo caudado siendo ligada la vena porta del mismo con seda 7-0. Luego se realizó el mismo procedimiento en las ramas portales de los lóbulos derecho e izquierdo, respectivamente. Posteriormente se procedió a la disección y ligadura de la rama izquierda de la porta que nutre el lóbulo medio. La correcta ligadura de la rama portal se visualiza por un cambio de coloración del parénquima, el cual se nota especialmente en el lóbulo medio donde la preservación del flujo portal del lado derecho ofrece la línea de demarcación isquémica. Seguidamente, se realizó la transección del parénquima hepático siguiendo la línea de demarcación isquémica. La misma se realizó con la colocación de puntos de polipropileno 7-0 en U, dispuestos paralelamente para luego seccionar el parénquima con tijera, pasos que se realizarán progresivamente hasta alcanzar el lóbulo paracava (fig. 2)17. Este último lóbulo se deja indemne. En todos los casos se preservó la circulación arterial y las ramas de la vía biliar.
Representación esquemática de los pasos técnicos para adaptar el lóbulo medio de la rata a las técnicas de oclusión portal (negro: flujo portal ocluido; gris: flujo portal presente). A) Hígado de la rata con sus respectivos lóbulos e irrigación portal preservada (véase descripción en el texto). B) Hígado con la ligadura de los pedículos portales de los lóbulos derecho, izquierdo y caudado. C) Hígado con ligadura de la rama portal izquierda del lóbulo medio, con lo cual se delimitan 2 sectores: sector derecho del lóbulo medio y sector izquierdo del lóbulo medio; la línea de demarcación isquémica será el sitio de transección en la técnica ALPPS.
Las extracciones de sangre se realizaron de manera seriada por punción del plexo retroocular en los días 1, 3, 7 y 14, según correspondiera el sacrificio del animal. El sacrificio del animal se realizó por exanguinación bajo anestesia por punción directa de la vena cava inferior, procedimiento que se aprovecha para tomar muestra de sangre para análisis bioquímico.
Mediciones realizadasPeso del animal: cada rata fue pesada al momento de la primera cirugía y al momento del sacrificio.
Relación porcentual peso final (PF)/peso inicial (PI): como medida de evaluación clínica se calculó esta variable de acuerdo a la fórmula siguiente:
Volumen hepático: se registró el volumen total del lóbulo medio (VTLM), el volumen del sector derecho del lóbulo medio (VSD) y del sector izquierdo (VSI). El cálculo se hizo a partir de la siguiente fórmula18:
Las mediciones se hicieron de forma directa al momento de la cirugía con calibre (Vernier® Caliper 0–150mm, China), siempre en la misma dirección y por el mismo operador. Fueron repetidas durante la cirugía y al sacrificio para su comparación.
Porcentaje de incremento de volumen del LM (% ILM): Se calcula la relación porcentual entre su volumen final (VF) y volumen inicial (VI) según la fórmula siguiente:
Porcentaje de incremento de volumen del SDLM (% ISD): se aplica la misma fórmula anterior
Porcentaje de disminución de volumen del SILM (% DSI): en este caso se asume una disminución del volumen posterior a la ligadura del pedículo portal. Se calcula como porcentaje de disminución del VF respecto del VI, de acuerdo a la siguiente fórmula.
Estudios bioquímicos: se realizaron dosajes de transaminasa glutámico-oxalacética (TGO), transaminasa glutámico-pirúvica (TGP), bilirrubina total (BT), lactato deshidrogenasa (LDH), concentración de protrombina (Quick).
Análisis estadísticoLos resultados se presentan como media±su desviación estándar. Se consideró significativo un valor de p ≤ 0,05. Se empleó el paquete estadístico SPSS v17.0 (Release 17.0.0; 2008).
ResultadosLa técnica se pudo llevar a cabo exitosamente en el modelo experimental propuesto. No se presentaron complicaciones hemorrágicas debido a la superficie de corte ni ascitis en el postoperatorio.
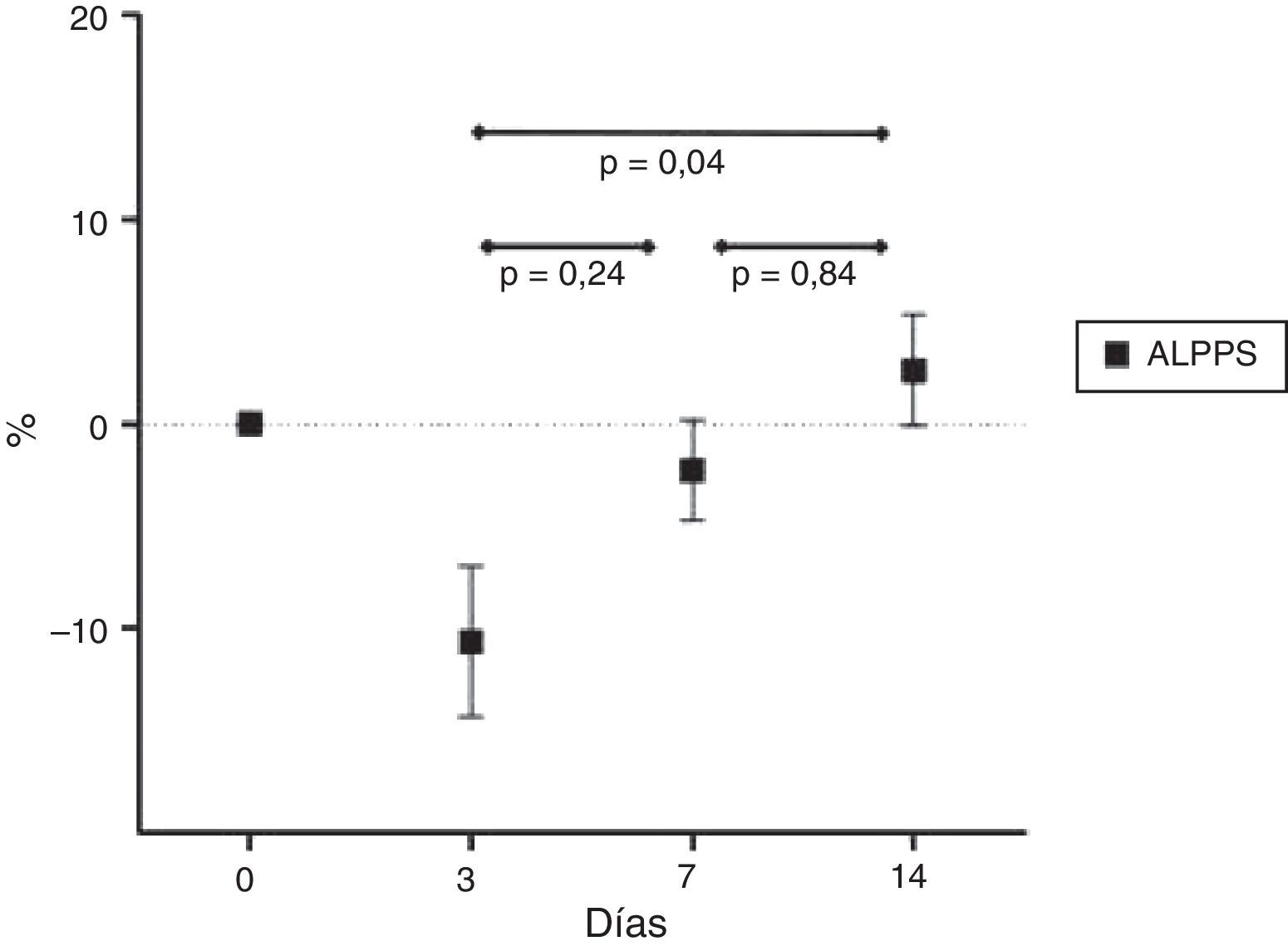
Las medias de relación porcentual entre el peso inicial y final del animal se representan en la figura 3.
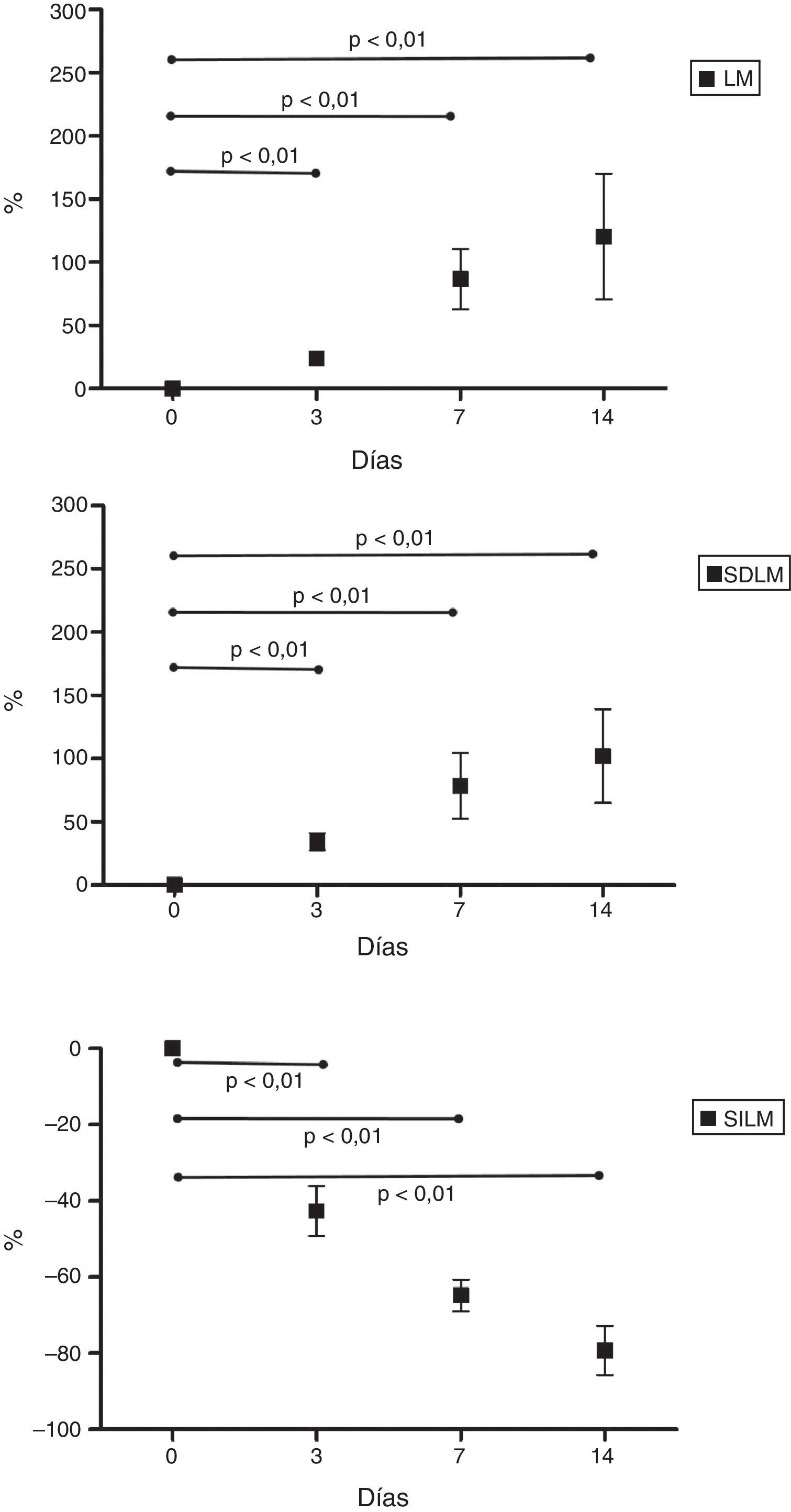
La media del incremento porcentual del LM fue de 24,1±8,8% a los 3 días; 86,9±47,8% a los 7 días y 120,4±99,5% a los 14 días. La media del incremento porcentual del SDLM fue de 34,4±21,6% a los 3 días; 78,8±81,7% a los 7 días y 102,0±117,7% a los 14 días. La media de disminución porcentual del SILM fue de 42,6±13,1% a los 3 días; 64,8±8,4% a los 7 días y 79,3±12,9% a los 14 días. Los resultados se ven representados en la figura 4. También hemos observado una disminución volumétrica de los lóbulos derecho, izquierdo y caudado que fueron ligados como parte del desarrollo de la técnica.
La tabla 1 representa los valores de las determinaciones bioquímicas.
Valores de las determinaciones bioquímicas analizadas
| Días | Media±DE |
| TGO (UI/ml) | |
| 1 | 1.422±808 |
| 3 | 280±112 |
| 7 | 214±79 |
| 14 | 164±70 |
| TGP (UI/ml) | |
| 1 | 888±700 |
| 3 | 114±68 |
| 7 | 64±26 |
| 14 | 65±32 |
| Bilirrubina total (mg/dl) | |
| 1 | 0,10±0,02 |
| 3 | 0,15±0,06 |
| 7 | 0,12±0,04 |
| 14 | 0,13±0,05 |
| LDH (UI) | |
| 1 | 1.369±845 |
| 3 | 1.019±537 |
| 7 | 2.251±802 |
| 14 | 909±371 |
| Quick (%) | |
| 1 | 94±45 |
| 3 | 87+0 |
| 7 | 64±0,7 |
| 14 | 75±3,5 |
Se presentan como medias ± desviaciones estándar.
p significativa≤0,05.
El principal objetivo para el presente trabajo fue el de desarrollar el primer modelo experimental en ALPPS, ya que la literatura consultada no cuenta con trabajos de investigación básica en el tema que permitan estudiar los mecanismos fisiológicos de regeneración asociados a esta innovación quirúrgica. Es por ello por lo que solo se describe el desarrollo de la técnica, sin realizar la comparación con la ligadura portal solamente y sin el segundo tiempo quirúrgico, que sería la segunda hepatectomía. Esto último, estudios funcionales y el estudio histológico, forman parte de la segunda etapa del proyecto.
El primer paso para poder desarrollar este modelo fue «humanizar» el hígado de la rata. Como hemos dicho anteriormente, el hígado de la rata tiene 5 lóbulos. El lóbulo medio, al tener 2 ramas portales, nos permitió ligar una de ellas y realizar la transección parenquimatosa, simulando un hígado entero al cual se le liga una rama de la vena porta y se le realiza el procedimiento de ALPPS. La elección de ligar la rama izquierda del lóbulo medio fue debido a la factibilidad técnica. Es de destacar que dicho procedimiento requiere un entrenamiento en cirugía experimental en ratas ya que es indispensable la preservación de la irrigación arterial y del conducto biliar de los lóbulos donde se realiza la ligadura portal19. Es aconsejable realizar este procedimiento con algún método de aumento de imágenes.
Se pudo observar que a los 3 días del postoperatorio ya existe un aumento significativo del volumen hepático del futuro hígado remanente (sector derecho del lóbulo medio), que continúa creciendo a los días 7 y 14. Este aumento se relaciona directamente con una disminución del volumen del sector del hígado al cual se le realizó la ligadura portal (sector izquierdo del lóbulo medio y el resto de los lóbulos hepáticos). Esto último guarda directa relación con la ausencia del flujo portal. Esto demuestra que el modelo reproduce lo mismo que ocurre en el humano, por lo cual consideramos que nuestro objetivo fue alcanzado.
Un dato importante que observamos es la repercusión que tiene el procedimiento en el peso del animal. Hemos visto que al tercer día del postoperatorio hay una disminución significativa del peso, seguramente asociada a un estado catabólico del animal. Este estado es recuperado recién a los 14 días del procedimiento. Creemos que este dato es de suma importancia ya que lo podemos correlacionar con lo que ocurre en el ser humano. Una de las mayores críticas que se le hace al procedimiento del ALPPS es que somete a un paciente a 2 procedimientos quirúrgicos complejos en un período corto de tiempo. La segunda hepatectomía se realiza habitualmente a la semana del primer procedimiento. En esta etapa, el paciente continúa en un período catabólico, por lo tanto puede ser que no esté en las mejores condiciones clínicas, ya que está cursando el postoperatorio inmediato de una primera cirugía compleja. Este hecho lo podemos asociar al aumento de la morbimortalidad que presentan los pacientes tratados con un ALPPS. Está bien claro que el ALPPS es una excelente técnica para lograr la hipertrofia del futuro hígado remante. Sin embargo, no sabemos qué ocurriría si en vez de operar a los pacientes en la primera semana del postoperatorio, esperamos 2 o 3 semanas a que el paciente esté en mejores condiciones clínicas.
Los aumentos obtenidos en las determinaciones bioquímicas de TGO y de TGP entendemos que se deben a la transección parenquimatosa realizada. La elevación enzimática en el postoperatorio es observada en la práctica clínica tras una hepatectomía, con la consecuente normalización postoperatoria.
Para avanzar en el estudio del fenómeno de regeneración asociado al ALPPS, se requieren otros análisis, ya en curso y que superan el objetivo primario de esta publicación que es la descripción técnica del modelo, que sin duda servirán para afianzar el conocimiento sobre el cual se desarrolle esta nueva y promisoria técnica. Podemos así concluir que el modelo experimental de ALPPS hoy es una realidad, es reproducible y serviría como base de comparación fisiopatológica con otras técnicas de resección hepática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.