Analizar la utilidad de tres índices predictivos de fibrosis en la detección de hígado graso no alcohólico (HGNA) como método no invasivo en atención primaria.
DiseñoEstudio descriptivo de base poblacional, multicéntrico y transversal, procedentes de 25 Centros de Atención Primaria de la provincia de Barcelona.
ParticipantesIndividuos sanos entre 17-83 años seleccionados aleatoriamente a partir del Sistema Informático de Atención Primaria (SIAP).
MétodoAnamnesis, exploración física, analítica para determinar los índices predictivos de fibrosis; HAIR (hipertensión arterial, resistencia a insulina, alaninaaminotransferasa); Fatty Liver Index (FLI) (índice de masa corporal, gammaglutamiltranspeptidasa, triglicéridos, perímetro abdominal) y Lipid Accumulation Product (LAP) (triglicéridos, perímetro abdominal), y ecografía abdominal.
ResultadosSetecientos dos individuos, 58% mujeres, edad media de 53±14 años. Un 30,8% tuvieron FLI positivo, 6,7% el HAIR y 15,5% el LAP, oscilando la concordancia entre los tres índices entre el 63,1% y el 84,9%, con índices kappa entre 0,18 y 0,50. Cumplían criterios ecográficos de HGNA 184 individuos representando una prevalencia de 26,29%. La prevalencia de HGNA en pacientes con índice FLI, HAIR y LAP positivo fue del 46,8%, 68,1% y 56,0% respectivamente. El índice con mayor sensibilidad para HGNA fue el FLI≥60 con un 84%. La especificidad fue mayor para el HAIR y LAP con un 97% y 91% respectivamente.
ConclusionesFLI, HAIR y LAP son muy prevalentes y se han mostrado como marcadores independientes para el diagnóstico de HGNA. La falta de concordancia entre estos índices, provoca la obtención de diferentes prevalencias siendo necesario unificar criterios para obtener un índice más útil para el diagnóstico de HGNA.
To analyze the utility of three indices to predict hepatic fibrosis in the detection of non-alcoholic fatty liver disease (NAFLD) as a non-invasive method in primary care.
DesignWe performed a descriptive, cross-sectional, multicenter study with a populational base from 25 primary care centers in the province of Barcelona.
ParticipantsHealthy individuals aged 17 to 83 years randomly selected from the Primary Care Computer System.
MethodsMedical history, physical examination, and blood analyses were used to determine the following predictive indices of fibrosis; HAIR (hypertension, alanine-aminotransferase, insulin resistance); Fatty Liver Index (FLI) (body mass index, gammaglutamyl-transpeptidase, triglycerides, abdominal perimeter) and Lipid Accumulation Product (LAP) (triglycerides, abdominal perimeter), and abdominal echography.
ResultsWe included 702 individuals; 58% were women and the mean age was 53±14 years. The FLI was positive in 30.8%, HAIR was positive in 6.7%, and LAP was positive in 15.5%. Agreement among the three indices ranged from 63.1% to 84.9%, with kappa indices between 0.18 and 0.50. A total of 184 individuals met the echographic criteria of NAFLD, representing a prevalence of 26.29%. The prevalence of NAFLD in patients with positive FLI, HAIR and LAP indices was 46.8%, 68.1% and 56%, respectively. The index with the greatest sensitivity for NAFLD was tFLI≥60 with 84%. Specificity was highest for HAIR and LAP with 97% and 91%, respectively.
ConclusionsFLI, HAIR and LAP are highly prevalent and have been shown to be independent markers for the diagnosis of NAFLD. Because of the lack of concordance between the indices, different prevalences are obtained, thus requiring criteria to be unified in order to obtain a more useful index for the diagnosis of NAFLD.
El hígado graso no alcohólico (HGNA), se caracteriza por el depósito de ácidos grasos libres y de triglicéridos en el citoplasma de los hepatocitos, en forma de grandes vacuolas, en pacientes sin un consumo tóxico de alcohol y no asociado a otras enfermedades hepáticas. Esta entidad engloba un amplio espectro de lesiones que van desde la esteatosis hepática simple a la esteatohepatitis con un grado variable de fibrosis y que en algunos casos puede progresar a cirrosis hepática e incluso al hepatocarcinoma1,2. La prevalencia de la enfermedad se sitúa entre un 20-30% de los adultos en la población general en países occidentales3,4 y esta aumenta hasta el 70-90% en los pacientes con obesidad y diabetes5.
Los pacientes con HGNA están asintomáticos y habitualmente el diagnóstico se realiza ante el hallazgo de alteración de las enzimas hepáticas cuando se les practica una analítica por cualquier motivo o incluso en el contexto de un examen de salud rutinario, o por la presencia de cambios sugestivos de esteatosis en una ecografía realizada por cualquier motivo1,2.
El diagnóstico de certeza de HGNA se obtiene mediante la práctica de una biopsia hepática, no obstante se trata de un método invasivo con importantes riesgos y elevado coste6. Por este motivo se están investigando otros métodos no invasivos, ya sean serológicos7 o radiológicos8, que permitan hacer el diagnóstico de HGNA y a su vez diferenciar entre la esteatosis simple de la esteatohepatitis.
El objetivo de este estudio es valorar la utilidad de algunos de los índices predictores de fibrosis para el diagnóstico del HGNA desde la atención primaria.
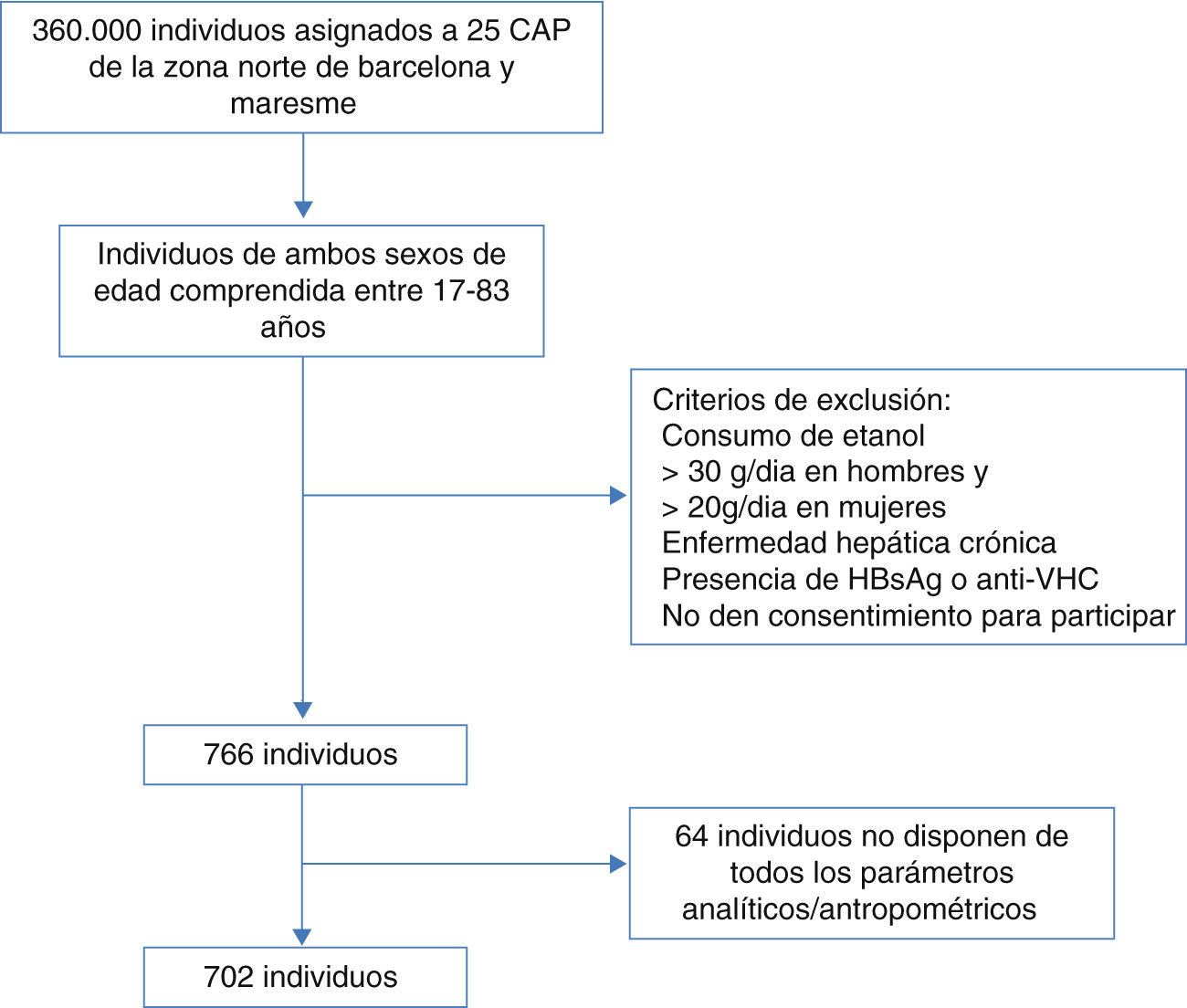
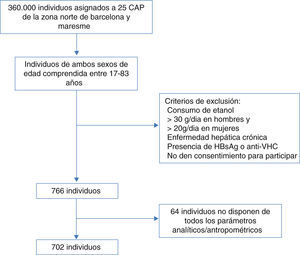
Materiales y métodosEste trabajo se basa en un estudio sobre la prevalencia de HGNA publicado previamente, donde puede consultarse con más detalle los procedimientos utilizados4. Resumiendo, se trata de un estudio descriptivo de base poblacional, multicéntrico, transversal, de individuos aparentemente sanos entre 15-85 años, procedentes de 25 centros de atención primaria de la zona del Barcelonès Nord i Maresme (Barcelona). Los individuos fueron seleccionados aleatoriamente a partir del Sistema Informático de Atención Primaria (SIAP) que equivale al censo municipal. Los criterios de exclusión fueron un consumo de alcohol superior a 30g/día en hombres y a 20g/día en mujeres, la presencia de enfermedad hepática conocida o presencia de antígeno de superficie del virus de la hepatitis B (VHB) o anticuerpos del virus de la hepatits C (VHC).
VariablesUna enfermera entrenada realizó una encuesta a todos los sujetos (datos sociodemográficos, hábitos de vida), recogió los datos antropométricos (obesidad general y central, tensión arterial) y revisó los datos de la historia clínica (antecedentes de enfermedad hepática, comorbilidades, fármacos). Se realizó una analítica: insulina basal, hemograma completo, glucemia basal, hemoglobina glucosilada, urea, creatinina, ácido úrico, perfil lipídico (colesterol, triglicéridos, colesterol HDL [cHDL], colesterol LDL [cLDL]), pruebas de función hepática (aspartato aminotransferasa [AST], alanino-aminotransferasa [ALT], gamma glutamiltansferasa [GGT]) incluyendo marcadores de hepatitis (antígeno de superficie del virus de la hepatitis B y anticuerpos frente al virus de la hepatitis c) y una ecografía en los centros de extracción y radiología habituales de cada sujeto. Se determinó la resistencia a la insulina (RI) mediante el método HOMA (homeostasis model assessment)([glucemia {mmol/L} x insulina {mU/L}]/22,5) considerándose presente con un HOMA ≥ 3,8.
Marcadores no invasivosSe calcularon y utilizaron 3 índices:
Índice HAIR9: que incluye las variables HTA (≥135/≥85mmHg), RI (HOMA>3,8) y ALT>40 UI/L. La presencia de dos o tres de estas variables indicaría la presencia de HGNA.
Índice FLI10: que incluye las variables triglicéridos, índice de masa corporal (IMC), GGT y el perímetro abdominal y se calcula a partir de la siguiente fórmula: FLI=(e0,953*loge (triglicéridos)+0,139*IMC+0,718*loge (GGT)+0,053* perímetro abdominal−15745)/(1+e0,953*loge (triglicéridos)+0,139*IMC+0,718*loge (GGT)+0,053* perímetro abdominal−15.745)*100. Si FLI<30 no HGNA; FLI≥60 HGNA; FLI entre 30-60 indeterminado.
Índice LAP11 incluye como variables el perímetro abdominal y los triglicéridos y se calcula mediante la fórmula: LAP para hombres=(circunferencia de cintura-65) x triglicéridos y el LAP para mujeres=(circunferencia de cintura-58) x triglicéridos. Valores de LAP en hombres<4 y en mujeres<4,4 indican no HGNA mientras que valores de LAP en hombres≥4 y en mujeres≥4,4 indicarían HGNA.
Ecografía abdominal: se realizó una ecografía abdominal con un tiempo máximo de tres meses después de la visita. El diagnóstico ecográfico de HGNA se realizó según los criterios estándares aceptados por la American Gastroenterology Association12.
Este estudio fue aprobado por el Comité de Ética de Investigación Clínica de la Función IDIAP Jordi Gol y el Instituto de Salud Carlos III.
Análisis estadísticoLos datos se presentan en frecuencias y porcentajes cuando se trata de variables categóricas, media y desviación estándar cuando se trata de variables continuas con una distribución aproximadamente simétrica y mediana y rango intercuartílico para variables continuas no simétricas. Se usó la prueba de chi cuadrado para comparar variables categóricas y la t de Student para comparar dos medias, empleando pruebas no paramétricas si la distribución de las variables lo exigía. La concordancia entre los diferentes scores se midió con el índice kappa. Se midió la asociación entre HGNA y cada score mediante modelos de regresión logística univariante y, posteriormente, mediante modelos de regresión logística multivariante ajustando por edad, sexo, IMC, HTA y diabetes mellitus 2. Para el cálculo de la sensibilidad, especificidad y valores predictivos positivo y negativo de los distintos scores respecto al HGNA se utilizó esta última como gold estándar. Todas las pruebas estadísticas efectuadas se han realizado con una significación del 5% y han sido bilaterales. Se usó el paquete estadístico Stata v12 para el análisis de los datos.
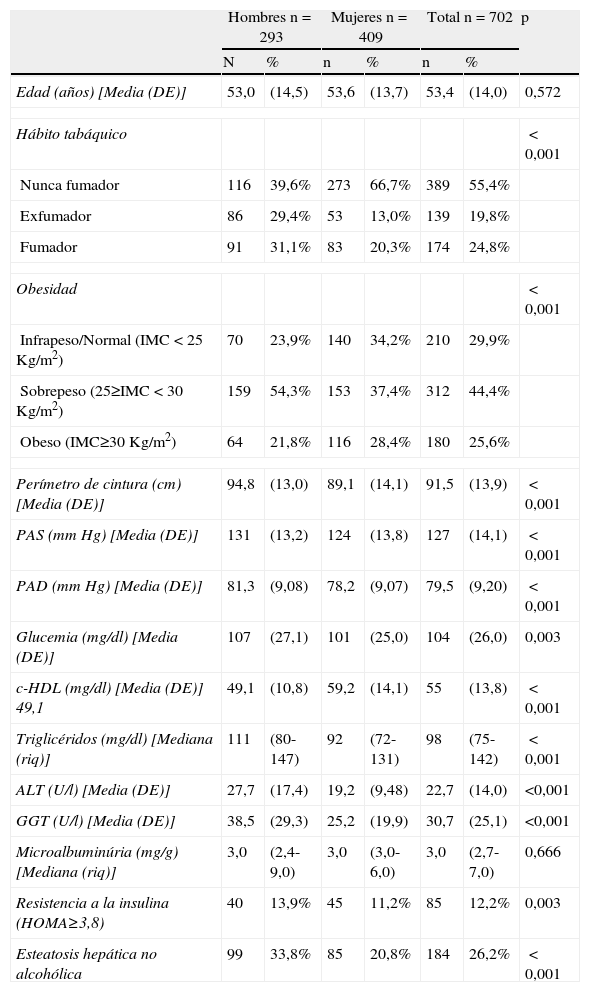
ResultadosFinalmente se incluyeron 702 individuos con toda la información disponible, 409 mujeres (58%) y 293 hombres (42%) (fig. 1). La edad media fue de 53±14 años con un rango de edad de 17 a 83 años. En la tabla 1 se describen las características basales de la muestra.
Descripción basal de la muestra
| Hombres n=293 | Mujeres n=409 | Total n=702 | p | ||||
| N | % | n | % | n | % | ||
| Edad (años) [Media (DE)] | 53,0 | (14,5) | 53,6 | (13,7) | 53,4 | (14,0) | 0,572 |
| Hábito tabáquico | <0,001 | ||||||
| Nunca fumador | 116 | 39,6% | 273 | 66,7% | 389 | 55,4% | |
| Exfumador | 86 | 29,4% | 53 | 13,0% | 139 | 19,8% | |
| Fumador | 91 | 31,1% | 83 | 20,3% | 174 | 24,8% | |
| Obesidad | <0,001 | ||||||
| Infrapeso/Normal (IMC<25 Kg/m2) | 70 | 23,9% | 140 | 34,2% | 210 | 29,9% | |
| Sobrepeso (25≥IMC<30 Kg/m2) | 159 | 54,3% | 153 | 37,4% | 312 | 44,4% | |
| Obeso (IMC≥30 Kg/m2) | 64 | 21,8% | 116 | 28,4% | 180 | 25,6% | |
| Perímetro de cintura (cm) [Media (DE)] | 94,8 | (13,0) | 89,1 | (14,1) | 91,5 | (13,9) | <0,001 |
| PAS (mmHg) [Media (DE)] | 131 | (13,2) | 124 | (13,8) | 127 | (14,1) | <0,001 |
| PAD (mmHg) [Media (DE)] | 81,3 | (9,08) | 78,2 | (9,07) | 79,5 | (9,20) | <0,001 |
| Glucemia (mg/dl) [Media (DE)] | 107 | (27,1) | 101 | (25,0) | 104 | (26,0) | 0,003 |
| c-HDL (mg/dl) [Media (DE)] 49,1 | 49,1 | (10,8) | 59,2 | (14,1) | 55 | (13,8) | <0,001 |
| Triglicéridos (mg/dl) [Mediana (riq)] | 111 | (80-147) | 92 | (72-131) | 98 | (75-142) | <0,001 |
| ALT (U/l) [Media (DE)] | 27,7 | (17,4) | 19,2 | (9,48) | 22,7 | (14,0) | <0,001 |
| GGT (U/l) [Media (DE)] | 38,5 | (29,3) | 25,2 | (19,9) | 30,7 | (25,1) | <0,001 |
| Microalbuminúria (mg/g) [Mediana (riq)] | 3,0 | (2,4-9,0) | 3,0 | (3,0-6,0) | 3,0 | (2,7-7,0) | 0,666 |
| Resistencia a la insulina (HOMA≥3,8) | 40 | 13,9% | 45 | 11,2% | 85 | 12,2% | 0,003 |
| Esteatosis hepática no alcohólica | 99 | 33,8% | 85 | 20,8% | 184 | 26,2% | <0,001 |
ALT: alanino aminotransferasa; DE: desviación estándar; GGT: gamma glutamiltransferasa; IMC:índice de masa corporal; P: p-valor de una comparación entre hombres y mujeres usando test de chi cuadrado (variables categóricas), t de Student (medias) y test de Mann-Withney (medianas);PAS:presión arterial sistólica; PAD:presión arterial diastólica; riq:rango interquartílico.
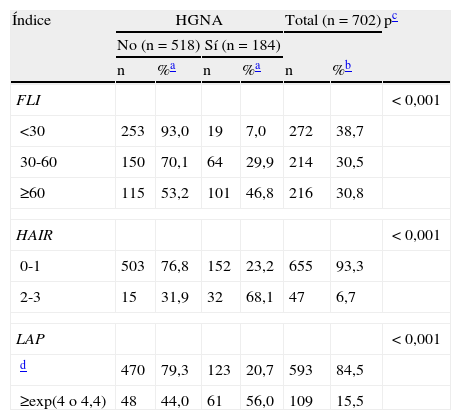
Cumplían criterios ecográficos de HGNA 184 individuos representando una prevalencia de 26,2%. Los índices FLI, HAIR y LAP fueron positivos en un 30,8%, 6,7% y 15,5% de los sujetos respectivamente. La prevalencia de HGNA entre los sujetos con índices FLI, HAIR y LAP positivos fue del 46,8%, 68,1% y 56,0% respectivamente, mucho mayor que cuando los índices eran negativos (p<0,001) (tabla 2).
Prevalencia de cada índice y relación con el hígado graso no alcohólico
| Índice | HGNA | Total (n=702) | pc | ||||
| No (n=518) | Sí (n=184) | ||||||
| n | %a | n | %a | n | %b | ||
| FLI | <0,001 | ||||||
| <30 | 253 | 93,0 | 19 | 7,0 | 272 | 38,7 | |
| 30-60 | 150 | 70,1 | 64 | 29,9 | 214 | 30,5 | |
| ≥60 | 115 | 53,2 | 101 | 46,8 | 216 | 30,8 | |
| HAIR | <0,001 | ||||||
| 0-1 | 503 | 76,8 | 152 | 23,2 | 655 | 93,3 | |
| 2-3 | 15 | 31,9 | 32 | 68,1 | 47 | 6,7 | |
| LAP | <0,001 | ||||||
| d | 470 | 79,3 | 123 | 20,7 | 593 | 84,5 | |
| ≥exp(4 o 4,4) | 48 | 44,0 | 61 | 56,0 | 109 | 15,5 | |
HGNA: hígado graso no alcohólico.
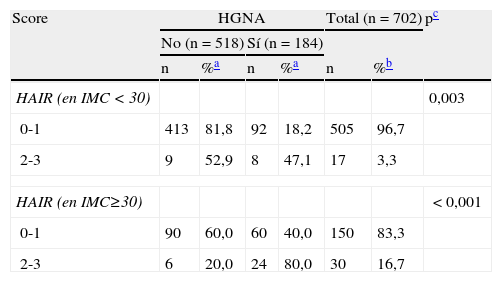
Dado que el índice HAIR es específico para personas con obesidad y en nuestra muestra hubo un porcentaje elevado de personas obesas (25,6%), se realizó un análisis específico en estos individuos. El HAIR se calculó según si el IMC era superior o inferior a 30. Se observó una relación significativa entre el índice HAIR y el HGNA en los dos grupos siendo mucho más significativa en el caso de los pacientes con un IMC≥30 (p<0,001) (tabla 3).
Prevalencia del índice HAIR y relación con el hígado graso no alcohólico según la obesidad
| Score | HGNA | Total (n=702) | pc | ||||
| No (n=518) | Sí (n=184) | ||||||
| n | %a | n | %a | n | %b | ||
| HAIR (en IMC<30) | 0,003 | ||||||
| 0-1 | 413 | 81,8 | 92 | 18,2 | 505 | 96,7 | |
| 2-3 | 9 | 52,9 | 8 | 47,1 | 17 | 3,3 | |
| HAIR (en IMC≥30) | <0,001 | ||||||
| 0-1 | 90 | 60,0 | 60 | 40,0 | 150 | 83,3 | |
| 2-3 | 6 | 20,0 | 24 | 80,0 | 30 | 16,7 | |
HAIR: hipertensión arterial, resistencia a insulina, alaninaaminotransferasa; HGNA: hígado graso no alcohólico; IMC: índice de masa corporal.
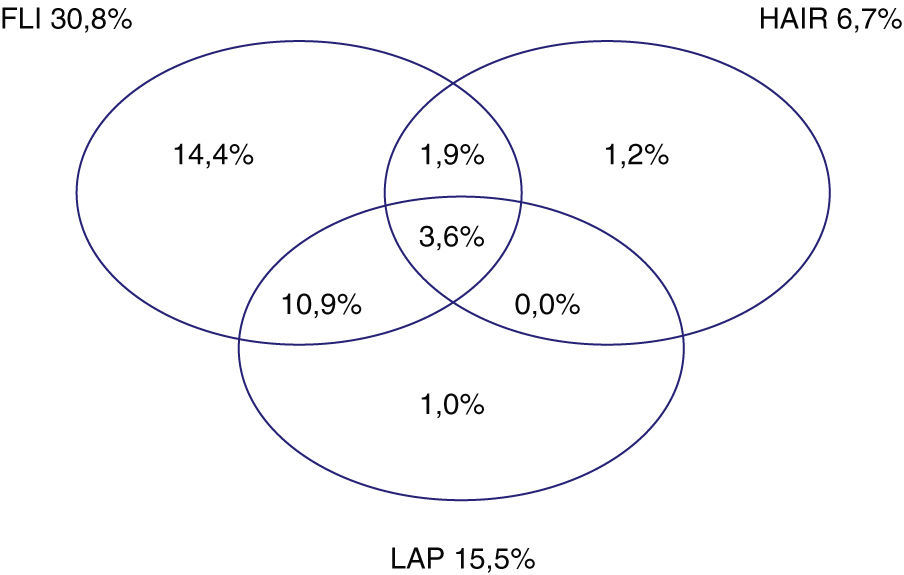
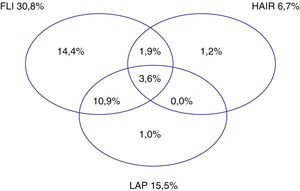
Un 33% de los sujetos presentaron al menos un índice positivo pero solo un 3,6% fueron positivos para los 3 tres índices a la vez (fig. 2), siendo el índice Kappa para los tres marcadores a la vez de 0,28. La concordancia entre los tres índices osciló entre el 63,1% (HAIR frente a FLI), 76,4% (LAP frente FLI) y el 84,9% (LAP frente a HAIR) con índices kappa entre 0,18 y 0,5.
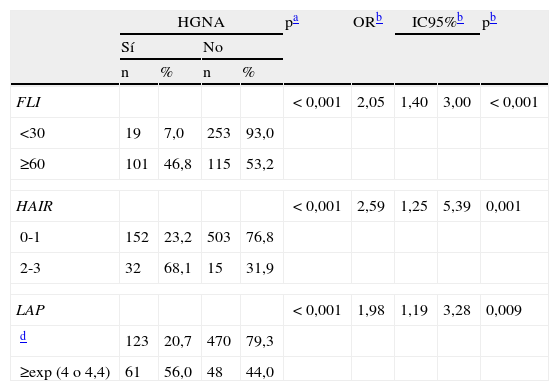
Relación entre los 3 índices con el HGNA según análisis de regresión logísticaHGNA se relacionó con la positividad de los índices usando un análisis univariante de regresión logística con el HGNA como variable dependiente con odds ratio (OR) de 2,05 (intervalo de confianza al 95% [IC95%] 1,40-3,00) para FLI, OR=1,98 (IC95% 1,19-3,28) para LAP y OR=2,59 (IC95% 1,25-5,39) para HAIR (tabla 4).
Relación entre los índices HAIR, FLI y LAP con el hígado graso no alcohólico según análisis de regresión logística univariante y multivariante
| HGNA | pa | ORb | IC95%b | pb | |||||
| Sí | No | ||||||||
| n | % | n | % | ||||||
| FLI | <0,001 | 2,05 | 1,40 | 3,00 | <0,001 | ||||
| <30 | 19 | 7,0 | 253 | 93,0 | |||||
| ≥60 | 101 | 46,8 | 115 | 53,2 | |||||
| HAIR | <0,001 | 2,59 | 1,25 | 5,39 | 0,001 | ||||
| 0-1 | 152 | 23,2 | 503 | 76,8 | |||||
| 2-3 | 32 | 68,1 | 15 | 31,9 | |||||
| LAP | <0,001 | 1,98 | 1,19 | 3,28 | 0,009 | ||||
| d | 123 | 20,7 | 470 | 79,3 | |||||
| ≥exp (4 o 4,4) | 61 | 56,0 | 48 | 44,0 | |||||
FLI: Fatty Lives Index; IC: intervalo de confianza; HAIR: hipertensión arterial, resistencia a insulina, alaninaaminotransferasa; HGNA: hígado graso no alcohólico; LAP: Lipid Accumulation Product; OR: odds ratio.
El índice con mayor sensibilidad fue el FLI con un 84%, siendo del 17% y del 33% para HAIR y LAP, respectivamente. En cuanto a la especificidad, fue mayor para el HAIR y LAP con un 97% y 91% respectivamente, siendo del 69% para FLI. Los VPP fueron del 47% (FLI), 68% (HAIR) y 56% (LAP). Los VPN fueron del 93% del (FLI), 77% (HAIR) y 79% (LAP).
DiscusiónLa elevada prevalencia de HGNA, la necesidad de diferenciar los diversos grados de afectación hepática y la limitación diagnóstica de la biopsia, hacen necesaria la búsqueda de métodos no invasivos para facilitar el diagnóstico y el seguimiento en estos pacientes. En este sentido, tienen interés los métodos no invasivos indirectos, que combinan diversos marcadores bioquímicos y parámetros clínicos, fáciles de obtener en la práctica clínica habitual. Por ello nos propusimos estudiar los índices HAIR, FLI y LAP y valorar su utilidad en el diagnóstico de HGNA.
El índice HAIR, descrito hace años por Dixon9 fue diseñado para el estudio de pacientes con HGNA, especialmente en población obesa, que pueden desarrollar una esteatohepatitis no alcohólica. De manera que unos valores>2 pueden indicar la presencia de esteatohepatitis. En nuestro estudio, la prevalencia de HGNA en pacientes con HAIR 2-3 fue del 68,1%, relacionándose ambos positivamente (OR:7,06). Como era de esperar, cuando separamos los pacientes según obesidad, aquellos con un IMC>30 y HAIR positivo tuvieron una prevalencia de HGNA muy superior, siendo del 80%, aunque también se observó una prevalencia del 47,1% de HGNA entre los pacientes HAIR positivos con IMC<30.
El índice FLI fue descrito por Bedogni10 para el diagnóstico de los pacientes con HGNA, e incluye el IMC, perímetro abdominal, triglicéridos y GGT, con unos valores que van de 0 a 100. En el presente estudio, la mitad de los pacientes con FLI>60 tuvieron HGNA, mucho más que el 7% obtenido en los que tenían FLI<30 (OR:3,42), con una sensibilidad del 84%, una especificidad del 69% y un valor predictivo negativo del 93%, mostrándose como un buen índice para el diagnóstico de HGNA. Estos resultados son comparables a los de Bedogni donde encontraron una sensibilidad del 87% y una especificidad del 64%. Recientemente se han publicado los resultados de un estudio poblacional europeo sobre la capacidad del FLI para el diagnóstico de HGNA en una población de 2.652 sujetos mayores, encontrando que el FLI demostró una excelente fiabilidad para identificar pacientes con HGNA, confirmada mediante ecografía13.
El LAP, descrito inicialmente por Kahn14 como un índice de riesgo cardiovascular y posteriormente por el grupo de Bedogni15 como marcador para diagnosticar el HGNA, incluye el perímetro abdominal y la determinación de los triglicéridos y comparten estos dos parámetros con el índice FLI. El estudio llevado a cabo por Kahn en el 2005 demostró que este índice era superior al IMC en detectar algunos factores de riesgo cardiovascular y la diabetes. En este sentido, en un estudio poblacional que incluyó 5.924 pacientes seguidos durante 11 años, también se observó que el índice LAP fue mejor predictor de enfermedad cardiovascular, así como la mortalidad asociada a las mismas, en comparación con el IMC16. En nuestro estudio el LAP fue un índice útil para el diagnóstico del HGNA, con una prevalencia de HGNA del 56% entre los LAP positivos (OR:4,86). Tanto LAP como FLI son dos índices fáciles de determinar y útiles para el diagnóstico de HGNA, sin embargo, el LAP a diferencia del FLI tiene una mayor especificidad, con un valor predictivo negativo moderadamente alto, comportándose como un buen índice, si bien, no tan importante como en el caso del FLI.
Se analizó el grado de concordancia entre los diferentes marcadores. Como era esperable FLI y LAP coincidieron más, probablemente por compartir algunas variables en sus fórmulas, aunque todos los índices kappa obtenidos fueron≤0,50. La falta de concordancia entre los diferentes índices provoca la obtención de diferentes prevalencias según el método utilizado. En este caso, también es necesario en un futuro, unificar criterios para obtener un índice útil para el diagnóstico de HGNA en un sector amplio de la población.
El HGNA es una enfermedad muy prevalente, y habitualmente el diagnóstico se basa en la presencia de grasa al practicar una ecografía abdominal. Sin embargo, la ecografía no refleja la gravedad de la enfermedad siendo necesario seguir la evolución de estos pacientes. En un reciente estudio sobre pacientes diagnosticados de HGNA mediante biopsia, un 23% de estos evolucionaron a esteatohepatitis en un seguimiento de 3 años17. Además, el HGNA se asocia a enfermedad cardiovascular18–20 y predice la presencia de diabetes21,22. Por lo tanto, no es sorprendente que en los pacientes con HGNA se ha incrementado la mortalidad y la morbilidad en comparación con la población general23. En este sentido, es interesante el papel del FLI como marcador independiente de enfermedad cardiovascular en pacientes con HGNA sin factores de riesgo cardiovascular, según los resultados de dos recientes estudios de la misma cohorte, en donde un valor de FLI>60 se asocia a un incremento del riesgo cardiovascular según la tabla de Framingham, resistencia a la insulina y arteriosclerosis24,25. Además, el FLI también ha mostrado ser un predictor independiente de incidencia de diabetes en pacientes con HGNA26,27. Por último, en una cohorte de población italiana, después de 15 años de seguimiento, FLI se asoció con un aumento de la mortalidad en relación con el HGNA, independientemente de la presencia de otros factores de riesgo cardiovascular28.
La principal limitación del estudio fue la utilización de la ecografía hepática para el diagnóstico de HGNA ya que el gold estándar es la biopsia. Sin embargo, los estudios que comparan la utilidad diagnóstica de la ecografía frente a la biopsia muestran una sensibilidad del 90% y una especificidad del 80% para la ecografía. Otra limitación de la ecografía es la falta de relación de los cambios histológicos asociados con la progresión de la enfermedad. Sin embargo, la ecografía es actualmente la prueba de referencia para la detección de hígado graso a nivel poblacional29.
Podemos concluir que los marcadores FLI, HAIR y LAP son muy prevalentes y se han mostrado como marcadores independientes para el diagnostico de HGNA. Es conveniente encontrar algún índice fácil de determinar, como ocurre en el FLI o el LAP que utilice determinaciones tanto clínicas como analíticas fáciles de obtener en la práctica clínica, como método no invasivo de diagnóstico que ayude a los profesionales a tomar decisiones en estos pacientes, en el sentido de solicitar ecografía abdominal para confirmar el diagnóstico, recomendar cambios de estilo de vida (régimen dietético, actividad física), o bien para derivar a la medicina especializada.
FinanciaciónEste trabajo es un subestudio del proyecto financiado por el Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III, Fondo de Investigación Sanitaria (PI070635).
Conflicto de interesesLos autores declaran no tener conflicto de intereses.