La toxina botulínica tipo A (BoNT-A) es una herramienta terapéutica ampliamente aceptada para la espasticidad y distonía, con buen nivel de evidencia respecto a efectividad y seguridad en su uso. En el último tiempo se ha ampliado notablemente el espectro de indicaciones a diversas patologías con resultados bastante prometedores. Destacan los beneficios del efecto relajante muscular y anti nociceptivo de la BoNT-A en el tratamiento del dolor musculoesquelético, síndromes miofasciales, síndrome del piriforme, bruxismo y espasmo muscular posterior a cirugías ortopédicas. El efecto facilitador de la terapia física, es útil en el tratamiento de la tortícolis muscular congénita refractarias a métodos conservadores y en cirugías para alargamientos óseos, permitiendo el aumento simultaneo y gradual del largo de partes blandas. El bloqueo de fibras colinérgicas parasimpáticas ha sido aplicado en procesos patológicos relacionados con función glandular, resultando útil en el tratamiento de la hiperhidrosis y sialorrea. Por último, destaca su efecto en cuanto a mejorar la sincronización de la actividad muscular, con repercusiones importantes en la reeducación motriz para el tratamiento de la parálisis braquial obstétrica, algunas deformidades articulares en niños con mielomeningocele e inhibición del patrón anormal en niños portadores de marcha idiopática en punta de pies.
Botulinum toxin type A (BoNT-A) is a widely accepted therapeutic tool for spasticity and dystonia, with a good evidence level of effectiveness and safety in use. Last time, indications spectrum has been extended to various pathologies with promising results. Highlight benefits of BoNT-A muscle relaxing and antinociceptive effect in musculoskeletal pain, myofascial syndrome, pyriform syndrome, bruxism and muscle spasm post orthopedic surgery. The facilitatory effect of physical therapy is useful in refractory congenital torticollis and bony surgeries for lengthening, allowing the simultaneous and gradual increase of soft parts. Parasympathetic cholinergic fibers blocking has been applied in pathological processes related to glandular function, providing useful in hyperhidrosis and drooling treatment. Finally, highlights its effect on improving muscular activity synchronization with important implications for motor reeducation in obstetric brachial palsy, joint deformities in myelomeningocele and abnormal pattern inhibition in idiopatic toe walking patients.
La bacteria Clostridium botulinum produce 7 serotipos de toxina, que se denominan de la A a la G. Estos polipéptidos actúan en los terminales presinápticos de las fibras nerviosas colinérgicas bloqueando la liberación de su neurotransmisor, la acetil colina. La toxina tipo A, actúa través de la inhibición de la molécula SNAP-25(proteína asociada al sinaptosoma) y la toxina tipo B inhibiendo la VAMP (proteína asociada a la Sinaptobrevina) produciendo mediante este efecto, una quimio-denervación, dosis dependiente y reversible de la fibra nerviosa. Los serotipos actualmente disponibles para su uso terapéutico son la Neuro Toxina Botulínica A (BoNT-A) y la Neuro Toxina Botulínica B (BoNT-B). La BoNT-A es la más potente y de mayor duración de los 7 serotipos, siendo, desde 1970, la más utilizada con fines terapéuticos, con la mayor evidencia en su efectividad y seguridad. A nivel de la placa motora, la toxina botulínica inhibe parcialmente la contracción muscular y a nivel glandular, la secreción de las glándulas ecrinas.
En el ámbito de la Medicina Física y Rehabilitación (MFR), su uso más frecuente en pediatría, desde hace más de una década, es en el tratamiento de la Espasticidad y la Distonía en Parálisis Cerebral (PC), pero en los últimos años se ha ido ampliando su espectro de uso a muchas otras patologías, con buenos resultados (1).
La BoNT-A comienza a hacer su efecto generalmente entre las 48 a 72 horas después de la inyección y alcanza su máxima efectividad alrededor de las 2 a 3 semanas, persistiendo por 3 a 4 meses, período que tarda la reinervación, producto del crecimiento de nuevos axones terminales (1), sin embargo, en muchos casos, el efecto ganado persiste por períodos más prolongados.
En los últimos años, esta neuro-toxina se está utilizando también en el tratamiento del dolor, cuyo mecanismo de acción sería independiente del efecto relajante muscular, postulándose la inhibición de neurotransmisores excitatorios asociados con el dolor crónico, incluyendo a la Sustancia P (SP), el Gen Relacionado con la Calcitonina (CGRP), la Proteína Cinaza C, Bradicinina y Glutamato. (1, 2).
El bloqueo local y selectivo producido por la BoNT-A, permite una acción focalizada y graduada, de acuerdo a las necesidades y objetivos terapéuticos de cada paciente. Al igual que cualquier intervención en Rehabilitación, los objetivos terapéuticos deben plantearse considerando las estructuras y funciones corporales comprometidas en la persona y también las restricciones en su actividad y participación social, tal como lo establecen los criterios de la Clasificación Internacional de Funcionamiento, Discapacidad y Salud (CIF) de la OMS (3).
Seguridad: Es un fármaco seguro (4-6), incluso en menores de dos años de edad (7, 8). La mayoría de las reacciones adversas descritas son leves, transitorias, de baja frecuencia y controlables mediante una adecuada prescripción y técnica de administración. Las reacciones adversas más frecuentes son debilidad muscular transitoria y dolor en los sitios de punción. Se han reportado también, malestar general y mialgias (“flu-like syndrome”), eritema, ptosis palpebral, vómitos, sequedad bucal, disnea, estridor, disfagia, disartria, compromiso respiratorio severo, pudiendo ser fatal. De acuerdo a la literatura, las reacciones adversas severas, relacionadas con el compromiso respiratorio, se han descrito en pacientes con compromiso neurológico grave y con dosis altas (4,7,9). Estas reacciones pueden ocurrir los primeros días o varias semanas después, lo que obliga a un adecuado seguimiento y dar información clara y completa al paciente y familia, de manera de estar alerta ante eventuales complicaciones. Las recomendaciones de la FDA se enumeran en la Tabla 1.
Vigilancia de efectos adversos bont-a: recomendaciones de FDA
| Estar alerta a potenciales efectos sistémicos como disfagia, disfonía, debilidad, disnea o distress respiratorio. |
| Tener claro que estos efectos han ocurrido desde 1 día hasta semanas post tratamiento. |
| Entregar a los pacientes y cuidadores la información necesaria para identificar los síntomas y signos de los efectos adversos sistémicos después de la administración de toxina botulínica. |
| Informa a los pacientes y cuidadores, que el paciente debe recibir atención médica inmediata si se deteriora o presenta inesperada dificultad para tragar o hablar, problemas respiratorios, o debilidad muscular. |
La toxina botulínica tiene interacción farmacológica con los aminoglucósidos y las quinolonas. Su uso concomitante aumentaría el efecto de relajación muscular, por lo que se debe evitar su administración conjunta.
Existen varias presentaciones comerciales de BoNT-A y una de BoNT-B. Cada uno de los productos tiene formulación y procesos de fabricación propios, lo que da por resultado diferentes potencias y perfiles de efectos secundarios, por lo que sus unidades y por ende sus dosis, no son homologables ni intercambiables. Las presentaciones aprobadas por la FDA se detallan en la Tabla 2.
La presentación más frecuentemente usada en Chile es la Onabotulinum Toxina A (Botox®) del laboratorio Allergan. Los criterios para el cálculo de las dosis se detallan en Tabla 3.
Criterios para el cálculo de dosis de BONT-A, IM(6)
| Total de Unidades (U) por sesión de tratamiento |
| Total de U por Kg de peso corporal por sesión |
| U por músculo |
| U por sitio de inyección |
| U por Kg de peso, por músculo |
| Severidad del compromiso |
| Antecedentes de disfagia, aspiración, problemas respiratorios |
| Tipo de hipertonía predominante (Espasticidad / Distonía) |
| Actividad del músculo |
| Tamaño del músculo |
| Presencia o no de fibrosis muscular |
| Distribución de las placas motoras |
| Respuestas previas al procedimiento |
Es muy importante respetar la cadena de frío y asegurar la adecuada preparación del medicamento, en un ambiente aséptico y comprobando siempre que el fármaco esté al vacío, lo que asegura su esterilidad.
La reconstitución del fármaco debe ser con solución fisiológica al 0,9%. En la infiltración intramuscular, se sugieren diluciones que van de 1 a 3ml, con un máximo de 5ml de solución fisiológica, por 100 U de Botox®, dependiendo del tamaño del músculo. Es importante considerar que a mayor dilución podría haber mayor difusión. En nuestra experiencia, lo habitual es utilizar la dilución en 1ml, pues da mayor seguridad y los efectos que hemos observado no difieren de cuando hemos utilizado diluciones de hasta 3ml.
En el procedimiento de infiltración intramuscular, es fundamental la localización precisa de la musculatura que se desea infiltrar. La guía con electromiografía en el paciente despierto, o la estimulación eléctrica en el paciente anestesiado, son los métodos más frecuentemente usados. En algunos casos es aconsejable el uso de la ecografía en músculos más profundos, especialmente cuando el paciente presenta sobrepeso. La infiltración de glándulas salivales se debe realizar bajo ecografía.
En nuestra experiencia, cuando es necesario realizar infiltración intramuscular en numerosos músculos (multinivel), músculos de cara y cuello o glándulas salivales, es conveniente realizar el procedimiento bajo anestesia general, sin relajante muscular, porque permite mayor precisión en la técnica, evita el dolor y la angustia del niño, más aun considerando que es un tratamiento periódico.
Usos más frecuentes de toxina botulínica-a en rehabilitaciónEspasticidad en parálisis cerebralLa espasticidad es un trastorno motor determinado por la lesión del sistema piramidal, caracterizada por un aumento exagerado del tono muscular frente al estiramiento. Lance en 1980, la define como “un trastorno motor caracterizado por un aumento del reflejo tónico de estiramiento, velocidad dependiente, acompañado de hiperreflexia debida a la hiperexcitabilidad del reflejo miotático”. Forma parte del Síndrome de motoneurona superior y se acompaña de hiperreflexia, clonus, espasmos musculares de mayor o menor envergadura, dependiendo del sitio de la lesión neurológica; además debilidad muscular y trastorno del control motor selectivo.
Es un fenómeno dinámico, que varía en reposo y movimiento y que clínicamente se percibe como una resistencia al movimiento, inicialmente alta, para ir posteriormente disminuyendo. Su intensidad es proporcional a la velocidad de estiramiento. Varía con la postura del paciente, la temperatura, el estrés, los estímulos cutáneos, co-morbilidades, entre otros.
La espasticidad frena el movimiento generando un mayor gasto energético, inhibe el control motor voluntario, inhibe la capacidad del músculo de elongarse durante la actividad limitando su crecimiento, induce torques anormales sobre el esqueleto en crecimiento determinando la aparición de torsiones óseas; genera contracturas articulares y posiciones viciosas, interfiere en la sensibilidad táctil, estereognosia y propiocepción y en un porcentaje variable de casos es fuente de dolor.
En pediatría, la PC es la causa más común de espasticidad, la cual, junto al trastorno del control motor, va a interferir en el proceso de aprendizaje y adquisición de los hitos motores básicos del desarrollo psicomotor y en la adecuada incorporación de los engramas motores del niño y en consecuencia, limitará sus posibilidades de explorar, aprender y relacionarse, con un menor desarrollo afectivo, cognitivo-social y funcional. Junto a lo anterior, al impedir el adecuado crecimiento músculo esquelético del niño, determinará la aparición de alteraciones secundarias tales como acortamientos musculares, retracciones articulares y torsiones óseas, con un deterioro progresivo de la postura y función que puede resultar devastador, por lo que su tratamiento es un imperativo.
Dentro de los tratamientos para la espasticidad, el uso de BoNT-A en PC está ampliamente difundido, con altos niveles de evidencia en la mejoría de las estructuras y funciones corporales y de la actividad. (1,5,6).
El objetivo general, es reducir la espasticidad, para optimizar los efectos de las terapias utilizadas para mejorar la postura y movimiento, el crecimiento muscular, la función y aliviar el dolor (1,5,6). Los objetivos específcos del tratamiento en el niño espástico con BoNT-A se resumen en la Tabla 4.
Objetivos específicos del tratamiento de la espasticidad
| Mejorar el crecimiento y el balance muscular entre agonistas y antagonistas | Retardar la aparición de contracturas articulares y torsiones óseas |
| Mejorar el Control Motor Selectivo | Mejorar la estabilidad y el patrón de marcha |
| Mejorar la fuerza muscular y la movilidad | Mejorar la función de extremidades superiores |
| Retrasar y reducir las cirugías ortopédicas | Mantener las correcciones conseguidas con la cirugía |
| Evitar el dolor y espasmos musculares | Mejorar la postura y el confort |
| Facilitar el uso de órtesis y mobiliario | Facilitar el cuidado, higiene y prevenir lesiones de la piel |
| Mejorar la Independencia y Autonomía | Lograr mayor participación social |
Este tratamiento requiere de una evaluación estandarizada, para definir el protocolo de infiltración y los objetivos terapéuticos, los cuales deben ser consensuados con el paciente, su familia y el equipo tratante. Este aspecto es crucial para el éxito del tratamiento.
La evaluación debe considerar el nivel de severidad del compromiso motor del paciente, la identificación de los grupos musculares responsables de la limitación y/o deterioro funcional (músculos clave), y su impacto a nivel de las dimensiones establecidas por la CIF (3). Dado que la espasticidad es un fenómeno dinámico, que cambia en reposo y en movimiento, su análisis se debe realizar en ambas condiciones. Los instrumentos de evaluación más relevantes se detallan en la Tabla 5.
Instrumentos de evaluación funcional en las dimensiones estructuras y funciones corporales, actividad y participación, utilizados en espasticidad
| Valoración | Instrumentos |
|---|---|
| Espasticidad | Asworth, Tardieu |
| Espasmos musculares | Penn |
| Control motor selectivo | Escala 0 a 2 |
| Fuerza muscular | MRC |
| Rango articular | Goniometría |
| Dolor | EVA |
| Marcha y Movimiento | Análisis Instrumentado de marcha y movimiento; QUEST;GMFM; FMS |
| Actividad | MACS, SHUEE, BMFM, GMFCS; FAQ |
| Independencia Funcional | WeeFIM; PEDI |
| Participación Integración | COPM, GAS |
| Calidad de vida | CHQ, PedsQL. CPQoL-Child |
Escala de Ashworth modifcada; Escala de Tardieu modifcada; Escala de espasmos musculares de Penn; Escala de graduación del control motor selectivo; MRC: Muscle Research Council; EVA:Escala de Evaluación Análoga; QUEST:Quality of Upper Extremity Skills Test; GMFM: Gross Motor Function Measure; FMS:Functional Mobility Scale; MACS:Manual Ability Classification System; SHUEE;Shriners Hospital Upper Extremity Evaluation Scale, BMFM:Bimanual Fine Motor Function; FAQ:Functional Assesment Questionnaire; WeeFIM:Functional Independence Measure, for children; PEDI: Paediatric Evaluation of Disability Inventory; COPM:Canadian Occupational Performance Measure; GAS:Goal Attainment Scale; CHQ:Child Health Questionnaire. PedsQL; Pediatric Quality of Life Inventory; CPQoL-Child: Cerebral Palsy Quality of Life Questionnaire for Children
Dentro de los instrumentos de evaluación para la indicación de BoNT-A, destacamos el Sistema de Clasificación de la Función Motora Gruesa (GMFCS); el Sistema de Clasificación de las Habilidades Manuales (MACS), la Escala de Evaluación de la Extremidad Superior en el paciente Hemipléjico, del Hospital Shriners (SHUEE) y el Análisis Instrumentado de la Marcha y Movimiento.
El GMFCS clasifica al paciente con PC en 5 niveles, de acuerdo a su capacidad de sedestación, transferencias y desplazamiento y establece su curva de evolución entre los 0 y 18 años de edad, lo cual permite anticiparse en su pronóstico y detectar en el niño, deterioros mayores de lo esperado para su nivel de compromiso. En base a él, es posible establecer las estrategias terapéuticas más efectivas, dentro de las cuales está el tratamiento de la espasticidad y comparar sus resultados con las experiencias internacionales, tal como lo establece el Consenso de Expertos Europeos 2009 (6). En este consenso, la BoNT-A, forma parte del tratamiento en todos los niveles funcionales de esta clasificación, con diferentes intensidades, durante los primeros 12 años de vida.
El MACS evalúa la capacidad manual para manejar objetos en la vida cotidiana y su desarrollo en el tiempo, entre los 4 y 18 años de edad. Mejora la comunicación entre los padres y el médico y al igual que la GMFCS, apoya la toma de decisiones respecto al tratamiento con BoNT-A y permite comparar los resultados con las experiencias internacionales (5).
El SHUEE es una prueba estandarizada y filmada, que analiza el movimiento del codo, antebrazo, muñeca, pulgar y dedos en niños mayores de 3 años, para la indicación de infiltración con BoNT-A y de cirugía ortopédica en el paciente Hemipléjico.
El Análisis Instrumentado de la Marcha y Movimiento, permite evaluar cómo actúa la espasticidad durante el movimiento y los cambios producidos en el largo muscular, rango de movimiento articular y eficiencia conseguidas con el tratamiento con BoNT-A (10).
De acuerdo a los criterios establecidos por la Academia Americana de Neurología (AAN), este tratamiento tiene recomendación Nivel A en extremidades inferiores y nivel B en extremidades superiores (1) en la PC espástica. En las extremidades superiores, los beneficios serían mayores en los niños pequeños y la frecuencia de infiltración recomendada no debería ir más allá de los 3 a 4 meses, con el fin de ir sumando los beneficios logrados (11).
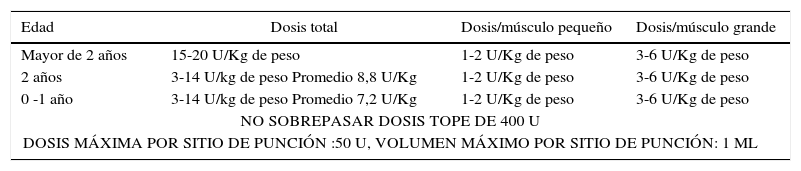
Los músculos más frecuentemente infiltrados son los biarticulares y antigravitatorios, que generalmente son los más afectados por la espasticidad y/o distonía y son los responsables de las deformaciones articulares y las torsiones óseas patológicas. Las dosis recomendadas se detallan en la Tabla 6.
Dosis recomendadas de onabotulinum-a (botox®) en espasticidad
| Edad | Dosis total | Dosis/músculo pequeño | Dosis/músculo grande |
|---|---|---|---|
| Mayor de 2 años | 15-20 U/Kg de peso | 1-2 U/Kg de peso | 3-6 U/Kg de peso |
| 2 años | 3-14 U/kg de peso Promedio 8,8 U/Kg | 1-2 U/Kg de peso | 3-6 U/Kg de peso |
| 0 -1 año | 3-14 U/kg de peso Promedio 7,2 U/Kg | 1-2 U/Kg de peso | 3-6 U/Kg de peso |
| NO SOBREPASAR DOSIS TOPE DE 400 U | |||
| DOSIS MÁXIMA POR SITIO DE PUNCIÓN :50 U, VOLUMEN MÁXIMO POR SITIO DE PUNCIÓN: 1 ML | |||
Uno de los inconvenientes señalados para la instauración masiva de este tratamiento, es el costo, sin embargo los estudios sobre los beneficios que produce respecto a la calidad de vida, planteada como los años de vida saludable ganados, al disminuir las complicaciones derivadas del trastorno muscular, disminuir la frecuencia de recambio de órtesis, disminuir las necesidades de atención por co-morbilidades y reducir en forma significativa el número de cirugías y días de hospitalización que requieren estos pacientes, lo posicionan costo-beneficio recomendable (12,13).
Ddistonía en parálisis cerebralLa Distonía es un trastorno del movimiento secundario a una alteración de la función de los ganglios basales. Puede ser primaria (determinada genéticamente), o secundaria a una injuria cerebral, como es el caso de la PC. Puede ser focal, segmentaria o generalizada. Se define como la contracción muscular sostenida o intermitente, que ocasiona frecuentes torsiones, movimientos y posturas anormales repetitivas. Se caracteriza por:
- a)
Resistencia al movimiento a muy baja velocidad, sin umbral de velocidad o de ángulo de movimiento.
- b)
Co-contracción de agonistas y antagonistas, observada como rápida resistencia a los movimientos rápidos de la extremidad, en dirección opuesta.
- c)
La extremidad vuelve hacia una postura involuntaria fija.
- d)
Es empeorada por el intento o esfuerzo de movimiento voluntario.
- e)
La amplitud de la actividad voluntaria varía con la excitación o intención de realizar la tarea (1).
El tratamiento de la Distonía en PC se basa en los mismos principios generales referidos para la espasticidad, considerando niveles de funcionamiento, actividad y participación. Persigue relajar la musculatura afectada, para posibilitar una postura más fisiológica y mejor control del movimiento.
La Distonía es generalmente más rebelde al tratamiento, siendo necesaria la administración más frecuente del fármaco y en mayores dosis. Al igual que en la Espasticidad, la mayor evidencia en pediatría con BoNT-A, es en el tratamiento de la Distonía en PC especialmente a nivel de extremidades superiores. De acuerdo a los AAN, tiene una recomendación nivel B en extremidades superiores (1)
Es muy importante precisar los músculos claves que desencadenan los movimientos distónicos y que interfieren en forma significativa en la postura y en el movimiento, ya que de esto dependerán los buenos resultados obtenidos. La elección inadecuada de los músculos puede determinar resultados insatisfactorios o desarrollo de un nuevo patrón alterado, con características diferentes al inicial. El fenómeno de co-contraccion de agonistas y antagonistas hace muchas veces necesario la infiltración de ambos grupos, en dosis diferentes, de acuerdo a la magnitud clínica del compromiso. En los pacientes con compromiso severo, el objetivo principal es el control de la postura del cuello, del tronco y del dolor, especialmente lumbar y de caderas.
Una de las escalas de evaluación que se utiliza, es la escala de Distonía publicada por Barry-Albright (BAD) (14). Establece el grado de severidad y limitación en la función de cada una de las regiones corporales que evalúa. Es válida y confiable para su evaluación y seguimiento. La Escala de Compromiso Funcional en niños con Movimientos Involuntarios (ECFMI), de Rodríguez y Gajardo (15) evalúa el rendimiento funcional del niño en los dominios sedente, actividades de la vida diaria básica (AVD) y la función manual. Estas escalas permiten evaluar el trastorno del movimiento en los distintos segmentos corporales y la capacidad funcional básica, pre y post infiltración y diseñar las estrategias terapéuticas de acuerdo a las características del niño.
Es importante destacar que el tratamiento con toxina botulínica debe ir siempre asociado a un programa de rehabilitación del niño o adolescente espástico/distónico y ser realizado en forma periódica, con el fin de apoyar el proceso de crecimiento y desarrollo y posibilitar el máximo desempeño funcional posible. Existe evidencia sólida que las terapias funcionales solas, no logran los resultados que se obtienen al asociar BoNT-A y asimismo, que la terapia con BoNT-A aislada tampoco es efectiva. (5,6,11,16,17).
A diferencia de otros medicamentos que se deben administrar a diario, éste requiere administrarse cada 4, 6 u 8 meses, de acuerdo a las características del paciente.
Marcha idiopática en punta de piesLa marcha idiopática en punta de pies, conocida como Idiopatic Toe Walking (ITW), es un trastorno de la marcha, caracterizado por caminar en la punta de los pies más allá de los tres años de edad, sin una causa aparente. Fue descrito por primera vez en 1967, por Hall quien lo definió como un acortamiento congénito del tendón de Aquiles. Su fisiopatología es desconocida y se han postulado algunas posibles etiologías, (18) no obstante ninguna de éstas ha sido demostrada. Se han descrito factores hereditarios basados en una incidencia familiar aumentada de entre 10 a 88% (19).
Su incidencia se estima entre un 7% - 24% de la población pediátrica, siendo igual para hombres y mujeres (20).
Se caracteriza por marcha en la punta de los pies desde que comienzan a caminar, sin antecedentes mórbidos pre ni post natales, desarrollo psicomotor normal, ausencia de signos de compromiso neurológico, psiquiátrico, muscular y esquelético. Corresponde a un diagnóstico de exclusión.
Estos niños no tienen limitaciones motoras durante la infancia y logran corregir este patrón y caminar en forma aparentemente normal cuando se les solicita, aunque rápidamente vuelven a retomar la marcha en punta de pies.
En la gran mayoría de los casos, se observa una leve disminución del rango de flexión dorsal de los tobillos, no obstante no existe claridad de si correspondería a la causa del trastorno de marcha o sería más bien una consecuencia. Lo anterior se basa en reportes que muestran persistencia del patrón en punta de pies en pacientes que han sido sometidos a alargamientos quirúrgicos (19,21,22) o estudios como el de Engstrom y cols que (23) muestran que las mejorías en el patrón de marcha obtenidas posterior a infiltración de gastrosóleo con BoNT-A, no se relacionan claramente con el aumento de rango de dorsiflexión del tobillo, ya que este parámetro no se modificó en ninguno de los pacientes tratados en este último estudio.
Si bien la evolución se describe como favorable en la mayoría de los estudios, este patrón de marcha perdura a través de toda la niñez, produciendo sobrecarga del antepié, con riesgo de desarrollar problemas osteoarticulares, musculotendinosos y alteraciones posturales, en un niño en crecimiento y desarrollo. Los problemas más frecuentemente descritos son presencia de equino estructurado, pie equino plano valgo, hallux valgus, fascitis plantar, metatarsalgia, tendinitis del tibial posterior, neuroma de Morton (23). Se ha descrito también la asociación con torsión tibial externa por el apoyo y progresión en valgo de los pies (24) y genu recurvatum por sobre elongación de la cápsula articular, cuando los gastrocnemios se han acortado. El desarrollo de estas complicaciones fundamenta su tratamiento.
El Análisis Instrumentado de la marcha, permite establecer las características kinemáticas (KNM), kinéticas (KN) y electromiográficas (EMG) de este cuadro y diferenciarlo de otras patologías que también se asocian con marcha en punta de pies, como es la PC tipo diplejía espástica y algunas enfermedades neuromusculares. Además permite definir con mayor precisión el tratamiento y evaluar su efectividad a través del tiempo (25). Los tratamientos clásicamente descritos consideran la kinesiterapia en base a masoterapia y ejercicios de elongación y fortalecimiento; terapias en área de integración sensorial; órtesis nocturnas y cirugía. La cirugía se recomienda en los casos en que se ha establecido un acortamiento estructurado del Tendón de Aquiles y que no han respondido al tratamiento conservador. Los resultados de los tratamientos descritos en la literatura son variables y si bien en muchos casos se logran atenuar las alteraciones, la corrección completa se logra sólo en un número acotado de casos. En los últimos años se ha introducido la infiltración con BoNT-A a nivel de gastrocnemios y sóleo, asociada a ejercicios y yesos seriados, con resultados promisorios que permitirían eventualmente evitar la cirugía. El fundamento para este tratamiento, se basa en la detección de actividad muscular fuera de fase de los gastrocnemios, durante las fases de apoyo y balanceo final en el registro de EMG dinámica. La BoNT-A permitiría cambiar el patrón de activación anormal, logrando una mejor sincronización de la actividad muscular, con corrección de las alteraciones de la marcha, de acuerdo a lo demostrado por Engstrom y cols. y Brunt y cols. (23,26). Estas mejorías persistirían al menos durante un año, y en algunos casos hasta 5 años (23).
En el 2007, Alvarez y cols (27) publicaron la Clasificación de Severidad del ITW basada en las alteraciones en la KNM y KN de la marcha de estos niños, clasificándolos en 3 tipos, siendo el tipo 1 leve, el tipo 2 moderado y el tipo 3 severo, sugiriendo un protocolo terapéutico en el cual, el tipo 3 tendría como primera indicación, la infiltración intramuscular con BoNT-A, seguida de yesos seriados, kinesiterapia y órtesis nocturnas y, en los casos que no respondieran, cirugía.
La dosis de BoNT-A descrita es de 6 U/Kg de peso distribuidas en ambos gastrocnemios o en el complejo gastrocnemio-sóleo, con un máximo de 400 U (23,26).
Tortícolis congénitaEl término tortícolis proviene del latín y significa “cuello torcido”. Corresponde a un término genérico y no a un diagnóstico por sí mismo. La forma más común corresponde a la tortícolis muscular congénita (TMC), caracterizada por acortamiento unilateral del músculo esternocleidomastoideo (ECM). Existen otras causas de alteración postural del cuello de tipo congénito o adquirido que pueden poner incluso en riesgo la vida del niño, entre ellas infecciosas, neurológicas, neoplásicas, ortopédicas, musculares, déficits visuales y auditivos. Se debe distinguir también, de la tortícolis postural, determinada por plagiocefalia o lesiones del plexo braquial que no presentan acortamiento ni alteraciones estructurales del ECM.
Es indispensable un buen diagnóstico para definir las intervenciones apropiadas. Está contraindicado realizar ejercicios de elongación o cualquier manipulación cervical sin haber descartado inestabilidad de columna u otro tipo de lesiones para evitar daño adicional de estructuras cervicales y/o neurales.
La TMC se manifiesta por inclinación mantenida de la cabeza hacia un lado y giro contralateral, manteniendo la barbilla hacia el hombro contrario al de la inclinación. Es evidenciable al nacer o a los pocos meses de vida. Se asocia a restricción de la movilidad activa y pasiva del cuello. En ocasiones puede ser palpable una masa fibrosa en el vientre muscular del ECM denominada fibromatosis colli. Su incidencia es entre 1 a 2% y si bien se han planteado posibles hipótesis sobre su etiología, ésta continúa siendo desconocida. Su curso es benigno, pero si no es tratada puede derivar en deformidad craneal tipo plagiocefalia, asimetría facial, acortamiento de musculatura cervical y escoliosis secundaria. El diagnóstico de la TMC se basa en la historia clínica y examen físico cuidadoso para determinar acortamiento muscular y limitación en rango de movilidad articular del cuello, examen neurológico completo y evaluación clínica de las funciones visual y auditiva, para descartar causas no musculares. La ecotomografía es una herramienta útil para evaluar el compromiso muscular del ECM, la presencia de fibromatosis colli y descartar masas tumorales a nivel de partes blandas del cuello, mientras que la radiografía de columna cervical es útil para descartar malformaciones vertebrales.
La mayor parte de los casos se resuelve con medidas conservadoras, tales como manejo postural, kinesiterapia, uso de órtesis cervicales o collarines. En aquellos casos resistentes a las medidas conservadoras, la BoNT-A tendría un rol terapéutico.
La BoNT-A intramuscular se utiliza habitualmente a nivel de ECM y porción superior del trapecio, sobre los 6 meses de edad. El efecto se basa en la relajación muscular local de la musculatura afectada, haciendo más fácil y efectiva su elongación; además de facilitar la activación y fortalecimiento de la musculatura contralateral. De este modo, es posible optimizar el efecto de la fisioterapia y en algunos casos evitar la cirugía. Al respecto existen reportes de series de casos, aun escasos, pero con resultados prometedores.
Oleszek y cols (28) reportó mejoría de rango de rotaciones e inclinaciones laterales en 20 casos tras una sola inyección y necesidad de re-infiltración una segunda vez en 3 casos, en una serie de 27 niños entre 6 a 18 meses portadores de TMC infiltrados con BoNT-A, a nivel de ECM y/o trapecio superior. Las reacciones adversas se presentaron sólo en 2 casos, consistentes en disfagia o debilidad cervical de carácter leve y transitoria. Las dosis utilizadas se basaron en la edad del niño y tamaño muscular, fluctuando entre 20 a 50U a nivel del ECM, 25 a 35 U en el trapecio, con dosis totales máximas de 80 U.
Joyce y cols (29) reportaron buenos resultados en un seguimiento de 22 meses de 14 pacientes con TMC tratados mediante infiltración con Botox®.
En suma la toxina botulínica tipo A ha surgido como una herramienta terapéutica adyuvante a la terapia física en aquellos casos resistentes, con resultados positivos y bajo riesgo de complicaciones. El adecuado diagnóstico e inicio de tratamiento precoz son aspectos claves para obtener buenos resultados, evitar el desarrollo de deformidades craneofaciales secundarias y disminuir efectivamente la necesidad de cirugía.
Desbalances musculares secundarios a lesiones del sistema nervioso periféricoEn los últimos años se ha comenzado a utilizar la BoNT-A en pacientes portadores de compromiso neuropático periférico, estabilizado y crónico, que presenten importantes desbalances musculares, generándose posturas viciosas y mayor compromiso funcional, muchas veces con riesgo de subluxación o luxación articular. En estos casos, previo a plantear una cirugía de alargamiento muscular, es importante considerar la administración de BoNT-A en los músculos más potentes, con el fin de ir logrando un equilibrio de las fuerzas musculares y además facilitar la expresión y fortalecimiento de la musculatura más debilitada.
De esta manera, en la actualidad, la BoNT-A se está usando en pacientes portadores de Mielomeningocele (MMC) (8) y en la Parálisis Braquial Obstétrica (PBO). El número de publicaciones aún es escaso y en su mayoría restringido a un bajo número de pacientes, especialmente en MMC, por lo que si bien los resultados muestran una buena respuesta, lo cual coincide con la experiencia de las autoras, aun no es posible asegurar sus beneficios.
La PBO tiene mayor número de publicaciones, por lo que a ella nos referiremos.
La Parálisis Braquial Obstétrica, generalmente asociada a un traumatismo obstétrico, ha mantenido su incidencia de acuerdo a la mayoría de los reportes, con incluso un leve aumento, que se ha relacionado con Recién Nacido de mayor peso al nacer debido a diabetes gestacional, parto prematuro y aparentemente también, en relación a la tendencia a la disminución de los partos por cesárea (30,31).
En Europa se reporta una incidencia variable, que va de 1 a 4,6 /1000 RNV. En Estados Unidos, sin embargo, habría una disminución de 1,7 /1000 RNV en 1997, a 1,3/1000 RNV en 2003 (32).
Si bien entre un 50% a 95% de los casos, se recuperan espontáneamente dentro de los 3 primeros meses, (30,33) existe un porcentaje que queda con secuelas, incluso después de una micro cirugía del plexo (30).
El compromiso más frecuente es de las raíces C5-C6 (parálisis de Duchenne Erb), asociada o no a compromiso de C7, ocasionando la típica posición en rotación interna del hombro, leve flexión del codo y pronación del antebrazo.
Cuando la recuperación completa no se produce, lo habitualmente observado es que la postura viciosa se mantiene y en esas condiciones el niño realiza las actividades manuales que le son posibles, instaurándose un patrón de movimiento anormal, contracturas articulares progresivas en hombro, codo y antebrazo y un menor desarrollo global de la extremidad, que a veces puede ser significativo.
Las alteraciones más frecuentemente encontradas en hombro y antebrazo, son secundarias al desbalance muscular producido entre los músculos indemnes o predominantes. En el hombro, predominio de los rotadores internos con un déficit de los rotadores externos y deltoides y, en el antebrazo, el predominio de los pronadores con un déficit de los supinadores.
En el codo, lo que se describe con más frecuencia, es la presencia de actividad simultánea de agonista y antagonista (co-contracción), que impide el movimiento aislado, ya sea de flexión o de extensión del codo. Este fenómeno se ha objetivado con EMG dinámica multicanal y se ha observado también en niños operados, lo que se ha atribuido a reinervación aberrante, ya sea espontánea o inducida por cirugía reconstructiva del plexo, donde los axones regenerados no llegan al músculo objetivo. También se ha sugerido una apraxia secundaria a una retroalimentación sensorial deficitaria en un cerebro inmaduro (31) Estos trastornos se producen durante el período más importante de aprendizaje, ejecución y consolidación de los patrones de movimiento en el niño.
La rotación externa del hombro es fundamental para posicionar adecuadamente el antebrazo y la mano y, con ello, permitir la prensión y manipulación de los objetos. Permite además, llevar la mano a la cara sin abducir el hombro y realizar la elevación de la extremidad.
La flexión del codo, permite llevar la mano a la cara y boca y la extensión permite los alcances y apoyos adecuados.
En la última década, se ha comenzado a utilizar la infiltración de BoNT- A con el fin de lograr un mejor balance muscular para facilitar el alineamiento y la actividad muscular recíproca y de esta manera, lograr un adecuado aprendizaje motor (30). La idea es que el debilitar los músculos predominantes, le permite al niño activar su musculatura más parética e ir desarrollando, con una adecuada estimulación, patrones normales de movimiento.
A nivel del hombro, el objetivo es debilitar los rotadores internos y con ello favorecer la acción y el fortalecimiento de los rotadores externos; en el antebrazo, debilitar la actividad de los pronadores para facilitar la actividad de los supinadores y en el codo, evitar la co-contracción muscular, relajando al músculo predominante (bíceps o tríceps braquial) para permitir la ejecución aislada de flexión y extensión.
Si bien el número de trabajos publicados es escaso y su nivel de evidencia es III-3 y IV, la mayoría reporta resultados favorables (32). Los mejores resultados reportados, han sido en lactantes y niños menores de 4 años (30,31,33), lo cual se condice con el período de mayor plasticidad neuronal y elasticidad de los tejidos blandos (músculos, tendones, cápsula articular).
La mejoría de la flexión del codo, después de la infiltración del tríceps braquial, ha sido aparentemente la más efectiva y duradera, donde se ha logrado la mejoría de la flexión activa y funcional del codo por periodos prolongados siendo en algunos casos, innecesario volver a infiltrar (30,31). La infiltración a nivel de los aductores y rotadores internos del hombro ha mostrado también mejorías significativas del rango de movimiento y la simetría de hombros, con una duración media de 4 a 5 meses (33), lo cual es importante de considerar, dado que es a este nivel, donde podemos ver en el largo plazo, las mayores complicaciones articulares.
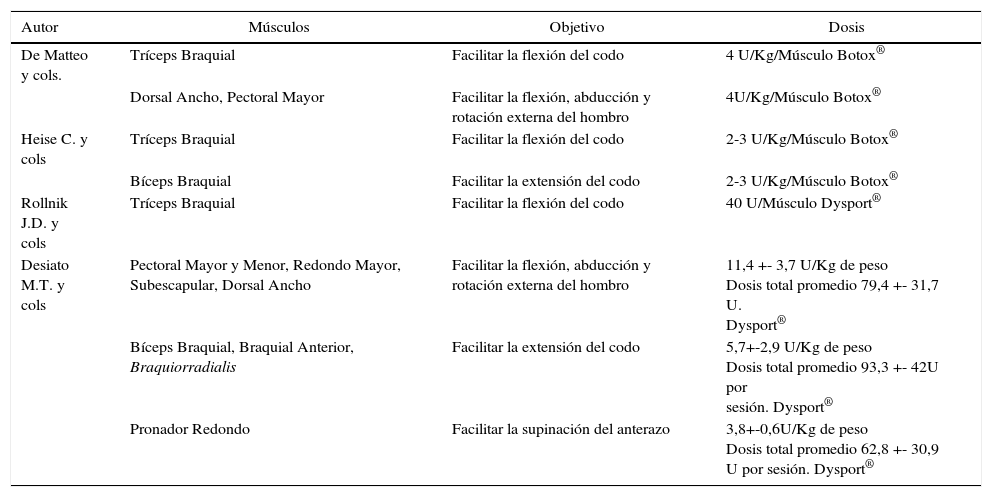
Esta terapia debe ir siempre asociada a un programa de entrenamiento funcional, para lograr el aprendizaje e incorporación de patrones más normales de movimiento (“ventana para la plasticidad neuronal”) (30,31). Las dosis frecuentemente utilizadas y sus objetivos en los distintos reportes se muestran en la Tabla 7.
Dosis de BONT-A en parálisis braquial obstétrica
| Autor | Músculos | Objetivo | Dosis |
|---|---|---|---|
| De Matteo y cols. | Tríceps Braquial | Facilitar la flexión del codo | 4 U/Kg/Músculo Botox® |
| Dorsal Ancho, Pectoral Mayor | Facilitar la flexión, abducción y rotación externa del hombro | 4U/Kg/Músculo Botox® | |
| Heise C. y cols | Tríceps Braquial | Facilitar la flexión del codo | 2-3 U/Kg/Músculo Botox® |
| Bíceps Braquial | Facilitar la extensión del codo | 2-3 U/Kg/Músculo Botox® | |
| Rollnik J.D. y cols | Tríceps Braquial | Facilitar la flexión del codo | 40 U/Músculo Dysport® |
| Desiato M.T. y cols | Pectoral Mayor y Menor, Redondo Mayor, Subescapular, Dorsal Ancho | Facilitar la flexión, abducción y rotación externa del hombro | 11,4 +- 3,7 U/Kg de peso Dosis total promedio 79,4 +- 31,7 U. Dysport® |
| Bíceps Braquial, Braquial Anterior, Braquiorradialis | Facilitar la extensión del codo | 5,7+-2,9 U/Kg de peso Dosis total promedio 93,3 +- 42U por sesión. Dysport® | |
| Pronador Redondo | Facilitar la supinación del anterazo | 3,8+-0,6U/Kg de peso Dosis total promedio 62,8 +- 30,9 U por sesión. Dysport® |
El bruxismo deriva de la palabra “brychein”, que significa masticar o rechinar los dientes. Puede verse en forma aislada o formando parte de un cuadro neurológico central, que es lo que ocurre con más frecuencia en la población pediátrica que atendemos. Su tratamiento requiere de un enfoque integral, con un trabajo coordinado y consensuado con el odonto pediatra y neurólogo.
La fisiopatología del bruxismo no ha sido exhaustivamente estudiada, pero se han descrito 3 causas principales; causas mecánicas, psicológicas y asociadas a determinadas patologías. Las causas mecánicas están determinadas por alteraciones como mal oclusión, cúspides ásperas o trauma dentario, que causan disconfort o tensión. Son habitualmente tratadas con éxito en base a tratamientos dentales en individuos normales, siendo mucho más difícil en pacientes con cuadros neurológicos por la baja tolerancia y nivel de colaboración, con el riesgo de autolesionarse con el uso de dispositivos intraorales. Siempre debe realizarse en primera instancia, una evaluación odontológica para identificar problemas oclusales que pueden desencadenar y mantener el problema en el tiempo.
Dentro de las causas psicológicas, destaca el stress emocional, habitualmente tratado con terapias conductuales, no obstante tampoco existen estudios que demuestren la efectividad de este tipo de terapias en individuos con trastornos generalizados del desarrollo (TGD).
La asociación de bruxismo con cuadros neurológicos también ha sido descrita. El bruxismo moderado a severo es frecuente en la PC y también en los niños con TGD. (34). Watts y cols. (35) en una serie de 79 pacientes con distonía cráneo-cervical encontraron una incidencia de bruxismo de 78%, muy aumentada con respecto a la incidencia de 15 a 20% de la población normal.
Si bien ocasionalmente nos vemos enfrentados a niños con bruxismo severo que impide la alimentación y la adecuada higiene bucal; la gran mayoría presenta un bruxismo moderado que produce dolor facial, desgaste dental y trastorno del sueño. Es en este tipo de pacientes donde la toxina botulínica ha mostrado utilidad y si bien su uso no ha sido estudiado en forma exhaustiva, existen reportes de casos en la literatura, aunque principalmente en pacientes adultos (35-37).
Guarda-Nardini y cols (38) en un estudio doble ciego controlado, trataron 10 casos con bruxismo y dolor miofascial asociado, mediante infiltración con BoNT-A y los compararon con 10 controles tratados con placebo. Los resultados mostraron significativa mejoría del dolor en reposo y durante la masticación post infiltración, con un seguimiento de seis meses. Lee y cols (39) realizaron registro electromiográfico nocturno a nivel de músculos maseteros y temporales en 12 pacientes portadores de bruxismo nocturno. Seis de los casos fueron infiltrados con BoNT- A, observándose disminución del dolor y de la actividad electromiográfica, principalmente a nivel de los maseteros y un efecto más pobre a nivel de los temporales.
Alonso y cols (37) reportaron efectividad con remisión de los síntomas y ausencia de complicaciones asociadas, en un estudio retrospectivo de 19 pacientes adultos con bruxismo, tratados con toxina botulínica a nivel de maseteros y temporales. Las dosis utilizadas fueron entre 25 a 40 U por músculo, no obstante con necesidad de aumento de dosis en re-infiltraciones sucesivas para un efecto óptimo. La duración del efecto reportada fue entre 12 y 26 semanas.
Los niños en general responden bien a la infiltración intramuscular con toxina botulínica de ambos maseteros, logrando buena relajación de la musculatura. Rara vez es necesario infiltrar los temporales u otros músculos relacionados como los pterigoideos. Las dosis habitualmente utilizadas van entre 1 U por kg de peso por músculo con un tope de 25 U en niños menores de 25 kgs. En los mayores de 25 kgs se usan dosis entre 25 a 40U por músculo. Es muy importante la utilización de estimulación eléctrica para evitar la infiltración de la rama del nervio facial y usar dosis bajas, dada la cercanía con la musculatura deglutoria.
Cirugía en parálisis cerebralEl niño con PC va sufriendo a lo largo de su crecimiento, torsiones óseas y retracciones articulares a causa de la espasticidad muscular, con un deterioro progresivo de su postura, estabilidad y de su marcha.
Frente a la indicación de cirugía de partes blandas, la BoNT- A se ha utilizado previamente para “simular” los efectos que se lograrían con la cirugía y de esta manera colaborar en la selección de los músculos a intervenir. Cuando la cirugía se ha definido, la infiltración intramuscular con BoNT-A se utiliza para mejorar la evolución en el post operatorio y facilitar su rehabilitación.
La Cirugía Multinivel (CMN) consiste en la realización de múltiples gestos quirúrgicos en un solo evento, destinados a restablecer el alineamiento de los ejes óseos y con ello, lograr la adecuada transferencia de las fuerzas musculares, con palancas de movimiento más efectivas. Son cirugías de gran envergadura, que producen una mejoría importante de la postura y la marcha de estos niños, mejorando en forma drástica el pronóstico funcional, pero que requieren de un largo proceso de rehabilitación.
La infiltración intramuscular con BoNT-A en las extremidades intervenidas, concomitantemente o días previo a la cirugía, mejora su evolución post operatoria por sus efectos analgésico y relajante muscular, previniendo o disminuyendo la aparición de dolor y espasmos musculares y facilitando el proceso de rehabilitación post operatoria. Se ha reportado menor dolor post operatorio, menores requerimientos de analgesia y disminución de los días de hospitalización en los niños operados tratados con BoNT- A (2).
Aalargamiento quirúrgico de extremidades superiores y/o inferiores en pacientes con talla bajaLos alargamientos óseos se están realizando cada vez con mayor frecuencia, con resultados muy exitosos dado el avance de la tecnología y de las técnicas quirúrgicas, que permiten alargar los huesos largos en varios centímetros en un relativo corto tiempo. Sin embargo, este rápido crecimiento óseo logrado con los tutores externos, no siempre es seguido de una elongación y un crecimiento muscular simultáneo adecuado, generándose con frecuencia intenso dolor muscular y de partes blandas al ser sometidas a esta mayor tensión, con contracturas musculares reflejas secundarias. Este desbalance entre segmentos óseos más largos y músculos más cortos y contracturados, que muchas veces no responde a la terapia analgésica y relajante muscular oral, va a interferir en forma significativa en la calidad de vida del paciente, en la movilidad articular y reentrenamiento funcional, además del riesgo de originar torsiones óseas e incluso llegar a la subluxación articular. En este contexto se postula la infiltración intramuscular con BoNT-A con objetivos analgésicos en el post operatorio inmediato y de relajación muscular en las semanas siguientes a la cirugía, que posibiliten una mejor adaptación al alargamiento óseo y una mejor ejecución del programa de elongación y ejercicios de recuperación funcional.
Hamdy (40,41), reporta una mejoría significativa del dolor en el post operatorio inmediato con la administración intramuscular de BoNT-A, requiriéndose de menor analgesia endovenosa y epidural y menores dosis de relajante muscular (diazepam) durante el post operatorio comparados con el grupo placebo. También reporta mejor puntuación en la encuesta de calidad de vida y funcionamiento emocional en los pacientes que recibieron BoNT-A y en sus padres. Con relación al espasmo muscular y la tolerancia a la movilización, los ejercicios y la carga de peso durante el periodo de alargamiento, este estudio reporta un mejor rendimiento y un menor número de complicaciones relacionadas con el procedimiento (infecciones, heridas profundas, fractura de los pines), lo que se ha atribuido a la relajación muscular y con ello, la menor tracción de los pines.
Los músculos candidatos a la infiltración con BoNT-A van a depender del o los segmentos a alargar. En las extremidades superiores, los flexores y extensores de codos y muñecas preferentemente y, en el caso de las extremidades inferiores, el cuádriceps, isquiotibiales mediales y laterales, flexores dorsales y plantares de tobillo y los inversores de tobillo.
Las dosis a utilizar, son con frecuencia menores que en los músculos espásticos, del orden de 10 U/Kg, no sobrepasando las 400U, siempre asociadas a un adecuado manejo de kinesiterapia.
Si bien en la literatura, la mayoría de los reportes sobre el uso de BoNT-A en cirugía ortopédica se refieren a la PC, existiendo escasas publicaciones referente a la cirugía de alargamientos, con un nivel bajo de evidencia; en la práctica clínica, este tratamiento se está utilizando cada vez con mayor frecuencia, con resultados positivos, por lo que nos ha parecido importante mencionarlo.
Síndrome del piriformeCorresponde al atrapamiento del nervio ciático en el músculo piriforme. Se caracteriza por dolor glúteo irradiado a la cara posterior del muslo que se incrementa con la maniobra de flexión, aducción y rotación interna de la cadera. Algunos lo consideran como un tipo de síndrome miofascial del músculo piriforme y las molestias estarían dadas no sólo por la compresión del nervio ciático, sino que por el espasmo muscular doloroso. Muchas veces es sub diagnosticado debido a que se piensa en otras causas de dolor radicular, originadas en la columna, llegándose finalmente al diagnóstico por descarte de otras patologías. Por este motivo es necesario un alto índice de sospecha al evaluar pacientes con dolor de la extremidad inferior. Su prevalencia no es tan clara. Se ha estimado que podría corresponder al 6% de los dolores por irritación ciática (42).
Esta entidad es de cierta frecuencia en la población joven, en relación a excesiva actividad deportiva, desencadenando dolor e impotencia funcional significativa. La infiltración intramuscular con BoNT-A del músculo piriforme, bajo ecografía y guía con electro-estimulación, es una alternativa de tratamiento, para reducir el espasmo muscular, con buen efecto y más prolongado en el tiempo que tras infiltración de lidocaína en combinación con corticoesteroides. Las dosis utilizadas van entre 50 a 200 U de Botox® en adultos y 2 a 3 U/Kg de peso en niños, seguidas de un programa de terapia física para elongación de la musculatura infiltrada.
El efecto de la BoNT-A se relacionaría con relajación muscular producida por bloqueo de la liberación de acetilcolina en el terminal nervioso, y en las vías aferentes del huso neuromuscular (43), además por bloqueo de la liberación de neutrotransmisores excitatorios como sustancia P y glutamato, entre otros (2).
Porta y cols (44) comparan el efecto de la toxina botulínica tipo A/lidocaína versus Metilprednisolona/lidocaína infiltrada vía intramuscular, en ambos casos asociada a un programa de fisioterapia, para el tratamiento de síndromes miofasciales de distintas localizaciones, entre ellos 4 casos de síndrome del piriforme en pacientes adultos, demostrando una eficacia superior con la toxina.
SialorreaSe define como la pérdida involuntaria de saliva a través de la boca. El control normal de la salivación se logra alrededor de los 15 a 18 meses. Se considera definitivamente anormal sobre los 4 años.
La excesiva salivación es un problema común en pacientes con disfunción neurológica, producida por la pérdida del control motor o hipotonía orofacial. Esta pérdida del control motor se manifiesta como disfunción orofaríngea sensitivo-motora y disfagia, que determina pérdida de la coordinación del mecanismo de deglución, llevando a la consecuente acumulación de saliva dentro de la cavidad bucal. En pacientes portadores de PC diskinética, se ha encontrado además de los aspectos relacionados con el control motor, un aumento real de la producción de saliva, que sería secundaria a los movimientos diskinéticos de la boca. A lo anterior puede agregarse la presencia de protrusión lingual que disminuye aún más la frecuencia de la deglución.
De acuerdo a los criterios establecidos por la CIF (4), tendremos a nivel de la dimensión corporal, excesiva cantidad de saliva que fluye hacia afuera de la cavidad bucal, determinando irritación cutánea con dermatitis perioral; además, aspiración del bolo alimenticio hacia la vía aérea con riesgo de neumonías aspirativas, con necesidad de hospitalizaciones repetidas y reducción de las expectativas de vida del paciente, más un significativo aumento de los costos en salud.
En la dimensión actividad, destacan la interferencia generada en la alimentación y lenguaje y en la dimensión participación, el rechazo social generado por la excesiva salivación y el mal olor, además de la sobrecarga de los cuidadores por el tiempo invertido para el manejo del problema.
La BoNT-A por su efecto anticolinérgico, es capaz de actuar sobre los terminales nerviosos de las glándulas salivales disminuyendo su producción en forma transitoria, no obstante algunos estudios en animales mostrarían denervación y subsecuente atrofia en el tiempo, especialmente tras infiltraciones repetidas, lo cual se traduciría en una menor producción permanente de saliva.
Desde el año 2002 se han reportado varias experiencias exitosas en el tratamiento de la sialorrea mediante inyección local de BoNT- A en niños y adultos con enfermedades neurológicas. Jongerius y cols. (45), trataron niños con PC con inyecciones bilaterales de las glándulas submandibulares, logrando significativa disminución de la producción de saliva, sin complicaciones asociadas. Bothwell y cols (46) administraron BoNT-A en ambas parótidas en niños con PC, logrando en casi todos una reducción de la producción salival. Pena y cols. y Kim y cols. (47,48) han reportado resultados prometedores en disminuir la producción de saliva y con ello la frecuencia de complicaciones respiratorias en niños con salivación y aspiración crónica.
Se puede considerar la infiltración de glándulas salivales con toxina botulínica como un procedimiento efectivo y seguro, siempre que se realice en forma adecuada, por profesionales entrenados, con adecuada definición de las dosis y dilución a usar, correcta elección de las glándulas a infiltrar así como la técnica de monitoreo a utilizar. Diversos autores han mostrado la efectividad y ausencia de complicaciones al realizar la infiltración de glándulas salivales bajo seguimiento ecográfico (47-50). La opinión de las autoras es la realización del procedimiento de infiltración con BoNT- A, a nivel de glándulas salivales bajo seguimiento ecográfico en todos los casos.
Adicionalmente, Kim y cols (48) han reportado la utilidad de usar en conjunto con el monitoreo ecográfico, la estimulación eléctrica a nivel de la parótida para evitar lesión del nervio facial.
Las dosis comúnmente utilizadas en niños y adolescentes son 0.6 a 2 U/ kg por glándula, en niños menores de 25 kgs y entre 5 a 25 U por glándula en los mayores de 25 kgs, no sobrepasando las 100U como dosis total.
Es importante considerar asociación con terapia fonoaudiológica con miras a mejorar el mecanismo deglutorio y lenguaje, el cual se facilita al contar con menor volumen de saliva intraoral post infiltración. Algunos autores (47) sugieren modificar la dieta la semana posterior al procedimiento de acuerdo a la recomendación del International Consensus Statement (51).
Los riesgos y complicaciones asociadas a la infiltración con toxina botulínica se relacionan con la posibilidad de lesionar el nervio facial a nivel de la parótida, la infiltración en estructuras vecinas, por ejemplo, a nivel de los maseteros produciendo debilidad en la masticación y, difusión hacia musculatura vecina con riesgo de generar disfagia, disfonía y neumonías aspirativas. Otras complicaciones descritas son el aumento de densidad de la saliva, xerostomia, dolor local, hinchazón e infección (9).
Existen diversas maneras de medir la producción salival y los efectos de la toxina botulínica sobre ésta, a través de la aplicación de escalas de evaluación (Drolling Impact Scale, Drolling Frecuency and Severity Scale) (9). Las más utilizadas son el recuento del número de baberos, aspiraciones realizadas o número de filtros de traqueostomía utilizados a lo largo del día. El registro del número de episodios respiratorios sufridos en el tiempo, especialmente pre y post infiltraciones es también una medida útil, usualmente utilizada.
Blasco (52) ha sugerido que mucho más importante que la medición cuantitativa de la sialorrea, es evaluar el impacto en la calidad de vida del individuo y de su familia. En este sentido la Drooling Impact Scale pareciera ser la escala más adecuada.
Hiperhidrosis en parálisis cerebralLa hiperhidrosis se define como la excesiva producción de sudor, más allá de lo esperado para las necesidades de termorregulación. Puede ser primaria, o secundaria a trastornos neurológicos, endocrinos, neoplasias, drogas, etc.
Puede ser focal o generalizada. Cuando es focal, generalmente afecta las axilas (40-50%), las palmas de las manos o las plantas de los pies (40-50%) y la cara (10%) (53).
Genera un problema social y emocional importante, especialmente en los adolescentes, con tendencia al aislamiento, baja autoestima y depresión. También se describen efectos negativos a nivel de la productividad en la escuela, la integración a actividades deportivas, la posibilidad de entablar relaciones sociales y la incomodidad generada por el número de veces que debe cambiar de ropa al día (53)
En rehabilitación, con frecuencia nos vemos enfrentados a la hiperhidrosis secundaria hiperactividad neurogénica, en pacientes portadores de PC, PNP, MMC y lesionados medulares adquiridos y, además, a la hiperhidrosis en el muñón de pacientes amputados.
Este problema agrava la discapacidad ya existente, pues además de producir los trastornos emocionales y sociales ya mencionados, interfiere en la funcionalidad. La hiperhidrosis altera la efectividad de la prensión, pinza y apoyo de las manos; interfiere con el uso de bastones y órtesis y produce maceración con riesgo de infección de la piel. En el caso de los amputados, se producen serios problemas con la tolerancia de la prótesis.
La BoNT-A actúa sobre las glándulas ecrinas, disminuyendo la producción de sudor a través del bloqueo de su neurotransmisor, la acetil colina. No elimina la producción de olor, que está a cargo de las glándulas apocrinas de inervación adrenérgica.
Existen numerosas publicaciones sobre la efectividad del tratamiento de la hiperhidrosis primaria con BoNT-A, con reducción importante y prolongada del sudor y mejoría significativa de la calidad de vida de los pacientes (54). Se ha reportado un nivel de evidencia A para la hiperhidrosis axilar y B para la hiperhidrosis palmar (55).
Los instrumentos de evaluación más utilizados, son La escalas de severidad de la hiperhidrosis (Hyperhidrosis Disease Severity Scale) que evalúa la severidad de la hiperhidrosis axilar y su interferencia en las actividades diarias (Tabla 8), la Gravimetría que consiste en pesar un papel filtro antes y después de estar en contacto con la zona hiperhidrótica por 1 o 5 minutos, estableciéndose como significativo un aumento en el peso mayor a 50 mg/min. y con referencia a la calidad de vida, el índice utilizado es el Índice Dermatológico de Calidad de Vida (DLQI) (56).
Escala de severidad de la hiperhidrosis (hdss)
| 1. Mi sudoración axilar nunca es notable y nunca interfiere con mis actividades diarias |
| 2. Mi sudoración axilar es tolerable, pero a veces interfiere con mis actividades diarias |
| 3. Mi sudoración axilar es apenas tolerable y frecuentemente interfiere con mis actividades diarias |
| 4. Mi sudoración axilar es intolerable y siempre interfiere con mis actividades diarias |
Las reacciones adversas a nivel axilar son prácticamente nulas. A nivel palmar se describe debilidad leve y transitoria, discreto edema y pequeños hematomas (53). Glass (57), como hecho aislado, reporta en un caso, severa atrofia de la musculatura intrínseca de las manos en un paciente tratado con Dysport®.
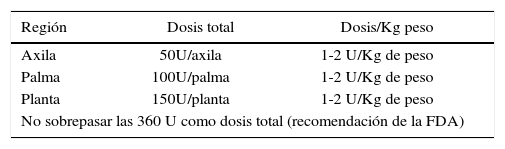
Considerando el nivel de seguridad y efectividad establecido para estas técnicas en la hiperhidrosis primaria (58), parece razonable extrapolar su uso a la hiperhidrosis secundaria a hiperactividad neurogénica en PC. En las PNP, se requiere de mayor investigación, dada la potencial debilidad agregada que se pudiera producir. En el caso del MMC, surge como una alternativa interesante a evaluar en la hiperhidrosis plantar, dado el riesgo de maceración e infecciones de la piel que tiene la hiperhidrosis, con mayor riesgo de heridas en estos pacientes, sumado a la interferencia con el uso de órtesis. En nuestra práctica clínica, las técnicas de infiltración y las dosis usualmente utilizadas en adolescentes con PC e hiperhidrosis secundaria a hiperactividad neurogénica, no difieren de las descritas para la hiperhidrosis primaria (59). Tabla 9.
Para la infiltración se recomienda utilizar una aguja de 26 o 30 gauge y una jeringa de tuberculina. En la axila rasurada, se realiza la infiltración subdérmica, en aproximadamente 40 sitios de punción separados en aproximadamente 1 cm, distribuidos en una cuadrícula, que cubra toda la superficie pilosa. La aguja debe orientarse en un ángulo de inclinación de 45° y una profundidad de aproximadamente 2 mm., inyectando 0,05 ml por punto.
En la palma de las manos se realizan aproximadamente 12 a 18 puntos de punción, separados aproximadamente por 1 cm. y 3 sitios de punción en cada dedo. Se aplican 2 a 3 U por punto de inyección a nivel de la dermis para evitar la debilidad de la musculatura intrínseca. En la planta de los pies el procedimiento es el mismo, con aproximadamente 40 a 45 puntos de punción, separados por 1 cm. y un punto de punción por cada dedo.
En nuestra experiencia, al igual que la literatura, este tratamiento es altamente exitoso a nivel axilar, con una duración que va de 4 a 12 meses (60), requiriendo infiltraciones cada vez más distanciadas e incluso después de algunos años, ya no ser necesarias. A nivel palmar y plantar el resultado es más corto, en promedio 6 meses (60) y en ocasiones menos efectivo, lo que se ha relacionado con la técnica de infiltración.
Una de las razones que se ha postulado para el menor resultado en la hiperhidrosis palmar y plantar, es el reflujo de la toxina desde los puntos de inyección. Walling (60) recomienda las siguientes técnicas para evitar el reflujo de la toxina:
- a)
Mantener el bisel de la aguja hacia arriba.
- b)
Inclinar la aguja paralela a la superficie de la pie.
- c)
Avanzar la aguja 2 mm dentro de la piel antes de la inyección.
- d)
Inserción lenta de la aguja, sin presionar el émbolo durante la inserción.
- e)
Esperar 1 a 2 segundos post inyección antes de retirar la aguja.
Es importante señalar que en las palmas y la planta de los pies, la inflitración es muy dolorosa, por lo que Doft (59) recomienda la aplicación de lidocaína tópica 1 hora antes asociado a frío local. Otros autores sugieren el cloruro de etilo o frío asociado a vibración para atenuar el dolor. Mannava (61) agrega acetaminofeno local post procedimiento. Gülec (62) recomienda diluir la toxina en lidocaína. Se ha utilizado también el bloqueo de Nervio Mediano y Cubital en la muñeca, pero existe el riesgo de injuria nerviosa y molestias disestésicas post procedimiento.
En suma, la hiperhidrosis por sí misma puede ocasionar serios conflictos emocionales y sociales, limitando en forma significativa las posibilidades de participación social en las personas que la sufren. Esto es doblemente significativo cuando se produce en personas portadoras de una discapacidad, por lo que su tratamiento es un imperativo. Dentro de las patologías discapacitantes que presentan esta complicación con cierta frecuencia, está la PC, donde la infiltración con BoNT-A parece ser una alternativa de tratamiento segura y eficaz. Se requiere de mayor investigación para plantear esta alternativa en pacientes cuyo compromiso de base es de origen neuropático periférico.
ConclusiónLa toxina botulínica tipo A es una alternativa terapéutica eficaz y segura para el tratamiento de la Espasticidad y Distonía en el niño con PC, así como en la sialorrea y la hiperhidrosis. Existe evidencia sólida de que al asociarla con un programa de tratamiento adecuado de rehabilitación, los resultados funcionales son mejores que las terapias aisladas y se sostienen en el tiempo.
En la actualidad, su espectro de uso aborda numerosas patologías para corregir desbalances musculares, mejorar la sincronización de la actividad muscular y el tratamiento del dolor musculoesquelético.
El impacto en la mejoría de la calidad de vida de los pacientes, mejoría de la funcionalidad, disminución de la necesidad de atenciones médicas, menor frecuencia de cirugías ortopédicas y recambio ortésico, la hacen costo-beneficio recomendable.
Sus reacciones adversas en general son leves, transitorias, de baja frecuencia y controlables mediante una adecuada prescripción, técnica de administración, supervisión cercana por el médico tratante y la entrega de información clara y completa a la familia.
Agradecimientos especiales a la Sra. Luz Navarrete T, Bibliotecaria Jefe de Clínica Las Condes y a la Srta. Maribel Garrido S. Asistente de Centro SAVAL, Clínica Las Condes, por su valiosa colaboración en la búsqueda bibliográfica.
Las autoras declaran no tener conflictos de interés, en relación a este artículo.