El choque cardiogénico es una condición hipercompleja que se asocia a una elevada morbimortalidad. La diversidad de procesos fisiopatológicos implicados converge en un deterioro progresivo de la perfusión tisular, inflamación sistémica y muerte. El estudio hemodinámico de estos pacientes mejora el proceso de estadificación, diagnóstico y escalamiento a terapias avanzadas. La utilización del catéter de la arteria pulmonar (CAP), aunque controvertida, se ha asociado a mejores desenlaces, particularmente en las primeras horas tras el diagnóstico. Los nuevos paradigmas enfocados en la fenotipificación del choque promueven estrategias terapéuticas individualizadas, posibilitando un mejor pronóstico.
Cardiogenic shock is a hyper-complex condition associated with a significant morbimortality. The diverse pathophysiological processes implicated in this disease converge into a spiral of progressively impaired tissue perfusion, leading to systemic inflammation and death. The hemodynamic assessment of these patients leads to improved disease staging, diagnosis and therapy escalation. The utilization of a Pulmonary Artery Catheter (PAC), although controversial, has been associated with better outcomes, especially when done in the first hours after diagnosis. The paradigm shift towards shock phenotyping fosters individualized care strategies, and eventually, a better prognosis.
Por décadas, mejorar los desenlaces asociados al choque cardiogénico (CC) ha sido un desafío. A pesar de los significativos avances en la estratificación de la enfermedad y el desarrollo de terapias dirigidas, la tasa de mortalidad a corto plazo continúa superando el 50%1,2. Este desalentador pronóstico se debe a la heterogeneidad fenotípica de la enfermedad, su curso clínico impredecible y los considerables riesgos asociados a las opciones terapéuticas disponibles. La identificación temprana, el abordaje completo y la escalamiento individualizada del tratamiento son estrategias vanguardistas que se han fomentado, con la intención de mejorar los desenlaces en esta condición3.
DefiniciónEl choque cardiogénico se define como un estado de hipoperfusión sistémica secundario a disfunción miocárdica2. Inicialmente, sólo los casos de choque cardiogénico avanzados eran reconocidos, utilizando criterios como los del estudio Should we Emergently Revascularize Occluded Coronaries for Cardiogenic Shock (SHOCK) o Intraaortic Balloon Pump in Cardiogenic Shock-II (IABP-SHOCK II) para su identificación2,4,5. Tales criterios están fundamentados principalmente en mediciones hemodinámicas (tensión arterial sistólica (TAS)<90mmHg por más de 30min, índice cardíaco (IC)<2,2 y una presión capilar pulmonar (PCP)>15mmHg) y signos de hipoperfusión (gasto urinario (GU)<30ml/h, alteración del estado de alerta, piel marmórea o fría, retardo en el llenado capilar, lactato sérico>2,2mmol/l), así como la necesidad de soporte con agentes vasoactivos2,4,5. No obstante, a medida que el entendimiento de esta condición fue progresando, se hizo evidente que un subgrupo considerable de pacientes presentaba hipoperfusión tisular manifiesta, incluso en ausencia de hipotensión arterial. Esta contradicción fue tomada en cuenta en la definición del grupo Shock Academic Research Consortium (SHARC), junto con la inclusión del requerimiento de dispositivos de asistencia mecánica circulatoria para mantener un estado hemodinámico adecuado2,3,6.
Si bien estas definiciones han desempeñado un papel fundamental, su utilidad se ve reducida en el contexto clínico. A diferencia de los centros académicos de vanguardia, en centros de primer y segundo nivel, la caracterización profunda de estos pacientes resulta un reto. Se ha reconocido la importancia de la hora dorada y las primeras 24 horas en el tratamiento de estos pacientes, por lo que su pronta identificación y traslado a centros o equipos especializados, es fundamental2,7. Por lo tanto, el paradigma actual ha favorecido definiciones operacionales más amplias, que permiten disminuir el umbral de sospecha de esta enfermedad y así promover un diagnóstico y tratamiento oportunos. Definiciones como la de Perioperative Quality Intitative/Enhanced Recovery After Surgery Cardiac Society (POQI/ERAS), la cual identifica al choque cardiogénico como el “fracaso circulatorio atribuible a una disfunción cardíaca que resulta en perfusión tisular anormal”, ejemplifican esta nueva dirección enfocada en el reconocimiento y manejo tempranos8–10 (tabla 1).
Definiciones del choque cardiogénico
| SIGLAS | Criterios diagnósticos del choque cardiogénico |
|---|---|
| SHOCK (1999) | • Al menos uno de los siguientes signos de hipotensión:ο TAS <90mmHg durante >30minο Necesidad de utilizar agente vasopresor para mantener la TAS >90mmHg• Datos de hipoperfusión (Gasto urinario <30ml/h o extremidades frías al tacto)• Parámetros hemodinámicos: IC <2,2l/(min×m2) y PCP >15mmHg |
| IABP-SHOCK II (2012) | • Al menos uno de los siguientes signos de hipotensión:ο TAM <70mmHgο TAS <100mmHg a pesar de hidratación adecuada con solución intravenosa (por lo menos 1l de solución intravenosa cristaloide o 500ml de coloide).• Al menos uno de los siguientes signos de hipoperfusión:ο Estado de alerta afectadoο Cambios de coloración cutáneosο Gasto urinario menor a 0,5ml/kg por 1hο lactato sérico > 2mmol/l |
| SHARC (2023) | Afectación cardíaca que se asocia a signos de hipoperfusión sostenida (IC ≤2,2l/min/m2, Lactato sérico >2mmol/l, estado mental alterado, extremidades frías, etc.). |
| SHARC: Choque Cardiogénico Normotenso (2023) | TAS >90mmHg sin apoyo con vasopresores, inotrópicos o tMCS pero que presenta hipoperfusión. Es necesario descartar causas alternativas para los signos relacionados a hipoperfusión. |
| POQI/ERAS (2025) | Disfunción circulatoria de causa cardíaca que culmina en hipoperfusión tisular. |
Abreviaturas: SHOCK: Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock; IABP-SHOCK II: Intraaortic Balloon Pump in Cardiogenic Shock II; SHARC: Shock Academic Research Consortium; POQI/ERAS: Perioperative Quality Initiative/Enhanced Recovery After Surgery; TAS: tensión arterial sistólica; IC: índice cardíaco; PCP: presión pulmonar capilar; TAM: tensión arterial media; tMCS, soporte mecánico circulatorio temporal. Modificado a partir de Vahadtpour et al.2; Hochman et al.4 Thiele et al.5 Waksman R et al6. Grant et al.8).
El choque cardiogénico es una complicación frecuente de la enfermedad cardiovascular, ocurriendo en 15% de los casos de infarto agudo al miocardio (IAM) y 5% de los casos de insuficiencia cardíaca (IC) aguda1. Tras el advenimiento del desarrollo y promoción de las terapias de reperfusión coronaria, la IC se ha convertido en una etiología progresivamente más frecuente de choque cardiogénico11,12.
Alrededor de 50% de los casos de IAM-CC se asocian con infarto del ventrículo izquierdo (VI), mientras que 5% se presentan con infarto aislado del ventrículo derecho (VD)1. Los pacientes femeninos, no-caucásicos y de edad más avanzada presentan tasas de mortalidad más elevadas, además de recibir terapias de reperfusión coronaria o dispositivos mecánicos circulatorios (MCS) con menos frecuencia1.
La incidencia de choque cardiogénico secundario a IAM (IAM-CC) se ha mantenido estable en los últimos años, a diferencia del choque cardiogénico debido a otras etiologías1,4. Estos últimos presentan mayor incidencia de comorbilidades, como miocardiopatías, arritmias, hipertensión pulmonar y enfermedad renal crónica. Respecto a los pacientes con insuficiencia cardíaca como la etiología predominante (IC-CC), la mayoría de casos son secundarios a insuficiencia cardíaca crónica agudizada (ICCA), seguida de insuficiencia cardíaca aguda de novo (ICADN). Los pacientes con CC secundario a ICCA (ICCA-CC) presentan mayor tasa de comorbilidades, así como una edad más avanzada que aquellos con CC secundario a ICADN (ICADN-CC) o IAM-CC; sin embargo, estos últimos tienden a presentarse con grados más graves de descompensación hemodinámica y tasas de mortalidad más elevadas1. En comparación con los pacientes con IAM-CC, los pacientes con IC-CC presentan una mayor reducción en la fracción de eyección del ventrículo izquierdo (FEVI), un menor requerimiento de agentes vasoactivos o MCS, y frecuentemente son candidatos a terapias de sustitución cardíaca, como dispositivos de asistencia ventricular izquierdo (LVAD) y trasplante cardiaco1.
El pronóstico continúa siendo sombrío, con tasas de mortalidad a los 30 días entre 30 y 60%, y de 50% a los 12 meses1. Así mismo, entre 50 y 90% de los pacientes con CC desarrollan insuficiencia respiratoria. Alrededor de 50% sufren de lesión renal aguda, la cual se asocia con mayor riesgo de mortalidad a los 90 días, si se produce en las primeras 48 horas1.
FisiopatologíaEl mecanismo patológico común del choque cardiogénico es una profunda disfunción miocárdica, la cual resulta en grados variables de hipotensión e hipoperfusión, dependiendo de la temporalidad, la etiología y las comorbilidades asociadas3,7,12.
En el IAM-CC, el insulto inicial es la reducción súbita y profunda del flujo coronario, la cual culmina en isquemia miocárdica3. El grado de disfunción miocárdica se refleja en la disminución segmentaria o global de la contractilidad y en el aumento de presiones intraventriculares de llenado, correspondientes a la extensión de los territorios coronarios afectados1. Como resultado, la hipocinesia ventricular genera una reducción progresiva del volumen latido, la cual se acompaña de taquicardia compensatoria, con el objetivo de mantener el gasto cardiaco7. Se genera un incremento retrógrado de las presiones hidrostáticas, reducción del flujo anterógrado, congestión vascular pulmonar y sistémica, así como hipoperfusión e isquemia tisular1,2.
En el contexto del IC-CC, las vías fisiopatológicas varían de acuerdo a si se trata de una ICADN o de ICCA. En el primer caso, los mecanismos patológicos son similares a los asociados al IAM-CC, con la excepción de que el insulto inicial es de etiología no isquémica, siendo la miocarditis aguda un ejemplo frecuente1. En el caso de la ICCA, los mecanismos difieren sustancialmente1. El sistema cardiovascular de estos pacientes se ha adaptado al estado hemodinámico propio de la insuficiencia cardíaca1. El incremento crónico de las presiones de llenado resulta en procesos de remodelado cardiaco e hipertrofia ventricular excéntrica1,7. La congestión sistémica se asocia además a un tono vascular constitutivamente elevado1. Estos cambios crónicos se asocian con un menor umbral para presentar hipotensión, pero un mayor umbral para que se traduzca en hipoperfusión tisular1. La carente reserva funcional miocárdica secundaria al remodelado cardiaco crónico puede asociarse a un declive estrepitoso de la función ventricular y CC refractario1.
Tras el espiral de descompensación hemodinámica asociado a ambas etiologías, la hipoperfusión evoluciona a hipoxia, liberación de patrones moleculares asociados al daño, y metabolitos de la respiración celular anaerobia, iniciando una cascada inflamatoria que disminuye el tono vascular, y genera fuga de líquido extravascular y depresión miocárdica7. Se produce daño orgánico a nivel sistémico, particularmente hepático y renal; ocasionando trastornos hidroelectrolíticos y metabólicos que exacerban el estado de choque2,3,7.
Abordaje del choque cardiogénicoSospecha clínicaLa presentación puede variar desde signos clásicos de hipoperfusión y daño a órgano blanco, hasta afectaciones tenues de la función orgánica, comúnmente infradiagnosticadas7,12. Signos de hipoperfusión antecedidos y acompañados de dolor de características anginosas (retroesternal agudo, incesante, opresivo y con irradiación a la mandíbula o el brazo izquierdo) es una viñeta clásica que debe despertar la sospecha de IAM-CC en evolución2. Respecto al IC-CC, los pacientes tienden a reportar signos y síntomas sugestivos de congestión pulmonar (disnea, ortopnea, disnea paroxística nocturna) y sistémica (aumento de peso, edema dependiente en miembros pélvicos, saciedad temprana y hepatoesplenomegalia)12. En esta población, los signos y síntomas sugestivos de hipoperfusión suelen ser menos pronunciados en la etapa inicial, debido a los procesos compensatorios efectuados en el contexto de la insuficiencia cardíaca crónica1.
Ambas etiologías eventualmente culminan en un estado de hipoperfusión, el cual se presenta con alteración del estado de alerta, prolongación del llenado capilar y oliguria (<30ml/h o<0,5ml/Kg/h)3,4. El conjunto de congestión e hipoperfusión da lugar al fenotipo clínico “frío y húmedo”, la presentación más frecuente en las etapas iniciales2,3. En los pacientes con choque cardiogénico asociado a IAM (IAM-CC), presentaciones clínicas euvolémicas, se asocian frecuentemente a antecedentes de cardiopatía coronaria o enfermedad renal crónica2,7. Los fenotipos clínicos asociados a resistencias vasculares periféricas disminuidas o “calientes” se asocian a una respuesta inflamatoria profusa y una mortalidad elevada2,7.
Exámenes de laboratorioDe manera característica, los niveles séricos de lactato superan los 2mmol/l en casos de choque establecido4–6. La hiperlactatemia; que puede ser secundaria a disminución del aclaramiento hepático o renal o por aumento de producción del ácido láctico; se ha identificado como un marcador independiente de riesgo de mortalidad en el choque cardiogénico, tanto en casos de IAM-CC como de IC-CC1. La afectación renal aguda con patrón de lesión renal prerrenal en este contexto, es un signo de hipoperfusión en proceso1. La aparición de hiponatremia o anemia dilucionales se asocian a estados crónicos de insuficiencia cardíaca con desregulación neurohormonal13. La transaminitis hepática, colestasis, y prolongación de los tiempos de sangrado reflejan lesión hepática secundaria a hipoperfusión y congestión (“hígado de choque”) 2,13. La leucocitosis, aumento del VSG y demás reactantes de fase aguda reflejan un estado de hipoperfusión profunda e isquemia tisular13.
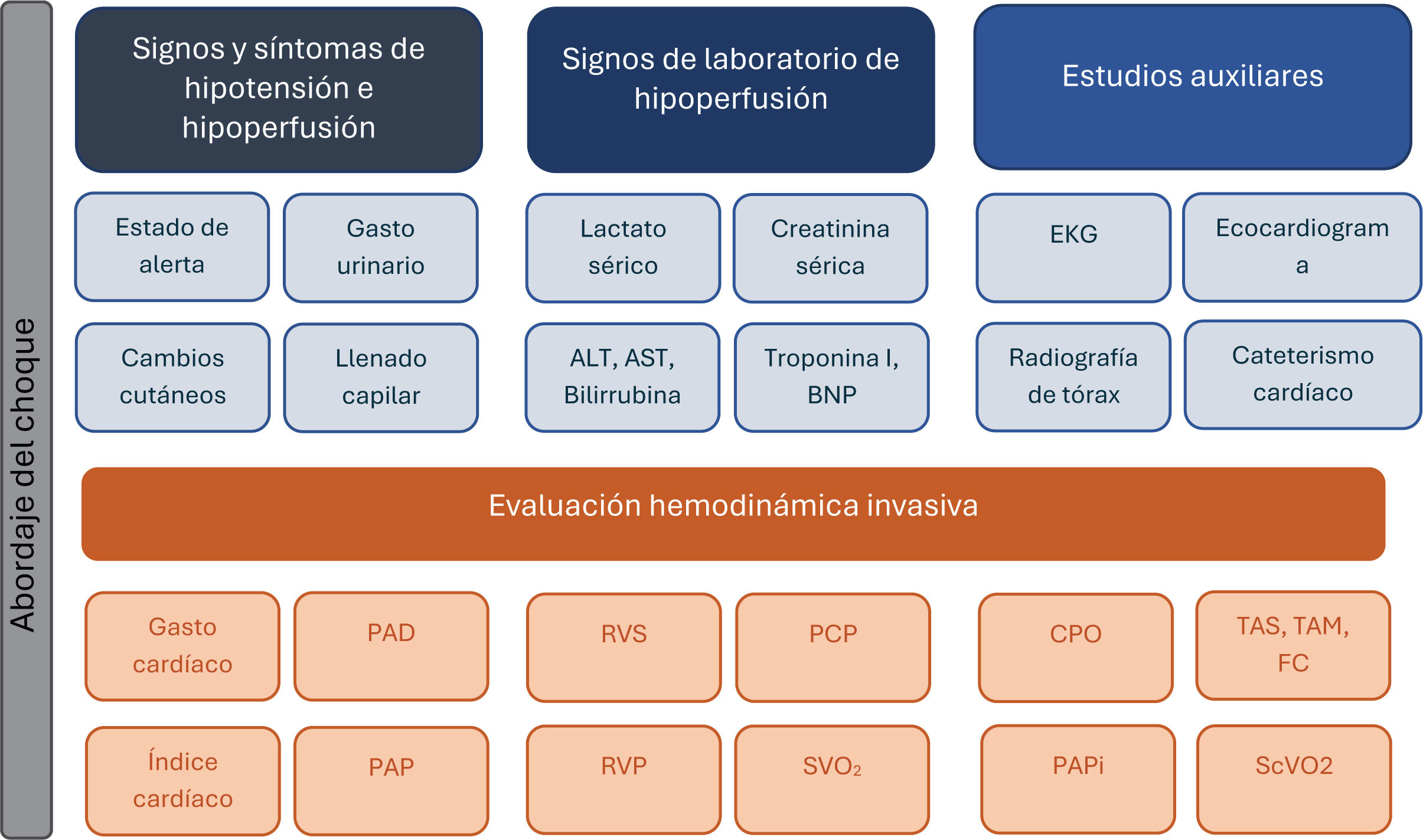
Estudios de imagenEl electrocardiograma es un recurso accesible, económico e irremplazable, tanto para el diagnóstico etiológico, como para la monitorización hemodinámica inicial y continua13. Es igualmente útil para el reconocimiento de factores exacerbantes, como arritmias, trastornos hidroelectrolíticos y toxicidades farmacéuticas2,13. Por otro lado, el ecocardiograma permite una investigación rápida, no invasiva y profunda de los parámetros volumétricos y hemodinámicos. Dentro de estos, la fracción de eyección del ventrículo izquierdo (FEVI) resulta fundamental en la perfilación de las terapias en los pacientes con IC-CC2. Permite estimar las presiones de llenado ventriculares, cuantificar la gravedad de las valvulopatías y evaluar la presencia de complicaciones graves, como trombos cavitarios y comunicaciones interventriculares13 (figura 1).
Abordaje clínico del choque cardiogénico
Abreviaturas: ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; BNP: péptido natriurético cerebral; EKG: electrocardiograma; PAD: presión de la aurícula derecha; PAP: presión de la arteria pulmonar; RVS: resistencia vascular sistémica; RVP: resistencia vascular pulmonar; PCP: presión capilar pulmonar; SVO2: saturación venosa mixta de oxígeno; CPO: poder cardíaco; PAPi: índice de pulsatilidad de la arteria pulmonar; TAS: tensión arterial sistólica; TAM: tensión arterial media; FC: frecuencia cardíaca; ScVO2 saturación venosa central de oxígeno. Modificado a partir de Narang et al.19.
Una vez identificado prontamente el estado de choque, el siguiente paso es esclarecer el estadio de gravedad en el que se encuentra el paciente, con el objetivo de determinar las opciones terapéuticas que se ofrecerán. La escala de la Society for Cardiovascular Angiography & Intervention (SCAI) ha sido validada clínicamente, asociándose con el riesgo de mortalidad14. Actualmente, está compuesta por 5 estadios en orden ascendente de gravedad. El primero, el estadio A (“At risk”), hace referencia a estados patológicos que confieren un riesgo elevado de desarrollar choque cardiogénico, pero sin presentar aún signos de este. El siguiente es el estadio B (“Beginning”), en el cual se incluyen pacientes hipotensos; definido como una TAS<90mmHg por más de 30min y/o una tensión arterial media (TAM)<65mmHg; o con signos de hipoperfusión, definida como cifras de lactato sérico>2mmol/l o alanina aminotransferasa (ALT) sérica superior a 200 U/l. El estadio B corresponde al estado clínico de “pre-choque”, en el que el deterioro hemodinámico es incipiente. Por otra parte, el estadio C (“Classic”), hace referencia al estado clínico clásico del choque; hipoperfusión sistémica manifiesta, hipotensión arterial sistémica y requerimiento de un agente vasoactivo, inotrópico o dispositivo MCS. En el estadio C, una vez se establece la terapia de soporte circulatorio con un único agente vasoactivo o MCS, el estado hemodinámico mejora. A comparación con el estadio C, en el estadio D (“Deteriorating”), un único agente vasoactivo o dispositivo MCS es insuficiente para recuperar la estabilidad hemodinámica, siendo necesarios entre 2 y 5 agentes vasoactivos o dispositivos de MCS. Además, las cifras de lactato sérico y ALT en este estadio superan a las de los anteriores, con niveles entre 5-10mmol/l y>500 U/l, respectivamente. El punto de mayor gravedad en el espectro del choque cardiogénico, corresponde al estadio E (“Extremis”), caracterizado por inestabilidad hemodinámica e hipoperfusión refractaria a todas las medidas terapéuticas disponibles. A su vez, si el paciente presenta un paro cardiorrespiratorio asociado al CC en el entorno extrahospitalario, automáticamente se clasifica como estadio E.2,7,14.
Recientemente, el Cardiogenic Shock Working Group (CSWG) enmendó la escala SCAI-CS, adaptándola para que sea más aplicable para pacientes con IC-CC14.
Las escalas SCAI-SHOCK y SCAI-CSWG posibilitan una evaluación continua, mínimamente invasiva y fácilmente replicable en centros de primer contacto. Son herramientas invaluables para la pronta identificación de pacientes con CC, así como para su seguimiento intrahospitalario y la escalamiento de terapias.
Monitorización hemodinámicaSi bien existen medidas de monitorización hemodinámica no invasivas; como la cuantificación del gasto urinario, el llenado capilar, la telemetría continua y la medición de la tensión arterial con catéter, la medición invasiva de parámetros hemodinámicos por medio del catéter de la arteria pulmonar (CAP, catéter “swan-ganz”), resulta esencial para estratificar el riesgo del paciente con choque, y para tomar decisiones respecto a la conducta terapéutica más adecuada15. La obtención de valores como la presión capilar pulmonar (PCP), la presión de la aurícula derecha (PAD) y el índice cardíaco (IC) brinda una perspectiva única respecto al estado hemodinámico del paciente. Además de estos parámetros universalmente reconocidos, la saturación venosa central de O2 (ScVO2) es otra variable de gran utilidad, al ofrecer una aproximación del grado de hipoperfusión, representando el desbalance de la utilización/demanda de O2 periférica16. El porcentaje de ScVO2 está directamente relacionado con mejores desenlaces en pacientes con IC-CC15. El índice de pulsatilidad de la arteria pulmonar (PAPi) es un parámetro que evalúa la función del VD, integrando su contractilidad, carga pulsátil y grado de congestión; se considera anormal si es<115,16. Por otra parte, el CPO es una estimación de la función contráctil del corazón, y se considera anormal cuando se encuentra debajo de 0,6W15-17. Valores anormales de ambos parámetros en pacientes con IAM-CC se asocian con un mayor riesgo de muerte16,17 (tabla 2). La medición invasiva de las resistencias vasculares sistémicas (RVS) permite distinguir entre diversos fenotipos de choque. Los fenotipos con RVS disminuidas han sido consistentemente asociados con una menor tasa de supervivencia hospitalaria18. En un análisis retrospectivo efectuado por Berg, et al, identificaron una relación independiente entre la TAM y RVS disminuidas; al igual que otros cuatro parámetros hemodinámicos; con mayor riesgo de mortalidad intrahospitalaria y mayores niveles de lactato sérico inicial, traduciendo hipoperfusión. La asociación entre mortalidad y la disminución de la TAM y RVS persistió incluso tras ajustar estos parámetros con la escala VIS y la necesidad de tMCS, respaldando su utilidad pronóstica18. Así mismo, Chavez et al., describieron una relación directamente proporcional entre las RVS, y la mortalidad a los 14 días del choque. En particular, su análisis describe que por cada 100 unidades que la RVS disminuyen debajo del umbral de 800-dynes/segundo/cm5, se presenta un incremento del 20% en el riesgo de mortalidad (aHR 1,23, p=0,004)19. Paralelamente, una respuesta disminuida al soporte con vasopresores se asoció con un riesgo dos veces mayor de mortalidad19. Los índices de tono arterial explorados por ambos grupos presentan una asociación notable con el desarrollo y desenlace del choque, haciendo eco al subgrupo de pacientes en el estudio SHOCK con fenotipo clínico mixto que presentaron una mortalidad elevada4,18,19.
Parámetros hemodinámicos asociados al choque cardiogénico
| Parámetros Hemodinámicos | Punto de Corte |
|---|---|
| Índice Cardíaco (IC) | ≤2,2l/min/m2 |
| Poder Cardíaco (CPO) | <0,6 W |
| Presión Capilar Pulmonar (PCP) | >18mmHg |
| Presión de la Aurícula Derecha (PAD) | >12mmHg |
| Índice de Pulsatilidad de la Arteria Pulmonar (PAPi) | ≤0,9*<1,85** |
El estudio hemodinámico individualizado y profundo es una de las fortalezas del equipo especializado de choque (shock team). Aunque la evidencia que respalda la integración de estos grupos interdisciplinarios de profesionistas es principalmente observacional, se ha reportado que su correcta implementación puede asociarse a un incremento en la supervivencia hospitalaria y a los 30-días post-choque9. Múltiples sociedades internacionales respaldan un manejo coordinado y complementario; con la evaluación hemodinámica como guía; ya que esta intervención puede ser la estrategia definitiva para mejorar los desenlaces en esta condición9,10.
Evidencia sobre el uso del catéter de la arteria pulmonar en choque cardiogénico: un debate en continua evoluciónSu uso es generalizado, aunque controversial, ya que en estudios como “Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness” (ESCAPE), la utilización del CAP se asoció con mayores tasas de mortalidad19,20. Sin embargo, una limitación importante de ESCAPE, es que se excluyeron de su análisis a pacientes con choque cardiogénico, debido a su impredecible condición clínica19,20.
Diversos estudios observacionales han sugerido que la utilización temprana de esta herramienta puede asociarse con un incremento en la supervivencia21,22. En un análisis realizado por Garan, et al. a partir del registro multicéntrico del CSWG, se observa una menor asociación con mortalidad en aquellos pacientes con choque cardiogénico que recibieron evaluación hemodinámica completa con CAP antes de recibir una intervención con tMCS, independientemente del estadio SCAI21. También identificaron que en los pacientes en los que no se utilizó CAP, la probabilidad de mortalidad era mayor (OR 1,57, IC 95% 1,06-2,33)21. De manera similar, la evaluación hemodinámica incompleta se asoció con una mayor probabilidad de muerte (OR 1,71, IC 95% 1,29-2,25)21. Ambos resultados fueron aún más pronunciados en los pacientes más graves de la cohorte, pertenecientes al estadio de gravedad D y E21. Se concluyó que la evaluación hemodinámica incompleta y la ausencia de evaluación hemodinámica con CAP presentaban una asociación equivalente con mortalidad, resaltando la importancia de una evaluación profunda del fenotipo hemodinámico de los pacientes con CC21.
El ensayo clínico aleatorizado y multicéntrico Pulmonary Artery Cathether in Cardiogenic Shock (PACCS, NCT05485376), se está llevando a cabo para confirmar la hipótesis obtenida en estos análisis observacionales, evaluando en qué grado influye el uso temprano de CAP en la supervivencia al egreso hospitalario y al seguimiento extrahospitalario. Estudios como PACCS permitirán validar esta herramienta que, aunque de uso controversial en esta población, es ampliamente disponible y favorecida por múltiples centros de referencia por la profundidad de la evaluación hemodinámica que permite.
Direcciones futuras: fenotipos derivados de biomarcadoresEn un estudio realizado por Zweck, et al, se extrajeron datos de dos registros multicéntricos clave; el Cardiogenic Shock Working Group Registry V1 (CSWG-V1) y el Danish Retroshock MI Registry (DRR). A continuación, se identificaron 3 fenotipos hemo-metabólicos con base en criterios laboratoriales y hemodinámicos obtenidos al ingreso hospitalario. Estos fenotipos fueron clasificados como Fenotipo I: No Congestivo, II: Cardiorrenal y III: Cardiometabólico23.
La iniciativa demostró ser clínicamente relevante, al predecir el riesgo de mortalidad entre los fenotipos. También se evidenció una capacidad predictiva sinérgica cuando se utilizaron estos fenotipos en conjunto con la escala de SCAI al ingreso hospitalario23. El análisis de agrupación para la conformación de grupos de estudio se realizó mediante técnicas de aprendizaje de máquinas semi- y no supervisado (Cluster based-Machine Learning, ML) 23.
Los hallazgos de este y otros trabajos similares resaltan el papel de la afectación multiorgánica como factor predictivo de riesgo de mortalidad antes del egreso hospitalario23–25. El análisis por aprendizaje de máquinas se ha convertido en un vibrante y dinámico campo de trabajo, que posibilitará mayor innovación y la creación de nuevos paradigmas en el manejo de esta población críticamente enferma.
ConclusionesEl choque cardiogénico es una condición multifacética, con un diagnóstico y estadificación complejos y un tratamiento desafiante. La investigación continua y el entendimiento profundo serán las llaves que abran la puerta de un futuro con mejores desenlaces para los pacientes con esta enfermedad.
Consideraciones éticasNada que declarar.
Declaración de conflicto de interésLos autores de declaramos que no tenemos conflicto de interés alguno con la redacción de este manuscrito y la creación de los materiales anexos al mismo.
Declaración de financiamientoLos autores declaramos que no recibimos financiamiento para la creación de este manuscrito.