La insuficiencia cardíaca terminal presenta una severa carga de morbimortalidad. Ante la ausencia de donantes para trasplante cardíaco o acceso a él, así como también ante algunas contraindicaciones, la asistencia ventricular mecánica de larga duración es una alternativa que optimiza notablemente el pronóstico vital y la calidad de vida, siendo comparable al trasplante al menos en algunos subgrupos hasta el quinto año post implante. Es por ello por lo que el conocimiento de su fisiología, hemocompatibilidad y hemodinamia se hacen imprescindibles en el ejercicio de la cardiología y cardiocirugía actual. En los últimos años se ha producido un aumento sostenido de los pacientes beneficiarios de dicha terapia en estrategia de destinación, lo que ha configurado en los hechos un nuevo fenotipo de insuficiencia cardíaca (soporte ventricular izquierdo de larga duración), con noveles paradigmas y desafíos, como un eficiente manejo de las eventuales complicaciones y su respectiva prevención. La evolución de nuevos dispositivos tiene aún la tarea de crear una bomba sin requerimiento de un driveline, que aumenta ostensiblemente la probabilidad de infecciones, eventualmente resultantes incluso en la indicación de trasplante de urgencia. Nuevos dispositivos están en desarrollo, intentando ofrecer una alternativa al aún único dispositivo de asistencia ventricular (ventricular assist device, VAD) aprobado por las autoridades norteamericanas y europeas: el HeartMate 3. Por lo anterior, el objetivo de esta revisión es describir la falla cardíaca avanzada y los elementos asociados tanto a la toma de decisiones como al seguimiento y pronóstico alrededor de la terapia de LVAD.
End-stage heart failure carries a significant burden of morbidity and mortality. In the absence of suitable donors for heart transplantation -or access to transplantation- as well as in the presence of certain contraindications, long-term mechanical ventricular assistance represents a valuable alternative that significantly improves both survival and quality of life. In some patient subgroups, its outcomes are even comparable to heart transplantation up to five years post-implantation.
For this reason, a solid understanding of its physiology, hemocompatibility, and hemodynamics has become essential in modern cardiology and cardiac surgery practice. In recent years, there has been a sustained increase in patients receiving this therapy under a destination strategy, effectively creating a new heart failure phenotype: long-term left ventricular support. This has introduced novel paradigms and challenges, particularly in efficiently managing and preventing complications.
The next generation of devices still faces the challenge of eliminating the driveline, which significantly increases the risk of infections, sometimes even leading to urgent transplantation. New devices are under development to provide alternatives to the currently sole FDA and CE approved ventricular assist device: HeartMate 3. Therefore, the objective of this review is to describe advanced heart failure and the factors associated with decision-making, follow-up, and prognosis in the context of LVAD therapy.
La insuficiencia cardíaca (IC) es un síndrome clínico complejo que, si bien en los últimos años ha visto mejoras en sus resultados luego de la extendida implementación de estrategias estandarizadas de terapia médica (terapia médica dirigida por guías clínicas, GDMT por su sigla en inglés), así como también de definiciones específicas1,2, mantiene prevalencias estimadas clásicamente entre el 1-2% de los adultos y que de cualquier manera continua progresando, dando cuenta la IC avanzada entre el 1 y el 10% de la población general que padece la enfermedad3,4. Adicionalmente, se espera que en Estados Unidos la prevalencia aumente cerca de un 34% en las próximas décadas5,6.
Los datos sobre la situación en Chile son algo más difusos, comenzando la caracterización sistemáticamente con el registro ICARO hace algo más de 20 años7. Promisorios datos se esperan del registro ambulatorio de insuficiencia cardíaca (ICARO-CR) así como también del registro GENESIS en lo relativo a diferencias sexo-específicas8,9.
En estudios poblacionales recientes, la mediana de mortalidad (IQR) del tiempo desde el diagnóstico de IC avanzada siguiendo los criterios de la Asociación de Insuficiencia Cardíaca (HFA) de la Sociedad Europea de Cardiología (ESC) hasta la muerte fue de 12,2 meses y la mortalidad a un 1 año 49,9%10. Lo anterior pone de relieve el ominoso pronóstico de esta entidad sin terapias como trasplante cardíaco, el gold standard y única terapia curativa para la IC terminal. Sin embargo, el soporte circulatorio mecánico (MCS por su sigla en inglés, mechanical circulatory support) toma un rol primordial en la terapia ante la ausencia de acceso o donantes para trasplante, así como en caso de contraindicaciones para él1.
El soporte circulatorio mecánico puede dividirse en dispositivos temporales -de corta duración- o de larga duración, como el soporte circulatorio ventricular izquierdo, derecho o biventricular (LVAD/RVAD/BiVAD por sus siglas en inglés, left/right/biventricular assist device) y el corazón artificial total (total artificial heart, TAH).
El foco de esta revisión estará puesto en las bases de la asistencia ventricular izquierda de larga duración, en sus distintas estrategias, en su rol del manejo de la IC avanzada, particularmente su fisiología, pronóstico y desafíos futuros.
MetodologíaLa evidencia incluida en esta revisión fue recopilada mediante una búsqueda bibliográfica en la base de datos PubMed, abarcando principalmente publicaciones de las dos últimas décadas. Se utilizaron términos de búsqueda como “insuficiencia cardíaca avanzada”, “soporte circulatorio mecánico”, “dispositivo de asistencia ventricular izquierda” y conceptos relacionados. Se otorgó prioridad a la evidencia de alta calidad, incluyendo ensayos clínicos aleatorizados, grandes registros internacionales (por ejemplo: INTERMACS, EUROMACS), guías de práctica clínica y consensos de expertos emitidos por sociedades científicas de referencia (ESC, AHA/ACC, ISHLT). Asimismo, se realizó una revisión manual de las referencias citadas en las publicaciones clave para identificar literatura adicional relevante. Sólo se consideraron estudios publicados en inglés o español. Se prestó especial atención a estudios/registros pivotales (por ejemplo: MOMENTUM 3, ELEVATE) y a la evidencia más reciente relacionada con avances tecnológicos, criterios de selección de pacientes y resultados a largo plazo de la terapia con LVAD.
Historia y evolución de los LVADEl desarrollo de los dispositivos de asistencia ventricular (VAD) ha tenido un relevante avance en las últimas décadas, registrando una gravitante repercusión en la incidencia de complicaciones y en la sobrevida. La primera generación de VADs fueron basados en flujo pulsátil. El advenimiento de los VADs de flujo continuo (continuous flow-LVAD, cf-LVAD), trajo consigo reducción en el tamaño de las bombas y de la cantidad de sus partes móviles, haciéndolas más durables y confiables, convirtiéndose en la terapia estándar para pacientes con IC terminal ya sea a la espera de trasplante, como puente a la decisión y cada vez más como terapia de destinación11,12.
Sólo en la década entre 2014 y 2024 se han implantado 29 634 cf-LVADs dentro del registro INTERMACS13. Notablemente, los resultados han demostrado una continua mejora luego de la introducción de dispositivos de levitación completamente magnética (HeartMate 3, Abbott)14, con una tendencia positiva en la mortalidad a 1 año (85,7% vs. 78,4%) y a 5 años (59,7% vs. 43,7%), según lo demostrado en el seguimiento a 5 años del estudio pivotal MOMENTUM 3, así como en el registro ELEVATE15,16.
Los cf-LVAD que han sido más frecuentemente usados en Europa y Estados Unidos son el HeartMate II (Abbott, bomba de flujo axial, 2da generación), HeartWare (HVAD, Medtronic, bomba centrífuga de 3ra generación), y la mencionada HeartMate 3, de levitación completamente magnética, también de 3ra generación. El problema de los dispositivos de flujo axial fue la alta incidencia de trombosis de la bomba, llevando a su disfunción y a la necesidad de su reemplazo17. En conjunto, con un aumento del riesgo de mortalidad y eventos adversos neurológicos hizo que otros dispositivos como el HeartWare fueran retirados del mercado por el fabricante para implante a pacientes en junio de 2021, siendo informado por la FDA norteamericana18. Lo anterior ha generado de facto un “monopolio accidental”, siendo actualmente el único VAD autorizado por la mencionada FDA y las autoridades europeas (CE) el HeartMate 319. Un dispositivo de levitación completamente magnética está siendo desarrollado en China (CH-VAD), con resultados clínicos aún preliminares20.
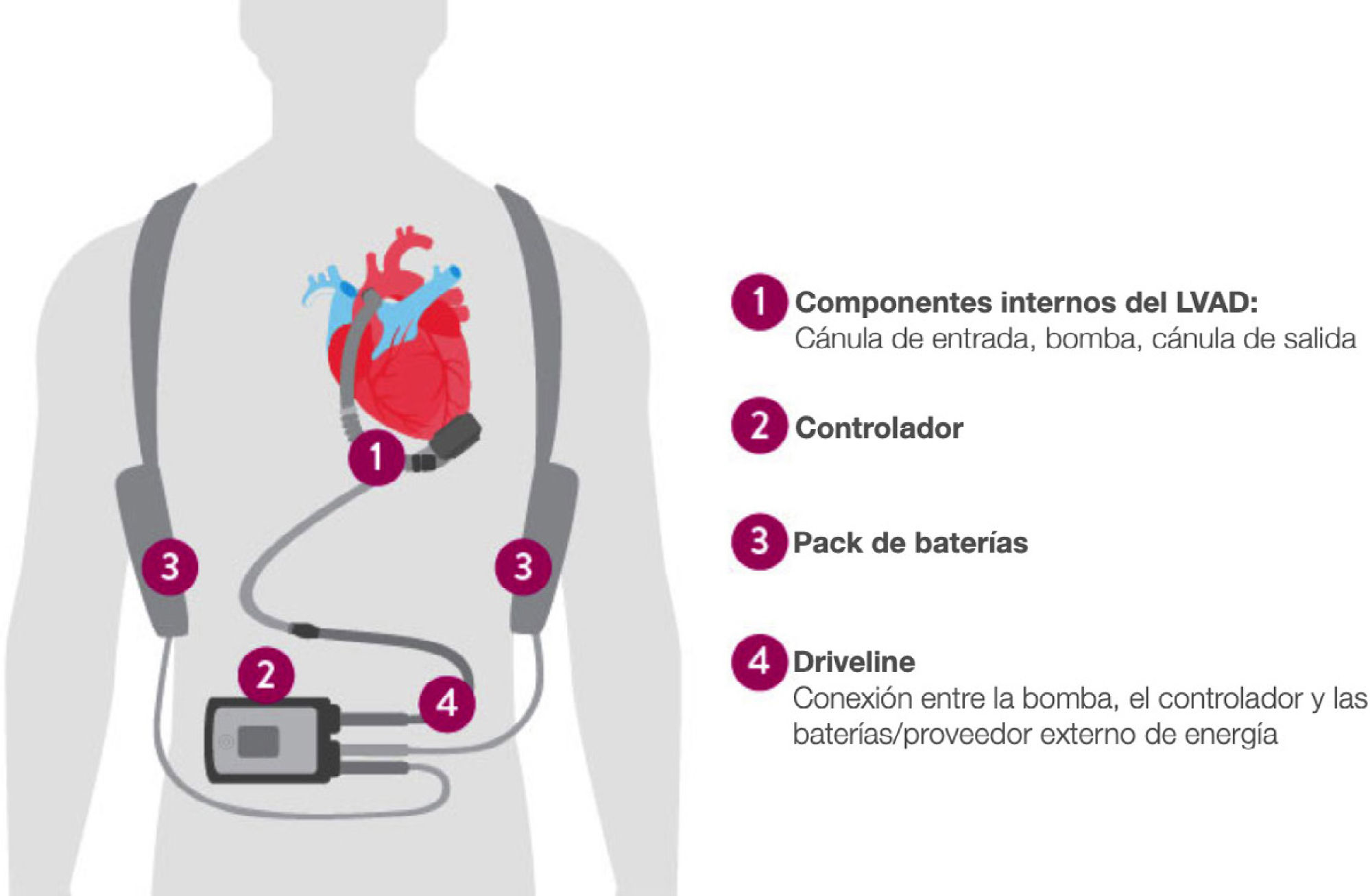
Fisiología y mecanismo de acción de los LVADPartes y componentesEsencialmente un LVAD está integrado de componentes internos -a las que el paciente no tiene acceso- y componentes externos -que el paciente puede manipular- unidas por un cable llamado “driveline” que discurre tunelizado, permitiendo la transmisión de energía y control al dispositivo (figura 1).
Los componentes internos de un LVAD consisten en una cánula de ingreso (inflow cannula) directamente conectada con la bomba y que es implantada en el ápex del ventrículo izquierdo. La bomba a su vez está a su vez unida a una cánula de egreso (outflow cannula) cuyo extremo distal es implantado en la aorta ascendente. La particularidad del dispositivo de levitación completamente magnética es que su funcionamiento interno carece de contacto y consiste en un rotor con imanes pasivos para la propulsión, un estator con bobinas electromagnéticas para la propulsión, así como un sistema de levitación que incluye sensores de distancia. La resultante ausencia de fricción reduce el fenómeno de shear stress en elementos figurados de la sangre optimizando la hemocompatibilidad y disminuyendo la probabilidad de trombosis de la bomba14.
Los componentes externos corresponden al driveline que se externaliza habitualmente a nivel abdominal alto y que provee conexión al controlador externo y a la energía, ya sea en forma de baterías o de fuente externa de poder. El controlador externo opera como computador del dispositivo, proveyendo además de información básica y puede mostrar alarmas en algunas situaciones clínicas o eventos de la bomba21.
Parámetros de funcionamientoLos parámetros de funcionamiento de un LVAD son la velocidad (pump speed, rpm), flujo de la bomba (pump flow, l/min), poder de la bomba (pump power, W) y el índice de pulsatilidad (pulsatility index). De ellos sólo la velocidad puede ser ajustada, el resto serán resultantes de la interacción reológica entre el dispositivo y la hemodinamia del paciente11,21.
Los rangos de velocidad de operación de la bomba varían entre los dispositivos, siendo la velocidad normal el HeartMate 3 entre 5 000 y 6 200rpm. El ajuste de la velocidad es realizado al momento de la implantación, así como también durante el seguimiento ambulatorio regular, con el objeto de optimizar el gasto y la descarga del ventrículo izquierdo, minimizando la ocurrencia de insuficiencia mitral, permitiendo la apertura ocasional de la válvula aórtica y la posición media del septum interventricular, consiguientemente evitando fenómenos de succión de la pared del ventrículo izquierdo en la cánula de entrada que pueden ocasionar alarmas de bajo flujo22. El poder de la bomba será medido directamente y el flujo de la bomba es calculado en base al poder y a la velocidad del dispositivo, considerando el hematocrito del paciente.
El índice se pulsatilidad a su vez es una medición que representa el pulso del flujo en la bomba y está determinado por la velocidad de la bomba y la función eyectiva propia del corazón. En consecuencia, la variabilidad de éste indica cambios en el estado del volumen intravascular efectivo y de la contractilidad cardíaca.
Es necesario hacer presente que un parámetro por sí mismo no da cuenta de la situación hemodinámica general del paciente, por lo que para ello es imprescindible tomar en consideración todos los parámetros clínicos, ecocardiográficos y también del dispositivo23 (tabla 1).
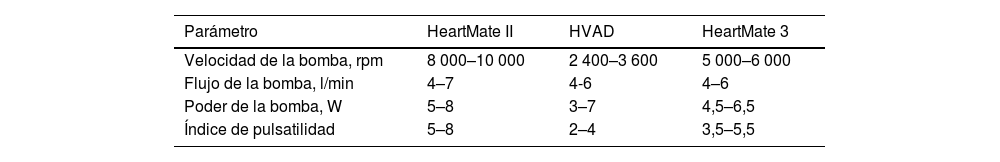
Parámetros de funcionamiento normal del HMII, HVAD y HM321
| Parámetro | HeartMate II | HVAD | HeartMate 3 |
|---|---|---|---|
| Velocidad de la bomba, rpm | 8 000–10 000 | 2 400–3 600 | 5 000–6 000 |
| Flujo de la bomba, l/min | 4–7 | 4-6 | 4–6 |
| Poder de la bomba, W | 5–8 | 3–7 | 4,5–6,5 |
| Índice de pulsatilidad | 5–8 | 2–4 | 3,5–5,5 |
La hemocompatibilidad es el resultado de la interacción entre la bomba y elementos circulatorios en la sangre, que incluye activación plaquetaria y hemólisis asociados entre otros al fenómeno de shear stress, baja pulsatilidad y disfunción microvascular, inflamación sistémica e interacción mecánica entre el dispositivo y el VI. Tales elementos se encuentran dentro de la cadena causal de eventos de trombosis, accidentes cerebrovasculares, y sangrado24.
El uso de LVADs requiere por tanto anticoagulación plena con antagonistas de vitamina K (AVK) y en general también ácido acetilsalicílico en dosis bajas25.
Sin embargo, hacia finales de 2023 el ARIES-HM3 trial, que analizó 589 pacientes en LVAD con HeartMate 3 y anticoagulados con AVK que randomizó 1:1 a aspirina 100mg/día o a placebo, puso de relieve nueva evidencia26. El endpoint primario de dicho estudio fue un compuesto de sobrevida libre de eventos adversos mayores de hemocompatibilidad no quirúrgicos (> 14 días luego del implante, sangrado, accidente cerebrovascular, trombosis de la bomba o embolias arteriales periféricas) a 12 meses luego del implante. Dicha evaluación concluyó que excluir aspirina del régimen antitrombótico es no inferior a terapia dual y está asociada a una disminución del riesgo de eventos de sangrado no quirúrgico (34%) sin aumento significativo del riesgo embólico. Más aún, un reciente análisis de subgrupo en aquellos pacientes que tenían indicación de aspirina previo al implante (PCI previa, cirugía de revascularización coronaria, accidente cerebro vascular o enfermedad arterial oclusiva) confirmó la seguridad de dicha estrategia, no asociándose con aumento del riesgo trombótico, pero sí con una reducción en sangrado no quirúrgico en comparación con quienes recibieron terapia dual27. La evidencia disponible entonces parece indicar que la anticoagulación con AVK en monoterapia es segura en pacientes asistidos con HeartMate 3 y es de esperar la consideración de dichos datos en las guías clínicas respectivas.
Con relación al uso de anticoagulantes directos (DOACs), experiencias previas con dabigatrán en pacientes asistidos con HeartWare (HVAD) demostraron aumento de eventos tromboembólicos28. Sin embargo, en estudios pequeños y con estrictos criterios de selección, el uso de DOACs, en particular apixabán en pacientes asistidos con HeartMate 3ha sugerido ser factible. Se esperan estudios pivotales al respecto29,30.
Los pacientes asistidos con otros dispositivos mantienen la recomendación de anticoagulación con AVK más antiagregación con aspirina, según las especificaciones de sus respectivos fabricantes.
Indicaciones y selección de los candidatosEl manejo de la IC avanzada -definida según los criterios actualizados HFA-ESC- ha mejorado luego de la implementación estandarizada de la GDMT, pero no ha dejado de ser una enfermedad progresiva1,31. Dada la ausencia de un marcador pronóstico o score de riesgo único que permita predecir precozmente la indicación de terapias avanzadas -definidas como trasplante o MCS- en general es necesario tomar múltiples factores en consideración, lo anterior siendo agravado tanto en el mundo desarrollado como en países en desarrollo por una notable demora en derivaciones a centros terciarios con equipos multidisciplinarios de falla cardíaca avanzada, habiendo ya desarrollado complicaciones (disfunción de órgano blanco, caquexia cardíaca, hipertensión pulmonar fija, etc.) o directamente shock cardiogénico, todo lo cual disminuye la sobrevida y la expectativa de resultado general de largo plazo en MCS25.
En general, terapias avanzadas de IC debe ser consideradas cuando a pesar de la terapia convencional, la severidad de los síntomas así lo determinen, así como en aquellos pacientes en los cuales la recuperación de la función ventricular sea improbable y la progresión de la enfermedad determine una perfusión insuficiente de órganos vitales y/o la imposibilidad de mantener una hemodinamia normal13,32. Las indicaciones y contraindicaciones de dispositivos permanentes de asistencia ventricular indicados en las guías norteamericanas y europeas de IC están descritos en la tabla 2.
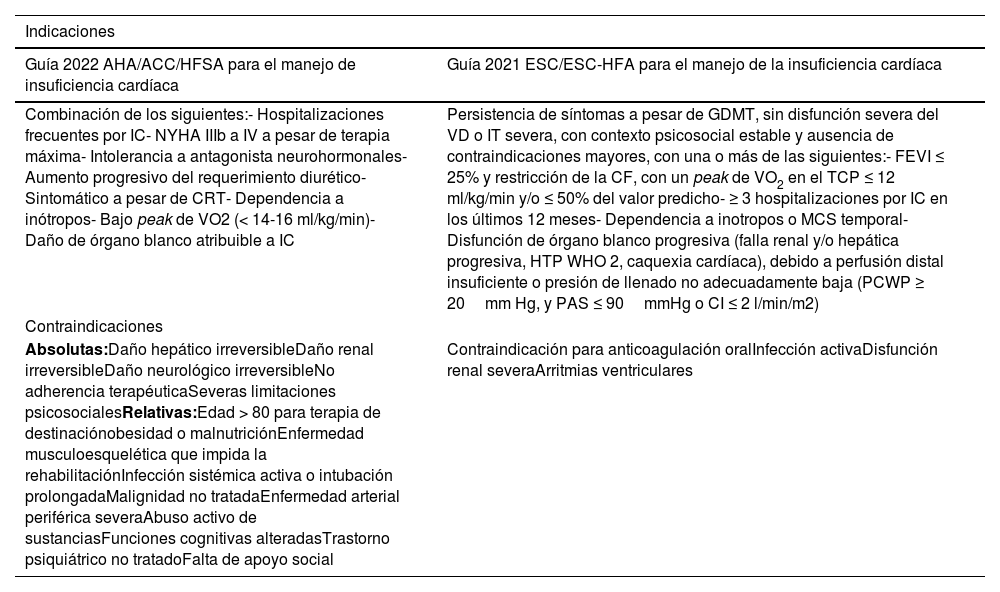
Comparación de las guías norteamericanas (ACC) y europeas (ESC) para la indicación y contraindicación de LVAD3,33
| Indicaciones | |
|---|---|
| Guía 2022 AHA/ACC/HFSA para el manejo de insuficiencia cardíaca | Guía 2021 ESC/ESC-HFA para el manejo de la insuficiencia cardíaca |
| Combinación de los siguientes:- Hospitalizaciones frecuentes por IC- NYHA IIIb a IV a pesar de terapia máxima- Intolerancia a antagonista neurohormonales- Aumento progresivo del requerimiento diurético- Sintomático a pesar de CRT- Dependencia a inótropos- Bajo peak de VO2 (< 14-16 ml/kg/min)- Daño de órgano blanco atribuible a IC | Persistencia de síntomas a pesar de GDMT, sin disfunción severa del VD o IT severa, con contexto psicosocial estable y ausencia de contraindicaciones mayores, con una o más de las siguientes:- FEVI ≤ 25% y restricción de la CF, con un peak de VO2 en el TCP ≤ 12 ml/kg/min y/o ≤ 50% del valor predicho- ≥ 3 hospitalizaciones por IC en los últimos 12 meses- Dependencia a inotropos o MCS temporal- Disfunción de órgano blanco progresiva (falla renal y/o hepática progresiva, HTP WHO 2, caquexia cardíaca), debido a perfusión distal insuficiente o presión de llenado no adecuadamente baja (PCWP ≥ 20mm Hg, y PAS ≤ 90mmHg o CI ≤ 2 l/min/m2) |
| Contraindicaciones | |
| Absolutas:Daño hepático irreversibleDaño renal irreversibleDaño neurológico irreversibleNo adherencia terapéuticaSeveras limitaciones psicosocialesRelativas:Edad > 80 para terapia de destinaciónobesidad o malnutriciónEnfermedad musculoesquelética que impida la rehabilitaciónInfección sistémica activa o intubación prolongadaMalignidad no tratadaEnfermedad arterial periférica severaAbuso activo de sustanciasFunciones cognitivas alteradasTrastorno psiquiátrico no tratadoFalta de apoyo social | Contraindicación para anticoagulación oralInfección activaDisfunción renal severaArritmias ventriculares |
IC: insuficiencia cardíaca; CF: capacidad funcional; HTP: hipertensión pulmonar; WHO: Organización Mundial de la Salud (Clasificación); PCWP: presión capilar pulmonar; PAS: presión arterial sistólica; FEVI: fracción de eyección del ventrículo izquierdo; CRT: terapia de resincronización cardíaca.
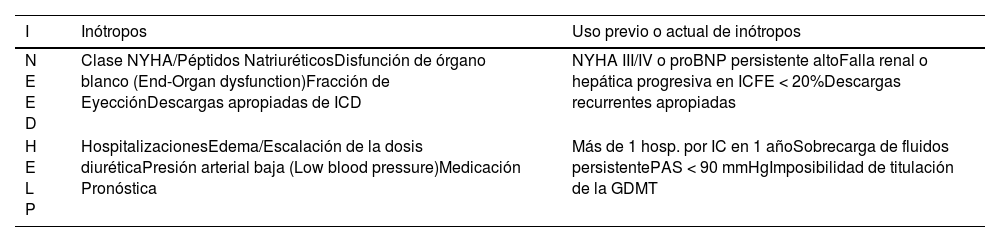
Existen múltiples herramientas disponibles para estratificar el riesgo en pacientes que sufren IC terminal. El acrónimo “I NEED HELP” (tabla 3) colabora en identificar estos pacientes que deben ser referidos a centros terciarios y que serán potencialmente candidatos a terapias avanzadas. Debido a su facilidad de aplicación es extensamente sugerido tanto en la declaración de posición de la ESC HFA, de expertos de ACC en terapia de la IC, así como también en la guía de MCS de la ISHLT1,25,32,34. Es necesario hacer presente que destacados referentes en la IC terminal y asistencia ventricular estiman que aún estos criterios ya indican la derivación en etapas muy tardías de la enfermedad, recalcando la necesidad de referencia precoz a programas de terapia avanzada aún dentro de la ventana dorada de derivación. Ellos sugieren simplemente una regla de 3 factores: (a) hospitalizaciones repetitivas por IC (≥ 2 eventos en un año); (b) ascenso progresivo de la dosis de requerimientos (ej.: aumento de diuréticos de asa más del 50% en los últimos 6 meses); y (c) intolerancia a la terapia neurohormonal con aumento de alteraciones cardiorenales19.
Marcadores de insuficiencia cardíaca avanzada, I NEED HELP34
| I | Inótropos | Uso previo o actual de inótropos |
|---|---|---|
| N E E D | Clase NYHA/Péptidos NatriuréticosDisfunción de órgano blanco (End-Organ dysfunction)Fracción de EyecciónDescargas apropiadas de ICD | NYHA III/IV o proBNP persistente altoFalla renal o hepática progresiva en ICFE < 20%Descargas recurrentes apropiadas |
| H E L P | HospitalizacionesEdema/Escalación de la dosis diuréticaPresión arterial baja (Low blood pressure)Medicación Pronóstica | Más de 1 hosp. por IC en 1 añoSobrecarga de fluidos persistentePAS < 90 mmHgImposibilidad de titulación de la GDMT |
Abreviaturas: NYHA: new york heart association; ICD: implantable cardioverter-defibrillator; IC: insuficiencia cardíaca; GDMT: Guideline-Directed Medical Therapy; FE: fracción de eyección; PAS: presión arterial sistólica.
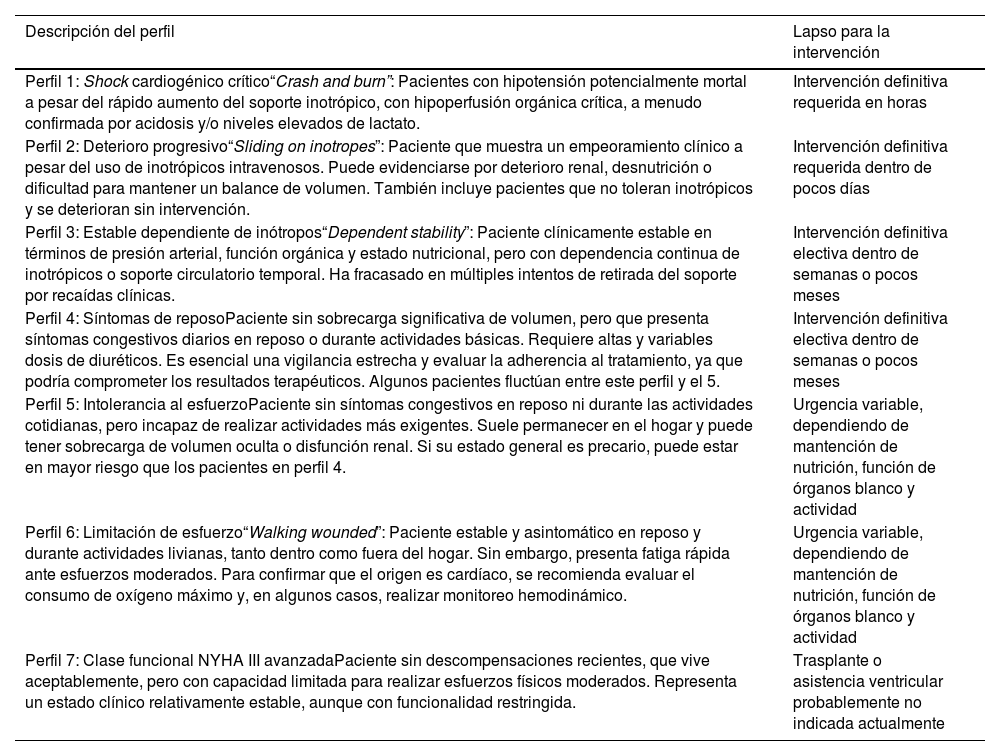
Clasificación de perfiles clínicos INTERMACS35
| Descripción del perfil | Lapso para la intervención |
|---|---|
| Perfil 1: Shock cardiogénico crítico“Crash and burn”: Pacientes con hipotensión potencialmente mortal a pesar del rápido aumento del soporte inotrópico, con hipoperfusión orgánica crítica, a menudo confirmada por acidosis y/o niveles elevados de lactato. | Intervención definitiva requerida en horas |
| Perfil 2: Deterioro progresivo“Sliding on inotropes”: Paciente que muestra un empeoramiento clínico a pesar del uso de inotrópicos intravenosos. Puede evidenciarse por deterioro renal, desnutrición o dificultad para mantener un balance de volumen. También incluye pacientes que no toleran inotrópicos y se deterioran sin intervención. | Intervención definitiva requerida dentro de pocos días |
| Perfil 3: Estable dependiente de inótropos“Dependent stability”: Paciente clínicamente estable en términos de presión arterial, función orgánica y estado nutricional, pero con dependencia continua de inotrópicos o soporte circulatorio temporal. Ha fracasado en múltiples intentos de retirada del soporte por recaídas clínicas. | Intervención definitiva electiva dentro de semanas o pocos meses |
| Perfil 4: Síntomas de reposoPaciente sin sobrecarga significativa de volumen, pero que presenta síntomas congestivos diarios en reposo o durante actividades básicas. Requiere altas y variables dosis de diuréticos. Es esencial una vigilancia estrecha y evaluar la adherencia al tratamiento, ya que podría comprometer los resultados terapéuticos. Algunos pacientes fluctúan entre este perfil y el 5. | Intervención definitiva electiva dentro de semanas o pocos meses |
| Perfil 5: Intolerancia al esfuerzoPaciente sin síntomas congestivos en reposo ni durante las actividades cotidianas, pero incapaz de realizar actividades más exigentes. Suele permanecer en el hogar y puede tener sobrecarga de volumen oculta o disfunción renal. Si su estado general es precario, puede estar en mayor riesgo que los pacientes en perfil 4. | Urgencia variable, dependiendo de mantención de nutrición, función de órganos blanco y actividad |
| Perfil 6: Limitación de esfuerzo“Walking wounded”: Paciente estable y asintomático en reposo y durante actividades livianas, tanto dentro como fuera del hogar. Sin embargo, presenta fatiga rápida ante esfuerzos moderados. Para confirmar que el origen es cardíaco, se recomienda evaluar el consumo de oxígeno máximo y, en algunos casos, realizar monitoreo hemodinámico. | Urgencia variable, dependiendo de mantención de nutrición, función de órganos blanco y actividad |
| Perfil 7: Clase funcional NYHA III avanzadaPaciente sin descompensaciones recientes, que vive aceptablemente, pero con capacidad limitada para realizar esfuerzos físicos moderados. Representa un estado clínico relativamente estable, aunque con funcionalidad restringida. | Trasplante o asistencia ventricular probablemente no indicada actualmente |
Modificadores:
- •
(TCS) MCS transitorio: Puede modificar sólo pacientes en setting hospitalario
- •
Arritmias: Puede modificar cualquier perfil. Arritmias ventriculares recurrentes pueden generar considerable compromiso clínico. Esto incluye descargas frecuentes de ICD.
- •
(FF) “Frequent flyer”: Puede modificar sólo pacientes ambulatorios, designando un paciente que requiere frecuentemente consultas en servicios de urgencia y hospitalizaciones para recompensación con diuréticos, ultrafiltración o terapia vasoactiva transitoria.
La clasificación según los perfiles INTERMACS de los pacientes considerados para MCS es internacionalmente aceptada y extensamente utilizada en la práctica clínica, pues permite con claridad establecer el escenario de acuerdo con la presentación clínica y terapia necesaria, ordenada por gravedad (tabla 5)35. En dichos términos, los pacientes que más se benefician de la terapia en términos de sobrevida son los perfiles 1 a 3. El perfil 4 pudiera también beneficiarse de LVAD, si bien la recomendación de la ISHLT es de menor grado25. El último reporte de INTERMACS informó que el perfil 3 constituyó la mayor proporción de pacientes implantados (37,2%) y que tuvieron la mayor tasa de sobrevida a 1 (88,1%) y a 5 años (62,6%), que se compara con la tasa de sobrevida a 5 años de los pacientes implantados en shock cardiogénico (perfil 1), que fue de 56,4%13.
Estrategias para la implantación de un dispositivo de asistencia ventricular. Modificado de Schulze et al. (2022)37
| Puente a trasplanteBridge to transplant (BTT) | Utilización de un dispositivo de MCS para estabilización de un paciente con alto riesgo de mortalidad hasta el trasplante cardíaco |
| Puente a decisiónBridge to decision (BTD) | Utilización de un dispositivo de MCS para mejorar disfunción de órgano blanco y evaluación de un paciente primariamente no candidato a trasplante cardíaco |
| Puente a recuperaciónBridge to recovery (BTR) | Utilización de un dispositivo de MCS para estabilización de la función ventricular de un paciente hasta la explantación del LVAD |
| Terapia de destinaciónDestination therapy (DT) | Implantación permanente de un LVAD o TAH como alternativa al trasplante en pacientes con IC terminal sin opción a él |
La indicación de implantación de un dispositivo de MCS debe insertarse dentro del contexto clínico del paciente, de su pronóstico y debe ser un paso concatenado dentro del tren de decisiones terapéuticas lógicas de mediano y largo plazo. Es por eso que una forma estandarizada de nomenclatura es definir con qué intención o estrategia se llevará ésta adelante, lo que se encuentra descrito con más detalle en la tabla 5.
En general, 2 indicaciones mayores de LVAD que son aceptadas en la regulación norteamericana y europea, es el puente a trasplante cardíaco y la terapia de destinación. En el registro INTERMACS de los pacientes implantados con dispositivos de levitación completamente magnética entre 2018 a 2023 el 16,2% lo fue como puente a trasplante (enlistado), el 7,5% como puente a decisión -a ser candidato a trasplante- y 74,4% como terapia de destinación. Notablemente la proporción de pacientes implantados con esta estrategia ha aumentado de forma progresiva, siendo 49,5% de los pacientes entre 2014 y 201713. La situación reportada en el registro EUROMACS es algo distinta siendo el 30,6% de los pacientes implantados como puente a trasplante, 35,3% como puente a decisión -posible puente a trasplante- y un 27,5% a terapia de destinación36.
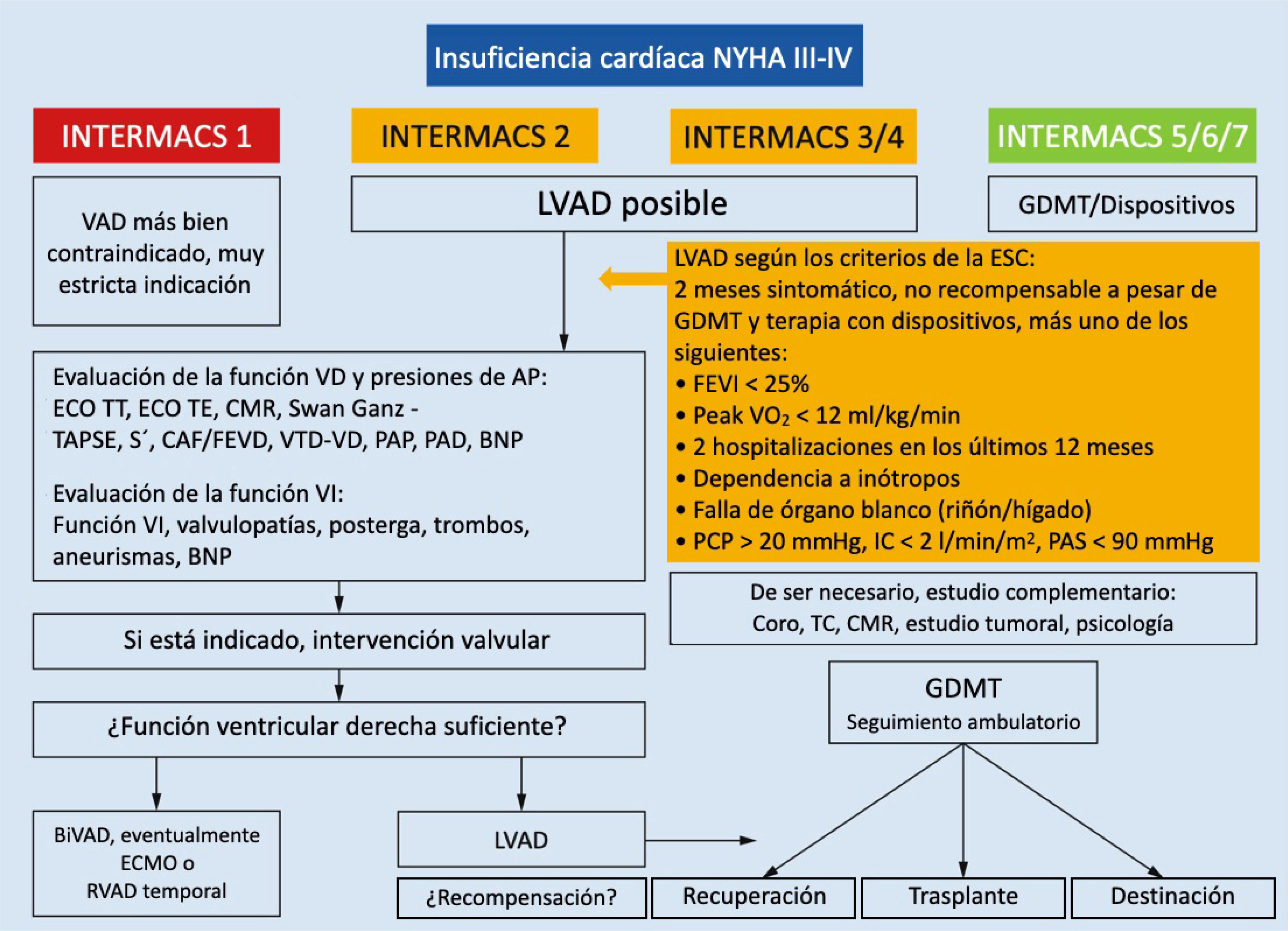
Existen múltiples algoritmos para la toma de decisión del implante de LVAD sugeridos por sociedades científicas internacionales. En la figura 2 se presenta una sugerencia conjunta de la Sociedad Alemana de Cardiología (DGK) y de Cirugía Cardíaca (DGTHG) sobre el tema37.
Toma de decisiones para el implante de LVAD37.
Abreviaciones: VAD: Ventricular Assist Device; LVAD: Left Ventricular Assist Device; RVAD: Right Ventricular Assist Device; BiVAD: Bi Ventricular Assist Device; GDMT: Guideline-Directed medical Therapy; FEVI: Fracción de Eyección Ventricular Izquierda; PCP: Presión Capilar Pulmonar; PAS: Presión Arterial Sistólica; IC: Insuficiencia Cardíaca; VD: Ventrículo Derecho; ECO TT: Ecocardiograma Transtorácico. ECO TE: Ecocardiograma Transesofágico; AP: Arteria Pulmonar; PAP: Presión Arterial Pulmonar; TAPSE: Tricuspid Annular Plane Systolic Excursion; CMR: Cardiac Magnetic Resonance; CAF/FEDV: Cambio de Área Fraccional/Fracción de Eyección Ventrículo Derecho; BNP: Péptido Natriurético tipo B; PAD: Presión Arterial Diastólica.
En relación con el pronóstico en LVAD específicamente se han publicado con las cohortes de validación de HeartMate II y HeartMate 3, respectivas herramientas para predecir la sobrevida38,39. Éste último, el “HM3 Survival Risk Score” consideró el total de los 2 200 pacientes del estudio pivotal y toma en consideración múltiples predictores: 2 variables demográficas (la edad y la realización previa de cirugía de revascularización coronaria o procedimiento valvular), 2 parámetros de laboratorio (la natremia y el nitrógeno ureico en sangre), 1 parámetro ecocardiográfico (la ausencia de dilatación ventricular izquierda estimada con parámetros lineales (< 55mm)) y 1 parámetro hemodinámico invasivo (la relación entre la presión de la aurícula derecha y la presión de capilar pulmonar, RAP/PCWP). Dicha herramienta lograría predecir mortalidad a 1 y 2 años luego de la implantación de un dispositivo de levitación completamente magnética. Es esperado con interés la evaluación en el futuro del comportamiento de esta fórmula para predecir la sobrevida de la terapia de LVAD de “ultra larga duración”, definida como mayor a 5 años.
La evaluación hemodinámica invasiva mediante la realización de un estudio de cateterismo derecho es también mandatoria en los pacientes considerados para implante de un LVAD, para determinar el nivel de disfunción ventricular derecha y entregar información con relación a la probabilidad de soporte inotrópico y/o soporte ventricular derecho transitorio postoperatorio25. Una falla cardíaca derecha severa precoz genera en principio un efecto concatenado de disociación entre el ventrículo derecho y la arteria pulmonar secundarios a cambios tanto transitorios como estructurales y que redundan en aumento del retorno venoso proveído luego del inicio del soporte circulatorio mecánico40.
El estudio invasivo permite la determinación de presencia de hipertensión pulmonar y su clasificación (pre-, post-capilar o combinada), así como también las presiones de llenado41. En general la recompensación previa al implante electivo debería incluir una terapia diurética con el objetivo de lograr una presión venosa central menor a 15mmHg, que puede incluir bloqueo secuencial de la nefrona en pacientes con resistencia diurética o respuesta subóptima a monoterapia42,43.
La medición de la relación entre la presión de la aurícula derecha y la presión de capilar pulmonar (RAP/PCWP) ha sido una referencia para predecir una falla cardíaca derecha aguda luego de la implantación de un LVAD, si bien el fenómeno de la interacción del corazón derecho es multifactorial. Dentro de las múltiples fórmulas descritas para cuantificar postcarga del ventrículo derecho (resistencia vascular pulmonar, compliance de arteria pulmonar, gradiente transpulmonar medio y diastólico, entre otras), el índice de pulsatilidad de la arteria pulmonar (PAPi) ha demostrado ser en la práctica un marcador confiable de falla cardíaca derecha aguda luego de la implantación de un LVAD, siendo un valor <1,85 +/- 0,1 asociado con mayor riesgo44.
Consideraciones biopsicosocialesExisten en general 5 dominios del riesgo biopsicosocial que han sido previamente descritos en pacientes con falla cardíaca avanzada, a saber: la función cognitiva, adherencia a la terapia, psicopatología, soporte social y abuso de sustancias. De acuerdo con una evaluación de los pacientes en cf-LVAD en el registro INTERMACS, un 20,5% tienen uno o más factores de riesgo psicosocial, siendo más prevalente el abuso de sustancias (12,6%; 7,9% abuso de alcohol y 7,6% abuso de otras sustancias).
Si bien en general el riesgo biopsicosocial no está asociado directamente con aumento de la mortalidad en LVAD, su presencia sí determina un aumento del riesgo de complicaciones como infecciones del dispositivo, sangrado gastrointestinal, trombosis de la bomba. Por lo anterior, la presencia de riesgo psicosocial no debería constituir por sí sola una contraindicación absoluta a esta terapia, sin perjuicio de que forma parte integral de la evaluación, selección del candidato y seguimiento45.
ComplicacionesSangradoEl sangrado es el evento adverso más frecuente en la etapa perioperatoria precoz y es una complicación frecuente en el período posterior12. El origen más frecuente de causa tardía es el sangrado gastrointestinal (SGI), con una prevalencia que oscila entre el 20 y el 35%. Si bien la relación entre SGI y aumento de la mortalidad en LVAD no ha sido claramente identificada, se encuentra asociada a aumento de las hospitalizaciones, morbilidad, eventos tromboembólicos y aumento de los costos de atención de salud46. Múltiples mecanismos han sido propuestos, entre otros la necesidad de terapia anticoagulante y antiagregante, el síndrome de von Willebrand adquirido (tipo IIa) atribuible al flujo continuo, la aparición de angiodisplasias y la señalización de la cascada de la angiogénesis. Sin embargo, cada mecanismo por separado parece jugar un rol47.
InfeccionesQuizás la principal debilidad aún de la asistencia con LVAD es la necesidad de la existencia del driveline que discurre transcutáneo, constituyéndose en una puerta de entrada para infecciones que, consecuentemente, determina pérdida de calidad de vida, morbilidad y mortalidad48. La formación de biofilm, definido como comunidades de microorganismos adosados a cualquier superficie y/o en dispositivos médicos, hace que la erradicación de la infección sea a menudo difícil. Las causas más frecuentes de infecciones del driveline son Staphlylococcus spp., seguido de Pseudomonas aeruginosa, otras bacterias y Candida spp49. A diferencia de otras características asociadas a la hemocompatibilidad, las tasas de infección asociadas al LVAD no han mejorado con el HeartMate 3, que tiene un driveline más ancho, pesado y grueso que HeartWare.
En términos generales, las infecciones se pueden dividir en superficiales -habitualmente comprometiendo el canal donde discurre el driveline, pero sin compromiso de estructuras profundas o de la bomba propiamente tal- y profundas -que incluyen una infección del torrente sanguíneo LVAD-específica, una endocarditis del dispositivo e infección de las superficies externas de un dispositivo implantable- con sus correspondientes complicaciones, entre ellas mediastinitis. Una infección profunda del dispositivo constituye formalmente según las normas de Eurotransplant indicación de trasplante cardíaco en alta urgencia.
Trombosis de la bombaLos eventos de trombosis de la bomba han decrecido progresivamente luego de las innovaciones incluidas en el diseño del HeartMate 3. En el estudio pivotal MOMENTUM 3 la incidencia de trombosis del LVAD sospechada o confirmada en pacientes asistidos con HeartMate 3 vs. HeartMate II fue de 7 pacientes (1,5%) versus 10 pacientes (13,9%), (p<0,001)50. El tratamiento de esta complicación potencialmente catastrófica puede incluir trombolíticos y de no ser suficiente, el recambio del dispositivo de urgencia.
Eventos neurológicosForma parte de las complicaciones más temidas e históricamente la causa más frecuente de mortalidad de largo plazo en cf-LVAD. Luego de la introducción de los dispositivos de levitación completamente magnética se ha observado una disminución de estos eventos. El reporte final del MOMENTUM 3 a dos años demostró 0,08 eventos por paciente/año con HeartMate 3 y 0,18 con HeartMate II (<0,001), tendencia que se confirmó en el seguimiento a 5 años de la misma cohorte15,50. Se espera una caída consistente en el tiempo en los próximos años de esta complicación12.
Falla cardíaca derechaLa falla cardíaca derecha post implante continúa siendo una preocupación mayor. El uso de RVAD, especialmente retrasado en relación con el implante del LVAD ha sido asociado con peores resultados asociado a LVAD primario. Sin embargo, en el último tiempo el implante de LVAD asociado con soporte ventricular derecho transitorio se ha asociado con un significativo aumento de la sobrevida a 1 y 5 años comparado con datos históricos. Sigue siendo una tarea refinar las herramientas predictivas y de optimización del VD en el perioperatorio para optimizar los resultados a largo plazo13.
Insuficiencia aórticaUna de las características únicas que puede aparecer luego de la implantación de un cf-LVAD es la aparición de novo de insuficiencia aórtica (IA) que, durante esta terapia puede generar un flujo circular con una porción del volumen eyectado regurgitado nuevamente al VI y una vez más a la bomba, generando flujo anterógrado inefectivo, mala perfusión distal y aumento de las presiones de llenado del VI51. Actualmente, los cirujanos cardíacos prefieren en conjunto con la implantación del LVAD realizar un recambio valvular aórtico con prótesis biológica en presencia de IA preoperatoria, más que ocluir la válvula propiamente tal. Al ocurrir una IA luego de la implantación las opciones son una cirugía abierta (SAVR), que conlleva mayor riesgo quirúrgico en pacientes regularmente con múltiples patologías, de tal manera que existiría un campo para recambio valvular percutáneo (TAVR). Recientemente se inició el registro ALIGN-AR LVAD (JENA-VAD) que estudia una válvula autoexpandible de implantación supraanular (JenaValve Trilogie©), por lo que se esperan sus resultados para 202752.
Resultados clínicosDesde la publicación del REMATCH trial en 2001 la sobrevida durante asistencia en LVAD ha mejorado ostensiblemente53. De la cohorte del estudio MOMENTUM 3 la sobrevida libre de eventos reportada fue de 74,7% a 2 años y sobrevida general de un 58,4% a los 5 años de seguimiento50,54. Estos datos son consistentes con los hallazgos del registro europeo ELEVATE, que considera únicamente dispositivos de levitación completamente magnética, con una sobrevida general a 2 años de 83,4% (95% CI, 79,7%-86,8%) y de 63,3% (95% CI, 58,2%-67,9%) a 5 años16. En el mismo sentido, el último reporte INTERMACS informó que los pacientes menores de 50 años con dispositivos similares tienen una sobrevida de 72,6% a 5 años de seguimiento post implante, con una sobrevida a 1 año libre de ACV del 94%, libre de sangrado de un 82,4% y libre de disfunción del dispositivo del 97%, no existiendo diferencias significativas en los resultados al comparar por sexo (p=0,22); etnicidad (p=0,34), riesgo psicosocial (p=0,10) o soporte social (p=0,28), lo que lo hace una estrategia particularmente plausible en este grupo etario13.
Sin embargo, el gold standard y única terapia curativa para la IC terminal sigue siendo el trasplante cardíaco, con sobrevidas generales informadas de 86% a 1 año, 79% a 3 años, 72% a 5 años y 53% a 10 años55,56.
Innovaciones y futuro del LVADLa terapia con cf-LVAD tiene aún retos relevantes. Como ya fue mencionado, las infecciones asociadas al driveline continúan siendo una de las causas principales de complicaciones, por lo que la comunidad médica apoya y espera el desarrollo de dispositivos más pequeños, con menor uso de energía y sin requerir cables externos, así como también con capacidad de adaptación fisiológica para suplir las demandas fisiológicas de un estilo de vida activo y de superficies biocompatibles para disminuir los requerimientos de anticoagulación.
ConclusionesLa asistencia ventricular de larga duración ha revolucionado el tratamiento de la IC avanzada, siendo una estrategia que mejora tanto sobrevida como calidad de vida en pacientes en espera de trasplante cardíaco o en aquellos que tienen contraindicaciones para él.
Si bien el trasplante cardíaco continúa siendo la terapia de elección y el LVAD todavía enfrenta desafíos importantes -como la incidencia de infecciones- es difícil encontrar en la medicina otra área con desarrollo y resultados tan promisorios: el LVAD mejora la sobrevida en el corto y mediano plazo, acercándose a los datos de trasplante cardíaco a los 5 años en el caso de los pacientes jóvenes (<50 años), siendo en cualquier escenario categóricamente superior que la terapia médica óptima.
Es por ello que la oportuna derivación a centros terciarios de IC y la evaluación de candidatura para una oportuna implantación de un cf-LVAD o enlistamiento para trasplante cardíaco deben ser materia de preocupación constante de la totalidad del equipo multidisciplinario a cargo del manejo de esta población de pacientes, de manera tal de no perder la ventana dorada de intervención.
Aunque la mirada está puesta en un futuro con dispositivos más sofisticados -como bombas totalmente implantables y de bajo consumo de energía-, no debe perderse de vista un hecho esencial: la terapia de LVAD ya no es una promesa futura en desarrollo sino una realidad terapéutica actual. Hoy, estos dispositivos son una herramienta que salva vidas, capaz de ofrecer tiempo, esperanza, así como también funcionalidad y autonomía a pacientes que, de otra manera, enfrentan un pronóstico sombrío.
Declaración de conflictos de interésLos autores declaran no tener conflictos de interés.
Referencia no citada[33].