La pericarditis constrictiva es una causa infrecuente, aunque potencialmente curable, de insuficiencia cardíaca con fracción de eyección preservada. Resulta de un proceso de inflamación y fibrosis pericárdica, cuyo diagnóstico representa un reto clínico por la necesidad de distinguirla de otras entidades, en particular la miocardiopatía restrictiva. La pérdida de elasticidad del pericardio genera limitación al llenado diastólico y congestión venosa sistémica, sustentada en dos mecanismos fisiopatológicos clave: la disociación entre presiones intratorácicas e intracardíacas y la interdependencia ventricular aumentada.
Las herramientas de imagen son fundamentales para su identificación. La ecocardiografía Doppler revela patrones de llenado restrictivo, rebote septal y variaciones respiratorias marcadas, mientras que la resonancia cardíaca permite caracterizar inflamación activa y fibrosis.
El tratamiento depende de la fase evolutiva: los casos con inflamación activa pueden responder a terapia antiinflamatoria, en tanto que la constricción crónica requiere pericardiectomía radical, la cual debe ser completa para garantizar resultados óptimos a largo plazo.
El presente trabajo revisa los aspectos fisiopatológicos, diagnósticos y terapéuticos de la pericarditis constrictiva, destacando su relevancia como diagnóstico diferencial en pacientes con insuficiencia cardíaca y fracción de eyección preservada.
Constrictive pericarditis is an uncommon but potentially curable cause of heart failure with preserved ejection fraction. It results from pericardial inflammation and fibrosis, and its diagnosis remains challenging due to the need to differentiate it from other entities, particularly restrictive cardiomyopathy. Loss of pericardial compliance leads to impaired diastolic filling and systemic venous congestion, explained by two key pathophysiological mechanisms: dissociation between intrathoracic and intracardiac pressures, and enhanced ventricular interdependence.
Imaging techniques are essential for diagnosis. Doppler echocardiography typically demonstrates restrictive filling patterns, septal bounce, and marked respiratory variation, while cardiac magnetic resonance provides detailed assessment of active inflammation and pericardial fibrosis.
Therapeutic strategies depend on disease stage: cases with active inflammation may respond to anti-inflammatory therapy, whereas chronic constriction requires radical pericardiectomy, which must be complete to achieve optimal long-term outcomes.
This review summarizes current knowledge on the pathophysiology, diagnostic approach, and management of constrictive pericarditis, highlighting its importance as a differential diagnosis in patients with heart failure and preserved ejection fraction.
La pericarditis constrictiva (PC) es consecuencia de la inflamación y fibrosis del pericardio, lo que genera restricción del llenado diastólico e insuficiencia cardíaca. Su diagnóstico, a menudo desafiante, debe considerarse dentro de las causas de insuficiencia cardíaca con fracción de eyección preservada, ya que se trata de una entidad con un enfoque terapéutico diferente y potencialmente curable.
El objetivo del presente trabajo es brindar una revisión actualizada de la PC, desde sus aspectos fisiopatológicos hasta el diagnóstico y tratamiento, planteando dicha entidad como un diagnóstico diferencial dentro de los síndromes de insuficiencia cardíaca.
EtiologíaHistóricamente, la pericarditis tuberculosa fue la primera causa de pericarditis constrictiva, situación que, en la actualidad, solo se mantiene en zonas endémicas. La mayoría de las series actuales a nivel global observan como causas principales a la idiopática, post cirugía cardíaca y post radioterapia. Estos números se reproducen en centros de referencia de Sudamérica, como la serie de Fundación Favaloro donde el 68% de las PC fueron de origen idiopático1.
El riesgo global de desarrollar PC luego de un episodio de pericarditis aguda es del 1,8%, siendo menos frecuente cuando es una pericarditis aguda viral o idiopática (<0,5%) y más frecuente con otras etiologías específicas2.
Dentro del resto de causas hay que considerar a las reumatológicas, neoplásicas, infecciosas, las derivadas de complicaciones traumáticas por colocación de dispositivos intracardíacos como marcapasos u otras más raras como enfermedad por IgG43.
FisiopatologíaEn la pericarditis constrictiva, el pericardio pierde su habitual elasticidad por incremento de la fibrosis y calcificación en los estadios avanzadas. Si bien es frecuente encontrarlo engrosado, en un 18% de los casos el grosor puede ser normal4. En las presentaciones subagudas lo que prima es la inflamación por sobre la calcificación.
En la pericarditis constrictiva, la rigidez del pericardio restringe el llenado cardíaco. Existe una fase inicial normal que cesa abruptamente en la diástole temprana con el repentino aumento de las presiones intracardíacas debido al encarcelamiento provocado por un pericardio rígido. Dicho evento hemodinámico ocasiona la elevación de las presiones diastólicas en las cuatro cavidades cardíacas y se evidencia con el clásico patrón dip-plateau en la curva de presión ventricular5.
Dos son las características fisiopatológicas que distinguen a la fisiología de constricción pericárdica; primero, la disociación de presiones intracardíacas e intratorácicas y, segundo, el incremento de la interdependencia ventricular5.
La disociación entre las presiones intratorácicas e intracardíacas da lugar a variaciones respiratorias en la presión diastólica de llenado a través de la válvula mitral. En un corazón con pericardio normal, la inspiración provoca una disminución de la presión intratorácica, la cual se transmite a las cavidades cardíacas. De este modo, durante el ciclo respiratorio, no se producen cambios significativos en la presión de llenado desde los pulmones, a través de las venas pulmonares, hacia la aurícula izquierda y a través de la válvula mitral hacia el ventrículo izquierdo. Por el contrario, en la pericarditis constrictiva, el pericardio rígido impide la transmisión de la disminución de la presión intratorácica a las cavidades cardíacas izquierdas. Durante la inspiración, las venas pulmonares -de localización extrapericárdica- disminuyen su presión, lo que no ocurre en el corazón izquierdo intrapericárdico aislado. Este fenómeno se traduce en un menor gradiente de presiones y, por tanto, menor llenado de cavidades izquierdas1.
El aumento de la interdependencia ventricular es otro efecto del encarcelamiento pericárdico sobre las cavidades cardíacas. En un paciente con pericarditis constrictiva, durante la inspiración el ventrículo izquierdo se llena de menos, con un incremento recíproco en el llenado del ventrículo derecho. A la inversa, durante la espiración se observa una disminución del llenado del ventrículo derecho y un aumento del llenado del ventrículo izquierdo. En un paciente con pericardio normal, durante la inspiración puede haber un aumento del llenado del ventrículo derecho debido al incremento del retorno venoso, pero el llenado del ventrículo izquierdo permanece sin cambios significativos a lo largo del ciclo respiratorio5.
Estas variaciones dinámicas durante el ciclo respiratorio son útiles para diferenciar la pericarditis constrictiva de la miocardiopatía restrictiva y serán la clave diagnóstica en los distintos métodos complementarios.
Manifestaciones clínicasLos pacientes con pericarditis constrictiva suelen desarrollar un síndrome de insuficiencia cardíaca de inicio insidioso, en el cual la disnea de esfuerzo y el edema constituyen las características más frecuentes. Con menor frecuencia, los pacientes pueden presentar molestia torácica, síntomas abdominales, arritmias auriculares, derrame pleural recurrente o manifestaciones compatibles con enfermedad hepática y ascitis6.
Casi todos los pacientes con pericarditis constrictiva presentan una presión venosa aumentada, lo que convierte a la evaluación de la onda yugular en uno de los componentes más relevantes del examen físico. Además de estar elevada, la morfología de la onda venosa se caracteriza por una pronunciada y profunda onda que refleja una fase rápida de llenado ventricular diastólico precoz. Una onda y rápida y profunda, que llega a ser más prominente que la onda X, se conoce como el signo de Friedreich (presente también en la fisiología restrictiva). La presión venosa yugular puede aumentar durante la inspiración, fenómeno conocido como signo de Kussmaul. Puede auscultarse también un “knock” pericárdico (ruido diastólico precoz)6.
Ocasionalmente, algunos pacientes con pericarditis constrictiva pueden no presentar una presión venosa yugular elevada. Esta situación puede observarse cuando el proceso constrictivo es leve, o si el paciente se encuentra en un estado de hipovolemia. En estos casos de constricción oculta, puede ser necesario realizar una expansión de volumen para evidenciar la hemodinamia característica de la pericarditis constrictiva5.
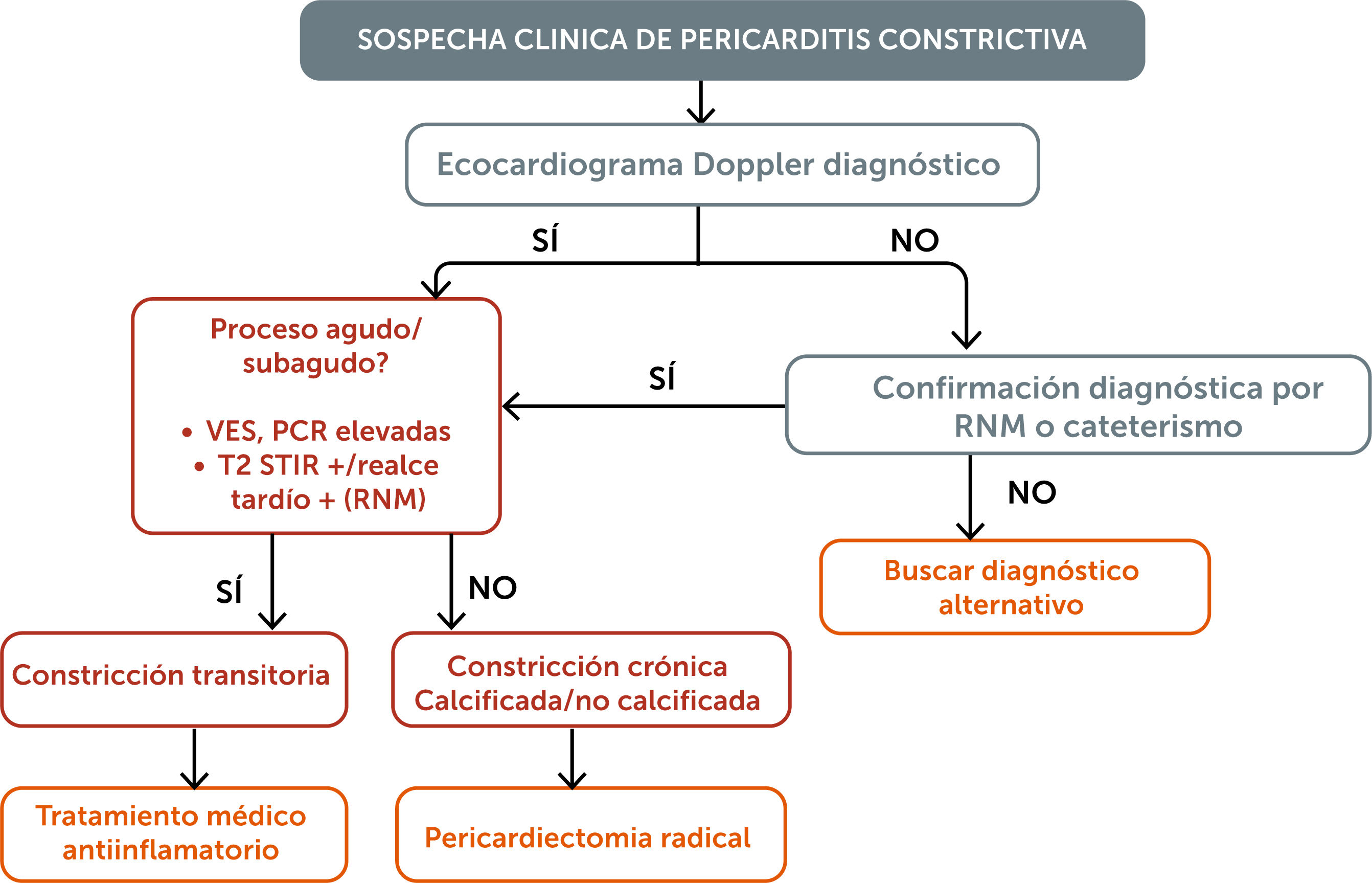
Evaluación diagnósticaLa pericarditis constrictiva suele no ser evidente en las pruebas diagnósticas estándar. Parte de la dificultad para establecer el diagnóstico radica en que la pericarditis constrictiva puede imitar otras causas de insuficiencia cardíaca, así como enfermedades pulmonares o hepáticas. Esta condición debe ser considerada en pacientes que se presentan con insuficiencia cardíaca de origen no claramente explicado, derrame pleural, ingurgitación yugular, edema periférico o alteraciones hepáticas. Debiera figurar siempre como una posibilidad cuando se baraja el diagnóstico de insuficiencia cardíaca con fracción de eyección preservada luego de haber descartado otros simuladores como miocardiopatías infiltrativas, miocardiopatía hipertrófica, enfermedades valvulares o insuficiencia cardíaca de alto gasto7.
El principal diagnóstico diferencial en estos casos es la miocardiopatía restrictiva, debido a las similitudes tanto en la presentación clínica como en los hallazgos hemodinámicos. Esta sospecha clínica adquiere mayor relevancia en pacientes con antecedentes de cirugía cardíaca, irradiación torácica o pericarditis previa.
La disfunción ventricular derecha severa también debe ser considerada en el diagnóstico diferencial de la pericarditis constrictiva. El signo de Kussmaul puede estar presente en cualquier causa de insuficiencia cardíaca derecha avanzada, independientemente de su etiología.
Por otro lado, una disminución de más de 10mmHg en la presión sistólica durante la inspiración —conocida como pulsus paradoxus— es un hallazgo frecuente en pacientes con taponamiento cardíaco, pero también puede observarse en otras condiciones como la obstrucción de la vena cava superior, el asma, la enfermedad pulmonar obstructiva, la embolia pulmonar y el shock cardiogénico7.
Una regurgitación tricuspídea masiva con flujo laminar, que puede pasar desapercibida en la evaluación ecocardiográfica convencional, constituye otro hallazgo que puede simular los efectos hemodinámicos de la pericarditis constrictiva. No obstante, es importante tener en cuenta que una regurgitación tricuspídea severa puede coexistir con pericarditis constrictiva, lo que añade complejidad al diagnóstico clínico y ecocardiográfico7.
Reconocer estas señales puede orientar el diagnóstico y diferenciar la pericarditis constrictiva de otras entidades clínicas, especialmente de la miocardiopatía restrictiva, con la que guarda importantes similitudes fisiopatológicas.
Ecocardiograma dopplerLa ecocardiografía transtorácica suele ser el estudio inicial en pacientes con sospecha de pericarditis constrictiva, ya que permite identificar los elementos propios de la fisiología de constricción. En cualquier paciente que esté siendo evaluado por insuficiencia cardíaca, el hallazgo de un movimiento septal anormal o disfunción diastólica con una velocidad e’ del anillo mitral conservada o aumentada, debe hacer sospechar pericarditis constrictiva. Si estos hallazgos son consistentes con la evaluación clínica, la ecocardiografía podría ser suficiente para confirmar el diagnóstico, como ocurre en aproximadamente el 75% de los pacientes evaluados en la Clínica Mayo8.
El desplazamiento del septum interventricular durante la respiración espontanea con la consiguiente variación de tamaño de los ventrículos, las velocidades de flujo a través de las válvulas auriculoventriculares y en las venas hepáticas y pulmonares, debida a la disociación entre las presiones intratorácicas e intracardíacas y al aumento de la interdependencia ventricular, apoya el diagnóstico de constricción5.
En aproximadamente el 80% de los pacientes con constricción se observa una muesca septal diastólica temprana en el modo M de la ecocardiografía, característica de un “rebote” o sacudida septal diastólica (bounce)8. El rebote septal indica un desplazamiento abrupto del septo interventricular en la diástole temprana de cada ciclo cardíaco (fenómeno latido a latido) y difiere del movimiento septal respiratorio, que describe el desplazamiento posterior del septo durante la inspiración. El cateterismo hemodinámico simultáneo con ecocardiografía en modo M ha demostrado que el rebote septal se relaciona con un aumento abrupto de la presión ventricular derecha en la diástole temprana, que supera la presión diastólica del ventrículo izquierdo durante el ciclo cardíaco en pacientes con pericarditis constrictiva9.
Debido a que la presión de llenado está elevada en la pericarditis constrictiva, las velocidades de llenado mitral y tricuspídeo suelen mostrar un patrón restrictivo o pseudonormalizado (es decir, la relación del flujo mitral [E/A] >0,8). Se ha informado una variación del 25% en la velocidad E mitral con la respiración como criterio diagnóstico en los pacientes con constricción. Sin embargo, cerca de un tercio de los pacientes con pericarditis constrictiva podrían no mostrar esta variación respiratoria10.
Un e’ medial mitral conservado o aumentado tiene un valor diagnóstico adicional para la constricción (en contraste con la restricción, donde la velocidad e’ es <7cm/s)11. Este fenómeno se ha denominado “annulus paradoxus” porque, en la constricción pericárdica, el e’ aumenta a medida que lo hacen las presiones de llenado, de forma paradójica respecto a lo que ocurre en las enfermedades miocárdicas, donde el e’ disminuye con el deterioro miocárdico. Evaluar la presencia de “annulus reversus” (es decir, e’ medial mayor que el lateral) es otro signo útil para el diagnóstico de pericarditis constrictiva.
La inversión del flujo en la vena suprahepática es el parámetro ecocardiográfico más específico para la constricción. Debido a la interdependencia ventricular en pacientes con pericarditis constrictiva, durante la espiración ocurre un flujo retrógrado diastólico desde la aurícula derecha hacia la vena cava inferior y la vena suprahepática12. Para cuantificar la magnitud del flujo retrógrado, se ha creado el “índice de velocidad de reversión diastólica en la vena hepática” (calculado como la velocidad del flujo retrógrado diastólico dividida entre la velocidad del flujo anterógrado diastólico). Un índice de reversión diastólica espiratoria >0,8 es específico para pericarditis constrictiva (figura 1).
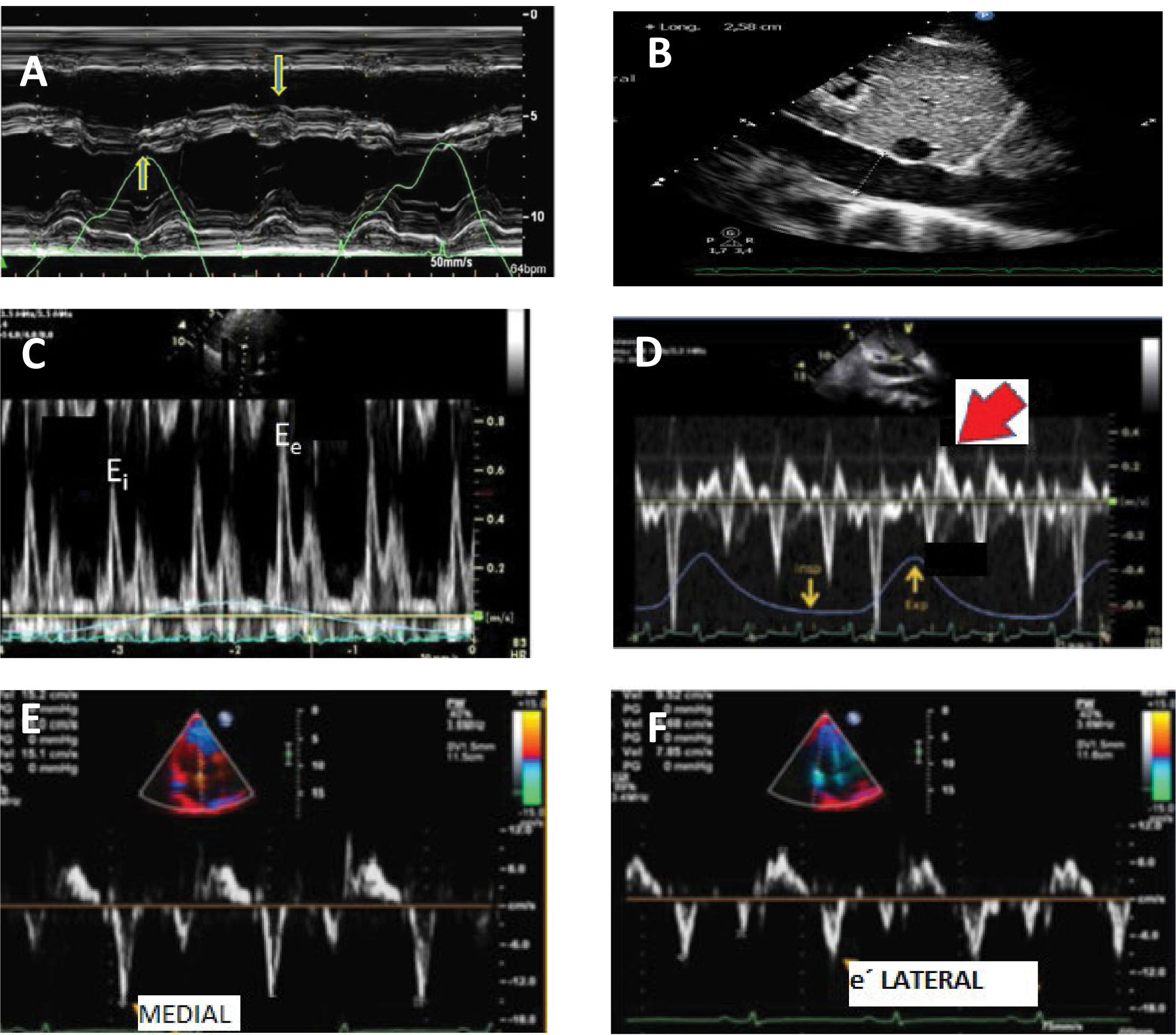
Caracteristicas ecocardiograficas en pericarditis constrictiva
A: Modo M en eje largo paraesternal medioventricular: movimiento septal respiratorio y rebote septal (latido a latido) B: Vena cava inferior dilatada sin colapso inspiratorio. C: flujo transmitral con Doppler pulsado con variación respiratoria y patrón restrictivo. D: Doppler pulsado en vena suprahepática con reversión espiratoria del flujo. E y F: Doppler tisular onda e’ del anillo mitral mayor a la del anillo lateral.
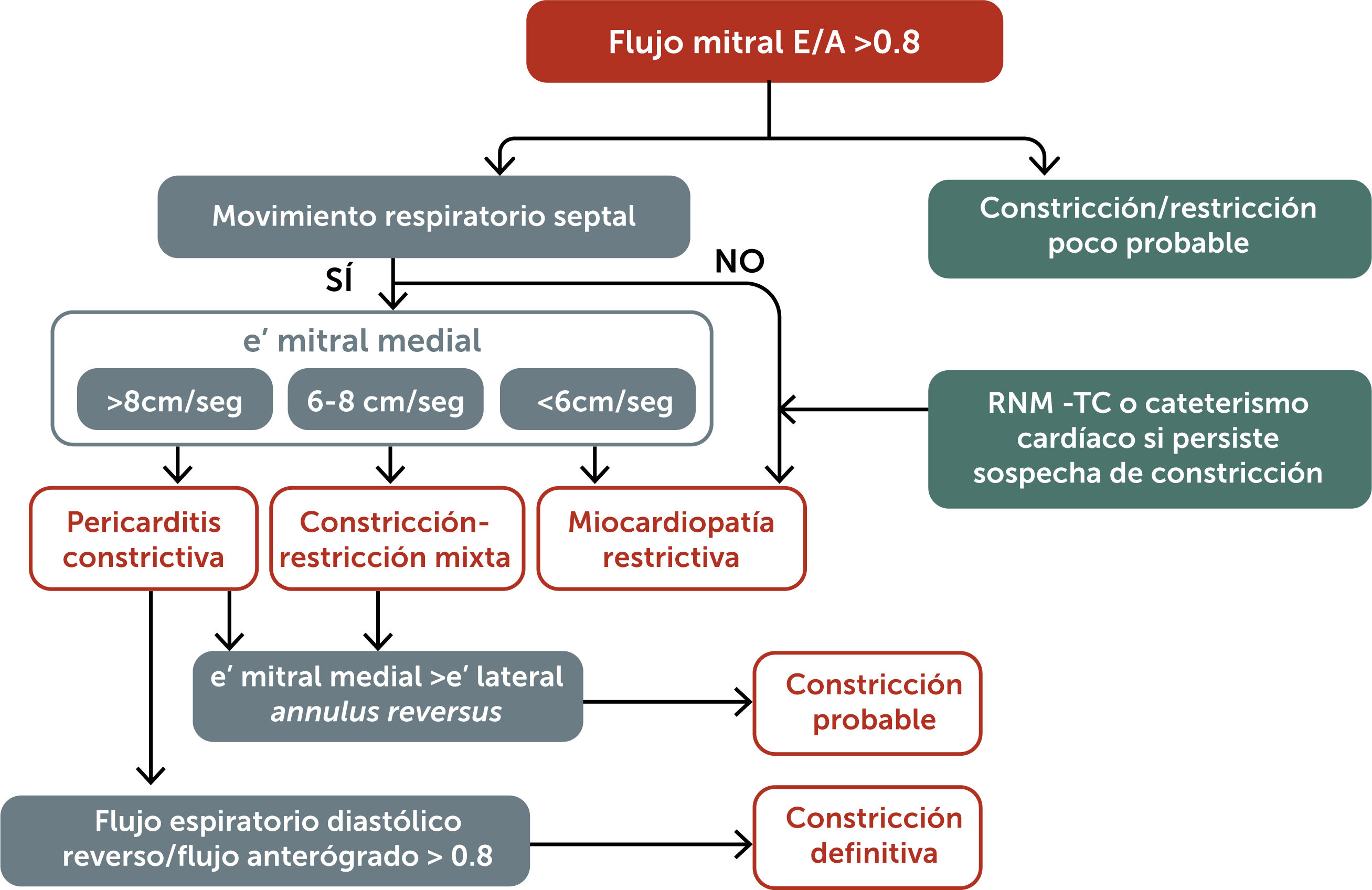
En un estudio que utilizó ecocardiografía bidimensional y Doppler en pacientes con sospecha de pericarditis constrictiva, se identificaron tres parámetros con alta sensibilidad (S) y especificidad (E) para el diagnóstico de constricción pericárdica: el movimiento septal respiratorio (S 93%, E 69%), un e’ medial mitral =9cm/s (S 83%, E 81%) y una inversión diastólica espiratoria del flujo hepático con índice >0,8 (S 76%, E 88%). Los pacientes con miocardiopatía restrictiva no presentan movimiento septal respiratorio, tienen un e’ mitral septal <7cm/s y la inversión diastólica en la vena hepática se incrementa durante la inspiración. Combinando un patrón restrictivo de llenado, inversión diastólica espiratoria del flujo hepático, movimiento septal anormal y hallazgos característicos en el Doppler tisular del anillo mitral, puede realizarse el diagnóstico de pericarditis constrictiva con alta precisión mediante ecocardiografía (S 64%, E 97%)13. Estos parámetros han sido propuestos como los criterios ecocardiográficos diagnósticos de la Clínica Mayo para pericarditis constrictiva (figura 2).
Algoritmo diagnóstico ecocardiográfico para pericarditis constrictiva14.
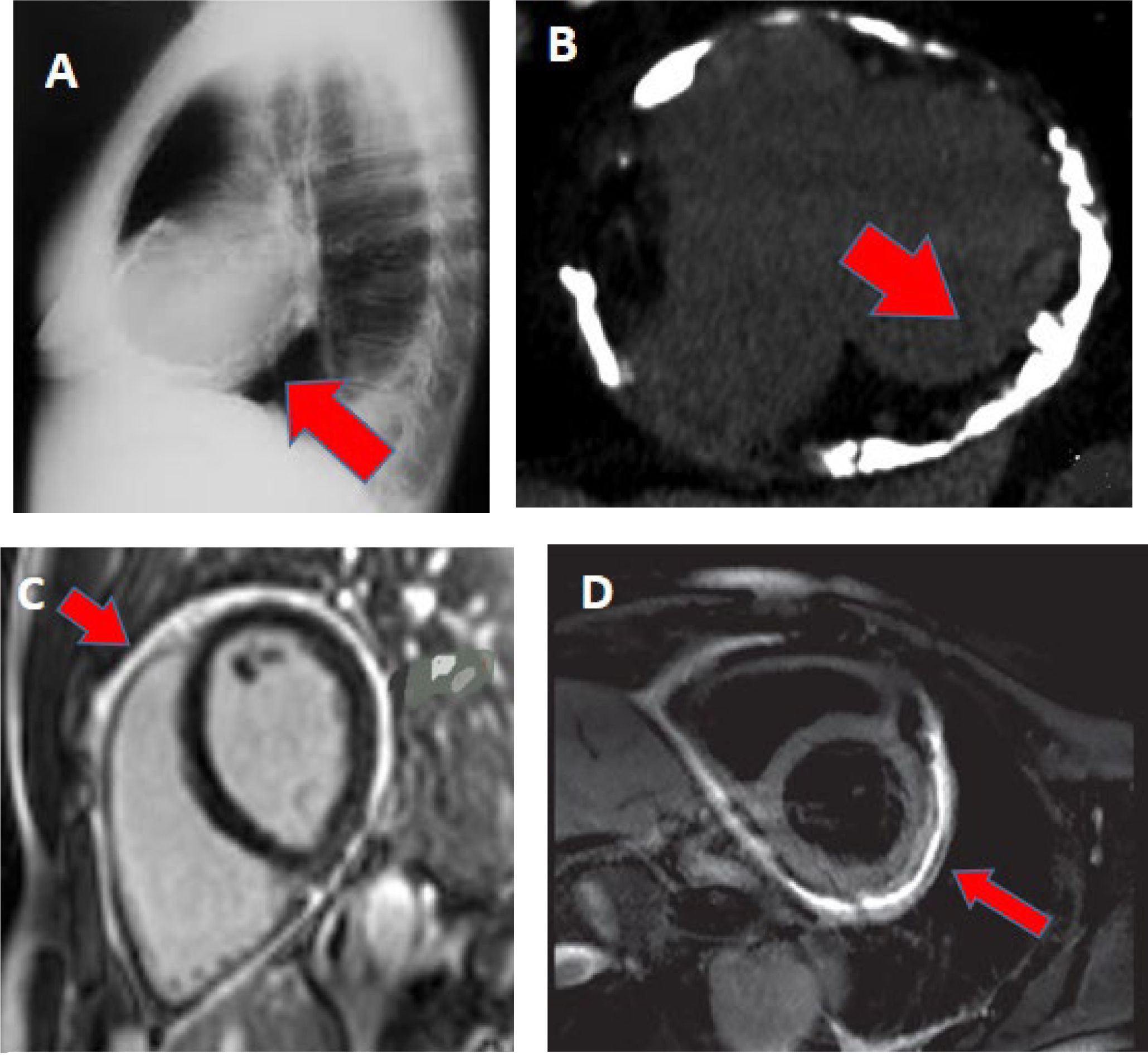
La radiografía de tórax generalmente muestra un tamaño cardíaco normal. En aproximadamente el 35-50% de los pacientes pueden observarse derrames pleurales, mientras que la calcificación pericárdica está presente en el 25-30% de los casos.
La tomografía computarizada cardíaca puede resultar útil para la evaluación del grosor pericárdico, la presencia de calcificación pericárdica y, previo a la pericardiectomía, para valorar las relaciones anatómicas del pericardio con las estructuras adyacentes.
La calcificación pericárdica puede adoptar un patrón circunferencial en forma de banda, que típicamente respeta la región basal anterior del ventrículo izquierdo, así como las regiones apicales de los ventrículos izquierdo y derecho. Además, puede extenderse hacia los anillos mitral y tricuspídeo14.
La resonancia magnética cardíaca representa una modalidad de imagen complementaria útil en esta enfermedad, ya que proporciona una excelente definición anatómica y permite evaluar la inflamación pericárdica. El edema pericárdico, evaluado mediante la secuencia T2-STIR, también ha demostrado correlacionarse con los hallazgos patológicos quirúrgicos. El realce tardío de gadolinio es un hallazgo frecuente y se asocia con aumento de la proliferación de fibroblastos, neovascularización e inflamación crónica. Tanto la evaluación cualitativa como cuantitativa del realce tardío ha demostrado capacidad para predecir la respuesta al tratamiento antiinflamatorio en pacientes con pericarditis constrictiva, aportando información adicional a la evaluación clínica y a los marcadores inflamatorios14 (figura 3).
La tomografía por emisión de positrones (PET) con 18F-fluorodesoxiglucosa ha demostrado utilidad en la evaluación de inflamación pericárdica. En una serie de pacientes con pericarditis constrictiva, la captación pericárdica basal más elevada se asoció con mejor respuesta a la terapia con corticoides, lo que sugiere su valor como predictor de respuesta al tratamiento. Además, la PET puede ser una herramienta diagnóstica particularmente útil en pacientes con marcapasos o contraindicaciones para la resonancia magnética cardiaca, aunque se requieren más estudios para confirmar su papel15.
Cateterismo cardíacoLos estudios hemodinámicos invasivos están indicados en pacientes con sospecha de pericarditis constrictiva que presentan estudios por imágenes no diagnósticos, o cuando se requiere establecer con mayor precisión la contribución relativa de múltiples patologías asociadas, como la disfunción miocárdica, enfermedad valvular o hipertensión pulmonar.
En pacientes con pericarditis constrictiva, los hallazgos típicos en el cateterismo cardíaco incluyen: aumento de la presión auricular con descensos prominentes de las valles x e y, igualación de las presiones telediastólicas entre las cavidades, la presencia de un patrón de “dip-plateau” o signo de raíz cuadrada en la presión diastólica ventricular, y variaciones opuestas en las presiones de llenado y sistólicas de los ventrículos derecho e izquierdo con la respiración16.
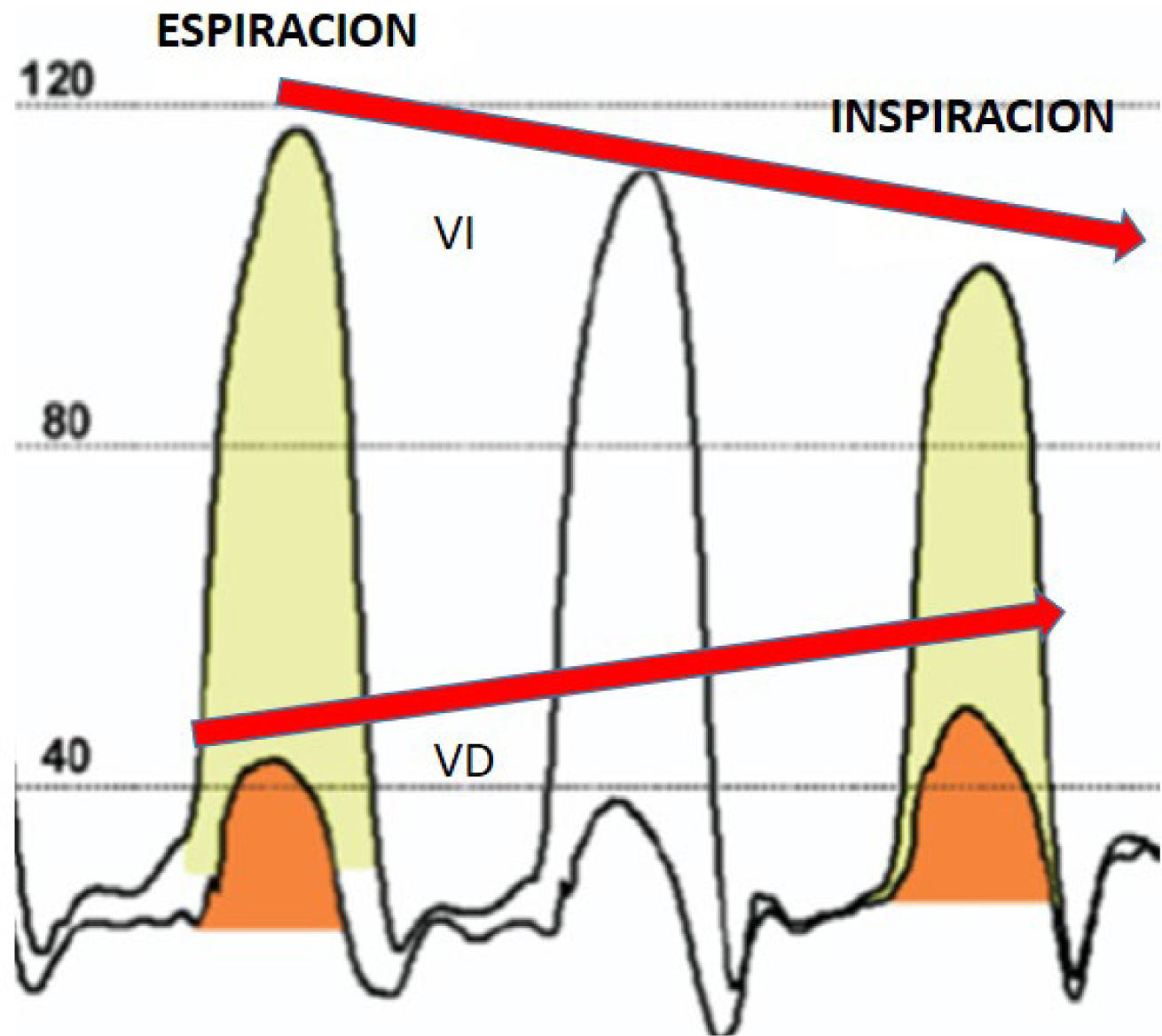
Sin embargo, estos cambios pueden no estar presentes en etapas tempranas de la enfermedad o en pacientes hipovolémicos, como aquellos bajo tratamiento con diuréticos. Los criterios hemodinámicos tradicionales para distinguir entre pericarditis constrictiva y miocardiopatía restrictiva presentan una sensibilidad y especificidad limitadas. De hecho, la hipertensión pulmonar está presente en una proporción considerable de pacientes con pericarditis constrictiva. No obstante, la variación respiratoria discordante en el llenado y presión de los ventrículos izquierdo y derecho puede diferenciar con precisión la constricción pericárdica de la miocardiopatía restrictiva17 (figura 4).
Curva de presiones en VI-VD en pericarditis constrictiva mostrando variación discordante de presiones por incremento de la interdependencia ventricular17.
La fisiología de constricción puede verse en todo el espectro de la enfermedad pericárdica, desde una forma transitoria en las pericarditis agudas, pasando por formas subagudas y crónicas con inflamación persistente hasta la forma calcificada en los estadíos avanzados de larga data.
La terapia inicial debe enfocarse en tratar la etiología subyacente cuando sea identificable. En los casos en que se detecta inflamación pericárdica, debe iniciarse un tratamiento antiinflamatorio potente antes de considerar una intervención quirúrgica. La pericardiectomía debe contemplarse en pacientes sintomáticos sin evidencia de inflamación pericárdica o en aquellos que no responden al tratamiento antiinflamatorio, siempre que el riesgo quirúrgico no sea prohibitivo.
El manejo médico de la sobrecarga de volumen en el contexto de la fisiología constrictiva puede realizarse con diuréticos, con el objetivo de restaurar la euvolemia, aunque esto no cambia la historia natural de la enfermedad.
La identificación de inflamación pericárdica, mediante evaluación clínica, marcadores en sangre (velocidad de eritrosedimentación, proteína C reactiva) y por imágenes (edema en T2-STIR o presencia de realce tardío de gadolinio), en el contexto de pericarditis constrictiva o pericarditis efusivo-constrictiva plantea la necesidad de tratamiento médico antiinflamatorio. La respuesta inicial al tratamiento en estos casos suele ser limitada y la recuperación lenta. No obstante, el tratamiento antiinflamatorio debe constituir la primera línea terapéutica, dado que en algunos casos puede lograrse la reversión del cuadro constrictivo (considerado transitorio). No existen datos comparativos sobre la eficacia de AINEs, colchicina, corticoesteroides y agentes inmunomoduladores en esta población; sin embargo, es frecuente la necesidad de una rápida escalada terapéutica17.
Se pueden emplear corticoesteroides (0,25-0,5mg/kg/día) o agentes anti-IL-118,19, en combinación con colchicina, durante un período mínimo de 8 a 12 semanas antes de realizar una nueva evaluación clínica y por imágenes. En algunos casos, el tratamiento antiinflamatorio puede extenderse de 3 a 6 meses, a fin de valorar la resolución adecuada de la inflamación pericárdica y la fisiología constrictiva20.
La pericarditis constrictiva sintomática debe tratarse con una pericardiectomía radical, que incluya la resección del pericardio anterior desde un nervio frénico al otro, extendiéndose inferiormente desde el diafragma hasta la vena cava superior, la aorta ascendente y la arteria pulmonar en su límite superior. Además, se incluye la extirpación del pericardio diafragmático y del pericardio posterior al nervio frénico izquierdo, abarcando el espacio por detrás de la aurícula izquierda, entre las venas pulmonares, y hacia la izquierda de la vena cava inferior. Dicho procedimiento requiere de un cirujano experto en patología pericárdica y del uso de circulación extracorpórea para descomprimir el corazón y permitir el acceso a dichas porciones del pericardio (figura 5).
La pericardiectomía parcial convencional, limitada a la resección del pericardio anterior y/o diafragmático, es insuficiente y se asocia con menor sobrevida a largo plazo y menor mejoría en los parámetros ecocardiográficos21. La repetición de una pericardiectomía por recurrencia tras una cirugía incompleta presenta una mortalidad a 30 días del 7,3%, lo que destaca la importancia de realizar una pericardiectomía radical desde la primera intervención22.
Datos de un meta-análisis muestran una mortalidad general a 30 días del 6.9%. Las etiologías relacionadas con cirugía cardíaca previa o radioterapia se asocian con un riesgo de mortalidad a largo plazo dos a tres veces superior al observado en etiologías idiopáticas23. Entre los predictores multivariados de mayor mortalidad a 30 días se incluyen: clase funcional NYHA (New York Heart Association) más avanzada, etiologías no idiopáticas, insuficiencia tricuspídea moderada o severa, disfunción renal, estado operatorio urgente, esternotomía previa, necesidad de circulación extracorpórea, menor superficie corporal, sexo femenino y fracción de eyección ventricular izquierda reducida. La necesidad de procedimientos concomitantes, como cirugía valvular tricuspídea, no se asoció a peores resultados24.
Informes recientes de centros especializados en cirugía pericárdica con alto volumen de casos indican que el riesgo operatorio depende en gran medida de la etiología y de las comorbilidades, siendo la mortalidad operatoria para los casos idiopáticos inferior al 1,5%25. Las características ecocardiográficas de pericarditis constrictiva pueden persistir hasta en el 20% de los casos en el período postoperatorio temprano, especialmente entre aquellos con síntomas preoperatorios prolongados. Estas alteraciones pueden resolverse durante el seguimiento a largo plazo y no deben interpretarse como un fracaso terapéutico en ausencia de síntomas clínicos26.
En algunos pacientes, el epicardio se encuentra engrosado y fibrosado, lo cual contribuye de forma significativa a la fisiología constrictiva; por lo tanto, es fundamental resecar también el epicardio (pericardio visceral) durante la pericardiectomía a fin de lograr un alivio completo de la constricción. La cirugía de “waffle”, que consiste en la realización de pequeñas incisiones en forma de cuadrícula en el epicardio, puede llevarse a cabo en pacientes con pericarditis constrictiva asociada a engrosamiento epicárdico27.
ConclusionesLa pericarditis constrictiva debe ser considerada en todos los casos de insuficiencia cardíaca de causa no aclarada, especialmente cuando predomina la falla cardíaca derecha con fracción de eyección de ventrículo izquierdo preservada. El diagnóstico y la distinción con la miocardiopatía restrictiva continúan siendo un desafío, y se basan principalmente en la identificación de los procesos fisiopatológicos característicos de la constricción: la disociación entre las presiones intrapleurales e intracardíacas, e interdependencia ventricular aumentada. El ecocardiograma Doppler suele ser el estudio inicial que pone en manifiesto la fisiología de constricción guiado por la sospecha clínica. La resonancia cardíaca es particularmente útil para identificar casos de constricción “transitoria”, potencialmente reversibles con tratamiento antiinflamatorio. No obstante, la pericardiectomía quirúrgica completa sigue siendo el único tratamiento eficaz para los pacientes con constricción sintomática crónica, observándose los mejores resultados postoperatorios en aquellos sin enfermedad avanzada ni antecedentes de radioterapia torácica. Dada la complejidad de estos pacientes y las exigencias técnicas del procedimiento, la pericardiectomía debe realizarse en centros de alto volumen con experiencia consolidada.
Conflicto de interesesEl autor no declara ningún conflicto de interés asociado a la elaboración de este artículo.