La disfunción sistólica (DS) en la miocardiopatía hipertrófica (MCH) constituye una entidad rara pero clínicamente significativa, asociada con un aumento de la morbilidad y la mortalidad. Se define convencionalmente por una fracción de eyección del ventrículo izquierdo (FEVI) inferior al 50%, lo que se correlaciona con un peor pronóstico. La fisiopatología de la DS en la MCH es multifactorial e involucra disfunción microvascular, fibrosis miocárdica y remodelado ventricular adverso. Estos procesos conducen a un deterioro progresivo de la contractilidad y a insuficiencia cardíaca. El enfoque terapéutico debe ser individualizado e incluir estrategias farmacológicas. En pacientes con DS avanzada refractaria al tratamiento médico, el trasplante cardíaco sigue siendo la intervención definitiva. Esta revisión ofrece un análisis exhaustivo de las estrategias terapéuticas actuales, los enfoques de estratificación del riesgo y las perspectivas futuras en el manejo de la disfunción sistólica en la MCH.
Systolic dysfunction (SD) in hypertrophic cardiomyopathy (HCM) constitutes a rare yet clinically significant entity that is associated with increased morbidity and mortality. It is conventionally defined by a left ventricular ejection fraction (LVEF) below 50%, correlating with a worse prognosis. The pathophysiology of SD in HCM is multifactorial, involving microvascular dysfunction, myocardial fibrosis, and maladaptive ventricular remodeling. These processes lead to progressive contractile impairment and heart failure. The therapeutic approach must be individualized, including pharmacological strategies. For patients with advanced SD refractory to medical therapy, heart transplantation remains the definitive intervention. This review provides a comprehensive discussion of current therapeutic strategies, risk stratification approaches, and future perspectives in the management of systolic dysfunction in HCM.
La miocardiopatía hipertrófica (MCH) es la enfermedad miocárdica hereditaria más frecuente, caracterizada por hipertrofia desproporcionada sin causa aparente. Generalmente se acepta como criterio para su definición un aumento del espesor ventricular izquierdo mayor o igual a 15mm que no se explica solamente por alteración en las condiciones de carga (o mayor a 13mm si se evidencia una variante genética patogénica, historia familiar o alteraciones en el electrocardiograma que sustenten el diagnóstico)1. Aunque se ha considerado predominantemente una enfermedad con disfunción diastólica, un subconjunto de pacientes desarrolla disfunción sistólica (DS), definida por una fracción de eyección del ventrículo izquierdo (FEVI) <50%2. Este fenotipo se asocia con mayor carga sintomática, progresión acelerada a insuficiencia cardíaca avanzada y mayor mortalidad cardiovascular. De hecho, se estima que los pacientes que desarrollan una caída de la FEVI por debajo de 50% tienen hasta 10 veces mayor probabilidad de muerte o trasplante en un periodo de 10 años que los pacientes con FEVI preservada3,4.
La detección temprana y una adecuada estratificación del riesgo son claves para optimizar el tratamiento y mejorar el pronóstico. El manejo de la DS en la MCH requiere un enfoque integral que combine estrategias farmacológicas, dispositivos implantables y, en casos avanzados, trasplante cardíaco. Esta revisión analiza las opciones terapéuticas actuales y los desafíos en la selección de candidatos a terapias avanzadas.
Disfunción sistólica en la miocardiopatía hipertróficaPrevalencia y características clínicasLa DS en la MCH es poco frecuente, con una prevalencia estimada entre el 4% y 9% en series clínicas5. Sin embargo, registros como SHaRe (Sarcomeric Human Cardiomyopathy Registry) sugieren una mayor incidencia en seguimientos prolongados, lo que indica que la progresión de la fibrosis miocárdica y la disfunción microvascular contribuyen a su desarrollo6. El fenotipo clínico de la MCH es heterogéneo, con manifestaciones que van desde función ventricular preservada hasta DS progresiva. La FEVI puede sobrestimar la función sistólica, por lo que, como se mencionó, una reducción por debajo del 50% es un hallazgo de mal pronóstico. Aunque la DS afecta a un subconjunto minoritario de pacientes, su impacto clínico es significativo.
Algunos pacientes con DS presentan dilatación progresiva del ventrículo izquierdo con remodelado excéntrico mientras que otros mantienen cavidades pequeñas con disfunción contráctil severa sin dilatación significativa7. Más del 70% de los pacientes con DS presentan disnea en clase funcional III-IV de la NYHA (New York Heart Association), con reducción significativa de la capacidad funcional y consumo máximo de oxígeno <15ml/kg/min en pruebas de esfuerzo. De igual modo se asocia con mayor mortalidad por insuficiencia cardíaca y muerte súbita8.
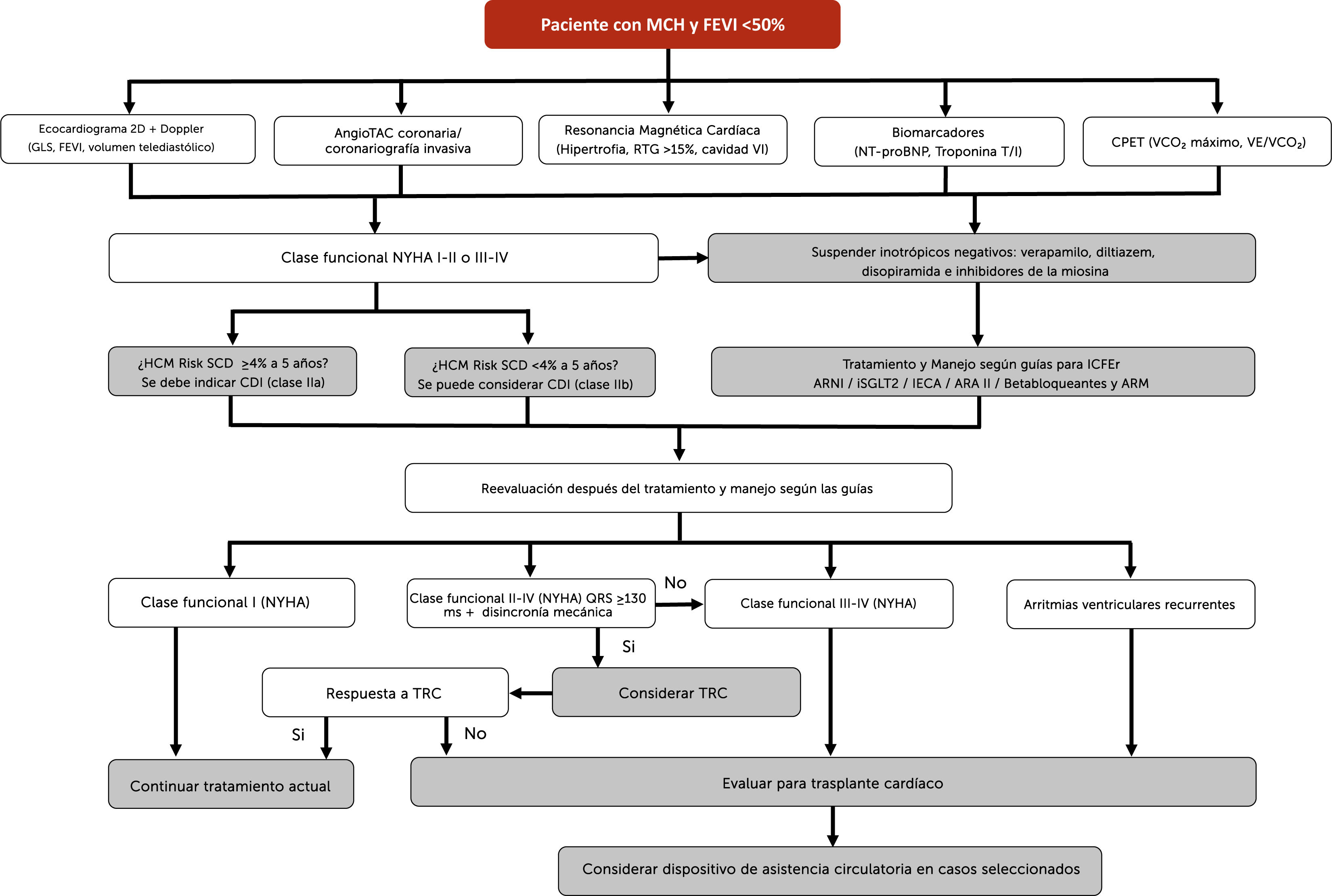
Algoritmo diagnóstico-terapéutico para pacientes con miocardiopatía hipertrófica (MCH) que evolucionan con disfunción sistólica (FEVI <50%).
Este algoritmo representa el abordaje diagnóstico y terapéutico de pacientes con MCHno que presentan disfunción sistólica con FEVI menor al 50%. El enfoque inicial incluye la evaluación multimodal mediante ecocardiograma, RMC, biomarcadores y CPET. Una vez completada esta evaluación, se indica tratamiento según las guías para ICFEr, incluyendo betabloqueantes, ARM, iSGLT2 y ARNI o, en su defecto, IECA o ARA II. Debe evaluarse el riesgo de muerte súbita y considerar la colocación de un CDI. La presencia de disincronía con QRS mayor o igual a 130 milisegundos justifica la evaluación para TRC. Si persisten síntomas en clase funcional NYHA III–IV o existen múltiples descargas del CDI por arritmias ventriculares potencialmente mortales refractarias al tratamiento antiarrítmico, se debe considerar la evaluación para trasplante cardíaco o asistencia circulatoria mecánica.
Abreviaturas: MCHno: miocardiopatía hipertrófica no obstructiva; FEVI: fracción de eyección del ventrículo izquierdo; ICFEr: insuficiencia cardíaca con fracción de eyección reducida; ARNI: inhibidor del receptor de angiotensina y neprilisina; iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2; IECA: inhibidor de la enzima convertidora de angiotensina; ARA II: antagonista del receptor de angiotensina II; ARM: antagonista del receptor de mineralocorticoides; CDI: cardiodesfibrilador implantable; TRC: terapia de resincronización cardíaca; CPET: prueba de ejercicio cardiopulmonar; RMC: resonancia magnética cardíaca; NYHA: New York Heart Association; TV: taquicardia ventricular. (Figura de elaboración propia).
Se estima que 1 de cada 15 pacientes con MCH progresará a estadios de insuficiencia cardíaca avanzada, el cual se define, similar a otras etiologías, como aquellos pacientes que persisten con síntomas severos, clase funcional III-IV de la NYHA, bajo tratamiento óptimo (farmacológico y no farmacológico), y esto es independiente de la FEVI5,9. De hecho, existen 3 perfiles de pacientes en esta población avanzada, aquellos que se presentan con FEVI menor a 50% (aproximadamente 30%), los que se presentan con FEVI preservada pero desarrollan DS en el seguimiento (50%) y los que persisten con una FEVI preservada (alrededor del 20%)9.
Mecanismos fisiopatológicosLa DS en la MCH resulta de mecanismos interrelacionados que comprometen la contractilidad miocárdica. La disfunción microvascular genera hipoperfusión crónica y reduce la reserva de flujo coronario, favoreciendo la isquemia miocárdica subclínica, la apoptosis miocitaria y la fibrosis intersticial progresiva. Estos procesos deterioran la función ventricular izquierda y aceleran la insuficiencia cardíaca.
El remodelado ventricular contribuye a la progresión de la enfermedad. Algunos pacientes desarrollan dilatación progresiva con remodelado excéntrico, mientras que otros presentan ventrículos hipertrofiados sin dilatación aparente, pero con disfunción contráctil severa y mayor rigidez parietal. La desproporción entre la hipertrofia miocárdica y la vascularización coronaria disminuye la densidad de la microcirculación, perpetuando la hipoxia tisular. Esta hipoxia crónica activa mecanismos inflamatorios y profibróticos que agravan la fibrosis y aceleran la progresión de la DS10,11.
Diagnóstico y tratamientoEl diagnóstico y evaluación de la DS en MCH requiere ecocardiografía avanzada con speckle tracking para evaluar la deformación miocárdica, resonancia magnética con realce tardío de gadolinio para cuantificar fibrosis y pruebas de esfuerzo para valorar capacidad funcional. Biomarcadores como NT-proBNP y troponinas aportan información sobre el estado hemodinámico y la progresión de la enfermedad1,2. Asimismo, el mapeo paramétrico (T1/T2 y fracción de volumen extracelular) aporta valor para el diagnóstico diferencial de fenocopias prevalentes en nuestra región (p. ej., enfermedad de Fabry y amiloidosis), que pueden cursar con DS y requieren terapias específicas. Además, debe considerarse la evaluación de enfermedad coronaria epicárdica (angioTAC coronario o coronariografía) como potencial factor contribuyente de DS y determinante pronóstico.
No debe considerarse como válido el concepto de que una miocardiopatía de origen genético no puede tener respuesta en el remodelado ventricular a tratamientos farmacológicos estándar. Existen estudios observacionales que muestran que diferentes miocardiopatías familiares pueden tener mayor o menor respuesta al tratamiento farmacológico según los genes involucrados, evidenciado por un remodelado reverso significativo luego del tratamiento médico12. Sin embargo, esta observación no aplica de forma universal a todas las miocardiopatías hereditarias: en la amiloidosis cardíaca por transtiretina (ATTR), componentes de la terapia estándar de ICFEr (IECA/ARA II/ARNI y betabloqueantes) pueden carecer de beneficio de remodelado e incluso resultar perjudiciales.
El tratamiento de la DS en MCH debe equipararse al de los pacientes con insuficiencia cardíaca con FEVI reducida1,2,13. Se recomienda el uso de inhibidor del receptor de angiotensina y neprilisina (ARNI) o inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas del receptor de angiotensina II (ARA II), betabloqueantes, antagonistas del receptor de mineralocorticoides y gliflozinas para mejorar síntomas y reducir hospitalizaciones2,14. Si bien la mayoría de los ensayos clínicos en insuficiencia cardíaca con FEVI reducida excluyen a los pacientes con MCH y por lo tanto la evidencia es escasa, existen algunos estudios que evaluaron algunos grupos farmacológicos en estos pacientes. En un estudio retrospectivo de 118 pacientes con MCH y DS, el tratamiento farmacológico y de dispositivos como terapia de resincronización cardíaca (TRC) logró estabilidad de los síntomas en 48% de los pacientes con una mortalidad 4 veces menor a la reportada previamente para MCH con DS, siendo igualmente la mortalidad de este grupo 10 veces mayor a la de los que no presentaron DS5. En lo que respecta al uso de betabloqueantes, en los pacientes con MCH que desarrollan DS se debe rotar el betabloqueante a alguno de los tres utilizados en insuficiencia cardíaca con FEVI reducida (bisoprolol, carvedilol, metroprolol XL) evitando mantener terapia con otros como atenolol. En MCH con DS, la evidencia es limitada, y la recomendación de las guías actuales es utilizar el tratamiento indicado para los pacientes con insuficiencia cardíaca con fracción de eyección reducida2. Los ARNI han sido evaluados en el estudio SILICOFCM en pacientes con MCH pero sin DS, con una mediana de FEVI de 64%, y si bien no han demostrado beneficios comparados con cambios en el estilo de vida a las 16 semanas, sí fueron bien tolerados15.
Las gliflozinas han mostrado una reducción de la mortalidad por todas las causas, las internaciones por todas las causas y los síntomas cardiovasculares, sin mayores efectos adversos, en un estudio de emparejamiento por puntuación de propensión de pacientes con MCH, con y sin gliflozinas16. Si bien no fue un estudio en pacientes con MCH y DS, muestran que podría haber un beneficio y con un buen perfil de seguridad. A estos datos se suman los de un estudio prospectivo, abierto, en MCH sin DS, donde el uso de gliflozinas se asoció a mejoría en parámetros de falla diastólica y en la capacidad funcional17. Finalmente, existen ensayos clínicos aleatorizados en curso con gliflozinas en MCH como el EMPA-REPAIR con empagliflozina y el SONATA-HCM con sotagliflozina que buscarán evaluar el beneficio en estos pacientes18,19.
En pacientes con fibrilación auricular, es prioritario restaurar el ritmo sinusal o controlar la frecuencia ventricular para reducir la sobrecarga hemodinámica. La ablación con catéter puede ser una opción en fibrilación auricular recurrente sintomática2.
Finalmente, parte del tratamiento de los pacientes con MCH debe suspenderse cuando aparece DS. Los inhibidores de la miosina, como mavacamten y aficamten, están contraindicados en DS por su efecto depresor sobre la contractilidad. Los bloqueantes cálcicos no dihidropiridínicos, como verapamilo y diltiazem, así como el bloqueante de los canales de sodio disopiramida, también deben suspenderse por su efecto inotrópico negativo.
Manejo avanzado y terapias invasivasTerapia de resincronización cardíacaLa TRC puede beneficiar a pacientes sintomáticos con DS y bloqueo de rama izquierda con QRS >130ms. Aunque su indicación en MCH se basa en extrapolaciones de insuficiencia cardíaca con fracción de eyección reducida, estudios sugieren que puede corregir la disincronía mecánica y mejorar la función ventricular20,21. Adicionalmente, se debe considerar en aquellos pacientes con DS que requerirán estimulación con marcapaso ventricular permanente por trastornos de la conducción con la consecuente generación de disincronía.
La selección de candidatos debe basarse en ecocardiografía avanzada para cuantificar la disincronía, resonancia magnética para evaluar la fibrosis y un análisis electrofisiológico detallado. La carga fibrótica puede afectar la respuesta a la TRC, por lo que su aplicabilidad debe evaluarse individualmente.
Disfunción sistólica en miocardiopatía hipertrófica y riesgo de muerte súbitaLa DS en la MCH es un factor de alto riesgo para muerte súbita cardíaca (MSC)2,8. La resonancia magnética cardíaca con realce tardío extenso es un marcador adicional de riesgo arrítmico22,23. Si bien la DS no forma parte de las puntuaciones habituales para el cálculo de riesgo de muerte súbita, la mayoría de las guías lo consideran un factor clave para determinar la colocación de un cardiodesfibrilador implantable (CDI)1,2.
Trasplante cardíaco en disfunción sistólica avanzadaEl trasplante cardíaco (TC) constituye la intervención terapéutica definitiva en un subconjunto selecto de pacientes con MCH que han evolucionado hacia insuficiencia cardíaca avanzada. Hay pacientes que presentan DS de carácter progresivo y refractario a la terapéutica médica convencional, lo que justifica la consideración del TC cuando otras estrategias terapéuticas, incluidas las opciones farmacológicas y TRC, no ofrecen mejoría clínica significativa2. Se recomienda la derivación oportuna a centros especializados en MCH e insuficiencia cardíaca avanzada para la evaluación y seguimiento integral antes de indicar trasplante cardíaco.
El deterioro clínico de estos pacientes suele manifestarse a través de un incremento progresivo de los síntomas, disminución de la tolerancia al ejercicio, elevación de biomarcadores de insuficiencia cardíaca y compromiso ventricular persistente. La identificación precoz de aquellos individuos que podrían beneficiarse del TC resulta fundamental para optimizar el tiempo de referencia a centros especializados y minimizar el riesgo de complicaciones asociadas a la progresión de la enfermedad.
La selección de candidatos al TC debe realizarse conforme a las recomendaciones de las guías clínicas vigentes, incluyendo la evaluación mediante pruebas de esfuerzo cardiopulmonar (CPET) para cuantificar objetivamente la capacidad funcional y la severidad de la enfermedad. La CPET no solo permite estratificar el riesgo, sino que también facilita una selección más precisa de los candidatos, considerando parámetros como el consumo máximo de oxígeno y la eficiencia ventilatoria. Los valores de corte que reflejan un compromiso cardiocirculatorio que amerita un trasplante cardíaco se extrapolan de pacientes sin MCH y son un consumo máximo de oxígeno =14ml/kg/min o =12ml/kg/min en pacientes sin betabloqueantes por intolerancia a los mismos. Es importante destacar que estos valores de corte deben considerarse bajo un tratamiento farmacológico y no farmacológico óptimo, y que en algunos pacientes con MCH puede existir una discordancia entre el consumo máximo de oxígeno y la limitación severa al ejercicio24.
Si bien tradicionalmente se consideraba como candidatos a TC predominantemente a aquellos pacientes con MCH y DS, en la actualidad casi la mitad de los pacientes candidatos a TC por MCH presentan FEVI mayor o igual a 50% debido a una evolución tórpida secundaria a una fisiología restrictiva que conlleva a insuficiencia cardíaca refractaria al tratamiento convencional9,25.
Las recomendaciones actuales de la Sociedad Internacional de Trasplante Cardíaco y Pulmonar (ISHLT) recomiendan el TC en los pacientes con MCH no obstructiva con insuficiencia cardíaca avanzada (clase funcional III-IV de la NYHA, pese a tratamiento óptimo) independientemente de la FEVI, o con arritmias ventriculares potencialmente fatales y refractarias al tratamiento antiarrítmico optimizado (indicación clase I, nivel de evidencia B-NR)26. En forma similar, en la población pediátrica con MCH, el TC debe considerarse en niños con insuficiencia cardíaca refractaria o arritmias ventriculares malignas no controladas por las terapias convencionales, dada la gravedad del pronóstico en este grupo26,27.
La selección de candidatos para TC exige un abordaje multidisciplinario con la participación de cardiólogos y cirujanos cardiovasculares, especialistas en insuficiencia cardíaca avanzada. Los pacientes con MCH y comorbilidades sistémicas presentan un mayor riesgo de fragilidad y deterioro de la función renal. Estos factores aumentan la probabilidad de eventos adversos en la lista de espera o la exclusión del proceso de trasplante por deterioro irreversible, por lo que la evaluación integral debe incluir la estratificación funcional, la determinación de la reserva fisiológica mediante CPET, la respuesta al tratamiento farmacológico y la identificación de comorbilidades que puedan comprometer la evolución postoperatoria28. Debe evaluarse, además, el uso concomitante de medicación inotrópica negativa tratando de utilizar fármacos de vida media corta en la etapa pretrasplante cardíaco para disminuir la probabilidad de falla primaria del injerto por la exposición de este a niveles sistémicos de estas drogas en los primeros momentos post operatorios. En este sentido, de aprobarse la utilización de inhibidores de la miosina como mavacamten en MCH no obstructiva, debe tenerse en cuenta que su vida media es de 6 a 9 días pudiendo llegar a 23 días en metabolizadores lentos del citocromo P450 2C193.
Desde una perspectiva fisiopatológica, los pacientes con MCH suelen presentar una cavidad ventricular izquierda reducida y fisiología restrictiva biventricular, lo que limita su tolerancia a agentes inotrópicos y los hace peores candidatos para dispositivos de asistencia circulatoria mecánica. En este contexto, la revisión de 2018 de la United Network for Organ Sharing (UNOS) modificó los criterios de asignación de órganos, priorizando a los pacientes con MCH según criterios clínicos, sin requerimientos estrictos de soporte hemodinámico o farmacológico. Esta revisión ha demostrado ser altamente efectiva, incrementando la tasa de trasplantes y reduciendo la mortalidad en lista de espera dentro de este subgrupo de pacientes29. Adicionalmente, si se requiere de la utilización de dispositivos de asistencia ventricular izquierda (DAVI) como puente al TC, o como terapia de destino en los pacientes no candidatos, debe considerarse la anatomía ventricular, utilizándose en pacientes con diámetro telediastólico del ventrículo izquierdo mayor a 46-50mm (indicación clase IIa, nivel de evidencia B-NR en las guías de la ISHLT). Esto se debe a que algunos estudios han demostrado peor sobrevida en pacientes con cavidades de menor tamaño, como un subanálisis del registro INTERMACS que mostró una sobrevida del 35% en pacientes con diámetros menores a 50mm comparado a 88% con aquellos que presentaban diámetros mayores a 50mm260,30. El pronóstico actual luego del TC en los pacientes con MCH es alentador, con una sobrevida al año de 91,6% y a 5 años de 82,5%, es por eso que la derivación temprana para TC es clave para garantizar una mayor sobrevida en este grupo de pacientes31.
ConclusionesLa DS en la MCH es una evolución poco frecuente, pero con alto impacto pronóstico. Su detección temprana, estratificación del riesgo y tratamiento integral son esenciales para optimizar la calidad de vida y reducir la morbimortalidad. En aquellos pacientes refractarios al tratamiento farmacológico y no farmacológico, no debe demorar su consideración para trasplante cardíaco dada la mala evolución a corto plazo, siendo este el tratamiento de elección en estadios avanzados.
Los avances en terapias y herramientas de imagen seguirán mejorando el abordaje de la DS en MCH, integrándose en estrategias de medicina personalizada y enfoques terapéuticos dirigidos a modificar su curso natural.
FinanciaciónEste trabajo no recibió financiamiento.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.