Reportar un caso de miocardiopatía periparto, con presentación de choque cardiogénico y paro cardiorrespiratorio, que presentó una evolución adecuada con secuelas mínimas.
Caso clínicoPaciente femenina de 31 años de edad, con embarazo a término, sin comorbilidades. Se realiza cesárea programada por doble circular de cordón. Durante el procedimiento la paciente presenta paro cardiorrespiratorio, con retorno a la circulación espontánea. Posteriormente, evoluciona con choque cardiogénico, arritmias y complicaciones tromboembólicas, requiriendo manejo en la unidad de cuidados intensivos. Presenta evolución clínica favorable, logrando retiro de las medidas de soporte, continuando con manejo ambulatorio de sus complicaciones.
La miocardiopatía periparto sigue siendo una patología de presentación infrecuente, requiriendo una alta sospecha para llegar a un diagnóstico temprano y abordaje oportuno. El uso de herramientas como la ecocardiografía son imprescindibles en la evaluación inicial. Esta enfermedad requiere de un manejo multidisciplinario en un centro especializado.
To report a case of peripartum cardiomyopathy with cardiogenic shock and cardiorespiratory arrest, which presented an adequate response to treatment with minimal sequelae.
Clinical case31-year-old female, with a full-term pregnancy, without comorbidities. A scheduled cesarean section was performed due to a double circular cord. During the procedure, the patient presented cardiorespiratory arrest with return to spontaneous circulation. The patient later presents cardiogenic shock, arrhythmias and thromboembolic events, requiring management in the intensive care unit. The patient had a favorable clinical evolution, allowing for withdrawal of support measures and outpatient management of minor complications.
Peripartum cardiomyopathy is a pathology with an infrequent presentation. In order to be addressed in a timely manner, high suspicion is required to reach an early diagnosis. The use of implements such as echocardiography is essential in the initial evaluation. Multidisciplinary management in a specialized center is required.
La miocardiopatía periparto (MCPP) se define como una miocardiopatía idiopática que ocurre al final o en los meses siguientes al final del embarazo, sin otras causas de falla cardíaca y con una fracción de eyección ventricular izquierda (FEVI) <45%. La incidencia es más alta en la raza africana y afroamericana. Un estudio realizado en Nigeria mostró que la zona noroeste tiene un riesgo mayor de presentación de hasta 1:100 de embarazos1. Brar et al. publicaron un estudio de la incidencia de MCPP en EE.UU. y observaron que variaba según la raza/etnia, observando incidencias dispares en blancos (1: 4 075), afroamericanos (1: 1 421), hispanos (1: 9 861) y asiáticos (1: 2 675)2. Otros estudios han demostrado que Dinamarca tiene una incidencia de 1:10 000 embarazos y que Japón tiene 1:20 000 embarazos3,4.
La MCPP se asocia a edad materna mayor a 30 años en más del 50% de los casos. Los factores de riesgo son embarazo múltiple, historia familiar, tabaquismo, diabetes, hipertensión arterial, preeclampsia, síndrome de HELLP, desnutrición, edad materna y el uso prolongado de agentes tocolíticos beta-agonistas5. En Nigeria se detectó una asociación de la enfermedad con deficiencia de selenio. A lo anterior se asocian los resultados del registro PEACE, donde el bajo peso y la preeclampsia emergieron como factores de riesgo independientes con una fuerte asociación con el desarrollo de MCPP1,6.
La MCPP tiene una elevada tasa de morbilidad y mortalidad. Requiere de una alta sospecha para un diagnóstico temprano y de una evaluación médica especializada, especialmente en presencia de síntomas graves7.
Presentamos el caso de una paciente que padeció las complicaciones más graves de la enfermedad llegando hasta el paro cardiorrespiratorio, y que, a pesar de ello, logra una adecuada evolución con secuelas mínimas y una recuperación completa de la función cardíaca.
Caso clínicoPaciente femenina de 31 años de edad, ama de casa. Niega consumo de alcohol, tabaco o drogas, esquema de vacunación para COVID-19 completo (3 dosis). Sus antecedentes gineco-obstétricos son menarquia a los 12 años, G3, P2, sin complicaciones en embarazos previos.
La paciente ingresa a un hospital privado para cesárea programada por doble circular de cordón. En el quirófano, al inicio de la inducción anestésica, presenta de forma súbita disnea y disminución de la saturación de oxígeno (SpO2). Posteriormente, presenta bradicardia sinusal que evoluciona a asistolia, iniciándose maniobras de reanimación cardiopulmonar. Se realiza un ciclo con administración de una dosis de atropina y adrenalina, logrando retorno a la circulación espontánea. Se intuba y se inicia norepinefrina por hipotensión sostenida. Se realiza cesárea de urgencia, con recién nacido único que pasa a la unidad de neonatología sin reportar complicaciones.
Se traslada la paciente a Hospital de Especialidades, recibiéndola en área de choque dado que se encuentra con inestabilidad hemodinámica a pesar del soporte vasopresor. La evaluación ultrasonográfica muestra un ventrículo izquierdo dilatado e hipocinesia global, motivo por el cual se inicia tratamiento con dobutamina. La evaluación con ultrasonido pulmonar muestra un perfil B. Se observan cambios de coloración en extremidad torácica izquierda. Los exámenes de laboratorio arrojan los siguientes resultados: hemoglobina 11g/dl [rango normal (RN): 11,5-14,5], hematocrito 36% [RN: 37%-47%], leucocitos 20 000/μl [RN: 4 000-10 500/μl], 89% de polimorfonucleares, dímero D 5 888 ng/ml [RN: hasta 500 ng/ml], troponina I 0,69 ng/ml [RN: 0-0,04 ng/ml], urea 22mg/dl [RN: 6-24mg/dl], creatinina 1mg/dl [RN: 0,6-1,1mg/dL], gasometría arterial pH 7,48 [RN: 7,35-7,45], pCO2 29mmHg [RN: 35-45mmHg], pO2 175mmHg [RN: 80-100mmHg], SO2 100% [RN: 95-100%], lactato 5 mmol/l [RN: 0,5 a 2,2 mmol/l, el electrocardiograma de 12 derivaciones reporta fibrilación auricular de respuesta ventricular rápida con extrasístoles supraventriculares.
Al examen físico, se observan cambios de coloración en extremidad superior izquierda.
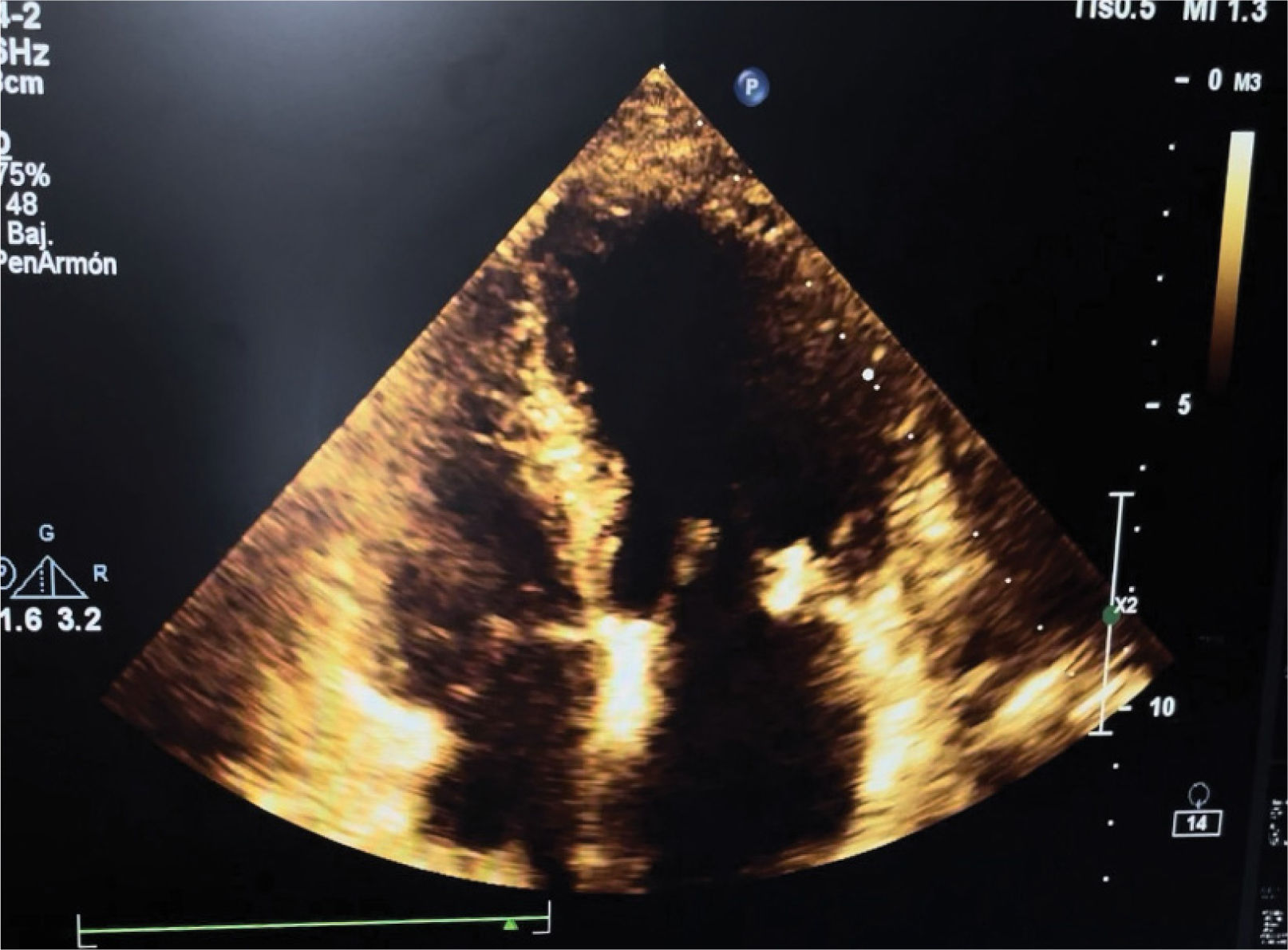
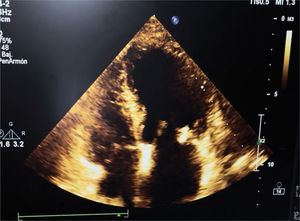
La paciente es trasladada a la unidad de cuidados intensivos, indicándose sedación y analgesia con monitoreo por índice biespectral (BIS) manteniéndolo entre 30-40. Por persistencia de inestabilidad hemodinámica, se inicia vasopresina como segundo vasopresor. Se realiza ecocardiografía transtorácica que permite corroborar la dilatación ventricular y disfunción sistólica izquierda, FEVI 30% por método de Simpson, integral velocidad tiempo 8,5cm, tracto de salida 20mm, índice cardíaco (IC) 1,8l/min/m2 (figura 1). Se coloca dispositivo de monitoreo hemodinámico por termodilución transpulmonar, cuyos valores iniciales fueron: IC 1,57l/min/m2, ELWI (extravascular lung water index) 8,3ml/kg, GEDI (global end-diastolic index) 507ml/m2, SVRI (systemic vascular resistance index) 5,376 dinas×seg×cm−5/m2, por lo que se continuó con soporte vasopresor e inotrópico, el cual se cambió a levosimendán durante 48 horas.
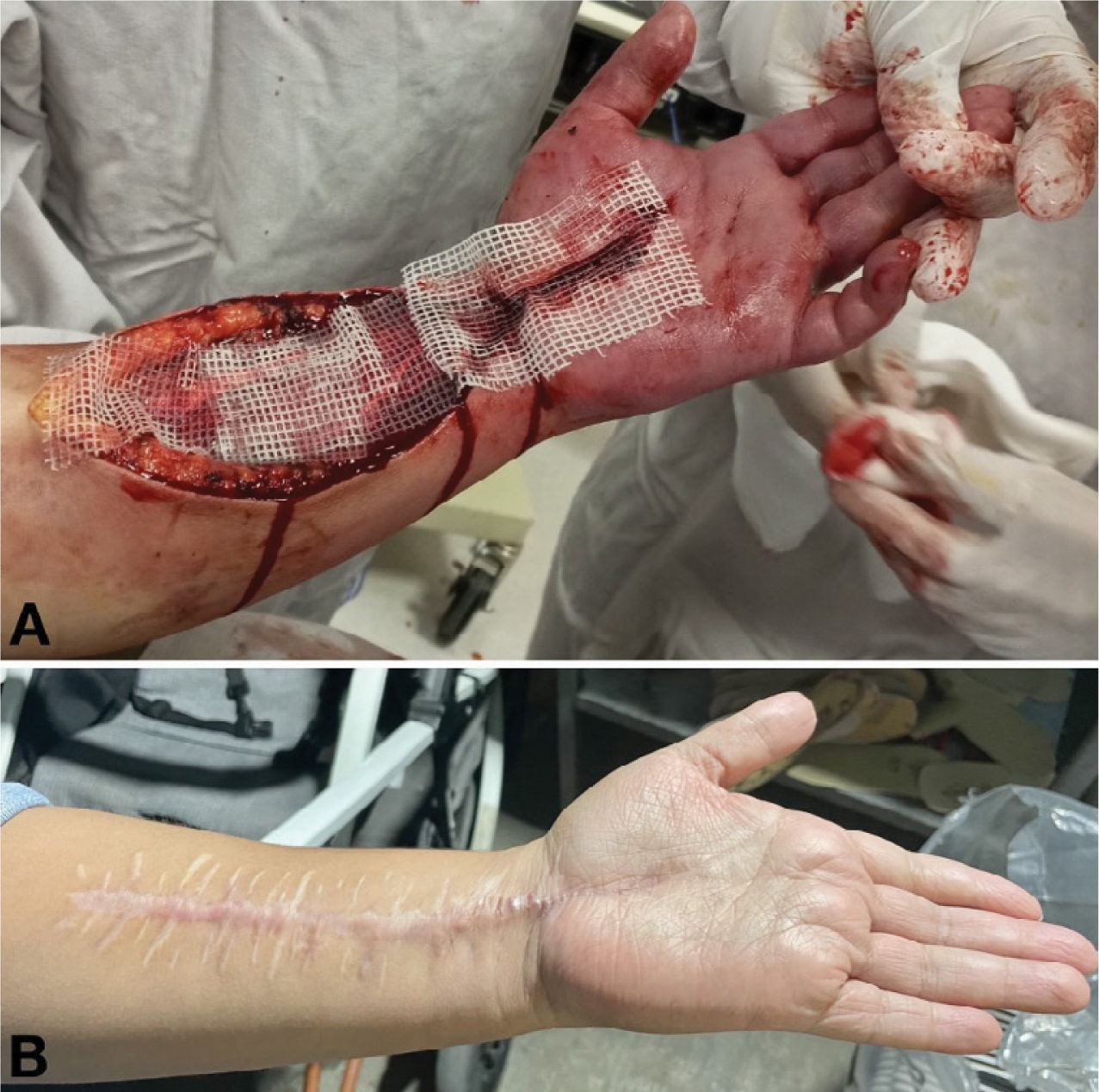
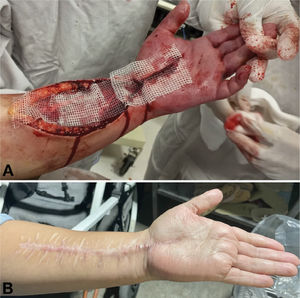
Se realiza ecografía Doppler venoso de extremidad superior izquierda por aumento de volumen y progresión del cambio de coloración, reportando trombosis venosa axilar y radial con indicios de síndrome compartimental. Es valorada por el equipo de angiología quienes realizan fasciotomías en cara ventral y dorsal de antebrazo y palma izquierda, mejorando la coloración, pulso y temperatura de la extremidad. Se mantiene con tratamiento anticoagulante (figura 2A). Se realiza tomografía de cráneo, la cual se informó sin anormalidades por lo que se inicia ventana neurológica, realizándose protocolo de weaning cardíaco. La paciente se extuba exitosamente a los 6 días post intubación, manteniéndose con requerimiento mínimo de oxígeno. Se retira dispositivo de monitoreo hemodinámico, mejorando los valores de IC y SVRI, último lactato 1,9 mmol/l, ΔCO2 5mmHg, y saturación central venosa de oxígeno (Scv02) de 67%. Se logra retiro de apoyo vasopresor a los 7 días.
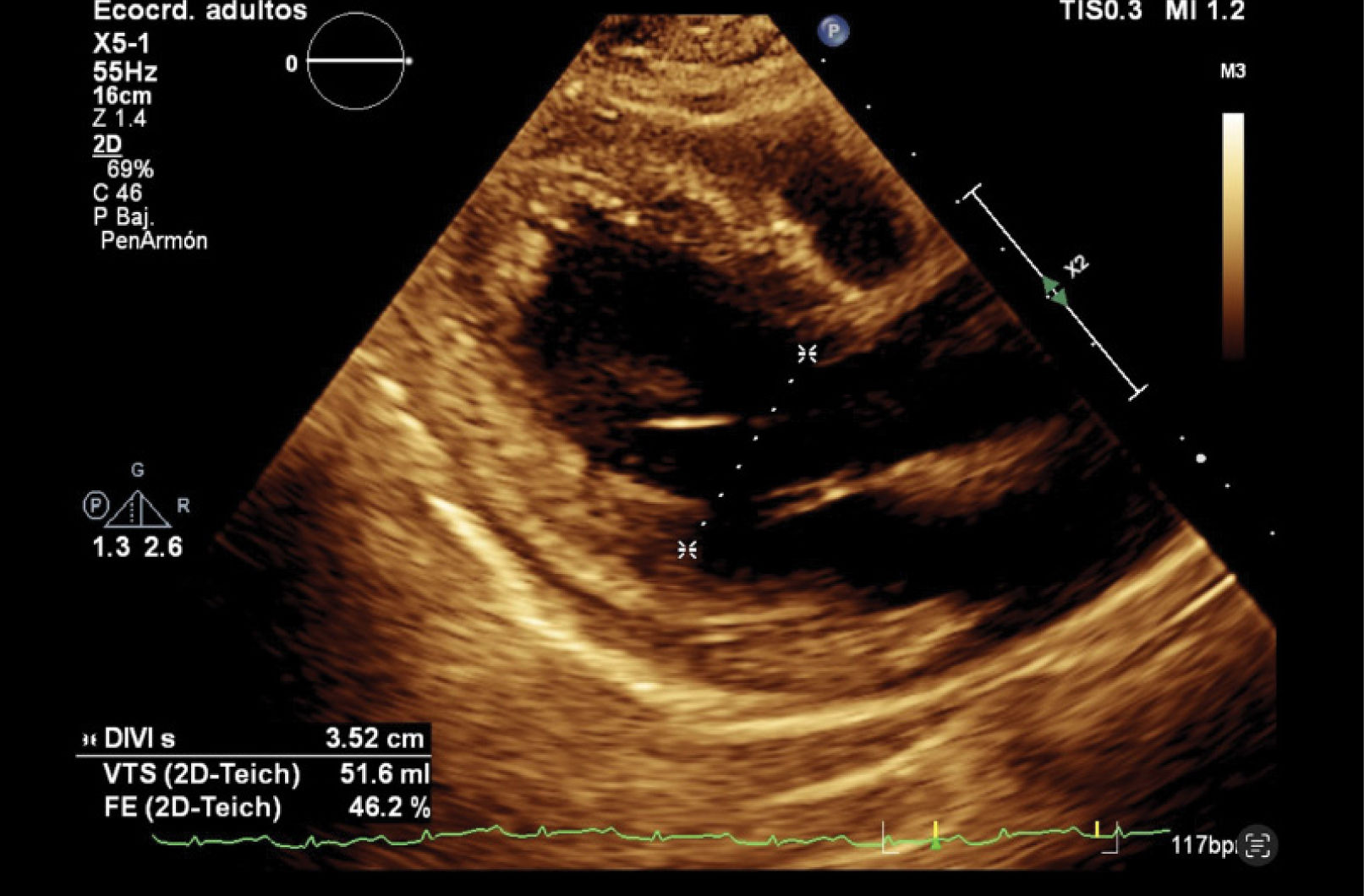
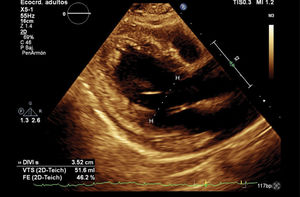
Se realiza ecocardiograma transtorácico de control que reporta remodelado concéntrico, hipocinesia global, ligera disquinesia posterolateral apical, FEVI por Simpson y Teicholz de 46%, ventrículo derecho sin dilatación, TAPSE (tricuspid annular plane systolic excursion) 14mm, adecuada función valvular, IC 2,2l/min/m2, función diastólica conservada con presiones de llenado normales. Los resultados de exámenes y evolución clínica se consideran compatibles con miocardiopatía periparto (figura 3).
Egresa de terapia intensiva después 7 días, continuando con cierres parciales de fasciotomías hasta lograr cierre total a las 5 semanas (figura 2B). Continua en control con el departamento de cardiología, quienes documentan recuperación total de la función cardíaca.
DiscusiónEstudios recientes han sugerido que los mecanismos patogénicos de la MCPP están desencadenados por hormonas producidas en el tercer trimestre por la hipófisis materna y la placenta durante el período periparto, que actúan en sinergia con factores cardíacos intrínsecos. La prolactina y sFlt-1 (tirosina quinasa 1 soluble similar a FMS) son hormonas producidas por la hipófisis y la placenta respectivamente, y normalmente modulan la fisiología materna para apoyar el crecimiento y desarrollo del feto. Sin embargo, se ha propuesto que, en la MCPP, la prolactina es escindida por la catepsina D (activada por estrés oxidativo) en un fragmento de 16 KDa (prolactina-16KDa) el cual es cardiotóxico al dañar la vasculatura cardíaca. Este daño vascular conduce a la liberación de microRNA-146a que bloquea importantes vías de señalización, lo que induce lesión miocárdica e insuficiencia metabólica. Por su parte, la secreción placentaria de sFlt-1 que está marcadamente elevada en la preeclampsia y embarazo múltiple, tiene efectos antiangiogénicos al unir y neutralizar al factor de crecimiento endotelial vascular (VEGF)7,8.
Además, el coactivador 1α del receptor γ activado por el proliferador de peroxisomas (PGC-1α) y el factor transcripcional 3 (STAT3) son producidos por los cardiomiocitos y normalmente protegen la vasculatura cardíaca de factores antiangiogénicos (como sFlt-1), en la fase periparto. PGC-1α induce la expresión de la enzima manganeso superóxido dismutasa, suprimiendo así las especies reactivas de oxígeno, y también induce la expresión de VEGF. En la MCPP, la ausencia de PGC-1α disminuye la producción local de VEGF, que, cuando se combina con sFlt1 circulante alto durante la gestación, conduce a toxicidad vascular. Por lo tanto, se ha planteado la hipótesis de que el exceso de sFlt1 secretado por la placenta al final de la gestación constituye una segunda injuria hormonal a la vasculatura del corazón, el cual se defiende de esta agresión, en parte con una fuerte secreción local de VEGF8–10.
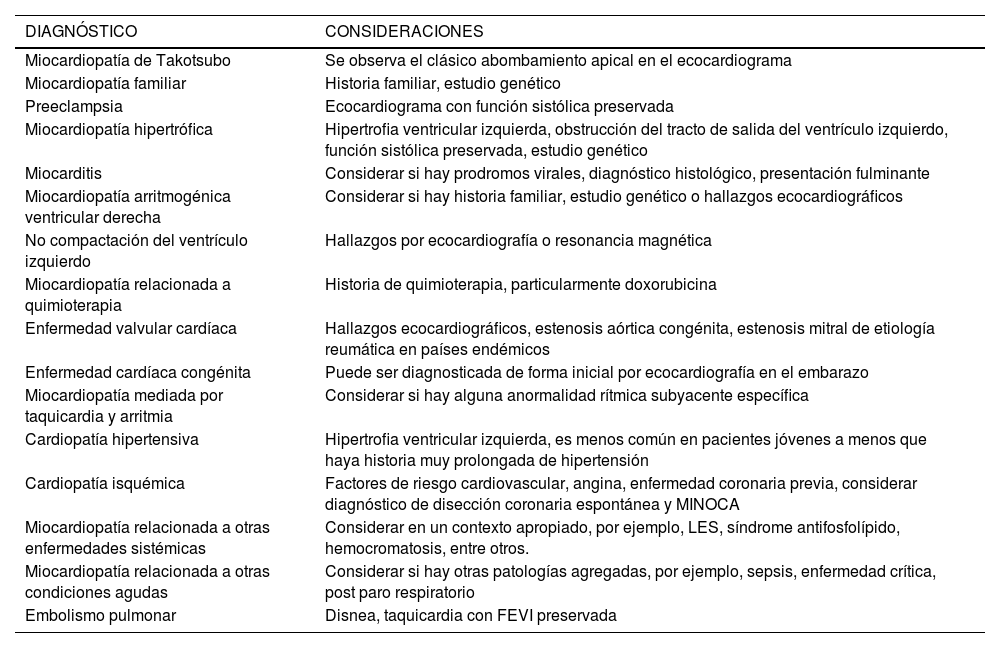
La MCPP es una patología de diagnóstico por exclusión, por lo que se deben descartar los diagnósticos diferenciales de falla cardíaca en el embarazo (tabla 1). En la evaluación ecocardiográfica encontraremos disminución de la FEVI, dilatación y/o disfunción ventricular derecha o izquierda, regurgitación mitral o tricuspídea, hipertensión pulmonar y dilatación auricular izquierda o biauricular. Se deben evaluar los niveles de péptido natriurético cerebral (PNC) y pro-PNC. En el caso de preeclampsia hay una elevación moderada y cuando existe MCPP hay una marcada elevación. El electrocardiograma puede mostrar anormalidades no específicas de dilatación de cavidades o arritmias. La resonancia magnética cardíaca proporciona medición de cavidades y FEVI cuando el ecocardiograma es inadecuado o no está disponibles. Debe tomarse en cuenta que el gadolinio está contraindicado durante el embarazo. La biopsia de endocardio está indicada solo si hay sospecha de un diagnóstico alternativo11.
Diagnósticos diferenciales de falla cardíaca en el embarazo
| DIAGNÓSTICO | CONSIDERACIONES |
|---|---|
| Miocardiopatía de Takotsubo | Se observa el clásico abombamiento apical en el ecocardiograma |
| Miocardiopatía familiar | Historia familiar, estudio genético |
| Preeclampsia | Ecocardiograma con función sistólica preservada |
| Miocardiopatía hipertrófica | Hipertrofia ventricular izquierda, obstrucción del tracto de salida del ventrículo izquierdo, función sistólica preservada, estudio genético |
| Miocarditis | Considerar si hay prodromos virales, diagnóstico histológico, presentación fulminante |
| Miocardiopatía arritmogénica ventricular derecha | Considerar si hay historia familiar, estudio genético o hallazgos ecocardiográficos |
| No compactación del ventrículo izquierdo | Hallazgos por ecocardiografía o resonancia magnética |
| Miocardiopatía relacionada a quimioterapia | Historia de quimioterapia, particularmente doxorubicina |
| Enfermedad valvular cardíaca | Hallazgos ecocardiográficos, estenosis aórtica congénita, estenosis mitral de etiología reumática en países endémicos |
| Enfermedad cardíaca congénita | Puede ser diagnosticada de forma inicial por ecocardiografía en el embarazo |
| Miocardiopatía mediada por taquicardia y arritmia | Considerar si hay alguna anormalidad rítmica subyacente específica |
| Cardiopatía hipertensiva | Hipertrofia ventricular izquierda, es menos común en pacientes jóvenes a menos que haya historia muy prolongada de hipertensión |
| Cardiopatía isquémica | Factores de riesgo cardiovascular, angina, enfermedad coronaria previa, considerar diagnóstico de disección coronaria espontánea y MINOCA |
| Miocardiopatía relacionada a otras enfermedades sistémicas | Considerar en un contexto apropiado, por ejemplo, LES, síndrome antifosfolípido, hemocromatosis, entre otros. |
| Miocardiopatía relacionada a otras condiciones agudas | Considerar si hay otras patologías agregadas, por ejemplo, sepsis, enfermedad crítica, post paro respiratorio |
| Embolismo pulmonar | Disnea, taquicardia con FEVI preservada |
Abreviaturas: MINOCA myocardial infarction in non-obstructive coronary arteries; LES lupus eritematoso sistémico; FEVI: fracción de eyección del ventrículo izquierdo.
En presencia de una insuficiencia cardíaca descompensada o choque cardiogénico se debe aplicar el tratamiento de acuerdo a las guías de insuficiencia cardíaca aguda, tomando las medidas necesarias para resguardar la seguridad del feto, así como la lactancia materna. Para el manejo de la falla cardíaca durante la lactancia se pueden utilizar beta-bloqueadores, ciertos inhibidores de la enzima convertidora de angiotensina (IECA) y/o inhibidores mineralocorticoides. Durante el embarazo se debe evitar el tratamiento con ciertos IECA, antagonistas de receptores de angiotensina II, sacubitrilo/valsartán, inhibidores del cotransportador de sodio-glucosa tipo 2 e inhibidores mineralocorticoides. En pacientes dependientes de inotrópicos se debe evitar el uso de dobutamina, debido a los efectos tóxicos en estas pacientes y, en caso de requerirlo se puede considerar el uso de levosimendán. El vasopresor de elección es la norepinefrina5,12,13. No hay un consenso en cuanto al uso de bromocriptina, sin embargo, se han realizado estudios en los cuales se sugiere un esquema de tratamiento durante una semana en casos no complicados y un esquema prolongado a 8 semanas para pacientes con FEVI <25%, compromiso del ventrículo derecho, requerimiento de cuidados intensivos o choque cardiogénico14.
ConclusiónLa MCPP sigue siendo una entidad clínica subdiagnosticada y poco reconocida entre los profesionales de la salud. A pesar de su rareza, sus implicaciones pueden ser devastadoras, como lo ejemplifica el caso presentado. En este caso clínico la paciente experimentó una serie de complicaciones graves, lo que resalta la importancia de la pronta identificación y gestión de esta condición.
El caso presentado ilustra un desenlace positivo, a pesar de las complicaciones iniciales. La pronta intervención multidisciplinaria, incluyendo medidas de reanimación y soporte cardiovascular, condujo a una recuperación completa de la función cardíaca de la paciente.
Este reporte de caso destaca la importancia de la vigilancia y el reconocimiento temprano de la MCPP, así como la necesidad de enfoques terapéuticos personalizados. La investigación continua y el intercambio de experiencias clínicas son esenciales para mejorar la comprensión y el manejo de esta compleja entidad médica.
FinanciaciónNo se cuenta con fuentes de financiación.
Conflicto de interésLos autores declaran no tener ningún conflicto de interés.