En el proceso de búsqueda de biomarcadores para el pronóstico del ictus agudo, en los últimos años los estudios realizados en torno al ácido úrico han mostrado resultados contradictorios.
MétodosSe recogieron muestras analíticas de 600 pacientes ingresados de manera consecutiva en un hospital de tercer nivel y se analizó la relación entre los niveles de ácido úrico y el pronóstico funcional de los pacientes medido mediante la escala de Rankin modificada (mRS). Se excluyeron los pacientes que habían recibido terapias de reperfusión, ya que podría existir un efecto diferencial en los mismos respecto a los no tratados.
ResultadosEl 73% de los pacientes tuvieron una mRS ≤2 y los niveles medios de ácido úrico fueron de 5,22mg/dl. Se encontró una relación no lineal entre el pronóstico funcional al alta y los niveles de ácido úrico sérico en el momento del ingreso al excluir del análisis la medida de la National Institutes of Health Stroke Scale (NIHSS).
ConclusionesLos valores séricos de ácido úrico en pacientes afectos de un ictus isquémico agudo se asocian significativamente con el pronóstico funcional en el momento de su alta, pero esta relación es no lineal. Se asocia un peor pronóstico a las concentraciones extremas, muy bajas o muy elevadas, de ácido úrico. Esto podría revelar un doble papel del ácido úrico en su relación con el ictus, como factor de riesgo asociado y/o como posible neuroprotector dado su papel antioxidante.
Recent studies on uric acid as a biomarker for the prognosis of acute stroke have found conflicting results.
MethodsWe collected blood samples from 600 consecutively admitted patients at our tertiary hospital and analysed the relationship between uric acid levels and functional prognosis (measured using the modified Rankin Scale [mRS]). Patients who had received reperfusion therapy were excluded since this may have influenced uric acid levels.
ResultsA total of 73% of patients had mRS scores ≤2; the mean uric acid level was 5.22mg/dL. We found a nonlinear relationship between functional prognosis at discharge and serum uric acid levels at admission when the National Institutes of Health Stroke Scale score was excluded from the analysis.
ConclusionsSerum uric acid levels in patients with acute ischaemic stroke are significantly associated with functional prognosis at discharge, although this relationship is nonlinear. In fact, poorer prognosis is associated both with very low and with very high concentrations of uric acid. This suggests a dual role of uric acid in relation to stroke: on the one hand, as an associated risk factor, and on the other, as a possible neuroprotective factor due to its antioxidant effect.
Numerosos biomarcadores han sido investigados como factor pronóstico en el ictus isquémico, sin quedar claro hasta hoy si alguno de ellos añade algún valor pronóstico a las variables clínicas1. Entre estos biomarcadores, los estudios realizados con el ácido úrico (AU) han mostrado resultados contradictorios, asociándose los niveles elevados de AU tanto con buen como con mal pronóstico2-4.
Los niveles de AU en plasma están relacionados con muchos de los factores de riesgo clásicos de ictus, como la hipertensión arterial5. El estrés oxidativo y la liberación de radicales libres juegan un papel fundamental en la fisiopatología del ictus agudo6. El AU es el principal antioxidante endógeno en plasma, en donde contribuye hasta en dos tercios de la capacidad de control sobre los radicales libres7, y por tanto podría jugar un papel protector ante determinadas enfermedades vasculares8 como el ictus.
En modelos animales, las concentraciones de AU se incrementan significativamente durante el ictus isquémico, pudiendo persistir esta elevación hasta 48h9. Los resultados clínicos en humanos son sin embargo contradictorios. Algunos estudios han demostrado una buena relación de niveles elevados de AU en pacientes ingresados por ictus con mejor pronóstico funcional2,10 y otros con peor pronóstico del ictus isquémico4,11. En el caso concreto de pacientes tratados con trombólisis el número de estudios es más limitado, pero los resultados van a favor de un efecto positivo de niveles elevados de AU en el resultado de la trombólisis12.
A la vista de estos resultados se ha valorado un posible efecto sinérgico del AU con el activador tisular del plasminógeno (rTPA, Alteplase). En un estudio en faseIII publicado en 2014 se concluye que añadir AU al tratamiento trombolítico aumentó de forma no significativa el porcentaje de resultados excelentes (resultado de 0-1 en la escala de Rankin modificada [mRS]) pero no supone ningún riesgo de seguridad, proponiéndose la ampliación del estudio para aumentar la potencia en búsqueda de resultados positivos13.
La actividad efectiva del AU en el ictus isquémico es por tanto un tema de investigación con resultados contradictorios en los últimos años. Por un lado, su importancia como marcador de riesgo vascular, y por otro, su posible valor pronóstico y terapéutico en la fase aguda del ictus, hacen de este producto endógeno una molécula de interés y una posible diana terapéutica.
Por todo ello, hemos efectuado este trabajo con el objetivo de analizar si los niveles séricos de AU tienen relación con un mejor pronóstico funcional al alta en pacientes que han tenido un ictus isquémico, valorando asimismo su posible relación con otras variables clínicas y analíticas.
Pacientes y métodosSe recogieron de forma prospectiva datos epidemiológicos y clínicos de un total de 600 pacientes que ingresaron de manera consecutiva por ictus en el Hospital Universitario de Gran Canaria Dr. Negrín a cargo del Servicio de Neurología durante 18 meses consecutivos. Se excluyeron los infartos hemorrágicos y aquellos pacientes que recibieron tratamiento trombolítico. Los pacientes que recibieron tratamiento trombolítico fueron excluidos al asumirse un posible efecto diferencial frente a los no tratados. El Hospital Universitario de Gran Canaria Dr. Negrín es un hospital de tercer nivel que atiende a un volumen poblacional de aproximadamente 335.000 habitantes del área norte de la isla de Gran Canaria y la isla de Lanzarote.
Los pacientes ingresaron en este Servicio en las primeras 72h tras el evento clínico principal, recogiéndose los datos en el momento del ingreso. Se extrajo sangre en ayunas, en las primeras 24h tras el ingreso hospitalario. El pronóstico clínico se midió en el momento del alta mediante la escala mRS14,15. Se eligió esa escala al tratarse de la más utilizada en estudios de ictus, si bien se trata de una escala que mide actividades de la vida diaria que no pueden ser evaluadas de forma óptima durante el ingreso.
Análisis de datosSe analizó la relación existente entre los niveles de AU en sangre con cada una de las variables obtenidas en la muestra para explorar posibles relaciones significativas que pudieran alterar los resultados.
En orden a determinar las variables que mantenían asociación independiente con la mRS se realizaron 2 análisis multivariantes, siendo en ambos casos la variable dependiente la mRS en escala continua. En el primero se llevó a cabo una selección de variables basada en el algoritmo de enumeración completa y el criterio de información bayesiano (BIC). En el segundo se realizó el mismo análisis, pero excluyéndose la puntución en la National Institutes of Health Stroke Scale (NIHSS). Para las variables numéricas seleccionadas se exploraron sus posibles efectos no lineales utilizando los modelos aditivos (Hastie y Tibshirani, 1986). Tales efectos no lineales se estimaron mediante splines cúbicos.
Un contraste de hipótesis se consideró estadísticamente significativo cuando el correspondiente valor de p fue inferior a 0,05. Los datos se analizaron utilizando el paquete R, versión 3.1.016.
ResultadosDescripción de la muestraLa edad media de los pacientes en el momento del ingreso fue de 68±12,9 años. El 55,2% (331) de los pacientes fueron hombres y el 69,8% (419) habían sido diagnosticados de hipertensión. Aproximadamente el 37% de los pacientes tenían diabetes mellitus o dislipidemia, el 20% fibrilación auricular y el 25,5% eran fumadores activos. La media de puntuación en la NIHSS fue de 3, con un rango intercuartílico de 1;5.
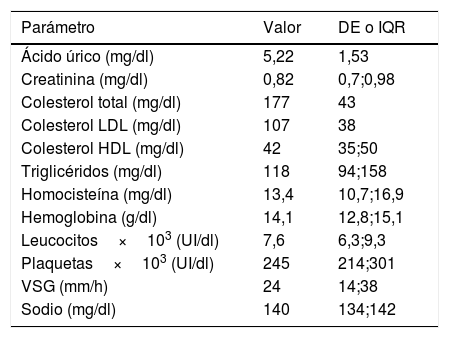
En la tabla 1 se muestran los resultados de los parámetros analíticos: hemograma y bioquímica.
Distribución de variables analíticas en la población total
| Parámetro | Valor | DE o IQR |
|---|---|---|
| Ácido úrico (mg/dl) | 5,22 | 1,53 |
| Creatinina (mg/dl) | 0,82 | 0,7;0,98 |
| Colesterol total (mg/dl) | 177 | 43 |
| Colesterol LDL (mg/dl) | 107 | 38 |
| Colesterol HDL (mg/dl) | 42 | 35;50 |
| Triglicéridos (mg/dl) | 118 | 94;158 |
| Homocisteína (mg/dl) | 13,4 | 10,7;16,9 |
| Hemoglobina (g/dl) | 14,1 | 12,8;15,1 |
| Leucocitos×103 (UI/dl) | 7,6 | 6,3;9,3 |
| Plaquetas×103 (UI/dl) | 245 | 214;301 |
| VSG (mm/h) | 24 | 14;38 |
| Sodio (mg/dl) | 140 | 134;142 |
DE: desviación estándar; IQR: rango intercuartílico; VSG: velocidad de sedimentación globular.
Todos los pacientes fueron estudiados mediante eco doppler de troncos supraaórticos, detectándose estenosis carotídea mayor del 50% en 49 (8,2%) y estenosis menor del 50% en 21 (3,5%), no hallándose estenosis significativa en los restantes 530 pacientes (88,3%).
La clasificación etiológica se estableció conforme a los criterios TOAST17, encontrando un 37% de ictus de origen indeterminado o inhabitual, un 23% de ictus lacunares, un 21% de ictus aterotrombóticos y un 19% de ictus cardioembólicos.
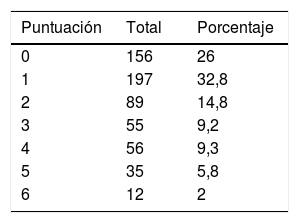
En el momento del alta se estratificó a los pacientes por grado de dependencia funcional según la escala mRS14,15. Estos resultados se muestran en la tabla 2.
Desde un punto de vista operativo y siguiendo modelos de estudios previos10,18, se dividió el pronóstico funcional como favorable si la puntuación en mRS era ≤2 o desfavorable si mRS puntuaba >2. Así en el momento del alta hospitalaria 442 (73,7%) pacientes tuvieron buen pronóstico funcional y 158 (26,3%) tuvieron mal pronóstico funcional o fallecieron durante el ingreso hospitalario.
Modelo de regresión aditivo multivariante para la escala funcional de Rankin modificadaSe realizó un modelo de regresión aditivo con los elementos más significativos de los obtenidos.
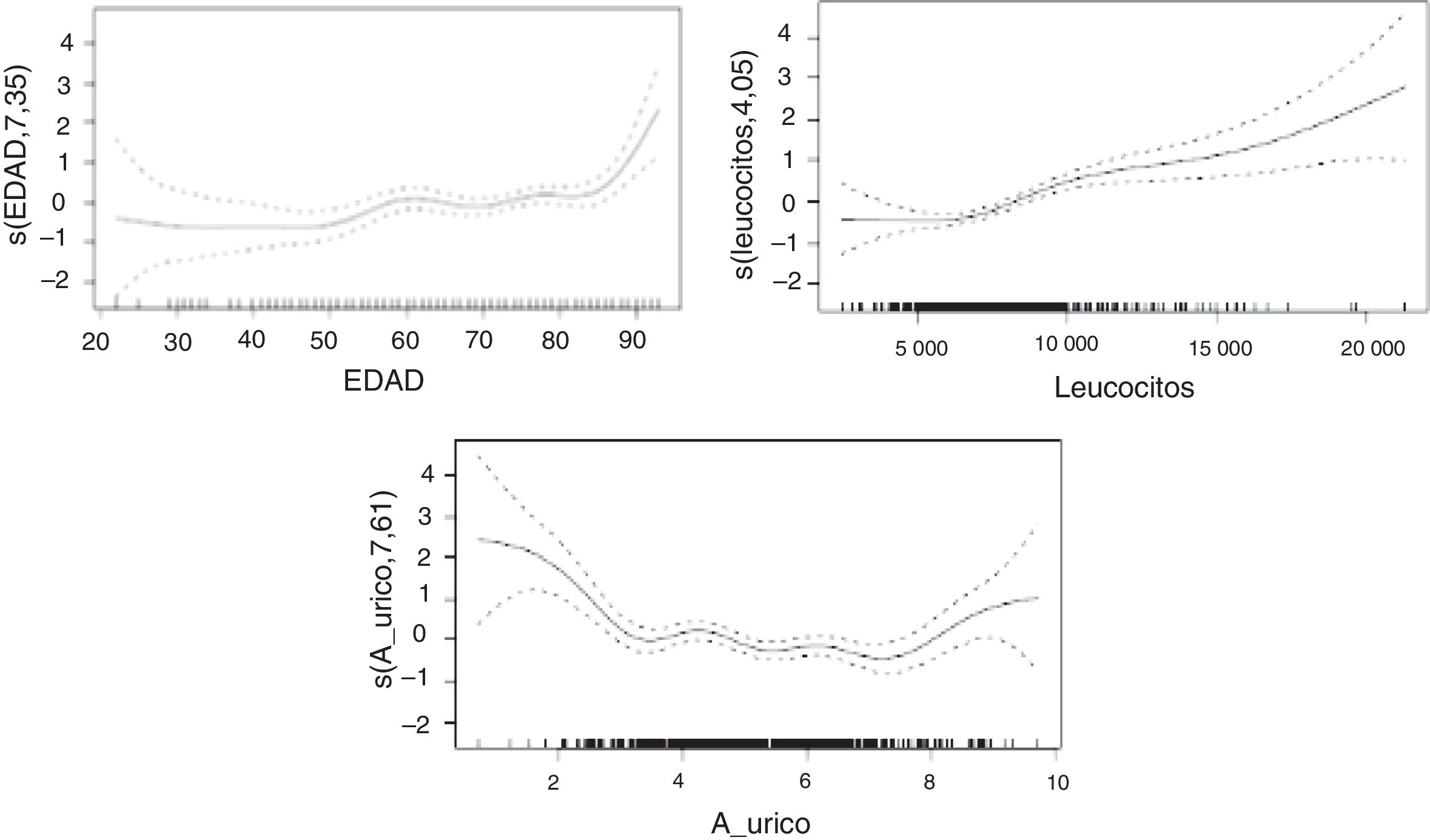
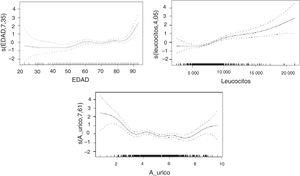
En un primer modelo las variables seleccionadas fueron la edad (p<0,001), el recuento leucocitario (p<0,001) y el índice de gravedad NIHSS (p<0,001). Para estas variables, el uso de los modelos aditivos mostró efectos no lineales para el recuento leucocitario y el NIHSS.
En múltiples modelos exploratorios realizados se observó una importante asociación de los niveles de AU con la funcionalidad en el momento del alta si se excluía la puntuación en la NIHSS. La puntuación en la NIHSS recoge aspectos de la gravedad del paciente e indirectamente del volumen del ictus, y tal vez por esto interfiere al analizar el efecto directo de otros marcadores como el AU. Por este motivo se realizó un segundo análisis multivariante excluyendo la NIHSS, que permitió analizar mejor el efecto del AU sobre el pronóstico funcional medido mediante la mRS al alta.
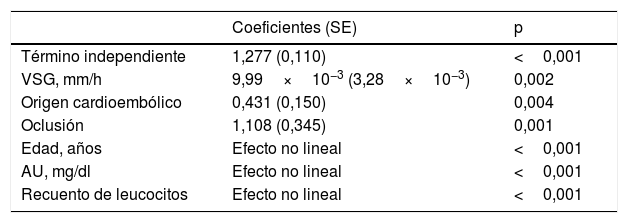
En el modelo que excluyó la puntuación de la NIHSS, permanecieron con la significación que se recoge en la tabla 3 variables como la velocidad de sedimentación globular, el origen cardioembólico del ictus y el hallazgo de oclusión carotídea con una relación lineal. La edad, los niveles de AU y el recuento de leucocitos mostraron una relación no lineal con la puntuación en la mRS al alta. La desagregación del análisis por sexos no muestra resultados significativamente diferentes para el comportamiento del AU que cuando se estudia la cohorte completa.
Modelo de regresión aditivo multivariante para la escala de Rankin modificada (mRS)a
| Coeficientes (SE) | p | |
|---|---|---|
| Término independiente | 1,277 (0,110) | <0,001 |
| VSG, mm/h | 9,99×10−3 (3,28×10−3) | 0,002 |
| Origen cardioembólico | 0,431 (0,150) | 0,004 |
| Oclusión | 1,108 (0,345) | 0,001 |
| Edad, años | Efecto no lineal | <0,001 |
| AU, mg/dl | Efecto no lineal | <0,001 |
| Recuento de leucocitos | Efecto no lineal | <0,001 |
AU: ácido úrico; SE: error estándar; VSG: velocidad de sedimentación globular.
Las relaciones no lineales entre la mRS y el AU, la edad de los pacientes y el recuento de leucocitos quedan recogidas en la figura 1.
La edad muestra una clara relación con incrementos de puntuaciones en la mRS, que se hace mucho más marcada en las personas de edad más avanzada. En cuanto a los valores de AU, se encuentra una relación en la que los valores extremos de la muestra están asociados a un marcado aumento en las puntuaciones de mRS, permaneciendo la relación con influencia menos marcada en los rangos intermedios. Por último, los leucocitos muestran una relación en la que concentraciones más elevadas de leucocitos se asocian a cambios más marcados en las puntuaciones de mRS.
DiscusiónEl conocimiento de los procesos fisiopatológicos que se ponen en marcha durante un ictus y en las fases inmediatamente posteriores es un elemento fundamental para ir más allá en el tratamiento y el pronóstico de esta enfermedad.
Los sucesivos estadios que conducen a la muerte neuronal, en este contexto son cada vez más conocidos y abarcan procesos de necrosis y de apoptosis. En ambos procesos la participación de mecanismos de oxidación juega un papel determinante6,19-21.
El AU es el principal antioxidante endógeno del organismo y se ha propuesto un posible papel protector del mismo en algunas enfermedades vasculares como el ictus7,8. Este extremo ha sido evaluado en varios estudios que han intentado mostrar la relación entre los niveles de AU en suero y el pronóstico funcional del ictus. Sin embargo, los resultados han sido contradictorios2,4,11,18,22-25.
Se observó una relación significativa entre los niveles de AU en el momento del ingreso y el pronóstico funcional al alta. Se comprobó que niveles más elevados de AU estaban relacionados con un mejor pronóstico funcional al alta. Estos hallazgos son concordantes con una parte de los estudios publicados en la literatura2,10 y, entre ellos, con un reciente metaanálisis publicado por Wang et al.25. Se atribuye a su capacidad antioxidante la causa subyacente al beneficio observado, contribuyendo a un menor daño neuronal al dificultar los procesos necróticos o de apoptosis en los territorios sometidos a isquemia7,26,27.
Al analizar estos hallazgos, teniendo en cuenta posibles factores de confusión que se relacionan con el ictus y con el AU, como la edad, el colesterol, los leucocitos o la hemoglobina, esta relación estadísticamente significativa (p<0,001) mostró un comportamiento no lineal, de manera que los pacientes que presentaron valores extremos de AU presentaron un peor pronóstico funcional. Estos resultados concuerdan con lo publicado por Seet et al., quienes en 201024 encontraron una relación en «U» e interpretaron que los pacientes con ictus y niveles muy bajos de AU podrían encontrarse en una situación de «mayor desprotección» ante situaciones de mayor estrés oxidativo y que los pacientes con niveles muy elevados tendrían peor pronóstico por un mecanismo no conocido. El mismo grupo insiste en que estos hallazgos no prueban causalidad de la relación.
En el presente estudio esta relación entre el AU y el pronóstico funcional del ictus se muestra como una relación en «U» o en «J», en la que tanto los niveles muy bajos como los niveles muy altos de AU en el momento del ictus son deletéreos para el pronóstico funcional al alta del paciente.
Estos resultados son concordantes con los publicados en la literatura asociando AU con variables de pronóstico neurológicas24, así como de la salud vascular global28. Teniendo todos estos datos en cuenta, cobra sentido el doble papel del AU en la etiopatogenia del ictus.
Por un lado, niveles muy bajos de AU serían perjudiciales, ya que estarían traduciendo un escaso poder antioxidante del organismo ante un evento como el ictus, en que el estrés oxidativo juega un papel importante29. Varios estudios han sido capaces de demostrar in vitro y en modelos animales el papel protector del AU sobre tejidos neuronales en situaciones de isquemia aguda26,30, por lo que globalmente un nivel bajo de AU predice un mal pronóstico en fase aguda de ictus. Sobre la base de este postulado, el AU se ha probado como adyuvante en el tratamiento trombolítico en el ictus agudo. Estos estudios han evidenciado que la adición de AU en la fase aguda del ictus no tiene un papel perjudicial, y que incluso podría tener un papel beneficioso, especialmente en mujeres (esto podría explicarse por sus niveles basales más bajos)13,31,32.
Por otro lado, los niveles muy altos de AU están asociados a un peor pronóstico funcional en fase aguda del ictus. Sin embargo, hasta ahora no se han diseñado estudios para profundizar en esta asociación estadísticamente significativa. Fisiopatológicamente, lo más plausible es atribuir el peor pronóstico a una peor «salud vascular» en los pacientes con niveles muy elevados de AU, con un elevado índice de presencia de factores de riesgo cardiovascular concomitante. En nuestra serie no disponemos de información detallada de comorbilidad asociada que pudiera corroborar esta hipótesis. El AU es un factor predictor independiente de hipertensión33. Los niveles elevados de AU promueven la peroxidación de los lípidos, lo que aumenta la fragilidad de la placa de ateroma34. También dificulta la generación de óxido nítrico, induce la proliferación de células musculares lisas y, globalmente, disfunción endotelial35,36. Además, la hiperuricemia modifica la adhesividad plaquetar, lo que puede tener efectos en los procesos de agregación y coagulación intravasculares28. Por último, el comportamiento como antioxidante del AU podría verse alterado en ciertas circunstancias como los niveles bajos de ácido ascórbico, que podrían disminuir su potencial efecto protector, incluso actuando como pro-oxidante37. Todos estos factores podrían contribuir a que en una situación en la que el flujo sanguíneo cerebral se ve alterado y se desencadenan procesos de necrosis y de apoptosis, el paciente con hiperuricemia disponga de «menos recursos» a la hora de mejorar la perfusión del territorio infartado, quizás por una menor disponibilidad de circulación colateral.
En cuanto a las limitaciones, en primer lugar, las características propias de los pacientes en cada estudio pueden generar diferencias importantes en los resultados. En el presente estudio se decidió no incluir a los ictus hemorrágicos ni a los pacientes tratados con trombolíticos, ya que nos pareció que en estos 2 grupos de pacientes el comportamiento clínico y los aspectos fisiopatológicos podían tener implicaciones diferentes debido a que, por ejemplo, precisamente en pacientes tratados con trombólisis el AU podría ser especialmente protector12. Además, no se ajustaron los niveles de AU por el uso de fármacos, ni se utilizaron medidores de estrés oxidativo que podrían contribuir a eliminar factores de confusión. Por otro lado, no se recogió la variable tamaño del infarto, y se excluyó del análisis final la puntuación en la NIHSS por la posibilidad de que ocurriera un consumo de AU durante la fase aguda del ictus y de que el consumo fuera mayor en ictus más extensos; esto podría suponer limitaciones en la interpretación de los resultados.
Quizá la limitación más relevante del presente estudio es la ausencia de una medición estricta de los tiempos de recogida de la muestra de sangre. Habitualmente la extracción en nuestro medio se realiza en el primer día tras el ingreso hospitalario, pero esto, dependiendo del momento en que consulta el paciente, puede oscilar desde menos de 6h hasta 24h.
La concentración de AU en sangre varía a lo largo de los primeros días tras un ictus isquémico. Amaro et al. encontraron una caída máxima en los niveles de AU 6h tras el evento en un estudio sobre 8 pacientes que recibieron tratamiento trombolítico38. Brouns et al. encontraron un comportamiento bifásico en las concentraciones de AU tras un ictus, con un nadir al que se llegaba a los 7 días del evento39.
En nuestro estudio, por tanto, los valores séricos de AU en pacientes afectos de un ictus isquémico agudo se asocian significativamente con el pronóstico funcional en el momento de su alta, pero esta relación es no lineal. De hecho, se asocia un peor pronóstico a las concentraciones extremas, o bien muy bajas, o bien muy elevadas de AU.
Conflicto de interesesLo autores declaran que no tienen ningún conflicto de intereses.
Comunicado parcialmente en la Reunión de la European Academy of Neurology 2016 (Copenhagen).