La miastenia gravis (MG) es una enfermedad autoinmune mediada por anticuerpos. El cuadro clínico se caracteriza por debilidad muscular fluctuante y fatigable, con frecuente afectación de músculos fonodeglutorios y respiratorios. Dada la severidad que implica el compromiso respiratorio en la MG, su evaluación rutinaria es esencial.
Nuestro objetivo fue identificar un marcador semiológico útil en la pesquisa del compromiso respiratorio en pacientes con MG.
MétodosSe realizó un trabajo observacional en pacientes con diagnóstico de MG. Los pacientes fueron evaluados con test de cuenta máxima, pico flujo espiratorio (PEF), cuestionario de disnea modificado (mMRC) y valoración de fuerza del cuello. Los resultados de estos parámetros fueron correlacionados con la medición de CVF (capacidad vital forzada) y presiones bucales estáticas máximas (PiMáx y PeMáx).
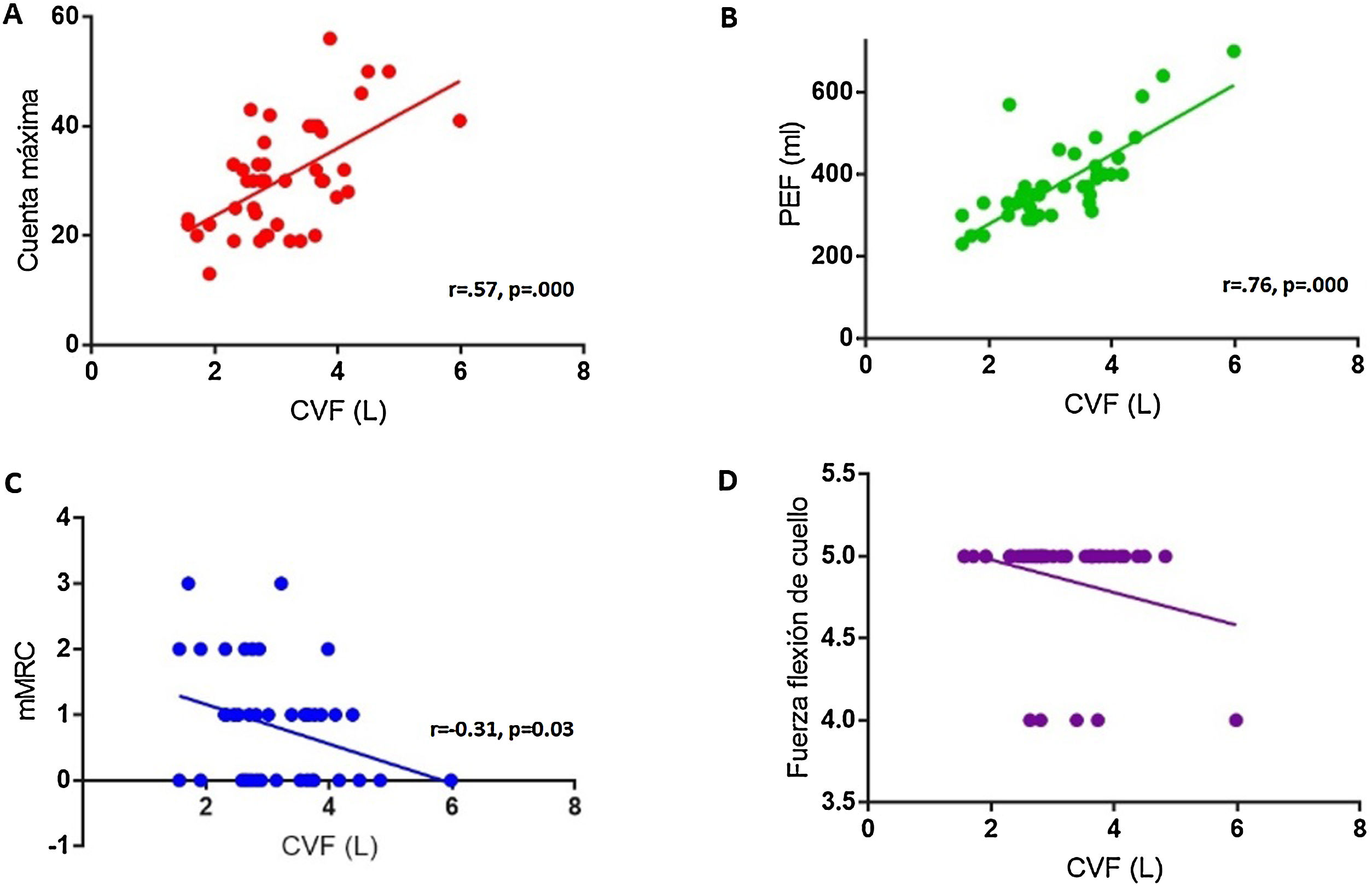
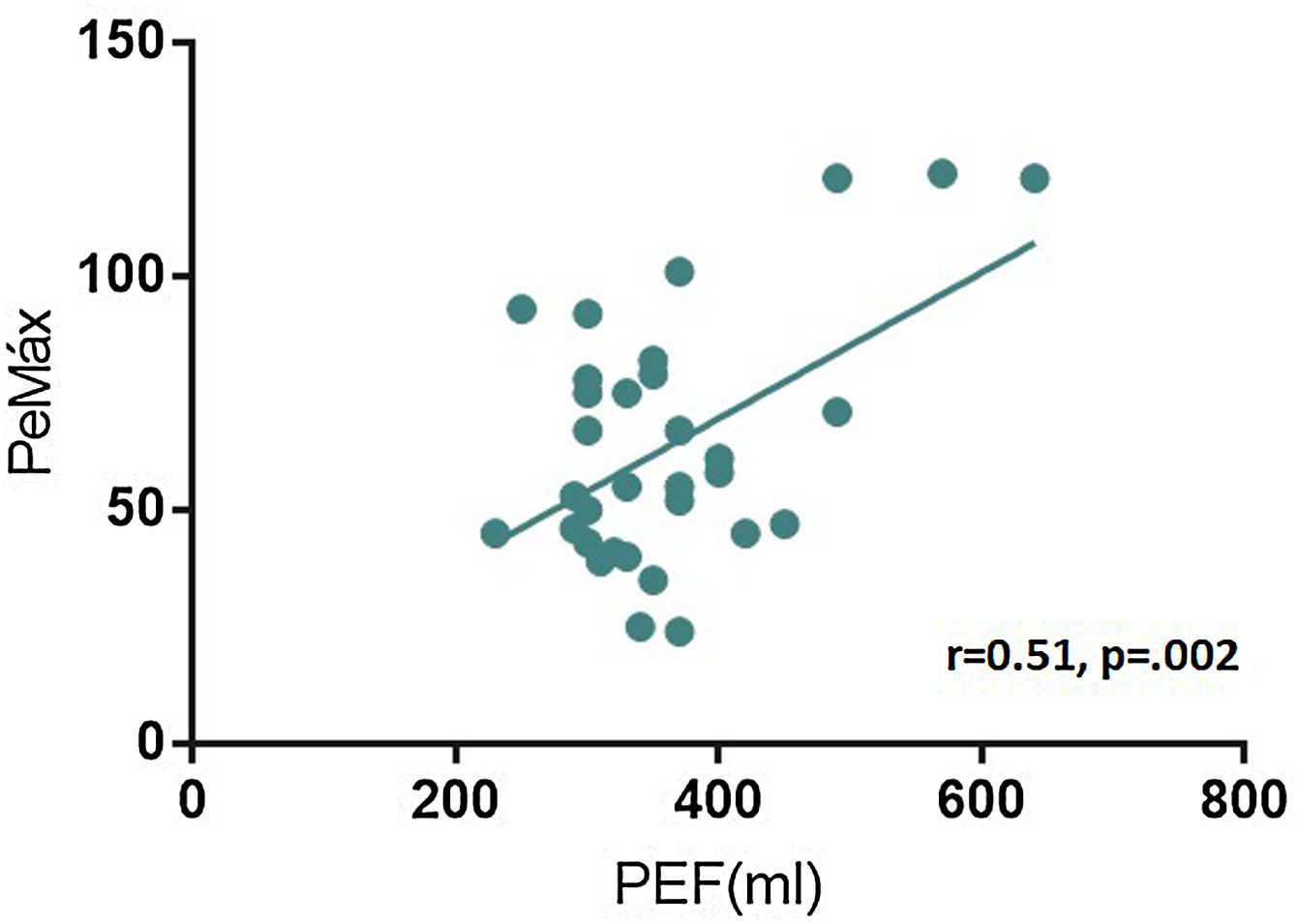
ResultadosCuarenta y cinco pacientes con MG fueron incluidos, dos pacientes tenían MGFA grado I, 35 grado II, siete grado III y uno grado IV al momento de la evaluación. Se halló una correlación positiva entre el test de cuenta máxima y la CVF (r = 0,57, p = 0,000), y entre el PEF y la CVF (r = 0,76, p = 0,000). El grado de disnea, según el mMRC, mostró una correlación negativa con la CVF (r =-0,31 p = 0,03). A su vez, el PEF correlacionó con la PeMáx de forma positiva, estadísticamente significativa (r = 0,51, p = 0,002).
ConclusionesEl PEF, el test de cuenta máxima y el mMRC fueron útiles para evaluar la función respiratoria en pacientes con MG.
Myasthenia gravis (MG) is an antibody-mediated autoimmune disease characterised by fluctuating, fatigable muscle weakness, frequently involving bulbar and respiratory muscles. Considering the severity of respiratory involvement in MG, routine evaluation of respiratory function is essential.
The aim of this study was to identify a useful clinical marker of respiratory involvement in patients with MG.
MethodsWe performed an observational study of patients with MG. All cases were evaluated with the single-breath counting test, peak expiratory flow (PEF), a modified Medical Research Council dyspnoea scale (mMRC), and a neck strength assessment. The results of these parameters were correlated with forced vital capacity (FVC), maximal inspiratory pressure (MIP), and maximal expiratory pressure (MEP).
ResultsThe study included 45 patients with MG: 2 patients classified as grade I on the Myasthenia Gravis Foundation of America classification at the time of evaluation, 35 classified as grade II, 7 classified as grade III, and one classified as grade IV. Positive correlations were found between single-breath counting test scores and FVC values (r = 0.57, p = .000), and between PEF and FVC values (r = 0.76, p = .000). Severity of dyspnoea according to the mMRC scale showed a negative correlation with FVC values (r = -0.31, p = .03). PEF also showed a significant correlation with MEP (r = 0.51, p = .002).
ConclusionsPEF, the single-breath counting test, and the mMRC scale are useful measures for evaluating respiratory function in patients with MG.
La miastenia gravis (MG) es una enfermedad autoinmune, mediada por anticuerpos, que afecta la trasmisión neuromuscular. La mayoría de los pacientes presentan anticuerpos dirigidos contra el receptor nicotínico de acetilcolina (ACRA). En una proporción variable de los pacientes ACRA negativos, se identifican otros anticuerpos con valor patogénico confirmado, como el anticuerpo contra tirosina quinasa músculo específica (anti-MuSK) o el anticuerpo contra la lipoproteína de baja densidad 4 (anti-LRP4). La acción de estos anticuerpos provoca destrucción de la membrana muscular postsináptica, con simplificación de las folias y reducción en el número de receptores y canales iónicos1,2.
El cuadro clínico se caracteriza por debilidad muscular fluctuante y fatigable. Los músculos oculares, apendiculares y bulbares son los más frecuentemente afectados, produciendo síntomas como: ptosis palpebral, diplopía, debilidad en miembros, disartria y disfagia3,4. Asimismo, síntomas respiratorios como disnea u ortopnea, son frecuentemente referidos por estos pacientes5,6.
La debilidad bulbar y/o de los músculos respiratorios puede derivar en alteraciones en los mecanismos fonodeglutorios, acumulación anormal de secreciones en la vía aérea y/o inadecuada expansión pulmonar. Como consecuencia, afecciones respiratorias, como atelectasias y neumonías aspirativas, son complicaciones temidas en estos pacientes7. Cuando una exacerbación de MG provoca un compromiso respiratorio, tal que requiere de soporte ventilatorio invasivo o no invasivo, se define como crisis miasténica. Esta situación ocurre en aproximadamente el 20% de los pacientes en algún momento de la evolución de la enfermedad8,9.
Dada la severidad que implica la debilidad de los músculos respiratorios, su evaluación rutinaria es de esencial importancia en todo paciente con diagnóstico de MG. El examen funcional respiratorio es el estudio de elección para determinar la presencia de trastornos respiratorios de origen neuromuscular. Estas pruebas permiten la determinación de la capacidad vital forzada (CVF), junto con la medición de las presiones bucales: presión inspiratoria máxima (PiMáx) y presión espiratoria máxima (PeMáx). La PiMáx valora la fuerza de los músculos inspiratorios, fundamentalmente del diafragma, pero también de músculos intercostales externos y accesorios. La PeMáx refleja la fuerza de los músculos espiratorios (intercostales internos y abdominales) y se correlaciona con la fuerza de la tos y la eliminación de secreciones. En adultos normales, la CVF cae menos de un 10% cuando es medida en decúbito respecto de su determinación en sedestación; una caída mayor refleja debilidad del diafragma10–12.
La espirometría no siempre se encuentra disponible en la consulta neurológica. Por tal motivo, contar con maniobras simples y accesibles para el neurólogo, que permitan estimar el grado de compromiso ventilatorio de los pacientes con MG, sería una herramienta útil en la práctica cotidiana.
ObjetivosEl objetivo de este estudio fue evaluar la correlación entre los parámetros del examen funcional respiratorio (CVF, PiMáx y PeMáx) y una batería de pruebas semiológicas seleccionadas –test de cuenta máxima, la fuerza de flexión de cuello, cuestionario de disnea modificado, modified Medical Research Council (mMRC), el pico flujo espiratorio–, en pacientes con MG.
Materiales y métodosSe realizó un trabajo correlacional, de corte transversal, en pacientes con diagnóstico de MG evaluados en la Sección de Enfermedades Neuromusculares y Neurofisiología de la División de Neurología del Hospital Ramos Mejía, durante el período de 2016 a 2018.
Se incluyeron pacientes mayores de 18 años con MG generalizada. Todos los pacientes firmaron un consentimiento informado, aprobado por el Comité de Bioética de la institución.
El diagnóstico de miastenia gravis se realizó en función de un cuadro clínico compatible con al menos uno de los siguientes estudios diagnósticos positivos: 1) Anticuerpos antirreceptor de acetilcolina (ACRA) positivos o anti-MuSK; 2) test de estimulación repetitiva con un decremento del potencial motor del 10% o mayor; 3) electromiografía de fibra única con jitter incrementado; 4) respuesta clínica evidente a inhibidores de la acetilcolinesterasa13.
Se consideraron criterios de exclusión: pacientes con enfermedad respiratoria concomitante, pacientes que presentaran debilidad facial que impidiera la realización de la correcta maniobra espirométrica, o comorbilidad cognitiva o psiquiátrica que interfiriera con la interpretación de las consignas.
Los pacientes que accedieron participar en el estudio fueron inicialmente evaluados en el consultorio de enfermedades neuromusculares. Se consignaron datos referentes al género, la edad, la edad de inicio de la MG y la severidad de la enfermedad, de acuerdo con el grado de la Myasthenia Gravis Foundation of America (MGFA) al momento de la evaluación. Se determinó el compromiso clínico actual de los pacientes mediante las escalas de Myasthenia Gravis activities of daily living (MG-ADL) y de Myasthenia Gravis Composite (MGC) y la sensación subjetiva de disnea referida por los pacientes, mediante la utilización del cuestionario de disnea modificado (mMRC)14. Tambien se realizaron el test de cuenta máxima y el pico flujo espiratorio (PEF).
Para el test de cuenta máxima, se pidió a los pacientes que realicen una inspiración profunda y comiencen a contar en voz alta, con un promedio de dos números por segundo, hasta que necesiten realizar nuevamente una inspiración. El valor más alto, luego de dos intentos, fue registrado (video 1).
En la determinación del PEF, los pacientes fueron instruidos para realizar una inspiración profunda hasta la capacidad pulmonar total (CPT), y a continuación, se colocó la boquilla del medidor de pico flujo en la boca, para luego realizar una espiración forzada. Se repitió la maniobra tres veces y se eligió la del máximo valor15 (video 2).
A continuación, el paciente fue examinado por un médico neumonólogo, quien no conocía los resultados de las pruebas anteriormente realizadas. Se realizó a cada paciente las pruebas funcionales respiratorias: medición de la CVF en sedestación y en decúbito dorsal, y presiones bucales estáticas PiMáx y PeMáx.
La espirometría se realizó en el laboratorio pulmonar, previa calibración, con jeringa de tres litros, de acuerdo con normas ATS/ERS. Se ocluyó la nariz de los pacientes con pinza nasal y fueron instruidos para colocar la boquilla descartable en la boca y realizar respiraciones tranquilas a volumen corriente, hasta llegar a la capacidad residual funcional. A continuación, realizaron una inspiración profunda hasta llegar a la CPT y luego una espiración forzada, la cual cumplió con los criterios de aceptabilidad de maniobra. Se realizaron la cantidad de maniobras necesarias para obtener tres aceptables, y de ellas, la que haya tenido los mejores valores, fue registrada. Se repitió este procedimiento en decúbito dorsal.
Se evaluaron la PiMáx y PeMáx; para la PeMáx se solicitó al paciente que respire tranquilamente a volumen corriente. A continuación, se indicó que inspire profundamente hasta CPT, y luego realice una espiración forzada manteniendo la presión generada por al menos 1,5 segundos. Para la medición de la PiMáx, se solicitó al paciente que espire el aire hasta alcanzar volumen residual (VR) y realizó una inspiración profunda y forzada, manteniendo la presión generada por al menos 1,5 segundos. Se realizaron ambas maniobras tres veces y se eligió la mejor.
El software SPSS versión 20.0 (IBM Corp. Released 2011. IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.) fue utilizado para el análisis estadístico. La correlación entre las variables se evaluó mediante el coeficiente de Pearson, considerando una variable como estadísticamente significativa cuando p <,05. Se realizó una regresión lineal de CVF, a través del método de pasos sucesivos considerando las variables que mostraron una correlación significativa con el puntaje CVF. Se utilizó un nivel de significación de,050.
ResultadosSe incluyeron en el estudio 45 pacientes, de los cuales 35 (78%) eran mujeres. La media de edad al momento de la evaluación fue de 40,7 años (rango 18-82); la edad media de inicio de la MG fue de 32,5 años (rango 12-82). La mayoría de los pacientes tenían anticuerpos contra el receptor de acetilcolina (ACRA) (89%), dos pacientes eran anti-MuSK positivos (4%) y tres doble-seronegativos (7%).
Con respecto al grado de MGFA al momento de la evaluación, dos pacientes estaban en grado I, 35 en grado II, siete pacientes en grado III y un paciente en grado IV. A su vez, de 43 pacientes con síntomas generalizados, 33 (73,3%) presentaban un compromiso principalmente de músculos axiales y/o apendiculares (a) y 10 (22,2%) debilidad principalmente de músculos orofaríngeos y/o respiratorios (b).
El 57,7% de los pacientes (26/45) refirieron una sensación subjetiva de disnea cuando se los evaluó utilizando el cuestionario mMRC; 17 de estos pacientes referían disnea al caminar muy rápido o al subir una cuesta poco pronunciada (grado I), siete disnea al caminar al mismo paso que otras personas de la misma edad (grado II) y dos disnea que obliga a detenerse antes de los 100 metros, a pesar de caminar a su paso y en terreno llano (grado III).
En relación con las pruebas funcionales respiratorias realizadas, la media de CVF realizada en 45 pacientes fue de 3,11 L, 87,4% del predicho (rango: 1,5 L, 54% del predicho - 5,9 L, 116%); 14/45 pacientes (31,1%) presentaron una CVF menor al 80%. En la exploración de la CVF en decúbito, se observó una caída respecto a la CVF en sedestación mayor al 10% en 11/45 pacientes (24,4%).
En 34/45 pacientes (75,5%) se evaluó la PiMáx y la PeMáx. La media de la PeMáx fue de 63,2 (rango 24-122) y de la PiMáx de -52,7 (rango -85 a -1).
Las diferentes pruebas semiológicas llevadas a cabo en el consultorio (test de cuenta máxima, PEF, fuerza en flexión de cuello y cuestionario de disnea) fueron relacionadas con la CVF. Se halló una correlación positiva estadísticamente significativa entre el test de cuenta máxima y la CVF (r = 0,57, p = 0,000) (fig. 1A), así como entre el valor del pico flujo espiratorio y la CVF (r = 0,76, p = 0,000) (fig. 1B). Al evaluar la relación entre la presencia de disnea y la CVF, observamos una correlación negativa significativa entre el grado de disnea, según el cuestionario mMRC y la CVF (r = -0,31 p = 0,03) (fig. 1C). De modo que, a mayor grado de disnea, menor fue la CVF obtenida en la espirometría. En relación con la valoración de la fuerza de cuello, no se halló una correlación entre debilidad en flexión del cuello y la CVF (fig. 1D).
A) correlación entre test de cuenta máxima y CVF (capacidad vital forzada) (r = 0,56, p = 0,000). B) correlación entre PEF (pico flujo espiratorio) y CVF (r = 0,76, p = 0,000). C) correlación entre cuestionario de disnea modificado (mMRC) y CVF (r = -0,31, p = 0,03). D) correlación entre FFC (fuerza de flexión de cuello) y CVF.
También se relacionó la severidad de la MG, determinada por el puntaje obtenido en las escalas MG-ADL y MGC con la CVF, no observándose una correlación significativa. Por otro lado, se discriminó el ítem relacionado con el compromiso respiratorio, determinado a partir de estas escalas que puntúa con un score de 0 a 3, con mayor puntaje señalando mayor afectación. Este parámetro, al ser relacionado con la CVF, tampoco mostró una correlación estadísticamente significativa.
Los valores de CVF correspondiente a los pacientes con MG fueron regresados, considerando cuenta máxima, PEF y el test de cuestionario mMRC, arrojando dos modelos. El primero explicó el 58% de la varianza en CVF y retuvo PEF (ß = 0,007, p < 0,001). El segundo modelo explicó el 62% de la varianza, siendo significativo, F (2, 42) = 35,520, p < 0,001, retuvo las variables PEF (ß = 0,006, p < 0,001) y cuenta máxima (ß = 0,023, p = 0,030).
Con respecto al grado de MGFA en relación con los resultados obtenidos en la espirometría, observamos que: todos los pacientes con MGFA grado I (2/2), presentaban CVF mayor al 80%; 77,1% (27/35) de los pacientes con MGFA grado II, tenían una CVF mayor al 80%; 28,6% (2/7) de los pacientes con MGFA grado III, tenían una CVF mayor al 80%; ningún paciente con MGFA grado IV tenía CVF mayor al 80% (p = 0,02).
En el análisis de la relación entre cuenta máxima, fuerza en flexión de cuello, cuestionario mMRC y PEF con los valores de PeMáx, se halló una correlación positiva estadísticamente significativa con el pico flujo espiratorio (r = 0,51, p = 0,002) (fig. 2), no observándose correlación significativa con las pruebas semiológicas restantes.
No encontramos correlación entre PiMáx y ninguno de los parámetros evaluados.
DiscusiónEl compromiso respiratorio en pacientes con MG determina una mayor severidad de la enfermedad, e incluso puede requerir su manejo en unidades de cuidados intensivos. Si bien no es frecuente como forma de presentación, en la evolución de la enfermedad hasta un 60% de los pacientes pueden presentar trastornos respiratorios16,17. Los síntomas respiratorios se asocian con cambios en la ventilación que son de carácter restrictivo, debido a una reducción en la resistencia muscular pulmonar.
La espirometría es el estudio de elección para determinar la presencia de trastornos respiratorios neuromusculares en el paciente con MG. Su uso se recomienda para pesquisar y establecer la severidad del compromiso respiratorio, así como para monitorear la evolución de la enfermedad16–18. En nuestra población, 24/45 pacientes (53,3%) tenían compromiso respiratorio evidenciado en los parámetros espirométricos: 14/45 pacientes (31,1%) tenían CVF menor al 80%, 7/45 (15%) pacientes CVF con caída en decúbito mayor al 10% y 3/34 (8,8%) pacientes una PeMáx menor a 80% del teórico.
En el presente estudio, nosotros valoramos la utilidad de evaluar fuerza del cuello, el test de cuenta máxima, el pico flujo espiratorio forzado e interrogar la presencia de disnea, según el cuestionario mMRC, para determinar la presencia de compromiso respiratorio en la consulta neurológica.
El test de cuenta máxima mostró utilidad para determinar el estatus respiratorio en pacientes con afecciones respiratorias obstructivas y restrictivas en estudios anteriores19,20. En pacientes con miastenia gravis, un estudio anterior mostró que el test de cuenta máxima se correlacionó positivamente con la CVF21. Estos resultados fueron reproducidos en nuestro estudio, realizado sobre una población de pacientes con MG en promedio más jóvenes que los incluidos en aquel, sugiriendo la utilidad de esta técnica en un mayor rango etario.
La implementación rutinaria del test de cuenta máxima en la evaluación de pacientes con MG resulta atractiva por ser una herramienta simple, rápida y económica. Una ventaja adicional de esta prueba es su utilidad para estimar el compromiso respiratorio en pacientes cuya debilidad facial imposibilita la realización de una correcta maniobra espirométrica, interfiriendo con la confiabilidad de sus resultados.
El PEF fue otro parámetro determinado y relacionado con los datos obtenidos de la espirometría (CVF y PeMáx). La monitorización de la fuerza de los músculos espiratorios en pacientes con enfermedades neuromusculares es importante porque su alteración se asocia con atelectasias, retención mucosa bronquial e infecciones respiratorias. En nuestro estudio, hallamos una correlación significativa entre el PEF y la CVF y, además, y entre el PEF y la PeMáx. Estudios realizados en pacientes con ELA y enfermedad de Duchenne demostraron una correlación entre el PEF y la PeMáx, sugiriendo la medición del PEF como una forma útil de monitorear la debilidad muscular espiratoria y el compromiso bulbar en estos pacientes22–24. Incluso en estas enfermedades, un PEF de al menos 270 L/min se asoció con un menor índice de complicaciones infecciosas respiratorias23. En nuestro conocimiento no hay estudios previos que valoren la relación del PEF con el examen funcional respiratorio en pacientes con MG.
El análisis estadístico mostró que el PEF y la cuenta máxima predijeron más de la mitad de la variación de los puntajes en CVF de nuestros pacientes con MG.
La valoración de la fuerza del cuello es un elemento usualmente jerarquizado en la evaluación de pacientes con enfermedades neuromusculares. Probablemente el rol que cumplen los músculos flexores como músculos accesorios de la respiración sostienen este fundamento. A diferencia de lo previamente comunicado por Elsheikh et al.21 nosotros no encontramos una asociación entre la debilidad de los músculos flexores del cuello y una disminución en la CVF de los pacientes.
Para determinar la importancia de la queja de disnea por parte de los pacientes para predecir hallazgos compatibles con debilidad neuromuscular en la espirometría, interrogamos este síntoma a partir del ítem de las escalas MG-ADL y MGC destinado a evaluar el compromiso respiratorio, y además utilizamos el cuestionario de disnea modificado mMRC. Este cuestionario fue propuesto inicialmente en 2012 en la guía Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease (GOLD) para estratificar a los pacientes con enfermedad pulmonar obstructiva crónica (EPOC), según la gravedad de la enfermedad14. Permite estimar el grado de esfuerzo respiratorio, a partir de las limitaciones en las actividades de la vida diaria que refiere el paciente25,26. En nuestro trabajo, 57,7% de los pacientes refirieron una sensación subjetiva de disnea al evaluarlos. Nosotros no encontramos relación entre la queja de disnea interrogada, a partir de escalas MG-ADL y MGC, y la probabilidad de hallar una limitación en la CVF. Sin embargo, se halló una correlación negativa entre el resultado del cuestionario de disnea mMRC y la CVF. Es decir, que a mayor grado de disnea, menor fue la CVF obtenida. Si bien no hay estudios realizados previamente que apliquen esta escala a pacientes con enfermedades neuromusculares, a partir de estos resultados creemos que podría ser una herramienta utilizada en la práctica diaria.
Las escalas de MGC y MG-ADL evalúan los aspectos funcionales más frecuentemente afectados en la MG. Son escalas fácilmente reproducibles y ampliamente utilizadas en la consulta neurológica27,28. En 2012, la Task Force de la MGFA recomendó su uso como una medida cuantitativa para determinar la mejoría o el empeoramiento en pacientes con MG generalizada29. En nuestro trabajo evaluamos la correlación entre el MGC y MG-ADL con los parámetros espirométricos, no encontrando relación entre ellos. Esta situación subraya la importancia de contar con otras pruebas accesibles a la consulta neurológica que permitan inferir la presencia de afectación respiratoria en los pacientes con MG.
ConclusionesDeterminar el riesgo de afectación muscular respiratoria en la evaluación de los pacientes con MG es fundamental en la práctica diaria, dado que su pesquisa permite estratificar a los pacientes en cuanto al pronóstico y tiene implicancias terapéuticas. El PEF y la cuenta máxima, así como en menor medida interrogar la disnea mediante el mMRC, mostraron ser herramientas útiles para estimar la función respiratoria en pacientes con MG. Su sencilla implementación y su accesibilidad los postula como estrategias apropiadas en la evaluación de la función respiratoria en pacientes con MG.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.