La miastenia gravis (MG) es un enfermedad autoinmune que afecta a la transmisión nerviosa a nivel de la unión neuromuscular causando debilidad muscular típicamente fluctuante. Los estudios epidemiológicos constatan un aumento de las tasas de prevalencia de la MG y es especialmente evidente en la población anciana.
ObjetivoRealizar un estudio epidemiológico retrospectivo para conocer las tasas de incidencia y prevalencia en la provincia de Ourense (Galicia) caracterizada por el envejecimiento poblacional.
Material y métodosLos pacientes fueron reclutados de nuestra base de datos clínica de enfermedades neuromusculares y a través de la búsqueda de pacientes con prescripción activa de bromuro de piridostigmina. La tasa de incidencia se estimó entre los años 2009-2018. Se estableció la fecha de prevalencia al 31/12/2018. El censo de la provincia de Ourense al 1/1/2019 era de 307.651 habitantes, de los que 96.544 (31,4%) tenían una edad ≥ de 65 años.
ResultadosSe identificaron 80 casos de MG. La prevalencia fue de 260 casos/1.000.000 habitantes (IC95%: 202,7-316,4), y en la población ≥ 65 años de 517,9/1.000.000 habitantes (IC95%: 363,2-672,9). La incidencia acumulada en el periodo de estudio fue de 15,4 casos/1.000.000 habitantes-año. El inicio precoz (≤ 50 años) ocurrió en el 29,1% de los casos.
ConclusiónLa prevalencia de la MG en nuestra área sanitaria es de las más altas entre las cifras previamente reportadas, y es una enfermedad muy prevalente en la población anciana.
Myasthenia gravis (MG) is an autoimmune disease affecting nerve transmission at the level of the neuromuscular junction, and typically causes fluctuating muscle weakness. Epidemiological studies show an increase in MG prevalence, particularly among the older population.
ObjectiveWe performed a retrospective epidemiological study to determine the incidence and prevalence of MG in the province of Ourense (Galicia, Spain), characterised by population ageing.
Material and methodsPatients were selected from our clinical neuromuscular diseases database by searching for patients with an active prescription for pyridostigmine bromide. Incidence was estimated for the period 2009-2018. We calculated prevalence at 31/12/2018. According to census data for the province of Ourense, the population on 1/1/2019 was 307,651, of whom 96,544 (31.4%) were aged ≥ 65 years.
ResultsWe identified 80 cases of MG, with a prevalence rate of 260 cases/1 000 000 population (95% CI, 202.7-316.4), rising to 517.9/1 000 000 population in those aged ≥ 65 (95% CI, 363.2-672.9). Cumulative incidence in the study period was 15.4 cases per 1 000 000 person-years. Early onset (≤ 50 years) was recorded in 29.1% of cases.
ConclusionThe prevalence of MG in our health district is one of the highest published figures, and the disease is highly prevalent in the older population.
La miastenia gravis (MG) es una enfermedad de etiología autoinmune en la que diversos anticuerpos, fundamentalmente aquellos dirigidos frente a los receptores de la acetilcolina (Ach-R) situados a nivel postsináptico en la unión neuromuscular, son responsables de la clínica característica consistente en debilidad muscular fluctuante. Aunque la positividad para dichos anticuerpos es alta, alcanzando el 85% en las formas generalizadas, hay casos en los que no son detectados y constituye la MG seronegativa; en estos casos otros anticuerpos, fundamentalmente los dirigidos frente a la quinasa músculo específica (MuSK) y en menor medida frente LRP4, pueden ser detectados. La clínica característica puede ser ocular (ptosis palpebral, diplopía), bulbar (disartria, disfagia) o generalizada con debilidad en extremidades. Un agravamiento de la clínica que cause insuficiencia respiratoria con la necesidad de ventilación mecánica es conocido como crisis miasténica. A nivel electrofisiológico esta debilidad se traduce en una reducción en los potenciales de acción muscular con la estimulación nerviosa repetitiva. El tratamiento implica fármacos sintomáticos como la piridostigmina y modificadores del curso evolutivo de la enfermedad, es decir los inmunosupresores, entre los que destacan la prednisona, la azatioprina y el micofenolato de mofetilo1,2.
La MG puede presentarse a cualquier edad, desde el nacimiento a la senectud. Los estudios epidemiológicos son consistentes en señalar para las mujeres una incidencia bimodal, con un pico entre los 20-40 años y otro entre los 60-80 años, mientras que en los varones predomina en edades avanzadas con un incremento sostenido desde los 60 años3. Esta distribución bimodal en el sexo femenino no se ha observado en la población coreana, en la que se produce un aumento continuo de la prevalencia hasta los 80 años en ambos sexos4.
Los estudios epidemiológicos también están constatando un incremento en las tasas de incidencia y prevalencia de la MG en las últimas décadas5–8, y lo que es más llamativo se está reportando un aumento de la prevalencia en la población anciana9–12, lo que también se ha demostrado a través de la selección de pacientes por medio de bases de datos clínicos, a nivel de laboratorio a través de las positividades en la determinación de los anticuerpos anti-Ach-R13,14, y a través de los registros de farmacia sobre el consumo de piridostigmina15.
De los estudios epidemiológicos se concluye que la prevalencia de la MG está incrementando en la población anciana, y muy probablemente está clínicamente infradiagnosticada por la concomitancia con otras patologías más frecuentes en este grupo de edad como la enfermedad cerebrovascular o la asimilación de síntomas de debilidad y fatiga con el mero proceso de envejecimiento. En este sentido, la provincia de Ourense es una de las que presenta un mayor envejecimiento poblacional, representando los mayores de 65 años el 31% de la población. El objetivo de nuestro estudio es conocer las tasas de incidencia y prevalencia de MG en nuestra provincia, e intentar confirmar este aumento de la incidencia que apuntan los más recientes estudios epidemiológicos.
Pacientes y métodosEl objetivo de nuestro estudio es calcular las tasas de prevalencia de la miastenia gravis en la provincia de Ourense, por medio de un estudio epidemiológico de diseño retrospectivo, tomando como fecha de la prevalencia el 31 de diciembre del 2018, y se estimó la incidencia de la MG en el periodo 2009-2018.
Los pacientes se recopilaron a través de las consultas externas del Servicio de Neurología en la provincia de Ourense (Complejo Hospitalario Universitario de Ourense, Hospital Comarcal de Verín, y Hospital Comarcal de O Barco de Valdeorras), y se contactó con las clínicas de asistencia médica privada en la provincia. A través del servicio de farmacia se realizó una búsqueda de pacientes que estuvieran en tratamiento con bromuro de piridostigmina (Mestinon®), y que se cruzó con la base de datos clínica. Finalmente, por medio del servicio de Documentación Clínica, se solicitarán los ingresos hospitalarios en los que figurase como diagnóstico principal o secundario la codificación para MG.
Definición de caso. Se consideró el diagnóstico de MG si el paciente presentaba una clínica compatible (debilidad muscular fluctuante, bien ocular, bulbar o generalizada), y además positividad para los anticuerpos Ach-R o MuSK, y/o un estudio neurofisiológico compatible con un decremento>10% en el potencial acción muscular en la estimulación nerviosa repetitiva o una prolongación del jitter en la electromiografía de fibra aislada. Los pacientes fueron clasificados siguiendo los criterios de la Myasthenia Gravis Foundation of America (MGFA) clinical classification16.
El estudio ha sido aprobado por el Comité de Ética de la Investigación de Galicia. Los pacientes firmaron el consentimiento informado para acceder a sus datos clínicos y realizar determinaciones serológicas que fueran necesarias.
El análisis estadístico se realizó con el paquete estadístico SPSS. Se comprobó la normalidad de las variables (bondad de ajuste) con el test de Kolmogorov-Smirnov, empleando a continuación las pruebas estadísticas paramétricas (media, desviación estándar, t de Student) o no paramétrica (mediana, rango, test de Mann-Whitney) según fue apropiado. Se consideró significación estadística con un valor de p<0,05.
ResultadosEl censo de la provincia de Ourense al 1/1/2019 era de 307.651 habitantes. A la fecha de prevalencia (31/12/2018), se detectaron 80 pacientes con MG (el paciente más anciano, con 92 años, disponía de un informe médico con el diagnóstico de miastenia gravis y se hallaba bajo tratamiento con piridostigmina, sin historia clínica digitalizada, ni se disponía de historia en papel, por lo que salvo para la tasa de prevalencia, el resto de las variables se calcularon sobre una población de 79 pacientes). La edad al diagnóstico fue de 57±18 años (mediana 61 años, rango: 20-85 años) y la edad a la fecha de la prevalencia fue de 68±16 años (mediana 72 años, rango: 30-92 años); con una evolución clínica de 9,8±9,2 años (mediana 8 años, rango 1-50 años). El sexo femenino representó el 53,8% de los casos.
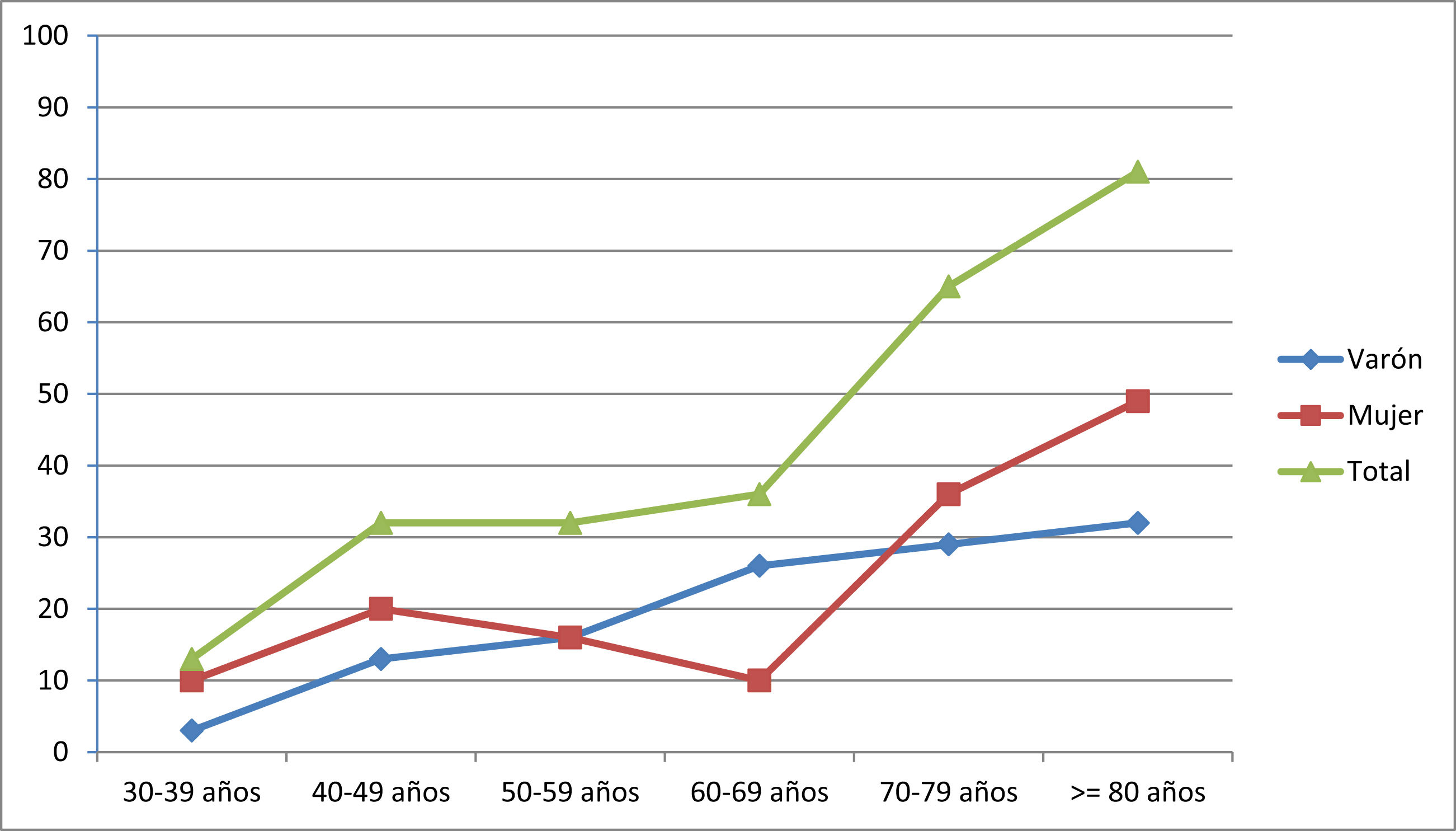
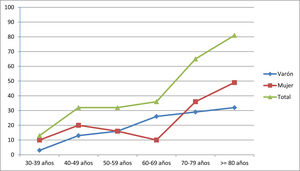
La prevalencia fue de 260,0 casos/106 habitantes (IC95%: 202,7 – 316,4). Los pacientes con edad ≥ de 65 años representaron el 62,5% de los casos (n=50). El censo de población para este grupo etario en la provincia de Ourense fue de 96.544 habitantes (31,4% de la población total), en consecuencia la prevalencia de MG en este grupo fue de 517,9 casos/106 de habitantes (IC95%: 363,2 – 672,9). La presentación precoz (< 50 años) ocurrió en el 29,1% de los casos (n=23) y el inicio tardío (≥50 años) en el 70,9% (n=56). La presentación precoz fue significativamente más frecuente en mujeres que en varones (39,1% vs. 60,9%, p<0,05). En la tabla 1 y en el figura 1 se muestran las tasas de prevalencia global y por sexo a la fecha de la prevalencia.
Prevalencia por millón de habitantes de los pacientes con MG agrupados por décadas de edad y separados por género
| 30-39 años | 40-49 años | 50-59 años | 60-69 años | 70-79 años | ≥80 años | |
|---|---|---|---|---|---|---|
| Varón | 3,24 | 12,94 | 16,18 | 25,88 | 29,12 | 32,35 |
| Mujeres | 9,71 | 19,41 | 16,18 | 9,71 | 35,39 | 48,53 |
| Total | 12,94 | 32,35 | 32,35 | 35,59 | 64,70 | 80,88 |
En el periodo del 2009-2018 se registraron 48 casos nuevos de MG, lo que supone una tasa de incidencia anual de 15,44 casos/106 habitantes-año (IC95%: 2,14-28,73).
La presentación clínica más frecuente fue la ocular representando el 57,7% (clase MGFA-I, n=45) y le siguen en frecuencia la clase MGFA-IIB con un 29,5% (n=23) y la clase MGFA-IIA con el 10,3% (n=8). Es decir, en el 92,5% de los casos la forma de presentación fue la ocular pura o las formas generalizadas leves.
A nivel serológico, el 79,7% de los casos (n=63) eran una MG con anticuerpos anti-Ach-R, el 3,8% (n=3) era MG con anticuerpos anti-MuSK, y en 16,5% casos la MG fue doblemente seronegativa (n=13).
Se realizó timectomía en el 31,6% de los casos (n=25), y en 12 pacientes el diagnóstico anatomopatológico fue de timoma. Un paciente con datos radiológicos en la TC-torácica de presentar timoma no se sometió a cirugía por comorbilidades médicas. La tasa de MG asociadas a timoma (paraneoplásicas) fue del 16,5%.
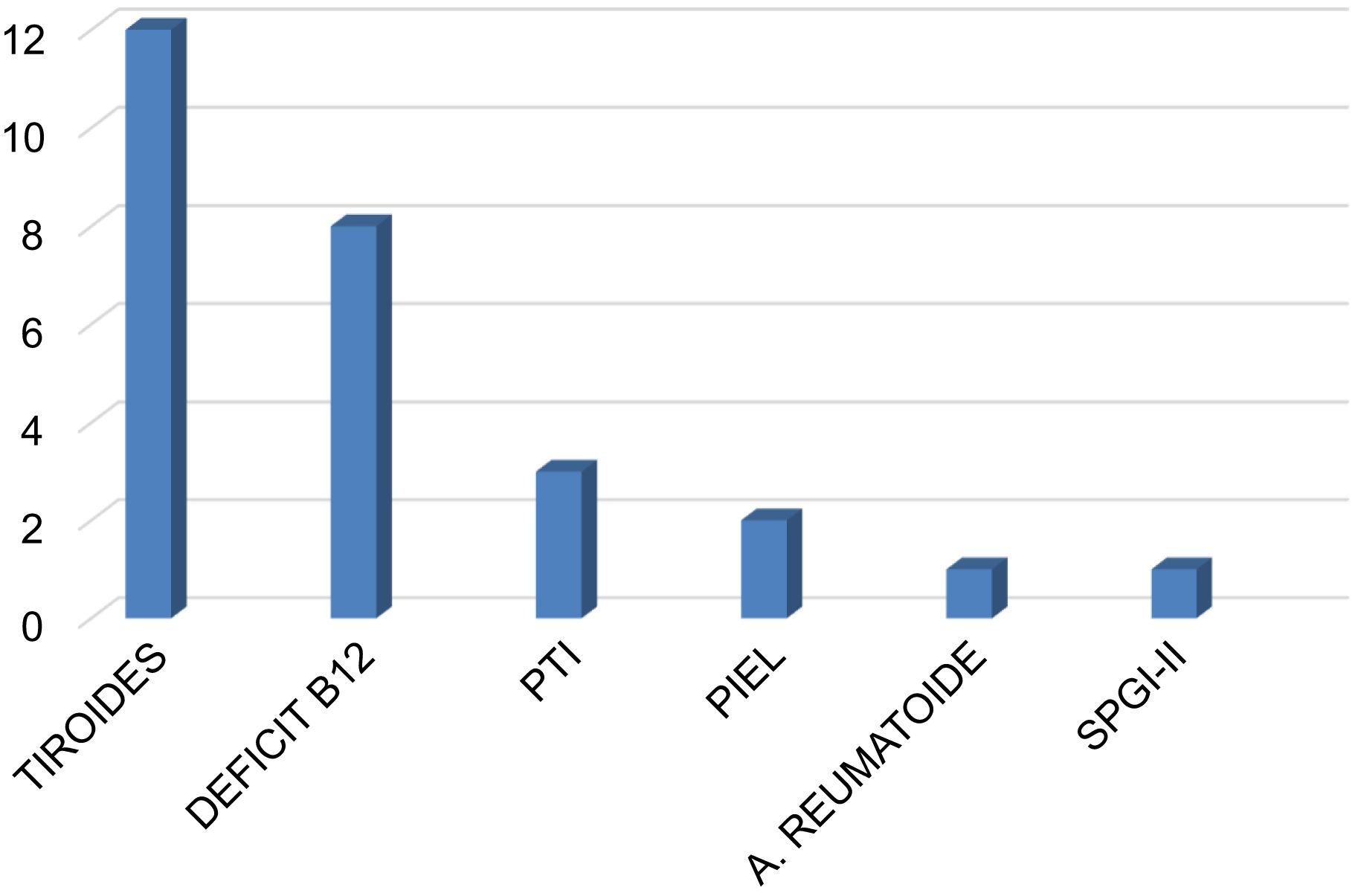
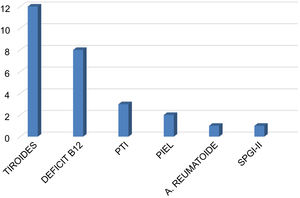
El nivel de vitamina D fue insuficiente (< 30ng/mL) en el 85,1% de los pacientes, con una mediana de 17 ng/mL (rango: 3-66 ng/mL). La comorbilidad autoinmune estuvo presente en el 35,4% de los casos (n=28), destacando la patología tiroidea con 13 casos (12 hipotiroidismo, uno enfermedad de Graves-Basedow), 8 casos con déficit de vitamina B12 y gastritis crónica atrófica, 3 casos con trombocitopenia autoinmune, 2 casos de enfermedades dermatológicas (dermatitis atópica, vitíligo), un caso de artritis reumatoide y un paciente con síndrome poliglandular inmune tipo 2. Tres pacientes con déficit de vitamina B12 presentaron concomitantemente hipotiroidismo (n=1) y trombocitopenia (n=2) (fig. 2).
Comorbilidades autoinmunes en la población de pacientes con miastenia gravis. La afectación más frecuente fue la patología tiroidea. En tres pacientes con déficit de vitamina B12 hubo asociación con un caso de hipotiroidismo y dos casos de PTI. PTI: púrpura trombocitopénica inmune; SPGI-II: síndrome poliglandular autoinmune tipo II.
Solo dos pacientes se hallaban en situación de remisión completa. El 91,3% de los pacientes tomaban piridostigmina. Un tratamiento inmunosupresor lo recibían el 87,5% de los pacientes (n=70), y de estos 47 casos tomaban prednisona (13,2±11,3mg/día), 18 casos azatioprina, 4 casos micofenolato de mofetilo, 2 pacientes rituximab, y un paciente tacrolimus. Durante el curso de la enfermedad 21 pacientes (26,6%) precisaron un ingreso hospitalario por agravamiento de la clínica miasténica o una crisis miasténica, recibiendo como primera elección tratamiento con IVIg frente a la plasmaféresis y asociada a altas dosis de corticoisteroides intravenosos.
DiscusiónUna revisión sistemática del año 2010 sobre los estudios epidemiológicos realizados en MG, constatan un amplio abanico de cifras para la tasa de incidencia de 5,3 casos/106 habitantes-año (IC95% 4,4-6,1) y de prevalencia de 77,7 casos/106 habitantes (IC95% 64,0-94,3)/ 106 habitantes. Por tanto se clasifica dentro de las enfermedades raras ya que su prevalencia en la población es <50 casos /100.000 habitantes3. En la tabla 2 se resumen las tasas de incidencia y prevalencia en la MG de los diferentes estudios epidemiológicos publicados4,15,17–37.
Tasas de prevalencia e incidencia de MG en diversos estudios epidemiológicos
| Autor | Origen | Año(periodo) | Población | Incidencia (x106) | Prevalencia(x 106) |
|---|---|---|---|---|---|
| Zieda A et al.17 | Letonia | 2010-2014 | 2.041.885 | 9,7 | 113,8 |
| Lee HS et al.4 | Corea | 2010-2014 | 50.420.000 | 6,9 | 129,9 |
| Quintero-López C et al.18 | Cuenca | 2014 | 105 | ||
| Santos E et al.19 | Portugal (norte) | 2013 | 3.689.682 | 6,3 | 111,7 |
| Aragonès JM et al.20 | Osona (Barcelona) | 2013 | 155.069 | 328,9 | |
| Breiner a et al.21(≥ 18 años) | Ontario (Canadá) | 1996-2013 | 11.274.236 | 28 | 320 |
| Joensen P22 | Faroe Islands | 1986-2013 | 48.101 | 9,4 | |
| Díaz Marín C23 | Marina Baixa (Alicante) | 2012 | 198.233 | 186,6 | |
| Park SY et al.24 | Corea | 2010-2011 | 50.908.646 | 24,4 | 106,6 |
| Gattellari M et al.15 | Australia | 2009 | 21.874.920 | 24,9 | 117,1 |
| Pallaver F et al.25 | Trento (Italia) | 2005-2009 | 524.826 | 14,8 | 129,6 |
| Lai C-H et al.26 | Taiwan | 2007 | 22.960.000 | 21 | 140 |
| Heldal AT et al.27 | Noruega | 1995-2007 | 4.737.171 | 7,0 | |
| Casetta I et al.28 | Ferrara (Italia) | 1985-2000 | 360.950 | 20 | |
| Robertson NP et al.29 | Cambrigeshire (England) | 1992-1997 | 684.000 | 15 | 111 |
| Poulas K et al.30 | Grecia | 1983-1997 | 10.475.878 | 7,4 | 70,63 |
| Villagra-Cocco A et al.31 | La Palma (Islas Baleares) | 1996 | 81.507 | 85,9 | |
| Cisneros AD et al.32 | Cuba | 1996 | 4,52 | 29,22 | |
| Christensen PB et al.33 | Dinamarca occidental | 1975-1989 | 2.800.000 | 5,0 | 78 |
| Somnier FE et al.34 | Dinamarca | 1987 | 4,4 | 77 | |
| Ööpik M et al.35 | Estonia | 1970-1986 | 1.462.130 | 4,0 | 99 |
| Philips LH et al.36 | Virginia (EE. UU.) | 1970-1984 | 555.851 | 9,1 | 142 |
| Storm-Mathisen A et al.37 | Noruega | 1951-1981 | 4,0 | 90 |
En cursiva figuran los estudios epidemiológicos realizados en España.
Nuestro estudio muestra una de las tasas más elevadas de prevalencia de MG reportadas hasta la actualidad. Además confirma que es una entidad más prevalente en edades avanzadas, en este sentido la prevalencia entre los mayores de 65 años se situó en 518 casos/106 habitantes. De forma indirecta también se aprecia en las formas de presentación tardía (≥50 años) que representan el 71% de los pacientes y la mediana de edad de los pacientes con MG que se sitúa en 72 años. La incidencia en el periodo de estudio (15.44 casos/106 habitantes) también se sitúa entre las más altas reportadas, y es de destacar que la mediana del tiempo de evolución desde el diagnóstico fue de 8 años, lo que significa que la mitad de los pacientes fueron diagnosticados en ese periodo de tiempo.
A nivel del género no hallamos un predominio sexual, representando la muestra de mujeres el 54% de la serie, que mostraron el típico patrón de incidencia bimodal con un discreto pico en el grupo de 40-49 años y un incremento sostenido después de 60-69 años. El predominio del sexo femenino se constató en las formas de presentación menores de 50 años. En los varones se aprecia un incremento dependiente de la edad, más evidente a partir de los 50 años.
A nivel nacional hemos encontrado cuatro referencias sobre la epidemiología de la MG en España. Entre ellos destaca el trabajo de Aragonés et al. realizado en la comarca de Osona (Barcelona) ya que es el que refleja la mayor tasa de prevalencia, cifrada en 329 casos/106 habitantes20. Resaltaban los autores el hecho de que se hallaban ante una población muy envejecida con un porcentaje de pacientes con edad ≥ 65 años, en el año 2013, del 16,87%, de forma que en este grupo de edad la prevalencia fue de 122,35 (CI: 79,9-164,7) casos /105 habitantes frente al grupo de 25 a 64 años donde la prevalencia era de 21,87 (CI: 12,03-31-70) casos /105 habitantes. En global nuestros datos epidemiológicos son similares, mostrando una tasa de prevalencia alta de 260 casos/106 habitantes, y claramente mostrando que es una patología más prevalente en la población mayor de 65 años. Sin embargo, dado el mayor envejecimiento de la población en nuestra provincia esperábamos todavía una mayor tasa de prevalencia en este grupo etario, que aunque elevada de 518 casos/106 habitantes, es sensiblemente inferior a los valores reportados por Aragonés et al.,20. Por tanto, debemos estar atentos a la clínica fluctuante e inespecífica en nuestros pacientes mayores por si se estuviera produciendo un infradiagnóstico de la enfermedad en nuestra área sanitaria.
Los restantes estudios epidemiológicos fueron realizados en la isla de La Palma (1996) con una prevalencia de 86 casos/106 habitantes31, en la provincia de Cuenca (2014) con 105 casos/106 habitantes18, y en Marina Baixa (Alicante, 2012) la prevalencia fue 186,6 casos/106 habitantes23.
De los estudios epidemiológicos a nivel internacional queremos destacar por su proximidad geográfica, y por tanto con unas coordenadas de latitud/longitud asimilables a la nuestra, el realizado por Santos et al. en la región norte de Portugal19. Estos autores reportaron para el año 2013, sobre un censo de población de 3.644.195 habitantes, una tasa de incidencia de 6,3 casos/106 habitantes-año, y una prevalencia de 111,7 casos/106 habitantes. En las mujeres la incidencia es bimodal con un pico en la franja de 15-49 años y otro en las ≥ 65 años, mientras que en los varones tanto ambas tasas de incidencia y prevalencia aumentan en cada franja de edad. La prevalencia en las mujeres es mayor cuando la clínica tiene un inicio precoz (< 50 años) mientras que predomina en el varón cuando el inicio de la clínica es tardío (≥50 años).
La vitamina D tiene un efecto modulador sobre la inmunidad innata y adaptativa38, y se ha comunicado su deficiencia en diversas enfermedades autoinmunes, como es el caso de la MG39. En nuestro estudio la deficiencia de vitamina D estuvo presente en más de 3 de cada 4 pacientes con MG. Si bien este déficit parece ser una pandemia e independiente de la latitud geográfica de un área determinada, y por tanto de las horas anuales de sol y de la cantidad de radiación ultravioleta recibida sobre la piel, en los pacientes con MG tiene una doble consideración. Por una parte, el tratamiento prolongado con prednisona forma parte del tratamiento habitual y pone en riesgo la salud ósea favoreciendo la osteoporosis con la presencia de fracturas patológicas, y por otra parte, la deficiencia de vitamina D puede dar lugar a un ambiente proinflamatorio que facilite la perpetuación de la cascada autoinmune40. Por tanto, suplementar con vitamina D, siempre que los niveles plasmáticos sean inferiores a 30 ng/mL, parece una buena práctica clínica. Aunque la fatiga en la MG mejora suplementando el déficit de vitamina D41, si la reposición de los niveles de vitamina D tiene una influencia sobre el curso evolutivo de la enfermedad tiene que ser todavía investigado. En este sentido, ha sido comunicado que el tratamiento con denosumab se ha asociado a una mejoría clínica y a un descenso en los niveles plasmáticos de anticuerpos anti-Ach-R42, y una remisión de una MG refractaria con megadosis de vitamina D43.
Las comorbilidades autoinmunes estuvieron presentes en 28 casos (35,4%), con un claro predominio de la enfermedad tiroidea seguida por el déficit de vitamina B12 con presencia de anticuerpos anti células parietales gástricas. Los estudios previos muestran una prevalencia de enfermedades autoinmunes asociadas a la MG entre el 14 y 23% de los casos44–46, siendo la tiroiditis autoinmune la más frecuentemente asociada en los tres estudios. En el presente trabajo no hemos encontrado asociación con enfermedades sistémicas con afectación del tejido conectivo.
En resumen, presentamos un estudio epidemiológico retrospectivo sobre la prevalencia de la MG en la provincia de Ourense que muestra una de las más altas tasas reportadas hasta la actualidad, siendo una entidad predominante en la población anciana, y que está asociada a un déficit de vitamina D.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.