La esclerosis lateral amiotrófica (ELA) es una enfermedad insidiosa y clínicamente heterogénea, lo que resulta en un retraso diagnóstico de unos 12 meses. En España el trayecto diagnóstico no ha sido analizado.
MétodosSe recogieron variables relativas al trayecto y retraso diagnóstico de pacientes diagnosticados de ELA entre octubre del 2013 y julio del 2017.
ResultadosSe incluyó a 143 pacientes con ELA (57% varones, 68% de inicio espinal). El 86% de ellos fueron estudiados en centros públicos y un 14% en privados. El retraso diagnóstico medio fue de 13,1 meses (mediana 11.7). El paciente tardó de media 7,9 meses en llegar al neurólogo y este, 5,2 meses más en diagnosticarlo. En la mitad de los pacientes se realizaron pruebas innecesarias y más de un estudio electrofisiológico para llegar al diagnóstico. El retraso diagnóstico fue mayor en los casos espinales (p = 0,008), atribuible a los pacientes cuyos síntomas se iniciaron en miembros inferiores, pero sin diferencias entre el sistema público y privado (p = 0,897).
ConclusionesEl retraso diagnóstico de la ELA en nuestro medio es similar al de países de nuestro entorno y parece determinado por factores propios de la enfermedad e independiente del sistema sanitario. Las formas de inicio en miembros inferiores constituyen el mayor reto. Los errores diagnósticos del neurólogo son frecuentes y en parte atribuibles a una mala orientación o interpretación del estudio electrofisiológico. La formación específica del neurólogo y neurofisiólogo general y la derivación precoz a centros de referencia podrían ayudar a reducir la demora.
Amyotrophic lateral sclerosis (ALS) is an insidious, clinically heterogeneous neurodegenerative disease associated with a diagnostic delay of approximately 12 months. No study conducted to date has analysed the diagnostic pathway in Spain.
MethodsWe gathered data on variables related to the diagnostic pathway and delay for patients diagnosed with ALS between October 2013 and July 2017.
ResultsThe study included 143 patients with ALS (57% men; 68% spinal onset). Patients were diagnosed in public centres in 86% of cases and in private centres in 14%.The mean diagnostic delay was 13.1 months (median 11.7). Patients were examined by neurologists a mean time of 7.9 months after symptom onset, with diagnosis being made 5.2 months later. Half of all patients underwent unnecessary diagnostic tests and multiple electrophysiological studies before diagnosis was established. Diagnostic delay was longer in cases of spinal onset (P = .008) due to onset of the disease in the lower limbs. No differences were found between the public and private healthcare systems (P = .897).
ConclusionsThe diagnostic delay in ALS in Spain is similar to that of neighboring countries and seems to depend on disease-related factors, not on the healthcare system. Patients with lower-limb onset ALS constitute the greatest diagnostic challenge. Misdiagnosis is frequent, and partly attributable to an incorrect approach or erroneous interpretation of electrophysiological studies. Specific training programmes for neurologists and general neurophysiologists and early referral to reference centers may help to reduce diagnostic delay.
La esclerosis lateral amiotrófica (ELA) es una enfermedad neurodegenerativa caracterizada por una debilidad progresiva secundaria a la muerte de motoneuronas corticales y espinales, que típicamente conduce al fallecimiento por insuficiencia respiratoria transcurridos 3-4 años del inicio de los síntomas1.
A pesar de su rápida progresión, el diagnóstico de la enfermedad en fases iniciales ofrece serias dificultades dado su inicio insidioso, su gran heterogeneidad clínica y la ausencia de marcadores diagnósticos2. Esto se traduce con frecuencia en errores diagnósticos, pruebas innecesarias y un retraso diagnóstico de alrededor de un año3-13, lo que representa aproximadamente un tercio de la supervivencia global de la enfermedad. Este retraso diagnóstico parece independiente del país y su sistema de salud2-10,14 y pese a diversas estrategias11 y a las actualizaciones propuestas a los criterios diagnósticos de El Escorial2,15, no se ha modificado significativamente en los últimos 20 años.
En una enfermedad devastadora como la ELA, acortar el tiempo hasta el diagnóstico puede repercutir positivamente sobre el paciente en tanto que reduce la incertidumbre y la ansiedad de pacientes y familiares durante el proceso diagnóstico, limita el número de pruebas e intervenciones innecesarias, permite un inicio precoz del tratamiento con riluzol (cuando este es probablemente más eficaz), favorece una mejor planificación futura y facilita la inclusión en ensayos clínicos en fases más iniciales de la enfermedad2.
Hasta el momento, en España no hay trabajos que analicen el trayecto diagnóstico de los pacientes con ELA. El objetivo de este estudio es, por tanto, describir el trayecto y retraso diagnóstico de los pacientes con ELA en nuestro entorno y compararlo con lo publicado en otros países.
Pacientes y métodosPacientesPara este estudio se incluyó a pacientes atendidos de forma consecutiva en la Unidad de ELA del Hospital La Fe y diagnosticados de ELA entre octubre del 2013 y julio del 2017.
El Hospital La Fe, en calidad de centro terciario, recibe a pacientes remitidos de otros centros públicos y privados para orientación diagnóstica y segunda opinión, o bien pacientes correctamente diagnosticados que desean ser atendidos en la Unidad multidisciplinar de ELA. Por ello, entre los pacientes incluidos en el estudio, algunos fueron diagnosticados en el Hospital La Fe y otros en centros diferentes.
Para los fines de este estudio se seleccionó únicamente a los pacientes con diagnóstico clínico de ELA. Aquellos pacientes que no cumplían criterios de El Escorial en una primera valoración fueron seguidos durante al menos 6 meses, excluyendo a aquellos en los que no pudo confirmarse el diagnóstico tras este seguimiento. Tampoco se incluyó en el estudio a los pacientes en seguimiento por neurología por deterioro cognitivo previo al inicio de síntomas motores, así como aquellos diagnosticados de atrofia muscular progresiva y esclerosis lateral primaria, definidas como la afectación exclusiva, durante al menos 4 años, de motoneurona inferior y superior, respectivamente16. Finalmente, se excluyó a los pacientes de los que no se disponía de datos suficientes del proceso diagnóstico.
Variables estudiadasSe trata de un estudio transversal descriptivo a partir de datos recogidos de forma prospectiva y retrospectiva. En la primera visita realizada en el Hospital La Fe, JFVC recogió de forma prospectiva datos demográficos y clínicos: edad, sexo, hospital de procedencia, fecha y región de inicio de síntomas, tasa de progresión17 y categoría de Awaji al diagnóstico15. JFVC, MMM y MFP participaron en la recogida retrospectiva de variables referentes al trayecto diagnóstico mediante la revisión de las notas médicas derivadas de cada atención, registradas en el sistema de información clínico-asistencial hospitalario (programa Orion Clinic) y el Sistema de Información de la Asistencia Ambulatoria de la Agencia Valenciana de Salud (SIA-Gaia), así como de los informes de otros centros no integrados en dichos sistemas, aportados por los propios pacientes. Las variables recogidas incluían: fecha y médico de primera consulta, especialistas visitados y fechas, pruebas realizadas (clasificadas en indicadas o innecesarias, basándonos en las guías europeas de diagnóstico2), fechas de estudios electrofisiológicos (EEF), consultas en urgencias, diagnóstico emitido por el neurólogo, fecha de diagnóstico, fecha de inicio de riluzol. En las tablas suplementarias 1 y 2 (anexo 1) se detalla cada una de las variables recogidas prospectiva y retrospectivamente. Las dudas surgidas en el proceso de recogida retrospectiva de datos se resolvieron por consenso de los 3investigadores. En aquellos pacientes que refirieron consultar en los primeros 15 días tras el inicio de síntomas, se revisó con minuciosidad la historia clínica antigua para recoger los síntomas que motivaban una consulta tan rápida. Finalmente, JFVC revisó todos los datos recogidos retrospectivamente.
Análisis estadísticoEl análisis estadístico se realizó mediante el programa R y Rstudio versión 3.3.1. Para el análisis descriptivo, se utilizaron medias y medianas (con desviación estándar y rango intercuartil, respectivamente) para las variables cuantitativas, y porcentajes para las variables cualitativas. Para el análisis inferencial se utilizó un modelo de regresión lineal en el caso de variables cuantitativas continuas (retraso diagnóstico) y un modelo de regresión logística para variables discretas con distribución Poisson (número de regiones afectas en el EEF según Awaji).
Comité bioéticaEl estudio contó con la aprobación del Comité Ético de Investigación Clínica del Hospital La Fe. Todos los pacientes firmaron un consentimiento informado para almacenamiento y uso de datos personales.
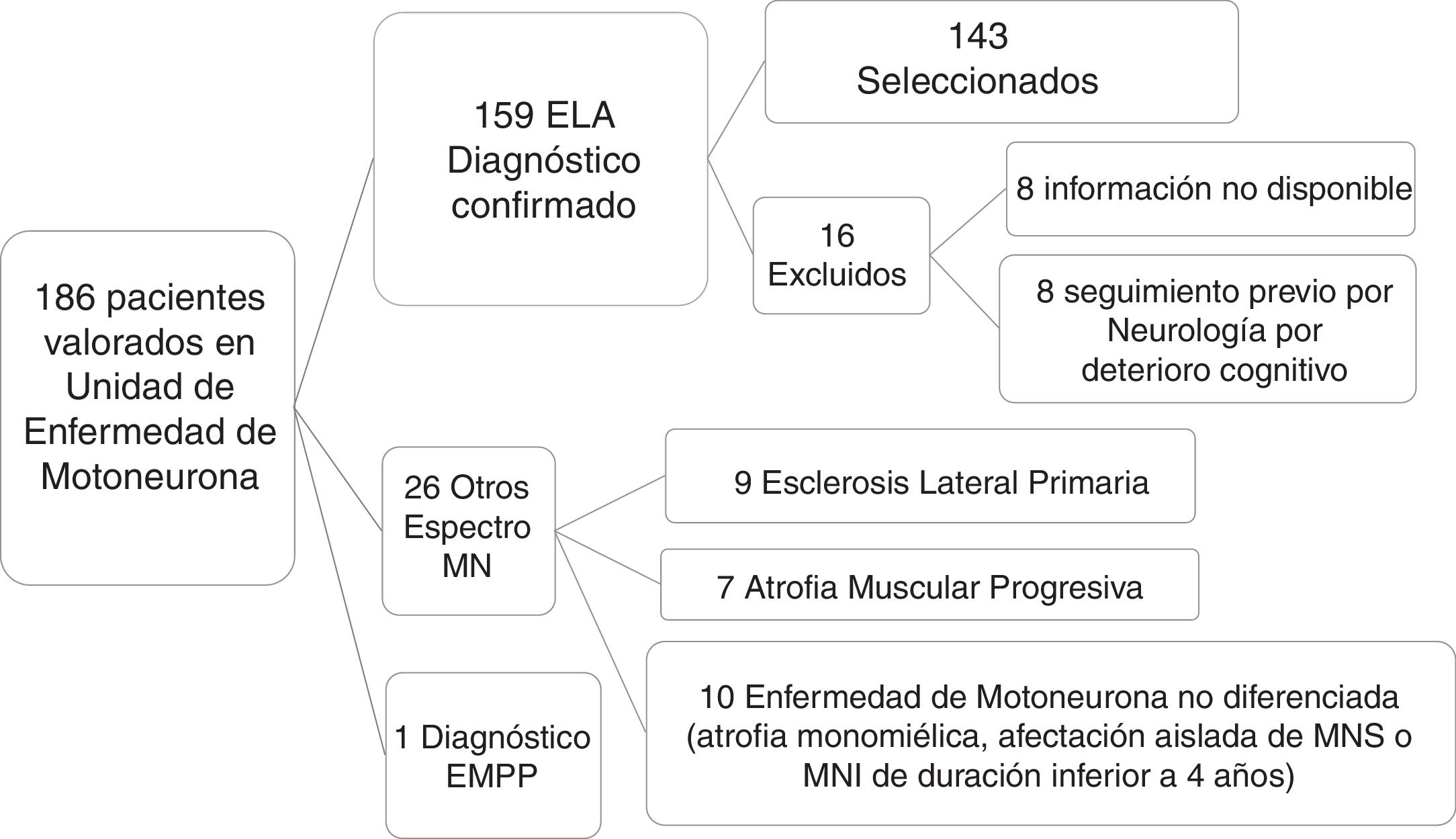
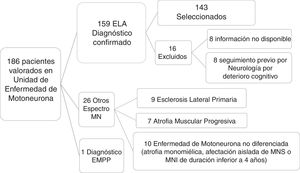
ResultadosCaracterísticas de los pacientesDe un total de 186 pacientes valorados y diagnosticados en la Unidad de Enfermedad de Motoneurona en el período comprendido entre octubre del 2013 y julio del 2017, se confirmó el diagnóstico de ELA en 159 pacientes, seleccionando finalmente a 143 según los criterios expuestos previamente (fig. 1).
Selección de pacientes. De un total de 186 pacientes valorados en la Unidad de Enfermedad de Motoneurona se confirmó el diagnóstico clínico de ELA en 159 tras un seguimiento de 6 meses. Se excluyó a 27 pacientes diagnosticados de otras entidades que se especifican en la figura. De los 159 pacientes con diagnóstico de ELA, finalmente se seleccionó a 143, tras excluir a 16 pacientes por diversos motivos. MN: motoneurona; MNI: motoneurona inferior; MNS: motoneurona superior.
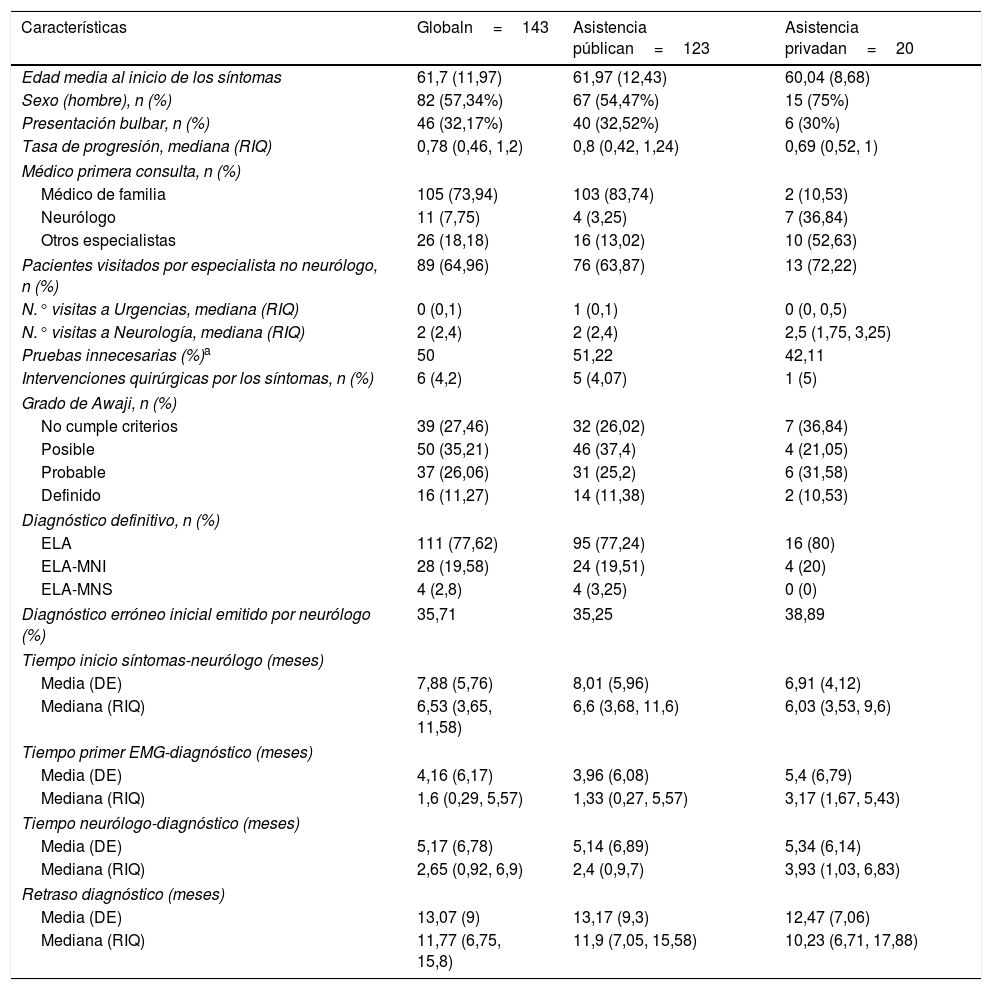
La tabla 1 resume las características demográficas, clínicas y de trayecto diagnóstico. La edad media fue de 62 años, con un predominio de varones y presentación espinal (especialmente en miembros inferiores [40%], seguido de miembros superiores [26%] y rara vez en musculatura axial [1,4%] o respiratoria [0,7%]). El 8% de los pacientes tenía antecedentes familiares de ELA.
Características de los pacientes y trayecto diagnóstico
| Características | Globaln=143 | Asistencia públican=123 | Asistencia privadan=20 |
|---|---|---|---|
| Edad media al inicio de los síntomas | 61,7 (11,97) | 61,97 (12,43) | 60,04 (8,68) |
| Sexo (hombre), n (%) | 82 (57,34%) | 67 (54,47%) | 15 (75%) |
| Presentación bulbar, n (%) | 46 (32,17%) | 40 (32,52%) | 6 (30%) |
| Tasa de progresión, mediana (RIQ) | 0,78 (0,46, 1,2) | 0,8 (0,42, 1,24) | 0,69 (0,52, 1) |
| Médico primera consulta, n (%) | |||
| Médico de familia | 105 (73,94) | 103 (83,74) | 2 (10,53) |
| Neurólogo | 11 (7,75) | 4 (3,25) | 7 (36,84) |
| Otros especialistas | 26 (18,18) | 16 (13,02) | 10 (52,63) |
| Pacientes visitados por especialista no neurólogo, n (%) | 89 (64,96) | 76 (63,87) | 13 (72,22) |
| N.° visitas a Urgencias, mediana (RIQ) | 0 (0,1) | 1 (0,1) | 0 (0, 0,5) |
| N.° visitas a Neurología, mediana (RIQ) | 2 (2,4) | 2 (2,4) | 2,5 (1,75, 3,25) |
| Pruebas innecesarias (%)a | 50 | 51,22 | 42,11 |
| Intervenciones quirúrgicas por los síntomas, n (%) | 6 (4,2) | 5 (4,07) | 1 (5) |
| Grado de Awaji, n (%) | |||
| No cumple criterios | 39 (27,46) | 32 (26,02) | 7 (36,84) |
| Posible | 50 (35,21) | 46 (37,4) | 4 (21,05) |
| Probable | 37 (26,06) | 31 (25,2) | 6 (31,58) |
| Definido | 16 (11,27) | 14 (11,38) | 2 (10,53) |
| Diagnóstico definitivo, n (%) | |||
| ELA | 111 (77,62) | 95 (77,24) | 16 (80) |
| ELA-MNI | 28 (19,58) | 24 (19,51) | 4 (20) |
| ELA-MNS | 4 (2,8) | 4 (3,25) | 0 (0) |
| Diagnóstico erróneo inicial emitido por neurólogo (%) | 35,71 | 35,25 | 38,89 |
| Tiempo inicio síntomas-neurólogo (meses) | |||
| Media (DE) | 7,88 (5,76) | 8,01 (5,96) | 6,91 (4,12) |
| Mediana (RIQ) | 6,53 (3,65, 11,58) | 6,6 (3,68, 11,6) | 6,03 (3,53, 9,6) |
| Tiempo primer EMG-diagnóstico (meses) | |||
| Media (DE) | 4,16 (6,17) | 3,96 (6,08) | 5,4 (6,79) |
| Mediana (RIQ) | 1,6 (0,29, 5,57) | 1,33 (0,27, 5,57) | 3,17 (1,67, 5,43) |
| Tiempo neurólogo-diagnóstico (meses) | |||
| Media (DE) | 5,17 (6,78) | 5,14 (6,89) | 5,34 (6,14) |
| Mediana (RIQ) | 2,65 (0,92, 6,9) | 2,4 (0,9,7) | 3,93 (1,03, 6,83) |
| Retraso diagnóstico (meses) | |||
| Media (DE) | 13,07 (9) | 13,17 (9,3) | 12,47 (7,06) |
| Mediana (RIQ) | 11,77 (6,75, 15,8) | 11,9 (7,05, 15,58) | 10,23 (6,71, 17,88) |
Se consideran pruebas innecesarias todas aquellas pruebas realizadas durante el estudio de la enfermedad que no figuran entre las indicadas para el diagnóstico de ELA según las guía europeas2 (p. ej., radiografía de la mano) o aquellas realizadas de forma reiterativa, innecesariamente. Esta categorización se realizó por consenso en cada paciente.
Los pacientes tardaron en consultar una mediana de 2,5 meses aunque, curiosamente, 20 pacientes (14%) consultaron de forma precoz, en los primeros 15días tras el inicio referido de los síntomas. Las notas médicas no especificaban cómo había sido el inicio en 7 de esos pacientes; sin embargo, en los otros 13 se describía un inicio agudo expresado en 3formas de presentación diferentes:
- –
Inicio con dolor (8 pacientes): 6de inicio en miembros inferiores y uno de inicio en miembros superiores, que consultaron por dolor lumbar (4), dolor en las extremidades (2) o calambres (2). Un paciente con inicio bulbar consultó por dolor faríngeo.
- –
Inicio tras cirugía (4 pacientes): en este caso refirieron el inicio de los síntomas en el contexto de un postoperatorio (tras intervención traumatológica en 3casos y apendicectomía en otro caso). En 3de ellos el inicio fue en miembros inferiores, y bulbar en otro.
- –
Inicio ictal: una paciente inició con disartria de forma aparentemente brusca, avisando al médico de urgencias, quien derivó al hospital ante la sospecha de ictus.
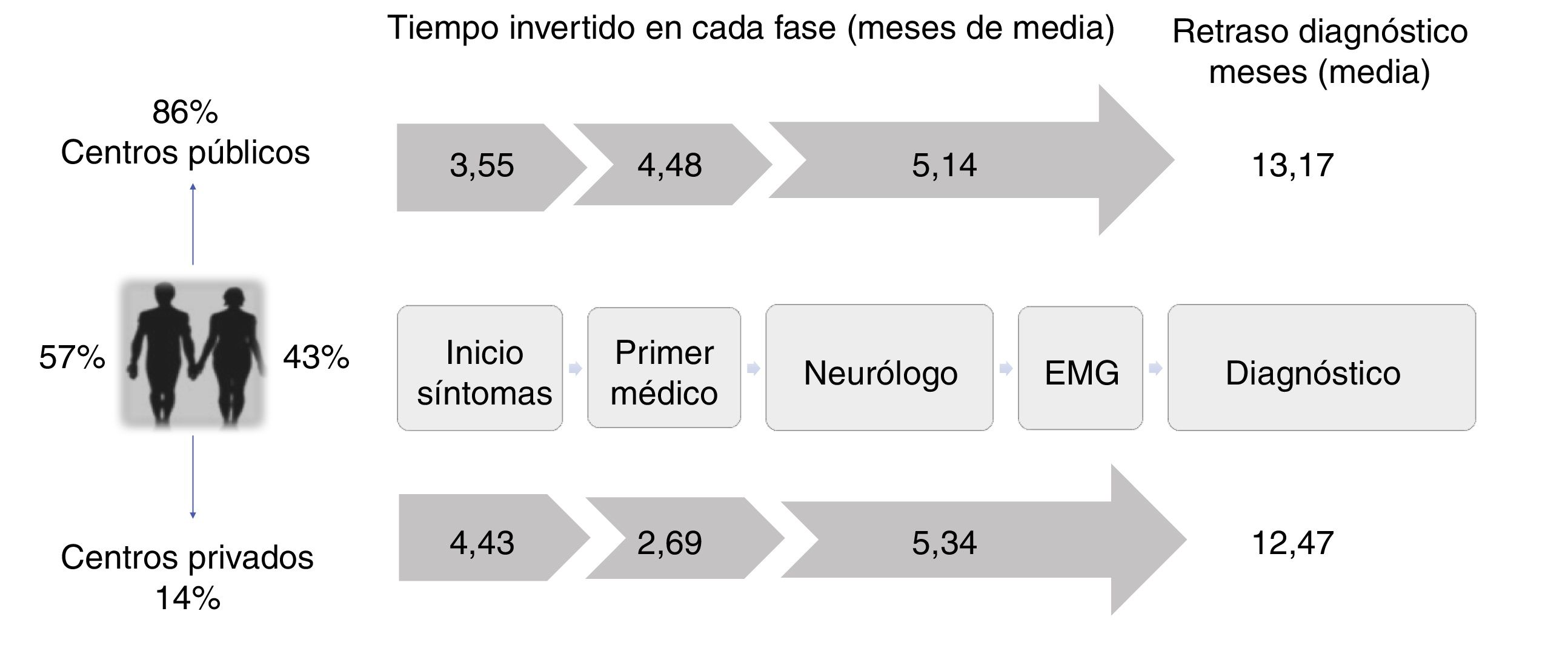
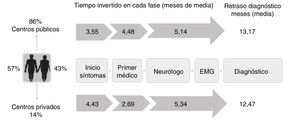
Del total de pacientes, 123 (86%) recibieron asistencia en centros públicos, mientras que 20 pacientes (14%) fueron estudiados en centros privados, si bien 2de estos pacientes habían consultado previamente a su médico de familia en la sanidad pública. De los pacientes estudiados en centros públicos, 16 fueron puntualmente visitados también en un centro privado. Por tanto, un 25% del total de pacientes consultaron en un centro privado en algún momento del trayecto diagnóstico.
El retraso diagnóstico medio fue de 13,1 meses (mediana 11,7) desde el inicio de los síntomas y el tiempo hasta el inicio de riluzol de 13,3 meses (mediana 12,2). El tiempo invertido en el proceso diagnóstico se puede dividir en 3fases diagnósticas: tiempo que tarda el paciente en consultar, tiempo desde que consulta por primera vez en el sistema sanitario hasta que llega a Neurología y tiempo desde que es visitado en Neurología hasta que se alcanza el diagnóstico (fig. 2).
Trayecto y retraso diagnóstico: sistema público vs. Privado. El periplo que siguieron los pacientes durante la fase prediagnóstica de la enfermedad fue similar en ambos sistemas sanitarios, aunque los pacientes atendidos en centros privados consultaron más tarde y llegaron antes al neurólogo por las particularidades de este sistema. Sin embargo, el retraso diagnóstico final fue similar en ambos sistemas sanitarios, ya que el tiempo invertido por el neurólogo en la privada fue algo superior.
Los pacientes tardaron una media de 3,6 meses (mediana 2,5 meses) en consultar con el primer médico (principalmente el médico de familia), quien orientó adecuadamente el caso (derivación a neurología en menos de un mes) en el 38% de las ocasiones.
El tiempo invertido desde que el paciente consulta por primera vez hasta que llega al neurólogo es muy variable, aunque la media es 4,48 meses (mediana 2,8 meses). El neurólogo fue el primer especialista consultado en la mayoría de los pacientes (53%). Pese a ello, un 29% de los casos fueron derivados a otros especialistas tras la valoración por Neurología, de manera que hasta el 65% del global de pacientes fue visitado por un especialista distinto al neurólogo en algún momento previo al diagnóstico. Las 2especialidades más consultadas fueron traumatología (26%) y otorrinolaringología (20%). Consecuentemente, en el 50% de los pacientes se realizaron pruebas no informativas para el diagnóstico de ELA (radiografías, endoscopias, etc.) y un 5% de los pacientes fue sometido a una intervención quirúrgica en relación con los síntomas iniciales de la enfermedad (normalmente hernias cervicales o lumbares).
El neurólogo necesitó una media de 5,2 meses y 3contactos para establecer el diagnóstico, con un primer diagnóstico erróneo en un 36% de los pacientes. Todo ello pese a que un 23% de los pacientes ya disponían de EEF en el momento de ser visitados. De modo que gran parte de este retraso ocurre tras haber realizado el primer EEF (tabla 1). De hecho, en la mitad de los pacientes se necesitó más de un EEF para llegar al diagnóstico, debido a que hasta un 34% de dichos estudios no fueron concluyentes, fundamentalmente (26%) porque no cumplían criterios electrofisiológicos de afectación de ninguna región según los criterios de Awaji. Tampoco fue desdeñable el porcentaje de pacientes (24%) que mostraron una única región afectada en la primera electromiografía. El primer estudio electrofisiológico fue menos informativo (mostró menos regiones de Awaji afectadas) cuando el médico solicitante no era el neurólogo (odds ratio = 0,7 [0,50-0,96], p = 0,034) (tabla 2).
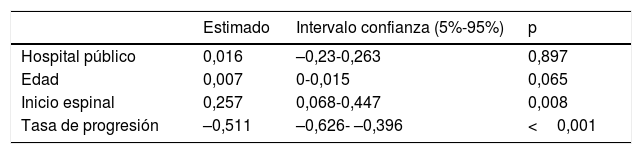
Trayecto diagnóstico en centro público respecto a centro privadoLa mayor parte de los pacientes atendidos en el sistema público comunicaron los primeros síntomas a su médico de familia, a diferencia de lo observado en pacientes estudiados en centros privados, quienes mayoritariamente consultaron directamente al especialista. El tiempo que tardaron los pacientes en consultar fue algo superior en el caso de pacientes estudiados en la sanidad privada, posiblemente porque presentaban una velocidad de progresión más lenta. Pese a ello, al tener un acceso más directo a los especialistas, los pacientes visitados en la privada llegaron de media un mes antes al neurólogo. Sin embargo, el retraso diagnóstico fue similar en ambos sistemas, ajustando por edad, forma de inicio y tasa de progresión (p = 0,897; tabla 3). Esto podría explicarse porque los pacientes estudiados en centros privados visitaron con más frecuencia a especialistas no neurólogos y requirieron en más ocasiones un segundo estudio electrofisiológico para llegar al diagnóstico respecto a los estudiados en la pública, resultando en un mayor tiempo invertido desde que se realiza el primer electromiograma (EMG) hasta el diagnóstico (tabla 1). Por lo demás, el trayecto diagnóstico y el impacto medido en pruebas complementarias o intervenciones no indicadas fueron similares en centros privados y públicos (tabla 1) (fig. 2).
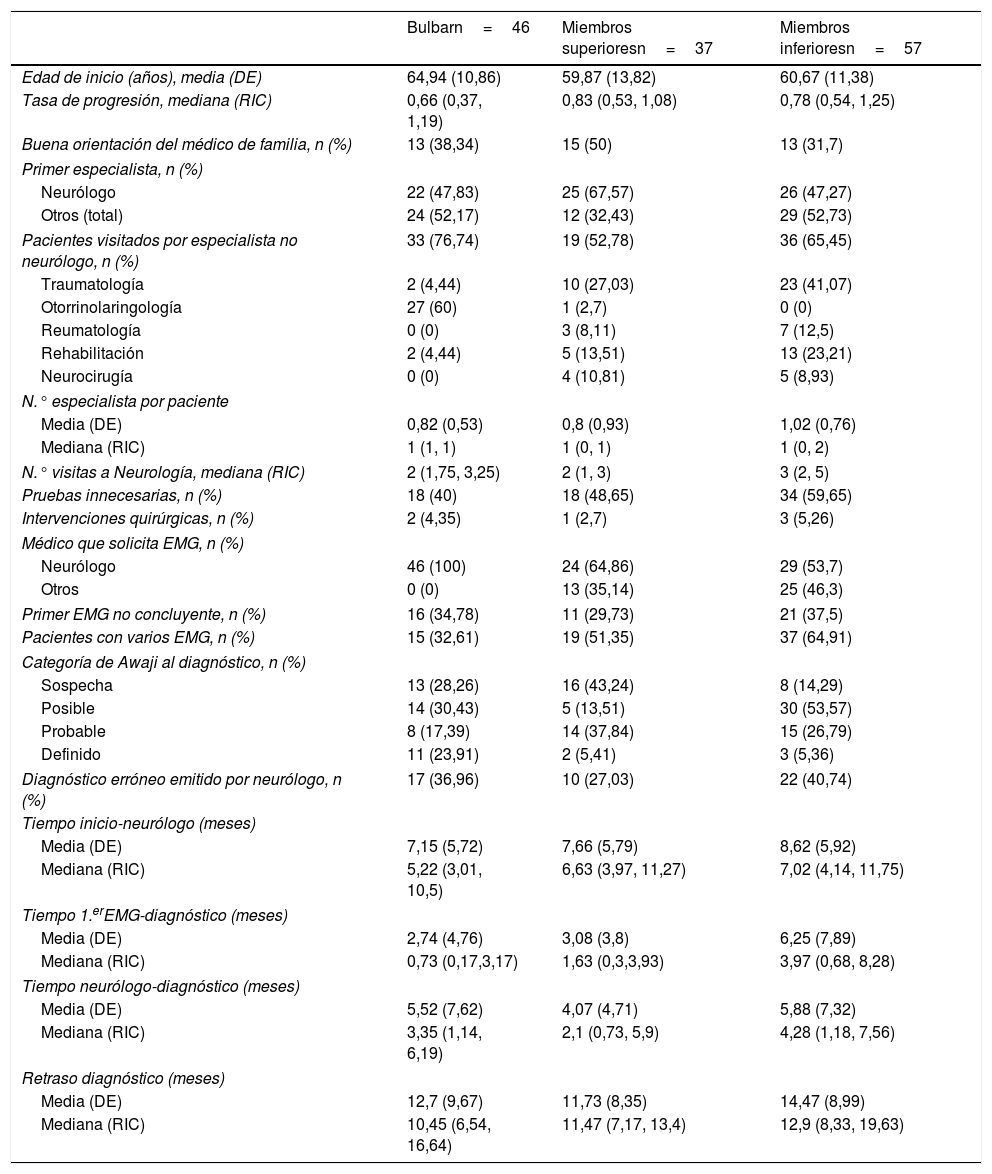
Trayecto diagnóstico según región de inicioSegún el modelo (tabla 3), los casos espinales presentaron un mayor retraso diagnóstico, independientemente de la edad, la tasa de progresión y el sistema en el que fueron estudiados. Esta diferencia puede atribuirse por un lado a un mayor porcentaje de pruebas innecesarias en casos espinales (55%) respecto a bulbares (40%) y, por otro, a mayor porcentaje de pacientes con varios EMG. Además, el tiempo desde el primer EMG hasta el diagnóstico fue mayor en formas espinales respecto a bulbares, pese a que el porcentaje de pacientes que no mostraban afectación de ninguna región neurofisiológica según criterios de Awaji en el primer EMG era similar en los de inicio bulbar (30%) que en los de inicio en miembros inferiores (30%) y superior a los de inicio en miembros superiores (19%).
El mayor retraso en pacientes espinales es atribuible a aquellos de inicio en miembros inferiores. La tabla 4 muestra que, por un lado, fueron los pacientes peor orientados por el médico de cabecera y, por tanto, llegaron más tarde al neurólogo. Por otro lado, resultaron los más difíciles de diagnosticar también por los diversos especialistas y el propio neurólogo, lo que se refleja en un mayor número de pruebas innecesarias solicitadas y también más errores diagnósticos. Además, es frecuente que en estos casos no fuera el neurólogo el que solicita el estudio electrofisiológico, por lo que con más frecuencia requirieron un segundo estudio electrofisiológico y, por ende, se emplearon más tiempo y visitas hasta llegar al diagnóstico de ELA.
Trayecto diagnóstico según región de inicio
| Bulbarn=46 | Miembros superioresn=37 | Miembros inferioresn=57 | |
|---|---|---|---|
| Edad de inicio (años), media (DE) | 64,94 (10,86) | 59,87 (13,82) | 60,67 (11,38) |
| Tasa de progresión, mediana (RIC) | 0,66 (0,37, 1,19) | 0,83 (0,53, 1,08) | 0,78 (0,54, 1,25) |
| Buena orientación del médico de familia, n (%) | 13 (38,34) | 15 (50) | 13 (31,7) |
| Primer especialista, n (%) | |||
| Neurólogo | 22 (47,83) | 25 (67,57) | 26 (47,27) |
| Otros (total) | 24 (52,17) | 12 (32,43) | 29 (52,73) |
| Pacientes visitados por especialista no neurólogo, n (%) | 33 (76,74) | 19 (52,78) | 36 (65,45) |
| Traumatología | 2 (4,44) | 10 (27,03) | 23 (41,07) |
| Otorrinolaringología | 27 (60) | 1 (2,7) | 0 (0) |
| Reumatología | 0 (0) | 3 (8,11) | 7 (12,5) |
| Rehabilitación | 2 (4,44) | 5 (13,51) | 13 (23,21) |
| Neurocirugía | 0 (0) | 4 (10,81) | 5 (8,93) |
| N.° especialista por paciente | |||
| Media (DE) | 0,82 (0,53) | 0,8 (0,93) | 1,02 (0,76) |
| Mediana (RIC) | 1 (1, 1) | 1 (0, 1) | 1 (0, 2) |
| N.° visitas a Neurología, mediana (RIC) | 2 (1,75, 3,25) | 2 (1, 3) | 3 (2, 5) |
| Pruebas innecesarias, n (%) | 18 (40) | 18 (48,65) | 34 (59,65) |
| Intervenciones quirúrgicas, n (%) | 2 (4,35) | 1 (2,7) | 3 (5,26) |
| Médico que solicita EMG, n (%) | |||
| Neurólogo | 46 (100) | 24 (64,86) | 29 (53,7) |
| Otros | 0 (0) | 13 (35,14) | 25 (46,3) |
| Primer EMG no concluyente, n (%) | 16 (34,78) | 11 (29,73) | 21 (37,5) |
| Pacientes con varios EMG, n (%) | 15 (32,61) | 19 (51,35) | 37 (64,91) |
| Categoría de Awaji al diagnóstico, n (%) | |||
| Sospecha | 13 (28,26) | 16 (43,24) | 8 (14,29) |
| Posible | 14 (30,43) | 5 (13,51) | 30 (53,57) |
| Probable | 8 (17,39) | 14 (37,84) | 15 (26,79) |
| Definido | 11 (23,91) | 2 (5,41) | 3 (5,36) |
| Diagnóstico erróneo emitido por neurólogo, n (%) | 17 (36,96) | 10 (27,03) | 22 (40,74) |
| Tiempo inicio-neurólogo (meses) | |||
| Media (DE) | 7,15 (5,72) | 7,66 (5,79) | 8,62 (5,92) |
| Mediana (RIC) | 5,22 (3,01, 10,5) | 6,63 (3,97, 11,27) | 7,02 (4,14, 11,75) |
| Tiempo 1.erEMG-diagnóstico (meses) | |||
| Media (DE) | 2,74 (4,76) | 3,08 (3,8) | 6,25 (7,89) |
| Mediana (RIC) | 0,73 (0,17,3,17) | 1,63 (0,3,3,93) | 3,97 (0,68, 8,28) |
| Tiempo neurólogo-diagnóstico (meses) | |||
| Media (DE) | 5,52 (7,62) | 4,07 (4,71) | 5,88 (7,32) |
| Mediana (RIC) | 3,35 (1,14, 6,19) | 2,1 (0,73, 5,9) | 4,28 (1,18, 7,56) |
| Retraso diagnóstico (meses) | |||
| Media (DE) | 12,7 (9,67) | 11,73 (8,35) | 14,47 (8,99) |
| Mediana (RIC) | 10,45 (6,54, 16,64) | 11,47 (7,17, 13,4) | 12,9 (8,33, 19,63) |
Por el contrario, las formas de inicio en miembros superiores parecen ser más fáciles de identificar. Como muestra de ello, fueron los pacientes mejor orientados por el médico de cabecera y, por tanto, fueron derivados con menor frecuencia a especialistas distintos del neurólogo. Además, una vez llegaron a Neurología se diagnosticaron más pronto y con menor porcentaje de errores diagnósticos.
Cabe señalar que el perfil de especialistas no neurólogos consultados también varió según la región de inicio, siendo el otorrinolaringólogo el principal especialista consultado en las formas de inicio bulbar y el traumatólogo en los casos de inicio en miembros superiores e inferiores.
DiscusiónCasi 20años después de que se revisaran los criterios de El Escorial, el diagnóstico de la ELA en fases tempranas sigue siendo una asignatura pendiente, como evidencian numerosos estudios realizados en distintos países. A tenor de los resultados de este estudio, nuestro entorno no es una excepción.
Con la aparición de los primeros síntomas, el paciente y sus familiares inician un largo periplo, de unos 12 meses según nuestro estudio y estudios previos (tabla 5), antes de llegar al diagnóstico. Esta fase prediagnóstica característicamente se compone de una serie de etapas en las que el tiempo se reparte más o menos equitativamente, de modo que el retraso diagnóstico no es atribuible al funcionamiento subóptimo de una única etapa, sino probablemente a diversos factores en cada una de ellas, que se detallan brevemente a continuación.
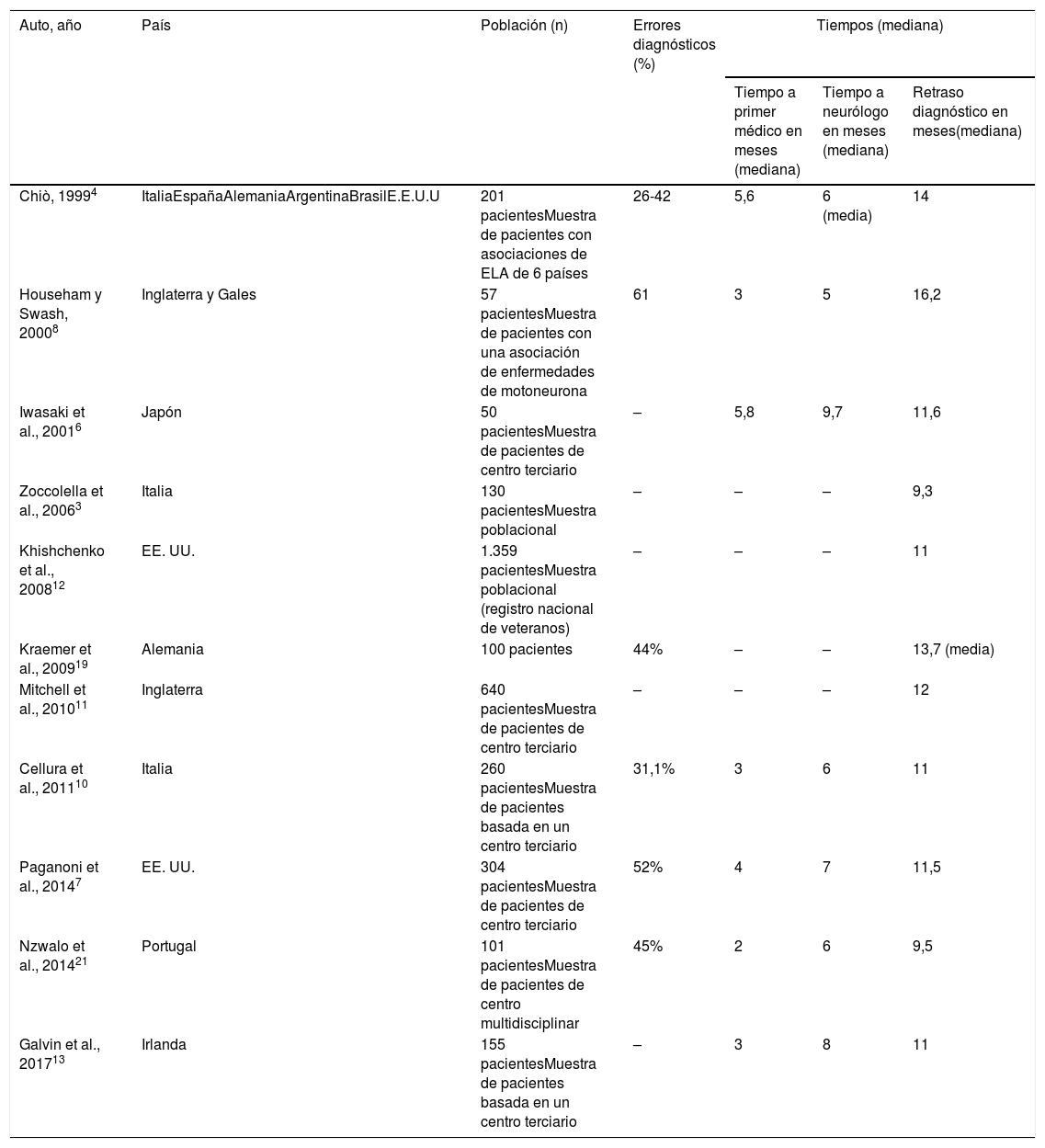
Retraso diagnóstico de la ELA en estudios previos
| Auto, año | País | Población (n) | Errores diagnósticos (%) | Tiempos (mediana) | ||
|---|---|---|---|---|---|---|
| Tiempo a primer médico en meses (mediana) | Tiempo a neurólogo en meses (mediana) | Retraso diagnóstico en meses(mediana) | ||||
| Chiò, 19994 | ItaliaEspañaAlemaniaArgentinaBrasilE.E.U.U | 201 pacientesMuestra de pacientes con asociaciones de ELA de 6 países | 26-42 | 5,6 | 6 (media) | 14 |
| Househam y Swash, 20008 | Inglaterra y Gales | 57 pacientesMuestra de pacientes con una asociación de enfermedades de motoneurona | 61 | 3 | 5 | 16,2 |
| Iwasaki et al., 20016 | Japón | 50 pacientesMuestra de pacientes de centro terciario | – | 5,8 | 9,7 | 11,6 |
| Zoccolella et al., 20063 | Italia | 130 pacientesMuestra poblacional | – | – | – | 9,3 |
| Khishchenko et al., 200812 | EE. UU. | 1.359 pacientesMuestra poblacional (registro nacional de veteranos) | – | – | – | 11 |
| Kraemer et al., 200919 | Alemania | 100 pacientes | 44% | – | – | 13,7 (media) |
| Mitchell et al., 201011 | Inglaterra | 640 pacientesMuestra de pacientes de centro terciario | – | – | – | 12 |
| Cellura et al., 201110 | Italia | 260 pacientesMuestra de pacientes basada en un centro terciario | 31,1% | 3 | 6 | 11 |
| Paganoni et al., 20147 | EE. UU. | 304 pacientesMuestra de pacientes de centro terciario | 52% | 4 | 7 | 11,5 |
| Nzwalo et al., 201421 | Portugal | 101 pacientesMuestra de pacientes de centro multidisciplinar | 45% | 2 | 6 | 9,5 |
| Galvin et al., 201713 | Irlanda | 155 pacientesMuestra de pacientes basada en un centro terciario | – | 3 | 8 | 11 |
Los pacientes tardan unos 3 meses en consultar desde que se inician los síntomas, de forma similar a lo descrito en estudios previos (tabla 5). Sin embargo, un porcentaje no despreciable de los pacientes (14% en nuestro estudio) consultan en menos de 15 días. Si bien esto puede atribuirse en a un recuerdo erróneo de los pacientes de la fecha exacta de inicio de los síntomas, al menos en una parte de estos pacientes se pudo comprobar un inicio agudo en forma de dolor o tras una cirugía que aparentemente actúa como desencadenante. El inicio de la enfermedad con o precedido por dolor ha sido descrito con anterioridad hasta en un tercio de los pacientes con ELA18 y es un aspecto reseñable porque, según nuestro estudio, estos pacientes parecen consultar de forma precoz. Sin embargo, esta forma de inicio no necesariamente se asocia a un menor retraso diagnóstico, probablemente porque el dolor se considera un síntoma atípico de ELA y sugiere otros diagnósticos. Respecto a la cirugía como desencadenante de los síntomas, un estudio19 mostró que el 3,5% de los pacientes con ELA habían sido operados en los 3meses anteriores al inicio de la enfermedad, existiendo una relación entre la región de la cirugía y la de inicio de síntomas, así como una aparente aceleración de la enfermedad tras la cirugía, lo que reforzaría un papel patogénico de la misma.
Tiempo primera consulta-neurólogoEste tiempo, de unos 4 meses en todos los estudios (tabla 5), no parece atribuible a la lista de espera, sino, en gran medida, a una incorrecta orientación diagnóstica por el médico de cabecera. Únicamente en el 38% de los casos se sospecha precozmente una enfermedad neurológica y aproximadamente la mitad de los pacientes son derivados a distintas especialidades (fundamentalmente otorrinolaringología en los de inicio bulbar y traumatología en los espinales) antes de llegar al neurólogo. Estos datos son, pese a todo, mejores a los encontrados en otro estudio europeo13.
Tiempo neurólogo-diagnósticoEste tiempo es quizás el más variable de un paciente a otro (media 5,2 meses, mediana 2,6). En cualquier caso, se antoja excesivamente largo, especialmente si consideramos que los pacientes llevan ya un trayecto de casi 8 meses cuando llegan al neurólogo. Efectivamente, el primer diagnóstico emitido por el neurólogo en la primera visita fue incorrecto en más de un tercio de los pacientes (datos similares a estudios previos, tabla 5) y muchos fueron derivados a otras especialidades, prolongando el periplo diagnóstico. Esta demora tampoco es atribuible a un retraso en la realización del estudio electrofisiológico, ya que la mayor parte del retraso ocurre tras dicho estudio. De hecho, en la mayoría de pacientes se necesitaron varios EEF para llegar al diagnóstico.
Factores modificadores del retraso diagnósticoAl igual que la demora y las etapas diagnósticas, los errores diagnósticos se repiten de forma constante en los diversos estudios, independientemente del trasfondo cultural y las características del sistema sanitario (tabla 5). De hecho, en el presente estudio no encontramos diferencias en el retraso diagnóstico en aquellos pacientes estudiados en la pública y en la privada, pese a las diferencias existentes entre ambos sistemas, con acceso más directo (sin mediación del médico de cabecera) al especialista y mayor celeridad en la realización de pruebas complementarias en la atención privada. Efectivamente, observamos que los pacientes estudiados en la privada llegan antes al neurólogo y se realizan antes el EMG. Sin embargo, esto no se traduce en un menor retraso diagnóstico, ya que se incrementa el tiempo desde la primera visita al neurólogo y la realización del primer EMG hasta el diagnóstico. Esto indica, por un lado, que el retraso diagnóstico no es atribuible a deficiencias del sistema sanitario como las listas de espera y, por otro lado, que una consulta precoz con el neurólogo no siempre garantiza un diagnóstico precoz, como han señalado previamente otros autores8,10,13.
El inicio bulbar y una progresión rápida son 2factores claramente establecidos de menor retraso diagnóstico3,6,12,20,21 que se replican en este estudio. La progresión rápida no solo condiciona una consulta precoz, sino que facilita el diagnóstico de ELA, puesto que este requiere una progresión continua objetivable. Mención especial merece el inicio bulbar. Si bien algunos autores han interpretado que el menor retraso en los pacientes de inicio bulbar es debido a su progresión más rápida12, nuestro estudio demuestra que este efecto es independiente de la velocidad de progresión y que es atribuible, en gran medida, al mayor retraso en las formas de inicio en miembros inferiores. En estos pacientes aumenta la probabilidad de incurrir en errores diagnósticos y realizar pruebas innecesarias ya que, para ojos inexpertos, la ELA puede simular un amplio abanico de enfermedades altamente prevalentes, especialmente del área traumatológica (hernias discales, enfermedad osteodegenerativa, etc.), con mucha más frecuencia que en las formas de inicio en brazos o bulbares.
Impacto del retraso diagnóstico en el paciente y el sistema sanitarioLos datos de nuestro estudio replican resultados previos y muestran un importante impacto negativo de los errores diagnósticos no solo sobre el paciente (y sus familiares)7,13, sino también sobre el sistema sanitario, con un gasto cuantificado en unos 3.500 euros por paciente13, 2.000 de los cuales se podrían ahorrar si el diagnóstico se realizara conforme a las recomendaciones de las guías actuales2.
Cómo reducir la demora diagnósticaTeniendo en cuenta que los errores diagnósticos están condicionados en gran medida por el inicio insidioso y la gran heterogeneidad clínica de la enfermedad, una posible línea de actuación sería la formación específica de aquellos especialistas (médicos de familia, traumatólogos, otorrinolaringólogos, etc.) implicados en el trayecto diagnóstico del paciente con ELA, con especial hincapié en las llamadas banderas rojas. Sin embargo, considerando que un médico de cabecera verá únicamente un par de casos de ELA a lo largo de su carrera profesional, es poco probable que esta medida tenga un efecto significativo en la demora diagnóstica, como ya han mostrado estudios previos13, más aún si tenemos presente que llegar antes al neurólogo no asegura un menor retraso diagnóstico8,10,13.
El retraso diagnóstico tampoco parece depender de listas de espera prolongadas ya que, ante la sospecha de ELA, es frecuente que se acelere la realización de estudios (incluso con ingresos programados en muchos centros). Además, intentos previos de crear sistemas de derivación rápida no han conseguido disminuir significativamente el retraso diagnóstico11.
Por tanto, la etapa del trayecto donde parece más razonable incidir para disminuir el retraso diagnóstico, sería desde que el paciente es valorado por primera vez por el neurólogo.
Es evidente que los criterios de El Escorial y sus revisiones posteriores han fracasado en su empeño por propiciar un diagnóstico más precoz. Por ello, y en ausencia de marcadores específicos, el diagnóstico de la ELA sigue siendo clínico, dependiendo fundamentalmente de la experiencia del neurólogo. El EEF representa una herramienta de apoyo de gran utilidad, siempre y cuando se solicite de forma dirigida con base en una sospecha clínica y se interprete de forma adecuada. De no ser así, los estudios pueden resultar subóptimos y, por tanto, no concluyentes, induciendo a confusión, errores diagnósticos y necesidad de repetir la prueba. Cabe resaltar que algo más de un tercio de los EEF realizados por primera vez no fueron compatibles con el diagnóstico de enfermedad de motoneurona según los criterios de Awaji15, fundamentalmente porque no cumplían criterios de afectación de ninguna región. Estos datos son compatibles con estudios previos22 y ponen de manifiesto que los criterios electrofisiológicos de El Escorial y su posterior revisión de Awaji15,23, diseñados para su uso en investigación, no se deben usar en la práctica clínica, especialmente si perseguimos un diagnóstico precoz. No se debe olvidar que determinados fenotipos, como la parálisis bulbar y seudobulbar progresiva muestran característicamente EMG normales en los primeros meses o años de enfermedad, y que hasta un 20% de los pacientes con ELA pueden presentar caídas en los potenciales sensitivos en los EEF24. Por ello, un EMG normal o con datos atípicos no es incompatible con un diagnóstico de enfermedad de motoneurona cuando la sospecha clínica está bien fundada. En este sentido, la formación específica de neurólogos generales en el diagnóstico de enfermedades de motoneurona o la derivación a centros de referencia de aquellos pacientes en que la sospecha diagnóstica no puede ser confirmada podría desempeñar un papel importante en la reducción de la demora diagnóstica.
ConclusionesLos datos de este estudio muestran un trayecto y retraso diagnóstico similar al de países de nuestro entorno, que parece ser independiente de las particularidades de cada sistema sanitario e intrínseco a la enfermedad e impacta negativamente sobre el paciente y el sistema sanitario. Las formas de inicio en miembros inferiores constituyen el mayor reto diagnóstico por el amplio abanico de diagnósticos diferenciales. Aunque en cada una de las etapas del trayecto diagnóstico existe margen de mejora, los errores diagnósticos del neurólogo son frecuentes y en parte atribuibles a una mala orientación o interpretación del estudio electrofisiológico. Por tanto, la formación específica del neurólogo y neurofisiólogo general y la derivación precoz a centros de referencia son 2medidas que podrían ayudar a reducir la demora. Se necesitan estudios que analicen si la derivación precoz a centros de referencia permite disminuir la demora diagnóstica.
FinanciaciónJFVC está financiado por un contrato de investigación del Instituto de Investigación Sanitaria La Fe (2016/0490).
Conflicto de interesesNinguno.