Las enfermedades de motoneurona (EMN) incluyen afecciones como la esclerosis lateral amiotrófica (ELA) y la esclerosis lateral primaria (ELP), caracterizadas por la degeneración progresiva de la primera y/o segunda motoneurona. La identificación de biomarcadores específicos es crucial para reducir los retrasos diagnósticos.
MétodosSe presentan 3 casos clínicos evaluados en el Hospital Universitario 12 de Octubre, donde el signo de la banda motora en PET/TC 18F-FDG cerebral contribuyó al diagnóstico de la EMN. Los estudios se realizaron con un equipo SIEMENS Biograph™ TruePoint™ 6 y se revisó la literatura relevante.
ResultadosEn los 3 pacientes, la PET/TC mostró un hipometabolismo en la región prerrolándica, indicativo del signo de la banda motora, que ayudó a definir el diagnóstico de ELP o ELA en cada caso.
DiscusiónEl signo de la banda motora en la PET/TC 18F-FDG cerebral emerge como un marcador potencial de afectación de primera motoneurona, si bien la heterogeneidad de las EMN y la variabilidad en los estudios requieren mayor investigación para definir su especificidad y sensibilidad.
ConclusiónEl signo de la banda motora en la PET/TC 18F-FDG cerebral es un biomarcador prometedor para las EMN, aunque se necesitan estudios adicionales para establecer su validez diagnóstica.
Motor neuron diseases (MND) encompass conditions like amyotrophic lateral sclerosis (ALS) and primary lateral sclerosis (PLS), marked by progressive degeneration of upper and/or lower motor neurons. The identification of specific biomarkers is crucial to reduce diagnostic delays.
MethodsThis study presents three clinical cases evaluated at the Hospital Universitario 12 de Octubre, where the motor band sign on brain 18F-FDG PET/CT aided the diagnosis of MND. The studies were conducted using a SIEMENS Biograph™ TruePoint™ 6, with a review of relevant literature.
ResultsIn all three patients, PET/CT revealed hypometabolism in the prerolandic region, indicative of the motor band sign, contributing to the diagnosis of PLS or ALS.
DiscussionThe motor band sign on 18F-FDG PET/CT emerges as a potential marker of upper motor neuron involvement, though the heterogeneity of MNDs and variability across studies call for further research to establish its specificity and sensitivity.
ConclusionThe motor band sign on 18F-FDG PET/CT is a promising biomarker for MNDs, although further studies are required to confirm its diagnostic validity.
El término enfermedades de motoneurona (EMN) engloba a un grupo heterogéneo de entidades caracterizadas por una degeneración progresiva de primera y/o segunda motoneurona. Se incluyen aquí la esclerosis lateral amiotrófica (ELA) y la esclerosis lateral primaria (ELP), entre otras1. Su incidencia aumenta con la edad, siendo mayor entre los 60-79 años2, con un riesgo estimado a los largo de la vida de aproximadamente 1 de 3503.
Su diagnóstico sigue siendo fundamentalmente clínico y de exclusión, con los problemas que ello plantea en casos no evidentes. En la actualidad persiste un importante retraso en el diagnóstico, con una mediana de unos 11-12 meses4, aunque en formas de inicio espinal puede ser de hasta 22 meses5. Es por ello que es necesaria la búsqueda de un biomarcador específico, en la misma dirección que han tomado otras enfermedades neurodegenerativas como la enfermedad de Alzheimer6.
En este trabajo se presentan 3 pacientes en los que la presencia de una alteración característica —aunque aún sin un papel claro dentro del proceso diagnóstico— tiene un papel relevante en el diagnóstico de la enfermedad: el signo de la banda motora en el PET/TC 18F-FDG cerebral.
MétodosExposición de 3 casos clínicos atendidos en la unidad de enfermedades neuromusculares y unidad de enfermedades desmielinizantes de un hospital español público de tercer nivel: el Hospital Universitario 12 de Octubre. Los datos clínicos se publican anonimizados. Los estudios de PET/TC 18F-FDG cerebral fueron realizados en un equipo SIEMENS Biograph™ TruePoint™ 6 y las imágenes analizadas mediante el software AW Server 3.2 Ext 4.8, Cortex ID. Se realizó posterirmente una revisión no sistemática de la literatura mediante una bíusqueda en PubMed®, utilizando términos de búsqueda «ALS», «PLS», «motor neuron disease», «FDG PET/CT», «motor band sign», «biomarkers»; en diferentes combinaciones, seleccionando aquellos artículos considerados de mayor relevancia por el número de pacientes incluidos, factor de impacto de la revista y el papel del hipometabolismo perirrolándico en aquellos estudios de PET/TC 18F-FDG cerebral. No se han incluido otros los que se centran en patrones generales de PET/TC 18F-FDG cerebral en las EMN, que están presentes en mayor medida en la literatura y exceden los objetivos de este trabajo, centrado en el signo de la banda motora. En la tabla 1 se resumen las características de algunos de los trabajos más relevantes consultados.
Algunos trabajos relevantes consultados sobre el PET/TC 18F-FDG cerebral en enfermedad de motoneurona
| Autores | Fecha | Revista | Tipo estudio | Número de pacientes | Resultados/conclusiones |
|---|---|---|---|---|---|
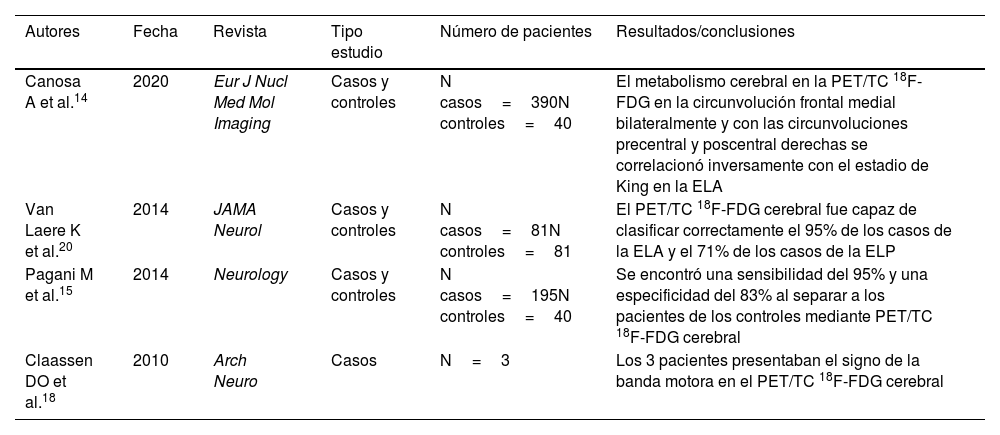
| Canosa A et al.14 | 2020 | Eur J Nucl Med Mol Imaging | Casos y controles | N casos=390N controles=40 | El metabolismo cerebral en la PET/TC 18F-FDG en la circunvolución frontal medial bilateralmente y con las circunvoluciones precentral y poscentral derechas se correlacionó inversamente con el estadio de King en la ELA |
| Van Laere K et al.20 | 2014 | JAMA Neurol | Casos y controles | N casos=81N controles=81 | El PET/TC 18F-FDG cerebral fue capaz de clasificar correctamente el 95% de los casos de la ELA y el 71% de los casos de la ELP |
| Pagani M et al.15 | 2014 | Neurology | Casos y controles | N casos=195N controles=40 | Se encontró una sensibilidad del 95% y una especificidad del 83% al separar a los pacientes de los controles mediante PET/TC 18F-FDG cerebral |
| Claassen DO et al.18 | 2010 | Arch Neuro | Casos | N=3 | Los 3 pacientes presentaban el signo de la banda motora en el PET/TC 18F-FDG cerebral |
ELA: esclerosis lateral amiotrófica; ELP: esclerosis lateral primaria; PET/TC: tomografía por emisión de positrones/tomografía computarizada.
Mujer con antecedentes de tabaquismo, dislipemia y artritis reumatoide seropositiva sin tratamiento de fondo. Comenzó a los 52 años con un cuadro progresivo consistente en arrastre de miembro inferior derecho con tendencia a las caídas, torpeza en la mano derecha y dificultad para articular las palabras. No refería alteración sensitiva, esfinteriana ni quejas cognitivas, aunque sí cierta labilidad emocional. A la exploración física destacaba disartria leve e hipertonía espástica en los 4 miembros sin clara debilidad en el balance por grupos, amiotrofia ni fasciculaciones a ningún nivel. La marcha era lenta, espástica, de predominio derecho. Una resonancia magnética (RM) cerebral realizada en otro centro informó una sutil hiperintensidad subcortical en circunvoluciones prefrontales y la vía corticoespinal (hallazgo inespecífico que puede observarse en los pacientes con enfermedad de motoneurona). La RM cervical descartó una compresión en médula cervical. Un electromiograma (EMG) realizado un año después del inicio de los síntomas fue anodino. El amplio estudio analítico, incluyendo serologías habituales, HTLV-1 y anticuerpos antineuronales, no mostró hallazgos relevantes. Se concluyó que la paciente presentaba una tetraparesia espástica asimétrica (peor derecha) y progresiva con datos de afectación de primera motoneurona por lo que, en ausencia de alternativas diagnósticas plausibles, recibió el diagnóstico de enfermedad de motoneurona tipo ELP (a los 53 años) e inició tratamiento con riluzol.
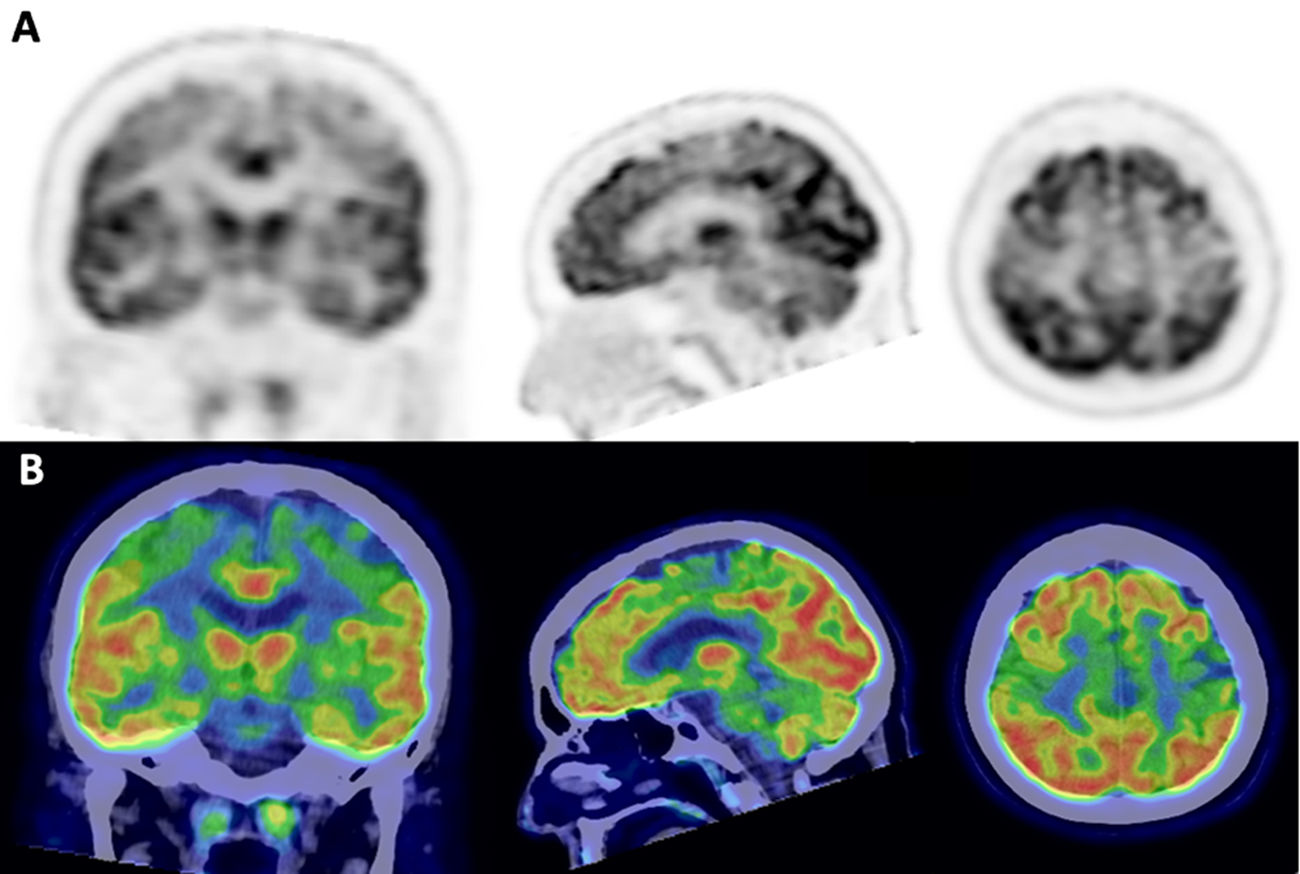
El curso clínico fue hacia el lento deterioro. A los 5 años del inicio (57 años) presentaba anartria, labilidad emocional, signos de liberación frontal, debilidad facial bilateral, atrofia lingual, tetraparesia 2/5 en la escala Medical Research Council (MRC) en general salvo proximal en miembros superiores 4-/5 y flexión cervical 4/5, con hiperreflexia e intensa espasticidad asociada. En este momento se realiza un PET/TC 18F-FDG cerebral que muestra un llamativo hipometabolismo en región prerrolándica bilateral (fig. 1), compatible en este contexto con un signo de la banda motora. La paciente siguió progresando, añadiéndose signos discretos de segunda motoneurona (amiotrofia en manos) y cambiándose el diagnóstico a ELA clínicamente definida. Finalmente falleció diez años desde el inicio de la enfermedad, con 62 años de edad.
Caso 2Varón con antecedentes de tabaquismo, consumo de alcohol moderado, hipertenso, cardiopatía isquémica revascularizada y bronquitis crónica. Comenzó a los 61 años con alteración sensitiva en ambas manos, siendo estudiado en otro centro mediante RM cervical que evidenció una mielopatía compresiva espondiloartrósica de la que fue intervenido 2 años después. Tras ello, la clínica sensitiva mejoró, pero mantuvo empeoramiento paulatino en forma de debilidad progresiva en las 4 extremidades, inestabilidad de la marcha y urgencia miccional. Se realizó una RM cerebral en la que se informaron lesiones de aspecto inflamatorio-desmielinizante que cumplían criterios de diseminación espacial para esclerosis múltiple, potenciales evocados visuales con afectación desmielinizante de ambos nervios ópticos de predominio izquierdo y una punción lumbar con bandas oligoclonales negativas. Con ello, se estableció el diagnóstico de esclerosis múltiple primaria progresiva (EMPP).
Fue remitido a nuestro centro a los 5 años desde el inicio de la enfermedad (con 66 años). Mantenía sensación de empeoramiento progresivo. A la exploración física no presenta déficit motor claro en el balance por grupos, no obstante, destacó una hiperreflexia generalizada con reflejo cutáneo plantar indiferente y espasticidad mayor en miembro superior derecho. La marcha era lenta con leve aumento de la base de sustentación. La sensibilidad era normal.
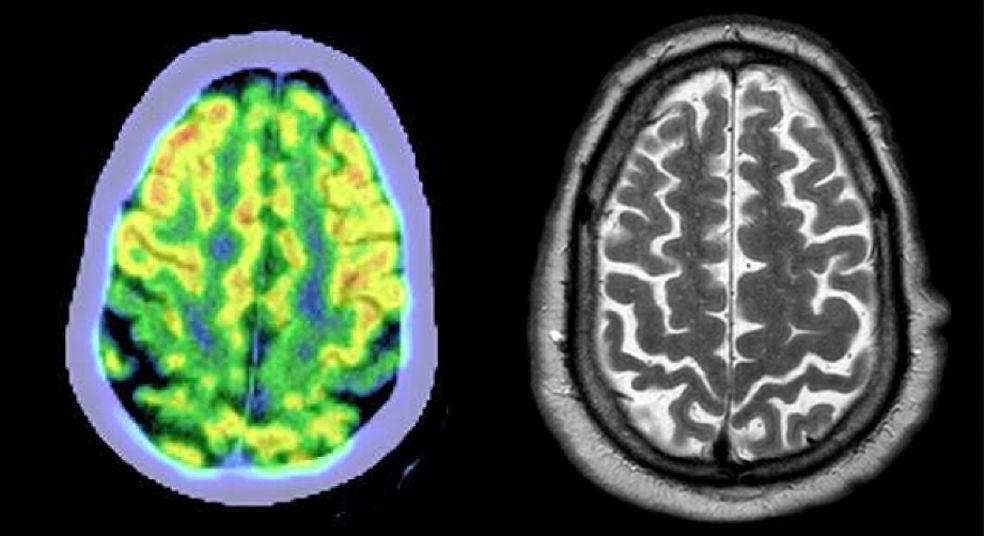
Se revisa el caso y no cumplía criterios de McDonald 2017 para el diagnóstico de EMPP, repitiéndose la RM cerebral en la que se observaron lesiones de sustancia blanca inespecíficas (una de mayor tamaño subcortical derecha que se informa como isquémica residual). Se completó estudio con determinaciones de B12, Borrelia, sífilis, HTLV-1 y autoinmunidad sin hallazgos de interés; un EMG que no evidenció signos de afectación de segunda motoneurona; y finalmente un PET/TC 18F-FDG cerebral en el que destacó un hipometabolismo perirrolándico bilateral (signo de la banda motora) (fig. 2). Ante estos hallazgos, con un cuadro clínico que parecía progresivo en los 2 años de seguimiento en nuestro centro (cuando el paciente contaba con 68 años), no justificable por la mielopatía cervical intervenida, y ante la ausencia de otras alternativas diagnósticas razonables, se estableció el diagnóstico provisional de ELP y se inició tratamiento con riluzol.
Caso 3Mujer alérgica a contrastes yodados, fumadora y sin otros antecedentes relevantes. Comenzó a los 61 años con un cuadro de debilidad sin alteración sensitiva en mano izquierda, de curso insidioso y lentamente progresivo. Se estudió inicialmente con un EMG que informó signos denervativos en miotomas C6-C7 del lado izquierdo, y una RM cervical que evidenció espondiloartrosis con cierta estenosis de canal cervical. Ante la ausencia de explicación alternativa al cuadro de debilidad, y al no poder excluir una mielorradiculopatía cervical espondiloartrósica en base a los hallazgos de la RM, se intervino mediante discectomía cervical C3-C4, C4-C5 y C5-C6. A pesar de ello, el cuadro siguió empeorando, añadiéndose debilidad en la pierna izquierda y disartria espástica. Se repitió un nuevo EMG que mostró signos de denervación cervical multimetamérica bilateral de predominio izquierdo. Se realizó un PET/TC 18F-FDG cerebral a los 4 años del inicio (65 años), que mostraba un signo de la banda motora perirrolándica derecha. A los 67 años la enfermedad había involucrado el hemicuerpo contralateral, con signos de primera motoneurona a la exploración física (incluyendo disartria espástica que claramente sobrepasaría cualquier lesión medular cervical), por lo que fue diagnosticada de ELP e inició tratamiento con riluzol.
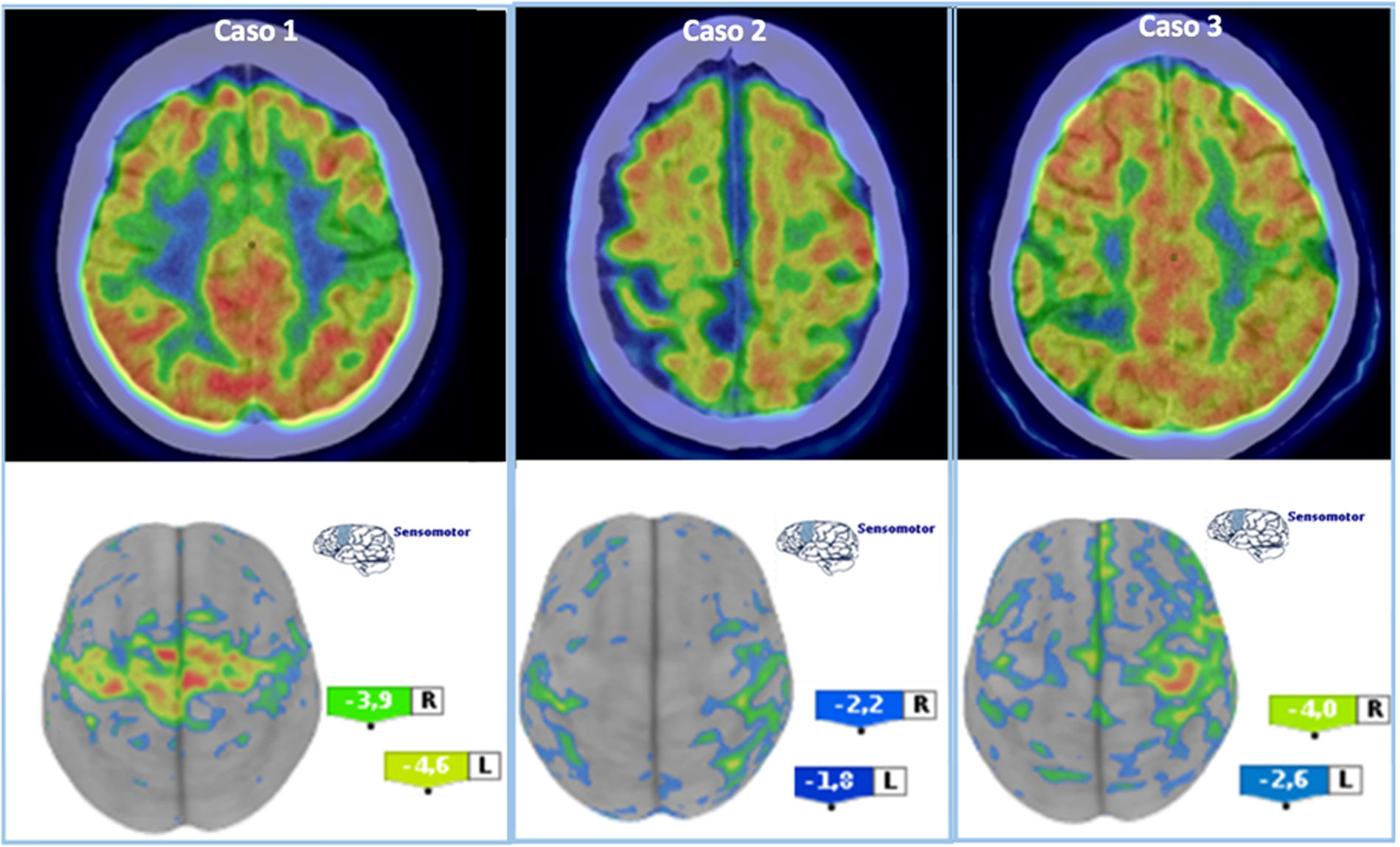
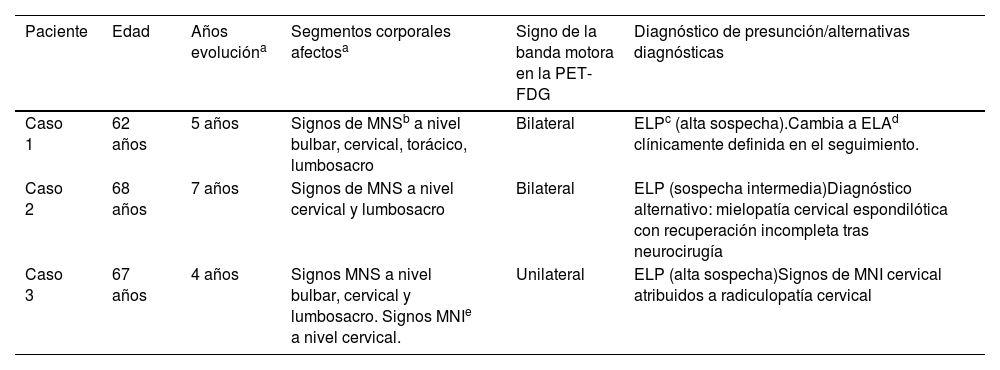
La tabla 2 resume las características principales de los 3 casos expuestos. En la figura 3 se recogen los estudios de PET/TC 18F-FDG cerebral de los 3 casos y su representación gráfica mediante software de análisis semicuantitativo.
Resumen de los casos expuestos
| Paciente | Edad | Años evolucióna | Segmentos corporales afectosa | Signo de la banda motora en la PET-FDG | Diagnóstico de presunción/alternativas diagnósticas |
|---|---|---|---|---|---|
| Caso 1 | 62 años | 5 años | Signos de MNSb a nivel bulbar, cervical, torácico, lumbosacro | Bilateral | ELPc (alta sospecha).Cambia a ELAd clínicamente definida en el seguimiento. |
| Caso 2 | 68 años | 7 años | Signos de MNS a nivel cervical y lumbosacro | Bilateral | ELP (sospecha intermedia)Diagnóstico alternativo: mielopatía cervical espondilótica con recuperación incompleta tras neurocirugía |
| Caso 3 | 67 años | 4 años | Signos MNS a nivel bulbar, cervical y lumbosacro. Signos MNIe a nivel cervical. | Unilateral | ELP (alta sospecha)Signos de MNI cervical atribuidos a radiculopatía cervical |
ELA: esclerosis lateral amiotrófica; ELP: esclerosis lateral primaria; MNI: motoneurona inferio; MNS: motoneurona superior.
Se muestran arriba los cortex axiales de fusión de los estudios PET/TC 18F-FDG en cada caso (fila superior). En la fila inferior se muestra el análisis semicuantitativo mediante software CortexID con reconstrucción tridimensional cerebral, con valores de z-score. El caso 1 es el más claro de los 3, con una afectación en rango muy patológico y bilateral. En el caso 2 la afectación es asimétrica, cuantitativamente menos llamativa pero patológica especialmente en el lado derecho (esta afectación más leve se corresponde con el paciente con menor grado de certidumbre en el diagnóstico). En el caso 3 la afectación es claramente asimétrica, peor derecha, concordante con la clínica del paciente (mayor afectación hemicorporal izquierda).
El diagnóstico de EMN sigue basado en los parámetros clínicos y electrofisiológicos sintetizados en los criterios de El Escorial revisados7 y adaptaciones como los de Awaji8 (tabla 3. En ellos, la utilidad del resto de pruebas complementarias queda relegada a la exclusión de causas alternativas.
Criterios de El Escorial con las recomendaciones de Awaji-Shimaa
| FundamentosEl diagnóstico de la ELA requiere (A) la presencia de:1. Evidencia de degeneración de motoneurona inferior (MNI) mediante examen clínico, electrofisiológico o neuropatológico; y2. Evidencia de degeneración de motoneurona superior (MNS) mediante examen clínico; y3. Diseminación progresiva de los síntomas y signos de una región a otras, determinado por la anamnesis, examen físico o estudios electrofisiológicos(B) En ausencia de:1. Evidencia electrofisiológica o patológica de otra enfermedad que pueda explicar los signos de degeneración de MNI y/o MNS; y2. Evidencia en neuroimagen de otra enfermedad que pueda causar los signos clínicos y electrofisiológicos observados |
| Categorías diagnósticasELA clínicamente definida: evidencia clínica o electrofisiológica de signos de MNI y MNS en la región bulbar y al menos 2 segmentos espinalesb o la presencia de signos de MNI y MNS en 3 segmentos espinalesELA clínicamente probable: evidencia clínica o electrofisiológica de signos de MNI y MNS en al menos 2 regiones con signos de MNS necesariamente rostrales a los de MNIELA clínicamente posible: evidencia clínica o electrofisiológica de signos de MNI y MNS en una única región; o signos de MNS en 2 regiones; o signos de MNI rostrales a los de MNS. Deben excluirse otras alternativas mediante estudios de neuroimagen y laboratorio. |
MNI: motoneurona inferio; MNS: motoneurona superior.
Mientras que se dispone de estudios neurofisiológicos para complementar la exploración física a la hora de detectar signos de segunda motoneurona, la afectación de la primera solo puede inferirse mediante la evaluación clínica, que a veces no es lo suficientemente sensible o específica (como en el caso 2 presentado, en la que los signos de primera motoneurona bien podrían ser achacados a la mielopatía intervenida o al diagnóstico erróneo de EMPP; la paciente del caso 3 fue asimismo intervenida de estenosis de canal cervical). Por ello, han surgido en los últimos años nuevas propuestas de criterios diagnósticos, como los de Gold Coast, que introducen entre los «criterios de apoyo» la evidencia extraída de la estimulación magnética transcraneal, resonancia magnética y los niveles de neurofilamentos como reflejo de disfunción de primera motoneurona9. No obstante, ninguno de ellos es per se específico de la enfermedad.
En la dirección de la búsqueda de un biomarcador fiable, la hiperintensidad en T2/FLAIR a nivel de la vía corticoespinal se ha propuesto como reflejo de degeneración de la primera motoneurona, aunque con baja sensibilidad y especificidad10,11. Cuando esta hiperintensidad se observa a nivel de la corteza prerrolándica, conforma el llamado signo de la banda motora, detectado con mayor sensibilidad en secuencias de susceptibilidad magnética (que reflejaría el acúmulo de hierro en siderófagos tras la degeneración y muerte neuronal). Cuando se usaron estas secuencias, pudieron detectarse hasta en un 78% de los pacientes con ELA en un estudio12, aunque su especificidad no fue establecida mediante estudios comparativos con controles sanos. En este otro13 se analizan de forma retrospectiva la RM cerebral con secuencias de susceptibilidad magnética de n=30 pacientes con ELA, n=5 con ELP y n=10 controles, evidenciando el signo de la banda motora en el 69,2, 80 y 0%, respectivamente, concluyendo con evidencia limitada que puede ser un marcador subrogado de afectación de primera motoneurona.
Cabe la pregunta de cómo se traduce el signo de la banda motora en estudios de neuroimagen funcional como el PET/TC 118F-FDG cerebral. En un estudio que incluye n=390 pacientes con diagnóstico de ELA, se encontró una correlación inversa del hipometabolismo en el giro frontal medial y en los giros pre y postcentral (que podemos asimilar como el signo de la banda motora) con el estadío de King (basado en la diseminación de los síntomas motores en 3 regiones corporales diferentes —bulbar, miembros superiores y miembros inferiores— y en la necesidad del uso de ventilación no invasiva y nutrición enteral)14. En este sentido, un estudio15 analiza patrones de PET/TC 18F-FDG cerebral en los pacientes con ELA (n=194 casos y n=40 controles), siendo el hipometabolismo en la corteza motora primaria un hallazgo frecuente (además de otras localizaciones del lóbulo frontal y occipital; e hipermetabolismo en a nivel mesencefálico, en el polo temporal e hipocampo). En su conjunto, el patrón de alteraciones del PET/TC 18F-FDG cerebral demostró una sensibilidad del 95% y una especificidad del 83% a la hora de separar a los pacientes de los controles. También es interesante otro estudio16, que incluye pacientes portadores presintomáticos de la mutación C9orf72 hasta 10 años antes del comienzo clínico, que muestra que la zona de mayor hipometabolismo es perirrolándica (asimilable al signo de la banda motora).
Si nos centramos en los pacientes con diagnóstico de ELP, las limitaciones mencionadas a la hora de obtener una certeza de disfunción de primera motoneurona se acrecientan, ya que por definición esta puede constituir los únicos signos y síntomas de la enfermedad, conformando en general un reto diagnóstico con un retraso habitual de varios años hasta llegar al mismo. Turner et al. proponen unos criterios de consenso17, en los que nuevamente se incluye la necesidad de descartar otros procesos mediante neuroimagen y estudios de laboratorio, reconociendo el signo de la banda en el PET/TC 18F-FDG cerebral como un marcador prometedor. En estos otros trabajos18,19, se describe este hipometabolismo en la corteza motora primaria en el PET/TC 18F-FDG cerebral en n=3 y n=1 paciente con ELP, respectivamente. Parece que el patrón de hipometabolismo en el PET/TC 18F-FDG cerebral en los pacientes con ELP y ELA no difiere significativamente20.
Como contrapartida, un estudio21 no mostró correlación entre la afectación motora y un patrón específico de alteración metabólica en el PET/TC 18F-FDG cerebral en n=131 pacientes con ELA, más allá de un hipometabolismo global del lóbulo frontal. En este otro22 que incluye pacientes con diagnóstico de ELA, «mimics», ELP y atrofia muscular progresiva, el PET/TC 18F-FDG cerebral no mostró diferencias específicas entre los pacientes con ELA/ELP y «mimics», requiriendo un PET/TC 18F-FDG espinal para diferenciarlas. Esta aparente contradicción en la literatura podría ser explicada por factores como: 1) la propia heterogeneidad de las enfermedades de la motoneurona; 2) diferencias en las técnicas, equipos y software de análisis; o 3) diferencias en las poblaciones de estudio y el momento de la evolución de la enfermedad cuando se realiza el PET/TC 18F-FDG. En todo caso y aunque hasta la fecha no existen estudios que hayan establecido la sensibilidad y especificidad del signo de la banda motora en el PET/TC 18F-FDG cerebral de manera aislada, parece razonable esperar una sensibilidad menor en casos donde la afectación de primera motoneurona no sea prominente —como ya plantean Claassen et al.18—, y en términos de especificidad sería razonable interpretar con cautela situaciones donde la afectación sea bilateral y leve.
ConclusionesEn conclusión, las EMN siguen teniendo un importante retraso diagnóstico debido a la ausencia de biomarcadores fiables hasta la fecha. Como se ha sugerido en este trabajo, unificando los hallazgos en neuroimagen estructural y funcional, el signo de la banda motora destaca como un biomarcador prometedor de degeneración de primera motoneurona, siendo necesarios más estudios acerca de sus parámetros de sensibilidad y especificidad antes de plantear su introducción dentro de futuros criterios diagnósticos de EMN.
AutoríaTodos los autores han contribuido de forma significativa en la realización de este trabajo, de acuerdo con las recomendaciones de la ICMJE.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimientos y financiaciónMariano Ruiz-Ortiz recibe financiación del Instituto de Salud Carlos III con cargo a los fondos europeos del Plan de Recuperación, Transformación y Resiliencia, con código de expendiente CM22/00183, en virtud de Resolución de la Dirección del Instituto de Salud Carlos III, O.A., M.P. de 14 de diciembre de 2022, por la que se conceden los Contratos Rio Hortega. Financiado por la Unión Europea-NextGenerationEU.
Julián Benito-León recibe financiación del National Institutes of Health, Bethesda, MD, USA (NINDS #R01 NS39422), la European Commission (proyecto ICT-2011-287739, NeuroTREMOR), el Ministerio de Economía y Competitividad (proyecto RTC-2015-3967-1, NetMD—platform for the tracking of movement disorder), el Instituto de Salud Carlos III (proyecto FIS PI12/01602 y proyecto FIS PI16/00451) y del Plan de Recuperación, Transformación y Resiliencia del Ministerio de Ciencia e Innovación (proyecto TED2021-130174B-C33, NETremor).