La hipercolesterolemia, en concreto el aumento en el conjunto de lipoproteínas que contienen apolipoproteínaB y, en especial el colesterol unido a lipoproteínas de baja densidad (cLDL), junto con el descenso de colesterol unido a lipoproteínas de alta densidad (cHDL), constituyen la base etiopatogénica de la enfermedad vascular aterosclerótica. Múltiples ensayos clínicos han demostrado que la reducción del cLDL mediante el tratamiento hipolipemiante se asocia con un descenso significativo en el riesgo de presentar complicaciones vasculares. De esta forma, el cLDL constituye el principal objetivo terapéutico en el paciente con dislipemia. Desafortunadamente, las cifras actuales de control de cLDL siguen siendo muy bajas, en parte debido a una insuficiente intensificación del tratamiento hipolipemiante, pero también a la necesidad de disponer de nuevas herramientas que nos permitan lograr dichos objetivos. En el presente documento se revisan las distintas opciones terapéuticas hipolipemiantes, incluyendo los últimos tratamientos disponibles, y se realiza una aproximación práctica para lograr los objetivos de control de cLDL en los pacientes con hipercolesterolemia, así como en distintos subgrupos de pacientes.
Hypercholesterolemia, specifically the increase in the set of lipoproteins containing apolipoproteinB and, in particular, low-density lipoprotein cholesterol (LDL-C), together with the decrease in high-density lipoprotein cholesterol (HDL-C) constitute the etiopathogenic basis of atherosclerotic vascular disease. Multiple clinical trials have shown that lowering LDL-C by lipid-lowering therapy is associated with a significant decrease in the risk of vascular complications. Thus, LDL-C is the main therapeutic target in patients with dyslipidemia. Unfortunately, current LDL-C control figures are still very low, partly due to insufficient intensification of lipid-lowering therapy, but also due to the need for new tools to achieve these goals. This paper reviews the different lipid-lowering treatment options, including the latest available therapies, and provides a practical approach to achieving LDL-C control goals in patients with hypercholesterolemia, as well as in different patient subgroups.
Las enfermedades cardiovasculares (CV) continúan siendo la primera causa de muerte en todo el mundo1. En España, en el año 2023, los tumores se situaron como primera causa de muerte en 2023, seguidos por las enfermedades del sistema circulatorio (26,6% y 26,5%, respectivamente). Y es que en comparación con el año 2022, mientras que las muertes por tumores aumentaron un 0,2%, las muertes asociadas a las enfermedades del sistema circulatorio descendieron un 5,3%, entre otros motivos, por un mejor control de los factores de riesgo CV2. En consecuencia, el mejor control de los factores de riesgo CV es fundamental para lograr este descenso de la mortalidad CV3.
En la base etiopatogénica de la enfermedad vascular aterosclerótica se encuentra la hipercolesterolemia, en concreto la elevación de lipoproteínas que contienen apolipoproteínaB, en especial el colesterol unido a lipoproteínas de baja densidad (cLDL) y el descenso de colesterol unido a lipoproteínas de alta densidad (cHDL)4. Múltiples ensayos clínicos han demostrado que la reducción del cLDL mediante el tratamiento hipolipemiante se asocia con un descenso significativo en el riesgo de presentar complicaciones CV. De esta forma, el cLDL constituye el principal objetivo terapéutico en el paciente con dislipemia. Ahora bien, el objetivo de cLDL se debe ajustar en función del riesgo vascular. En consecuencia, es imprescindible estratificar el riesgo CV de nuestros pacientes. En la tabla 1 se resume cómo estratificar el riesgo CV según las guías de la Sociedad Europea de Cardiología de 2019 y 2021 y el consenso sobre nuevas terapias hipolipemiantes de diferentes sociedades científicas de 20243,5,6. Hay que señalar que en la estratificación del riesgo CV se debe plantear que cada grupo es excluyente, y para facilitar la estratificación se deben ir excluyendo patologías (enfermedad CV, enfermedad renal, hipercolesterolemia familiar, diabetes). Una vez excluidas dichas causas, en los sujetos aparentemente sanos la estratificación de riesgo vascular se debe realizar en función de las tablas Systematic Coronary Risk Evaluation 2 (SCORE2) y Systematic Coronary Risk Evaluation 2 older persons (SCORE2-OP) (tabla 2). Asimismo, también es importante considerar los factores modificadores del riesgo CV, como la obesidad, el sedentarismo, los antecedentes familiares de enfermedad vascular, la raza, o los determinantes socioeconómicos, entre otros, para poder afinar más en la correcta estratificación de riesgo CV3,5,6.
Estratificación de riesgo vascular según las guías de la Sociedad Europea de Cardiología de 2019 y 2021 y el consenso sobre nuevas terapias hipolipemiantes de diferentes sociedades científicas
| Riesgo CV (objetivo cLDL) | ESC 2019 | ESC 2021 | SEC 2024 |
|---|---|---|---|
| Riesgo extremo(< 40 mg/dl) | ≥ 2 EVA | ≥ 2 EVA | • ≥ 2 EVA• EVA y ≥ 2 de los siguientes:∘ SCA en joven (varón/mujer <55/65 años)∘ Revascularización coronaria previa∘ DM∘ Enfermedad renal crónica moderada-grave (FG <44 o ACR 30-300)∘ Enfermedad polivascular.∘ Lp(a)> 50 mg/dl• Hipercolesterolemia familiar+EVA |
| Riesgo muy elevado(< 55 mg/dl y ≥ 50% reducción) | • Sin ninguna condición específica, SCORE ≥ 10%• EVA clínica o documentada por imagen de manera inequívoca• DM con daño en órganos diana (microalbuminuria, retinopatía o neuropatía.) o al menos 3 factores de riesgo mayores o DM1 de inicio precoz y larga duración (> 20 años)• Enfermedad renal:∘ FG <30• Hipercolesterolemia familiar con EVA u otro factor de riesgo mayor | • Sin ninguna condición específica:∘ SCORE2 (< 50 años): ≥ 7,5%∘ SCORE2 (50-69 años): ≥ 10%.∘ SCORE2-OP (≥ 70 años): ≥ 15%.• Pacientes con EVA (documentada por clínica o técnicas de imagen inequívocas)• DM tipo 1> 40 años y DM tipo 2:∘ DM con EVA o LOD grave: ▪ FG <45 ▪ FG 45-59 y ACR 30-300 ▪ Proteinuria (ACR> 300) ▪ Enfermedad microvascular ≥ 3 localizaciones (microalbuminuria, retinopatía, neuropatía).• Enfermedad renal:∘ FG <30∘ FG 30-44 y ACR> 30 | • Sin ninguna condición específica:∘ SCORE2 (< 50 años): ≥ 7,5%∘ SCORE2 (50-69 años): ≥ 10%∘ SCORE2-OP (≥ 70 años): ≥ 15%• Pacientes con EVA (sin criterios de riesgo extremo)• DM tipo 1> 40 años y DM tipo 2:∘ DM con EVA o LOD grave: ▪ FG <45 ▪ FG 45-59 y ACR 30-300 ▪ Proteinuria (ACR> 300) ▪ Enfermedad microvascular ≥ 3 localizaciones (microalbuminuria, retinopatía, neuropatía)• Enfermedad renal:∘ FG <30∘ FG 30-44 y ACR> 30• Hipercolesterolemia familiar +3 factores asociados (tabaco, DM, HTA, obesidad, Lp(a)> 50 mg/dl, > 45 años o menopausia)• Estudios de imagen arteriosclerótica subclínica:∘ Calcio-Score ≥ 300 UA∘ Estenosis vascular> 50%∘ 3-4 placas o enfermedad en diversos territorios |
| Riesgo elevado(< 70 mg/dl y ≥ 50% reducción) | • Sin ninguna condición específica, SCORE ≥ 5-10%• DM sin daño en órganos diana, DM de duración ≥ 10 años u otro factor de riesgo adicional• Enfermedad renal:∘ FG 30-59• Hipercolesterolemia familiar sin otros factores de riesgo mayores• Factores de riesgo aislados muy elevados, sobre todo colesterol > 310 mg/dl, cLDL > 190 mg/dl o presión arterial ≥ 180/110mmHg | • Sin ninguna condición específica:∘ SCORE2 (< 50 años): 2,5-7,5%∘ SCORE2 (50-69 años): 5-10%∘ SCORE2-OP (≥ 70 años): 7,5-15%• DM (tipo 1 > 40 años y DM tipo 2) sin EVA o LOD grave, que no cumplen los criterios de riesgo moderado• Enfermedad renal:∘ FG 30-44 y ACR <30∘ FG 45-59 y ACR 30-300∘ FG ≥ 60 y ACR > 300• Hipercolesterolemia familiar | • Sin ninguna condición específica:∘ SCORE2 (< 50 años): 2,5-7,5%∘ SCORE2 (50-69 años): 5-10%∘ SCORE2-OP (≥ 70 años): 7,5-15%• EVA, si expectativa de vida limitada, paciente muy frágil o muy anciano• DM (tipo 1 > 40 años y DM tipo 2) sin EVA o LOD grave, que no cumplen los criterios de riesgo moderado• Enfermedad renal:∘ FG 30-44 y ACR <30∘ FG 45-59 y ACR 30-300∘ FG ≥ 60 y ACR > 300• Hipercolesterolemia familiar• Estudios de imagen arteriosclerótica subclínica:∘ Calcio-Score 100-300 UA∘ Estenosis vascular <50%∘ 3-4 placas o enfermedad en diversos territorios• Lp(a) >180 mg/dl |
| Riesgo moderado(< 100 mg/dl) | • Sin ninguna condición específica, SCORE ≥1-5%• DM tipo 1 <35 años o tipo 2 <50 años, con duración DM <10 años, sin otros factores de riesgo | • Sin ninguna condición específica:∘ SCORE2 (< 50 años): <2,5%∘ SCORE2 (50-69 años): <5%∘ SCORE2-OP (≥ 70 años): <7,5%• DM (tipo 1> 40 años y DM tipo 2 <10 años), bien controlada, sin LOD ni factores riesgo de EVA: moderado | • Sin ninguna condición específica:∘ SCORE2 (< 50 años): <2,5%∘ SCORE2 (50-69 años): <5%∘ SCORE2-OP (≥ 70 años): <7,5%• DM (tipo 1> 40 años y DM tipo 2 <10 años), bien controlada, sin LOD ni factores riesgo de EVA• Lp(a)> 90 mg/dl |
| Riesgo bajo(< 116 mg/dl) | • Sin ninguna condición específica, SCORE <1% | • Sin ninguna condición específica:∘ SCORE2 (< 50 años): <2,5%∘ SCORE2 (50-69 años): <5%∘ SCORE2-OP (≥ 70 años): <7,5% |
ACR: cociente albúmina/creatinina (mg/g); DM: diabetes mellitus; ESC: European Society of Cardiology; EVA: enfermedad vascular aterosclerótica; FG: filtrado glomerular (ml/min/1,73m2); HTA: hipertensión arterial; Lp(a): lipoproteína(a); LOD: lesión órgano diana; SCA: síndrome coronario agudo; SCORE: Systematic Coronary Risk Evaluation; SCORE2: Systematic Coronary Risk Evaluation 2; SEC: Sociedad Española de Cardiología; UA: unidades Agatston.
Tabla realizada con datos de las referencias 3, 5, 6.
Aspectos principales de las escalas de riesgo de estratificación de riesgo cardiovascular SCORE2/SCORE2-OP
| SCORE2/SCORE2-OP | |
|---|---|
| Qué mide | Riesgo a 10 años de eventos cardiovasculares mortales y no mortales |
| Variables analizadas | Edad, sexo, fumador, presión arterial sistólica, colesterol no-HDL |
| Rango edad | SCORE2: 40-69 añosSCORE2-OP: ≥ 70 años |
| Riesgo cardiovascular muy elevado | SCORE2: <50 años: ≥ 7,5%; 50-69 años: ≥ 10%SCORE2-OP (≥ 70 años): ≥ 15% |
| Riesgo cardiovascular elevado | SCORE2: <50 años: 2,5 a <7,5%; 50-69 años: 5 a <10%SCORE2-OP (≥ 70 años): 7,5 a <15% |
| Riesgo cardiovascular moderado | SCORE2: <50 años: <2,5%; 50-69 años: <5% |
| Riesgo cardiovascular bajo | SCORE2-OP (≥ 70 años): <7,5% |
SCORE2: Systematic Coronary Risk Evaluation 2.
Tabla realizada con datos de las referencias 3, 5, 6.
Aunque en la actualidad el cLDL constituye la principal diana terapéutica en el paciente con dislipemia, existen determinados pacientes en los que habría que considerar otros parámetros lipídicos. Así, en personas con triglicéridos elevados, diabetes, obesidad o cLDL muy bajo, sería preferible la determinación del colesterol no-HDL, para el cribado, diagnóstico y tratamiento, así como la determinación del riesgo CV residual. Además, se recomienda el colesterol no-HDL para la estratificación de riesgo CV según SCORE2/SCORE2-OP. En cuanto a los objetivos de colesterol no-HDL, serían <85mg/dl y <100mg/dl, para los pacientes con un riesgo CV muy elevado y elevado, respectivamente. Asimismo, la apolipoproteínaB (ApoB) tendría utilidad para la evaluación de riesgo vascular, tipificación de dislipidemias y caracterización del tamaño de partículas3,6. La lipoproteína (a) (Lp(a)), sobre todo en sus niveles más elevados, tiene relación directa con el riesgo de desarrollar complicaciones CV. A diferencia de otros parámetros lipídicos, está determinada genéticamente en más de un 80%, por lo que suele ser bastante estable a lo largo de la vida y es poco sensible a los cambios en los estilos de vida. En consecuencia, se recomienda la determinación de Lp(a) una vez en la vida coincidiendo con la primera determinación del perfil lipídico, así como en aquellos pacientes que estén recibiendo tratamientos hipolipemiantes que modifiquen sus niveles, como los inhibidores de la proproteína convertasa subtilisina/kexina tipo9 (PCSK9) o inclisirán7.
En la población general se debe considerar el cribado de los factores de riesgo, incluido el perfil lipídico completo, de los varones mayores de 40años y las mujeres mayores de 50años o posmenopáusicas. Se debería repetir al menos cada 5años, o antes si el paciente se encuentra cerca de los umbrales a partir de los cuales está indicado iniciar tratamiento. En caso de que el paciente tenga algún otro factor de riesgo CV, se debería realizar una analítica completa incluyendo el perfil lipídico, independientemente de la edad, para realizar una estratificación de riesgo vascular adecuada, que ayude a determinar el tipo de tratamiento en base a los objetivos terapéuticos3,5,6,8. De acuerdo con el documento de consenso para la determinación e informe del perfil lipídico en laboratorios clínicos españoles, se recomienda realizar dos determinaciones separadas 1-2semanas antes de iniciar el tratamiento hipolipemiante, excepto en los pacientes con un riesgo CV muy elevado o tras un evento CV, en los que está indicado iniciar tratamiento farmacológico de alta potencia (con capacidad para descender el nivel de LDL al menos un 50%)8.
Después de iniciar el tratamiento hipolipemiante, se debería repetir el perfil lipídico a las 4-6semanas tras un evento vascular aterosclerótico agudo y a las 4-12semanas en el resto. Una vez alcanzados los objetivos lipídicos, la analítica se debería repetir a los seis meses en un primer momento, para confirmar el cumplimiento de los objetivos terapéuticos, para posteriormente realizar controles anuales siempre que se mantenga la adherencia terapéutica6,8. El panel lipídico básico debería incluir colesterol total, cHDL, cLDL, colesterol no-HDL y triglicéridos, así como la Lp(a) una vez en la vida. Además, también resultan de interés la determinación de las concentraciones de lipoproteínas «aterogénicas», como la ApoB, y algunos índices aterogénicos, como triglicéridos/cHDL o cLDL/ApoB, que nos pueden ayudar a reclasificar el riesgo cardiovascular de los pacientes, al alza, y plantearnos objetivos terapéuticos más estrictos5,8. Por último, el cribado y la detección de la hipercolesterolemia familiar son objetivos a tener en cuenta en atención primaria. Para ello, lo más coste-efectivo consiste en el cribado en cascada familiar de los casos índices. Además de ello, se debe realizar una búsqueda oportunista de la hipercolesterolemia familiar en todo paciente con colesterol total >300mg/dl o enfermedad CV prematura o xantomas tendinosos en el paciente o en un familiar de primer grado9.
Tratamientos hipolipemiantesLa adquisición de hábitos de vida cardiosaludables es fundamental en los sujetos con dislipemia3,5,6. En todo paciente con dislipemia se debería recomendar una dieta saludable, basada en un estilo mediterráneo, así como la práctica de ejercicio físico de manera regular10–14. El estudio PREDIMED demostró que en pacientes con un elevado riesgo CV, pero sin enfermedad CV, en comparación con la dieta control (consejos sobre dieta baja en grasas), el seguimiento de la dieta mediterránea suplementada con aceite de oliva o nueces se asoció con una reducción significativa del 31% y del 28%, respectivamente, en el riesgo de eventos CV mayores (muerte CV, infarto de miocardio no mortal o ictus no mortal) tras una mediana de seguimiento de 4,8años10.
En base a este patrón dietético, las recomendaciones generales sobre la dieta incluyen3:
- •
Pérdida de peso para personas con sobrepeso u obesidad.
- •
Dieta sana, en nuestro medio, preferiblemente la dieta mediterránea.
- •
Dieta basada en productos vegetales (frente a productos animales).
- •
Los ácidos grasos saturados deben representar <10% de la ingesta calórica total, siendo sustituidos por ácidos grasos monoinsaturados y ácidos grasos poliinsaturados. Disminuir al máximo los ácidos grasos insaturados trans.
- •
Consumo total de sal <5g/día.
- •
30-45g de fibra diarios.
- •
≥200g de fruta al día y ≥200g de verduras al día.
- •
Reducir el consumo de carne roja a 350-500g a la semana, y consumir pescado 1-2 veces por semana.
- •
Limitar el consumo de alcohol y evitar bebidas azucaradas.
Con respecto al ejercicio físico, son numerosos los estudios que han demostrado los efectos beneficiosos de la práctica del ejercicio físico sobre los parámetros lipídicos11. Así, el entrenamiento físico disminuye significativamente la concentración de triglicéridos en sangre y aumenta los niveles de colesterol unido a lipoproteínas de alta densidad (cHDL), así como el tamaño de las partículas de cLDL, lo que lo hace especialmente beneficioso en el caso de pacientes con dislipemia aterogénica12. Las recomendaciones generales sobre la actividad física incluyen:3
- •
Realizar al menos 150-300minutos a la semana de actividad física de intensidad moderada o 75-150minutos a la semana de actividad física aeróbica vigorosa o una combinación equivalente, adaptada a la edad y condición física del sujeto. Si esto no es posible, tratar de mantenerse tan activo como sea posible, según el estado de salud y la capacidad física de cada paciente.
- •
Reducir el tiempo de sedentarismo a lo largo del día.
- •
Combinar la actividad física aeróbica con ejercicios de fuerza, al menos 2 días a la semana.
El tratamiento farmacológico hipolipemiante es necesario en muchos pacientes con dislipemia para lograr los objetivos de control de cLDL. La intensidad del tratamiento hipolipemiante (solo o en combinación) se debe ajustar en función de la reducción de cLDL que sea necesaria para lograr los objetivos de cLDL. En este sentido, podríamos hablar de terapia hipolipemiante de alta intensidad la que es capaz de lograr reducciones >50% de cLDL, y de muy alta intensidad para reducciones >70% de cLDL. Así, se recomienda el tratamiento farmacológico hipolipemiante, además de los cambios en el estilo de vida5,13:
- •
Pacientes con riesgo CV bajo-moderado:
- ∘
cLDL 116-190mg/dl: considerar alimentos funcionales o tratamiento farmacológico.
- ∘
cLDL >190mg/dl: iniciar tratamiento farmacológico hipolipemiante de alta intensidad.
- ∘
- •
Pacientes con riesgo CV alto:
- ∘
cLDL 70-115mg/dl: iniciar tratamiento farmacológico si no se logran los objetivos.
- ∘
cLDL ≥116mg/dl: iniciar tratamiento farmacológico hipolipemiante de alta intensidad.
- ∘
- •
Pacientes con riesgo CV muy alto:
- ∘
cLDL 55-70mg/dl: iniciar tratamiento farmacológico hipolipemiante.
- ∘
cLDL ≥70mg/dl: iniciar tratamiento farmacológico hipolipemiante de alta/muy alta intensidad
- ∘
- •
Pacientes con riesgo CV extremo:
- ∘
cLDL 40-55mg/dl: iniciar tratamiento farmacológico hipolipemiante.
- ∘
cLDL ≥55mg/dl: Iniciar tratamiento farmacológico hipolipemiante de alta/muy alta intensidad.
- ∘
En la actualidad disponemos de numerosos tratamientos hipolipemiantes con diferentes mecanismos de acción, que han demostrado, solos o en combinación, reducir el cLDL de manera eficaz y segura, y que van a permitir alcanzar los objetivos de control en los pacientes con dislipemia5. No obstante, es importante destacar que el beneficio de la reducción de las complicaciones CV asociadas al descenso de cLDL depende, no tanto del mecanismo de acción específico del fármaco hipolipemiante per se, como de la intensidad con la que reduce el cLDL15. Así, se estima que por cada reducción de 1mmol/l (38,7mg/dl) del cLDL, descienden los eventos vasculares mayores en un 23% para las estatinas y un 25% para las no estatinas (p<0,001 en ambos casos respecto al placebo; P interacción=0,72)15. Por otra parte, no se ha observado un umbral por debajo del cual sea perjudicial reducir el cLDL, esto es, no se ha demostrado una curva en J y, en consecuencia, disminuir las cifras de cLDL no solo es seguro, sino que muestra beneficios clínicos16,17.
Los alimentos funcionales, además de su valor nutricional, proporcionan beneficios mensurables adicionales, entre los que se incluye la reducción en las cifras de colesterol, tras la adición, modificación y/o retirada de un componente. Ejemplos de alimentos funcionales son los productos lácteos y margarinas fortificadas con fitoesteroles o estanoles18,19. En cambio, los nutracéuticos son derivados de alimentos y/o productos naturales, con efecto biológico, y que se presentan en forma de cápsulas, comprimidos, tabletas u otras preparaciones galénicas18,20. El consumo de ambos ha aumentado de manera marcada en los últimos años. Dentro de los nutracéuticos existen distintos tipos, con mecanismos diferentes de acción. Existen distintas presentaciones, aislados o en combinación. No todos los nutracéuticos tienen las mismas evidencias científicas ni han demostrado el mismo beneficio a la hora de reducir el cLDL. Por ejemplo, la combinación de levadura roja de arroz, berberina y policosanoles ha mostrado reducciones significativas de cLDL en torno al 15-30%, lo que equivaldría en términos de equipotencia a una estatina de baja intensidad21. Estarían indicados en pacientes con un riesgo CV bajo/moderado, que no pueden o no quieren tomar estatinas u otros tratamientos hipolipemiantes, y no logran los objetivos de control de cLDL a pesar de los cambios en el estilo de vida. Se pueden tomar de manera aislada o asociados a otros tratamientos hipolipemiantes20.
Sin duda, las estatinas constituyen el tratamiento hipolipemiante de base para reducir el cLDL en el paciente con hipercolesterolemia, tanto en pacientes sin un evento vascular previo, como en aquellos que ya lo han presentado. Además, ese beneficio ocurre en todo el espectro de edad, incluyendo los pacientes más ancianos. De hecho, en los pacientes más ancianos, si bien en términos relativos el beneficio CV es similar al de los más jóvenes, en términos absolutos el beneficio es todavía mayor, ya que tienen un mayor riesgo absoluto de presentar complicaciones vasculares22–24.
Los beneficios de la combinación de una estatina más ezetimiba en comparación con estatinas en monoterapia en pacientes que habían tenido un síndrome coronario agudo fue demostrado en el estudio IMPROVE-IT, con una reducción significativa del cLDL del 60-65% con respecto a los valores basales y de los eventos CV del 6% en comparación con las estatinas en monoterapia25. En cuanto a los inhibidores PCSK9, de media producen descensos del cLDL en torno al 60-75%, pero también de otros parámetros lipídicos relevantes como la ApoB (59%), la Lp(a) (36%) o el colesterol no-HDL (65%)26. El estudio FOURIER con evolocumab en pacientes con enfermedad vascular aterosclerótica y el ODYSSEY OUTCOMES con alirocumab en sujetos con un síndrome coronario agudo mostraron, en comparación con el grupo control, una reducción significativa del 15% en el riesgo de eventos vasculares mayores27,28.
Recientemente se ha incorporado al arsenal terapéutico el ácido bempedoico y el inclisirán. El ácido bempedoico disminuye la síntesis del colesterol intracelular a través de la inhibición de la enzima adenosina trifosfato-citrato liasa. Al ser un profármaco que necesita activarse en el hígado, pero no en el músculo esquelético, presenta un menor riesgo de efectos adversos a este nivel. De media, el ácido bempedoico produce una reducción del cLDL en torno al 17-29% de media, en función de si se combina con estatinas y la potencia de estas. Cuando se combina el ácido bempedoico con la ezetimiba, la reducción del cLDL se sitúa en torno al 38%29,30. El ensayo clínico CLEAR Outcomes demostró en 13.970 pacientes con un elevado o muy elevado riesgo CV y niveles elevados de cLDL tratados con estatinas a baja dosis, sin estatinas y/o con ezetimiba, que en comparación con el grupo control, el tratamiento con ácido bempedoico 180mg/día se asociaba con una reducción significativa del 13% en la variable primaria del estudio (MACE-4: muerte CV, infarto de miocardio no mortal, ictus no mortal o revascularización coronaria) y del 15% en el MACE-3 (muerte CV, infarto de miocardio no mortal o ictus no mortal). En ambos grupos aproximadamente el 22-23% tomaban estatinas y el 11,5%, ezetimiba. El beneficio del ácido bempedoico en la reducción de eventos CV fue independiente del empleo concomitante de estos tratamientos31.
Inclisirán es un ARN de interferencia pequeño que interfiere con el ARN que codifica PCSK9, produciendo de esta forma el silenciamiento selectivo de la expresión génica de la PCSK9 en los hepatocitos, disminuyendo así la concentración de PCSK9 y secundariamente incrementando el reciclado y la expresión del receptor del cLDL en la superficie celular de los hepatocitos, lo que incrementa la recaptación de cLDL, y disminuye la concentración de cLDL. Este mecanismo de acción permite su administración subcutánea bianual (excepto la segunda dosis, que se pauta a los 3 meses), a diferencia de los inhibidores PCSK9, que se administran cada 2 o 4 semanas32. Su administración se asocia con reducciones del cLDL de alrededor del 50%, además de producir descensos significativos de otros parámetros lipídicos relevantes, como la ApoB (39%), la Lp(a) (19%) o el colesterol no-HDL (43%)33. Actualmente están en marcha los ensayos clínicos en fase3 sobre el impacto del tratamiento con inclisirán sobre los eventos CV. Sin embargo, análisis secundarios de estudios ya publicados sugieren un beneficio en este sentido, en línea con su capacidad para reducir el cLDL34.
En el presente documento nos hemos enfocado en el tratamiento para reducir el cLDL, que es donde hay una mayor evidencia del beneficio del tratamiento hipolipemiante. Si bien la elevación de triglicéridos se asocia con un mayor riesgo de presentar eventos CV, es en el estudio REDUCE-IT, en el que un fármaco con capacidad para disminuir los niveles de triglicéridos, además de tener propiedades antiinflamatorias y antiagregantes, demuestra una reducción de eventos CV, si bien este efecto beneficioso va más allá de la capacidad de icosapento de etilo para reducir los niveles de triglicéridos. Y es que el icosapento de etilo, un éster etílico del ácido eicosapentaenoico altamente purificado, mostró en el estudio REDUCE-IT que la administración de 2 cápsulas cada 12horas en pacientes con enfermedad vascular aterosclerótica o diabetes con otros factores de riesgo en tratamiento con estatinas, y niveles de cLDL 40-100mg/dl y triglicéridos entre 150-499mg/dl, se asociaba con una reducción significativa del 25% en el riesgo de la variable primaria, compuesta por muerte CV, infarto de miocardio no mortal, ictus no mortal, revascularización coronaria o angina inestable, pero con un leve aumento en la incidencia de fibrilación auricular y hemorragias no mortales35. Dado que no tiene un efecto significativo sobre las cifras de cLDL, el beneficio de este fármaco, que no es extensible a otros preparados de omega-3, de composición diferente, se ha relacionado con su capacidad para reducir los niveles de triglicéridos, además de tener efectos antiinflamatorios y antiagregantes, de mejorar la función endotelial y de estabilizar la capa fibrosa de la placa aterosclerótica36.
Aproximación práctica desde atención primaria para lograr el control del cLDL en los pacientes con dislipemiaEstudios recientes muestran que en la actualidad el control de cLDL es francamente mejorable en España. Así, en el observatorio de la dislipemia, en el que se incluyeron un total de 4.010 pacientes, de los que el 61% tenían un riesgo CV muy elevado, el adecuado control de cLDL se alcanzó en el 31% de los pacientes (los médicos consideraban que el 62% de estos pacientes habían logrado las metas de control). En cuanto al tratamiento hipolipemiante, un tercio tomaba estatinas de alta intensidad, el 32% estatinas/ezetimiba, y el 4% inhibidores PCSK9. Solo en un tercio de los pacientes con mal control de cLDL se realizó algún cambio en el tratamiento hipolipemiante37. En el estudio IBERICAN, en 3.000 pacientes atendidos en atención primaria el grado de control de cLDL fue del 25,8%, mientras que el estudio TERESA AP mostró que los médicos de atención primaria consideraban que los pacientes tenían unas cifras más elevadas de control de cLDL38,39. En otro trabajo realizado en pacientes que habían un tenido un síndrome coronario agudo se objetivó que con la aplicación del consenso de la Sociedad Española de Cardiología, que recomendaba pasar del tratamiento hipolipemiante escalonado a pautar el tratamiento individualizado en función del cLDL basal del paciente para lograr el control adecuado (<55mg/dl), este pasó del 33,5% al 45,6%, lo que se debió principalmente a un mayor uso del tratamiento combinado de estatinas con ezetimiba40. En Europa, tanto el estudio SANTORINI como el DA VINCI han mostrado cifras incluso más bajas de control, tanto en prevención primaria como en secundaria, en parte debido a un bajo uso del tratamiento hipolipemiante disponible en ese momento (estatinas, ezetimiba e inhibidores PCSK9), pero también a la necesidad de disponer de nuevos tratamientos hipolipemiantes41,42. En resumen, todos estos estudios muestran que el control actual de cLDL es francamente mejorable, y esto se debe a tres motivos fundamentales: una falsa percepción del control adecuado de los pacientes, un empleo insuficiente de la terapia hipolipemiante, y la necesidad de disponer de nuevas herramientas terapéuticas37,42.
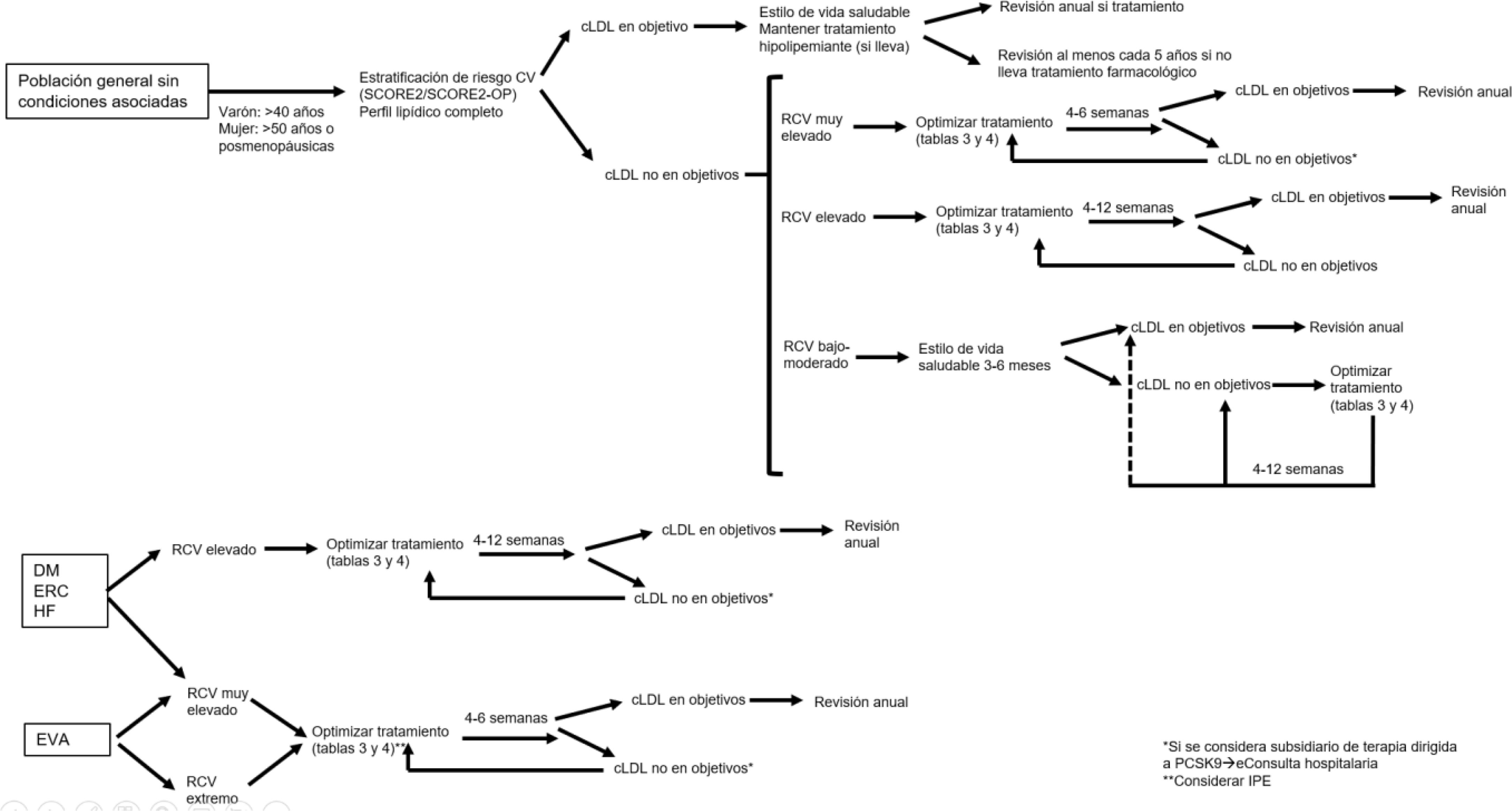
En los últimos años se ha producido una evolución en el enfoque a la hora de actuar sobre el paciente con dislipemia. Así, si en las guías de práctica clínica de la Sociedad Europea de Cardiología de 2019 se recomendaba seguir un tratamiento escalonado (comenzar con estatinas, si no se controla añadir ezetimiba y finalmente inhibidores PCSK9)6, en la actualidad se ha pasado al concepto fire to target, esto es, teniendo en cuenta la capacidad que tienen los tratamientos hipolipemiantes (solos o en combinación) para reducir el cLDL (tabla 3), emplear aquellos tratamientos que sean capaces de lograr los objetivos de control cLDL en función del riesgo CV y del cLDL del que parta el paciente (tabla 4) y, en caso de que no sea suficiente, optimizar el tratamiento en la siguiente revisión (fig. 1)5,13,30,43–46. Esta aproximación es fundamental para disminuir la inercia clínica, esto es, la no optimización del tratamiento hipolipemiante, a pesar de que el paciente no logra los objetivos de control5,13,40. En este contexto, el enclave óptimo para el control de los diferentes factores de riesgo CV, y en particular la hipercolesterolemia, es la atención primaria.
Tratamientos hipolipemiantes y capacidad estimada para reducir el colesterol LDL
| Reducción cLDL | Alternativas terapéuticas | |
|---|---|---|
| Monoterapia | Terapia combinada | |
| 20-25% | • Nutracéuticos con evidencia científica (preferible combinación)• Estatinas de baja intensidada• Ezetimiba• Ácido bempedoico | |
| 25-40% | • Estatinas moderada intensidad | • Estatinas baja intensidad +ezetimiba• Estatinas baja intensidad +ácido bempedoico |
| 40-50% | • Estatinas moderada intensidadb +ezetimiba• Estatinas moderada intensidad +ácido bempedoico• Ezetimiba +ácido bempedoico | |
| 50% | • Estatinas de alta intensidad• Inclisirán | |
| 60% | • Estatinas de alta intensidadc +ácido bempedoico | |
| 60-65% | • Inhibidores PCSK9 | • Estatinas de alta intensidad +ezetimiba |
| 70% | • Estatinas de alta intensidad +ezetimiba +ácido bempedoico | |
| 75% | • Estatinas de alta intensidad +inclisirán | |
| 80-85% | • Estatinas de alta intensidad +inhibidores PCSK9 | |
| > 85% | • Estatinas de alta intensidad +ezetimiba +inhibidores PCSK9• Estatinas de alta intensidad +ezetimiba +ácido bempedoico +inclisirán | |
Estatinas de baja intensidad: simvastatina 10mg; pravastatina 10-30mg; lovastatina 20mg, fluvastatina 20-40mg; pitavastatina 1mg.
Reducción inicial de colesterol LDL necesaria para lograr los objetivos de control en los pacientes en función del riesgo vascular y el colesterol basal de los pacientes
| Reducción inicial estimada cLDL | Riesgo CV: cLDL basal |
|---|---|
| Reforzar estilo de vida saludable | Bajo: <116 mg/dlModerado: <100 mg/dl |
| 20-25%a | Bajo: 116-140 mg/dlModerado: 100-130 mg/dl |
| 25-40%a | Bajo: > 140 mg/dlModerado: 130-160 mg/dl |
| 40-50%a | Moderado: > 160 mg/dl |
| 50% | Alto: > 70 a <100 mg/dlMuy alto: > 55 a <100 mg/dlExtremo: > 40 a <80 mg/dl |
| 65% | Alto: ≥ 100-170 mg/dlMuy alto: ≥ 100-155 mg/dlExtremo: ≥ 80-120 mg/dl |
| 75% | Alto: 170-200 mg/dlMuy alto: 155-190 mg/dlExtremo: 120-170 mg/dl |
| ≥ 80% | Alto: > 200 mg/dlMuy alto: > 190 mg/dlExtremo: > 170 mg/dl |
Algoritmo de manejo de la hipercolesterolemia en atención primaria.
cLDL: colesterol LDL; CV: cardiovascular; DM: diabetes mellitus; ERC: enfermedad renal crónica; EVA: enfermedad vascular aterosclerótica; HF: hipercolesterolemia familiar; IPE: icosapento de etilo; SCORE2: Systematic Coronary Risk Evaluation 2.
Figura realizada en base a referencias 5, 13, 30, 43-46.
En nuestro medio, es importante considerar las condiciones de reembolso dentro del Sistema Nacional de Salud, en particular con el ácido bempedoico47 y las terapias dirigidas a inclisirán o PCSK948–50. El ácido bempedoico se encuentra financiado en caso de pacientes en prevención secundaria o hipercolesterolemia familiar heterocigota, cuando el paciente no logre los objetivos de control a pesar del tratamiento con estatinas y ezetimiba o ezetimiba en intolerantes a estatinas. Se puede prescribir directamente desde atención primaria. En cuanto a la terapia dirigida a PCSK9 (alirocumab, evolocumab, inclisirán), los anticuerpos antiPCSK9 (alirocumab y evolocumab) se encuentran financiados en el caso de pacientes con enfermedad vascular aterosclerótica (alirocumab y evolocumab) y/o hipercolesterolemia familiar heterocigota (alirocumab y evolocumab) y/o hipercolesterolemia familiar homocigota (evolocumab) con cLDL>100mg/dl, con la dosis máxima tolerada de estatinas o contraindicación/intolerancia a estatinas. Asimismo, inclisirán es una opción de tratamiento en pacientes con enfermedad vascular aterosclerótica establecida y/o hipercolesterolemia familiar heterocigótica cuando no se consigue alcanzar los objetivos terapéuticos de cLDL a pesar del tratamiento intensivo con estatinas con o sin ezetimiba, o con ezetimiba en caso de intolerancia o contraindicación a estatinas. Sin embargo, hay que tener en cuenta que no se dispone de datos de morbimortalidad CV con inclisirán, a diferencia de lo que ocurre con alirocumab y evolocumab. Es importante destacar que la terapia dirigida a PCSK9 se considera medicación de uso hospitalario, y que por lo tanto no se puede prescribir directamente desde atención primaria, sino que se tiene que prescribir desde el hospital (cardiología, medicina interna, geriatría y endocrinología principalmente). Por ello, en cuanto se identifique a un paciente que pudiese ser subsidiario de estos tratamientos, habría que realizar interconsulta (eConsulta, derivación), según los casos.
Manejo de la dislipemia en situaciones específicasEnfermedad vascular ateroscleróticaLa enfermedad vascular aterosclerótica incluye a los pacientes con cardiopatía isquémica (síndrome coronario agudo, cardiopatía isquémica crónica, revascularización coronaria percutánea o quirúrgica), enfermedad cerebrovascular aterosclerótica (ictus, ataque isquémico transitorio) y enfermedad arterial periférica aterosclerótica (carótida, claudicación intermitente, etc.)3. El paciente puede encontrarse sintomático o no (paciente estabilizado o detección mediante pruebas diagnósticas, principalmente de imagen)3,5,6. En cualquiera de los casos, el objetivo general es un cLDL <55mg/dl y una reducción del cLDL de al menos el 50% con respecto al cLDL que tiene el paciente en el momento del diagnóstico de enfermedad vascular. Hay determinadas circunstancias en las que el paciente se beneficiará claramente de un objetivo más estricto (<40mg/dl), como aquellos con 2 eventos vasculares ateroscleróticos, si bien en las últimas recomendaciones de la Sociedad Española de Cardiología, junto con SEMERGEN y otras sociedades científicas, se ha ampliado este grupo, como también se recomienda un objetivo menos estricto (<70mg/dl) en aquellos sujetos más frágiles y/o con una expectativa de vida limitada5. Dado que en este grupo de pacientes los objetivos de control son más estrictos, solo un pequeño porcentaje de pacientes se va a controlar con estatinas de alta intensidad, requiriendo desde el inicio en la mayoría de los casos la terapia hipolipemiante combinada, preferentemente con ezetimiba (tratamiento hipolipemiante de alta intensidad)5,13,40,43. Al ser un grupo que tiene un riesgo muy elevado de presentar un nuevo evento vascular, es imprescindible lograr el control precoz del cLDL. Por ello, si no se logra el control con la primera aproximación, habrá que optimizar el tratamiento hipolipemiante, no más allá de las 4-6 semanas del inicio/cambio del tratamiento5,43. Por otra parte, en esta población se debería considerar el tratamiento con icosapento de etilo 4g/día, con el fin de disminuir el riesgo residual35.
Enfermedad renal crónicaLos pacientes con enfermedad renal crónica tienen un riesgo especialmente elevado de presentar complicaciones vasculares durante el seguimiento51. De hecho, según las escalas de estratificación de riesgo, estos pacientes se clasifican en pacientes con un riesgo vascular elevado (objetivo cLDL <70mg/dl y reducción ≥50%) o muy elevado (objetivo cLDL <55mg/dl y reducción ≥50%) (tabla 1)3,5,6. Las alteraciones del metabolismo lipídico son frecuentes en estos pacientes ya desde las fases iniciales de la enfermedad, con elevaciones en los niveles de triglicéridos y disminución del cHDL, además de un incremento de las partículas LDL pequeñas y densas, y de las concentraciones de Lp(a). En consecuencia, estas alteraciones del perfil lipídico son especialmente aterogénicas3,5,6. Diferentes estudios han mostrado que estos pacientes se benefician de la terapia hipolipemiante intensiva, incluyendo la terapia hipolipemiante oral combinada y los inhibidores PCSK952,53. Sin embargo, parece que este beneficio de la reducción de cLDL no sería tan evidente en los pacientes en diálisis54. Las guías y consensos recomiendan en el paciente con enfermedad renal crónica un manejo similar al del resto de pacientes con riesgo CV alto o muy alto, excepto en el caso de los pacientes en diálisis, donde no se recomienda comenzar el tratamiento con estatinas o estatina/ezetimiba, pero sí continuar con el tratamiento hipolipemiante si ya lo tomaban en el momento de iniciar la diálisis3,5,6.
Hipercolesterolemia familiarLos pacientes con hipercolesterolemia familiar tienen un riesgo incrementado de desarrollar complicaciones vasculares de forma prematura13. En aquellos pacientes con antecedentes familiares de cardiopatía isquémica precoz, xantomas y/o arco corneal, o que hayan desarrollado enfermedad vascular precoz, o que tengan xantomas tendinosos o arco corneal en jóvenes, o bien cifras de cLDL muy elevadas, se debe sospechar la presencia de hipercolesterolemia familiar, que deberá confirmarse con el diagnóstico genético (tabla 5)9,55. Para la estratificación de riesgo de estos pacientes no hace falta emplear la escala SCORE2, si bien se han desarrollado escalas específicas para perfilar mejor el riesgo vascular individual de esta población56,57. En cualquier caso, estos pacientes, al tener un riesgo vascular elevado/muy elevado de presentar enfermedad vascular y tener cifras basales de cLDL altas, requieren del empleo de terapia intensiva hipolipemiante para lograr los objetivos de control de cLDL5,13.
Criterios de sospecha de hipercolesterolemia familiar
| Variable | Puntuación | Posibilidad diagnóstica |
|---|---|---|
| Historia familiar- Familiar de primer grado con antecedentes de CI precoz y/o- Familiar de primer grado con cLDL>percentil 95- Familiar de primer grado con xantomas y/o arco corneal y/o- Niños <18 años con cLDL>percentil 95 | 1221 | - HF definida: > 8- HF probable: 6-8- HF posible: 3-5- HF improbable: <3 |
| Antecedentes personales- Enfermedad coronaria prematura 2- Enfermedad cerebrovascular o periférica prematura | 21 | |
| Exploración física- Xantomas tendinosos- Arco corneal <45 años | 64 | |
| Niveles cLDL- > 330 mg/dl (> 8,5 mmol/l)- 250-329 mg/dl (6,5-8,4 mmol/l)- 190-249 mg/dl (5,0-6,4 mmol/l)- <190 mg/dl (5,0 mmol/l) | 8531 | |
| Análisis genéticoMutación conocida del gen del receptor de las cLDL | 8 |
CI: cardiopatía isquémica; cLDL: colesterol unido a lipoproteínas de baja densidad; HF: hipercolesterolemia familiar.
Tabla realizada con datos de la referencia 55.
La gran mayoría de los pacientes con diabetes tipo2 tienen un riesgo CV elevado o muy elevado58,59. En cuanto al perfil lipídico, en estos sujetos es frecuente la presencia de dislipemia aterogénica [elevaciones en los niveles de triglicéridos y disminución del cHDL, además de un incremento de las partículas LDL pequeñas y densas y de las concentraciones de Lp(a)]6. En consecuencia, en estos pacientes pequeñas elevaciones del cLDL son particularmente dañinas, por lo que es fundamental lograr los objetivos de control. El objetivo primario para el control lipídico en la población con diabetes debería ser el cLDL o el colesterol no-HDL, de acuerdo con el riesgo vascular, y como objetivo secundario, unos niveles de triglicéridos <200mg/dl5,13. Para ello, en la mayoría de los casos va a ser necesario el uso de la terapia intensiva hipolipemiante, bien mediante el empleo de estatinas de alta intensidad, o más frecuentemente mediante la combinación de tratamientos hipolipemiantes5,13. Aunque las estatinas de alta intensidad, sobre todo a las dosis más elevadas, puedan tener un efecto diabetogénico moderado, principalmente en aquellos sujetos con unas cifras de hemoglobina glicosilada (HbA1c) próximas al diagnóstico de diabetes, el beneficio clínico en cuanto a la prevención de eventos vasculares es mucho mayor que este potencial riesgo, por lo que este hecho no debería disuadirnos de su uso60.
Pacientes oncológicosEn los últimos años se ha observado un aumento en la supervivencia de los pacientes con cáncer gracias a los nuevos tratamientos antitumorales. Sin embargo, estos pacientes tienen un mayor riesgo de presentar complicaciones vasculares durante el seguimiento, en parte relacionados con el propio tumor, pero también con algunos tratamientos específicos. Por ejemplo, el empleo de fármacos como asparraginasa, bexaroteno, ciclosporina, copanlisib, corticoides, duvelisib, everolimus, idealisib, inhibidores de aromatasa (anastrozol, letrozol), mitotane, nilotinib, pegaspargasa, ruxolitinib, temsirolimus o tretinoína se ha asociado con alteraciones en el metabolismo lipídico61. De hecho, los supervivientes de cáncer tienen un riesgo de 2 a 7 veces mayor de fallecer por enfermedad vascular que la población general62. En cuanto a los objetivos lipídicos, los consensos de expertos recomiendan los mismos objetivos que en la población general y la misma estratificación de riesgo, pero conociendo que hay determinados tumores que se asocian con un mayor riesgo vascular, tanto a corto como a largo plazo61. Además, aunque los fármacos hipolipemiantes que se pueden emplear son seguros en los pacientes con cáncer, hay que tener en cuenta la posibilidad de presentar interacciones con el tratamiento quimioterápico, y escoger aquellos que presentan un menor riesgo63. Finalmente, es importante destacar que las reducciones de cLDL, incluso a cifras muy bajas, no se han asociado con un incremento en el riesgo de desarrollar neoplasias64.
Enfermedades autoinmunes, reumáticas e inflamatoriasLas enfermedades inflamatorias, reumáticas y autoinmunes se asocian con un agravamiento de la aterosclerosis y, secundariamente, con un incremento de la morbimortalidad CV en comparación con la población general. Ejemplos de estas enfermedades incluyen lupus eritematoso sistémico, psoriasis, artritis psoriásica, síndrome antifosfolípido, artritis reumatoide, espondilitis anquilosante, colitis ulcerosa, o enfermedad de Crohn6,65–67.
Y es que la inflamación de baja intensidad y el sistema inmunológico juegan un papel fundamental en todo el proceso de la aterosclerosis, desde el inicio de la placa, la progresión y la rotura de la misma68,69. No solo es que la inflamación favorezca el desarrollo de la aterosclerosis, sino que la propia acumulación de colesterol en las células desencadena una respuesta inflamatoria70. Además, ensayos clínicos como el estudio JUPITER han demostrado que el tratamiento con rosuvastatina en pacientes sin enfermedad CV previa, cLDL elevado y proteínaC reactiva aumentada reduce los eventos CV71.
A pesar de estas evidencias, la estratificación de riesgo vascular en estos pacientes y la aproximación al manejo de la dislipemia son similares a las de la población general. En consecuencia, la estratificación de riesgo por SCORE2/SCORE2-OP puede infraestimar el riesgo en estos sujetos. Ahora bien, no se recomienda el tratamiento hipolipemiante por el único hecho de tener algunas de estas condiciones. Por otra parte, también hay que tener en cuenta que los niveles de CPK pueden estar elevados en algunas de estas condiciones, incrementando la posibilidad de intolerancia a las estatinas, por lo que debería considerarse de elección en muchos de estos pacientes la combinación de la terapia hipolipemiante con estatinas a dosis bajas6,67.
Virus de la inmunodeficiencia humana (VIH)Los pacientes con VIH tienen un riesgo CV aumentado en comparación con la población general, y el tratamiento antirretroviral, en particular los inhibidores de la proteasa, incrementa aún más este riesgo72-74. En cualquier caso, el aumento en el riesgo CV absoluto con la terapia antirretroviral se ve claramente compensado con el beneficio del tratamiento para el VIH6,67.
Típicamente los pacientes con VIH tienen niveles bajos de cHDL y elevados de triglicéridos, mientras que el tratamiento antirretroviral se asocia con aumentos en los niveles de colesterol total, cLDL y triglicéridos, junto con un descenso del cHDL y predominio de partículas pequeñas y densas de cLDL72.
En cuanto al tratamiento hipolipemiante, es importante considerar el riesgo de interacciones con el tratamiento para el VIH, principalmente inhibidores de la proteasa y el inhibidor no nucleósido de la transcriptasa inversa efavirenz, y ciertas estatinas que se metabolizan por CYP3A4 o CYP2C9, lo que aumentaría el riesgo de miopatía y rabdomiólisis con el tratamiento concomitante. En este contexto, las estatinas preferidas serían pitavastatina y pravastatina. En general, la estratificación de riesgo vascular y la aproximación terapéutica serían similares a las de la población general, considerando el riesgo de interacciones con las estatinas6,67,72.
AncianoLas cifras elevadas de colesterol incrementan el riesgo de presentar complicaciones CV, independientemente de la edad, si bien en términos absolutos el riesgo aumenta con la edad75. Un metaanálisis de 28 ensayos clínicos mostró una reducción significativa del 21% en el riesgo de eventos vasculares mayores por cada descenso de 1mmol/l de cLDL, siendo independiente de la edad en los pacientes con enfermedad CV, pero en prevención primaria el beneficio era menor en los sujetos de mayor edad76. Otro metaanálisis objetivó que el beneficio de la reducción de cLDL se extendía a otras terapias hipolipemiantes diferentes a las estatinas24. Con todas estas evidencias, las guías europeas de dislipemia recomiendan el tratamiento con estatinas en sujetos ≤75años de acuerdo con el riesgo vascular, pero por encima de esa edad debería considerarse en prevención primaria en los sujetos con un riesgo vascular alto o muy alto. En prevención secundaria la aproximación terapéutica hipolipemiante debería ser la misma, independientemente de la edad6.
Por otra parte, se recomienda utilizar SCORE2-OP en los mayores de 70años para valorar iniciar tratamiento hipolipemiante3. En los pacientes ancianos se producen diferentes cambios farmacocinéticos, incluyendo el aumento del tejido adiposo, disminución del contenido de agua y de la albúmina sérica, deterioro de la función renal y disminución del metabolismo hepático. Además, es frecuente que estos pacientes presenten otras comorbilidades y se encuentren polimedicados, existiendo también un mayor riesgo de intolerancia a estatinas. En este contexto, es recomendable comenzar con estatinas a bajas dosis y titular de manera progresiva, empleando aquellas estatinas que se toleren mejor, principalmente las hidrofílicas, como la rosuvastatina o la pravastatina (la simvastatina, la atorvastatina y la pitavastatina entrarían dentro del grupo de las lipofílicas)6,67.
Por ello, a tenor de lo mostrado, se recomienda mantener el tratamiento hipolipemiante en mayores de 75años, especialmente en aquellos en prevención secundaria, y solo retirarlo en caso de intolerancia total o efectos secundarios
Diferencias según el sexoEn las mujeres, el aumento de cLDL se asocia con un incremento en el riesgo de infarto de miocardio, cardiopatía isquémica y muerte77. Sin embargo, mientras que el cLDL elevado es un potente predictor de riesgo de cardiopatía isquémica en las mujeres <65años, es algo menor para las mujeres más mayores. En cambio, el cHDL bajo es un predictor más fuerte de mortalidad para cardiopatía isquémica en mujeres que en hombres, especialmente en mujeres ≥65años78.
Hasta el estudio CLEAR-OUTCOMES, tradicionalmente las mujeres han estado infrarrepresentadas en los ensayos clínicos con tratamientos hipolipemiantes31. Además, los mecanismos específicos del género en la fisiopatología y la historia natural de la enfermedad CV siguen sin comprenderse bien. Más allá de los factores de riesgo clásicos, las mujeres presentan otros factores de riesgo de enfermedad CV ligados al género, como parto prematuro, hipertensión arterial gestacional, diabetes gestacional, síndrome del ovario poliquístico, menopausia precoz o terapia hormonal sustitutiva5,6,79,80.
En cualquier caso, diferentes metaanálisis han mostrado que el beneficio de reducir el cLDL mediante el tratamiento hipolipemiante sería similar en varones y mujeres78,81,82. Sin embargo, parece que el control del cLDL sería peor en las mujeres que en los varones, probablemente condicionado por una inercia diagnóstica relacionada por la percepción del facultativo de un menor riesgo en este sexo, lo que indica la necesidad de hacer más esfuerzos para mejorar este control77. Por otra parte, en comparación con los varones, las mujeres que toman estatinas pueden tener un mayor riesgo de diabetes mellitus y de miotoxicidad inducida por estatinas. En este contexto, la terapia combinada con estatinas no a dosis máximas podría aportar un valor añadido, en comparación con las estatinas a dosis máximas78.
Personas transgéneroEn atención primaria se atiende también a las personas transgénero con problemas similares a los de la población general, incluidos los programas preventivos. La historia clínica debe tener los mismos objetivos que en cualquier otra persona, pero en su caso es imprescindible incluir datos sobre el uso de la terapia hormonal y la edad de inicio, ya que implica una serie de efectos secundarios de riesgo cardiovascular; así, en cuanto al riesgo lipídico, en las mujeres trans existe mayor riesgo de aumento de triglicéridos y de cLDL y cHDL reducido, así como mayor riesgo de hipertensión arterial sistólica y tromboembolismo venoso; y en los hombres trans con síndrome de ovario poliquístico se debe realizar un estudio de cribado de dislipemia y diabetes. Por ello se recomiendan controles periódicos de presión arterial y analítica, incluyendo perfil lipídico y glucémico. La frecuencia de estos controles se individualizará en cada caso según la estratificación del riesgo (SCORE2)83.
ConclusionesLa hipercolesterolemia no es solo un factor de riesgo, sino la causa subyacente de la aterosclerosis. En consecuencia, todos los esfuerzos encaminados a reducir las cifras de cLDL para conseguir los objetivos en función del riesgo CV son fundamentales para disminuir la carga de enfermedad CV. Desafortunadamente, las cifras actuales de control del cLDL siguen siendo muy bajas, en parte debido a una insuficiente intensificación del tratamiento hipolipemiante, pero también a la necesidad de disponer de nuevas herramientas que nos permitan lograr dichos objetivos. En este contexto, el mayor empleo de la terapia combinada hipolipemiante ayudará a mejorar el control de cLDL en España. Para lograr la consecución de objetivos, atención primaria es el enclave óptimo para lograr dicho control.
FinanciaciónEl presente trabajo se ha realizado a iniciativa de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), que ha recibido una beca no condicionada de Almirall.
Consideraciones éticasEl presente manuscrito-posicionamiento SEMERGEN cumple las consideraciones éticas de una publicación científica de estas características.
Conflicto de interesesJ. Polo-García declara haber participado como asesor de Astra-Zeneca y Bristol-Mayer-Squibb; haber participado como ponente en reuniones patrocinadas por GSK, Bayer, Boehringer-Ingelheim, Astra-Zeneca, L’Oreal, Bristol-Mayer-Squibb, Kern y Pfizer, y haber recibido financiación para estudios de investigación de Boehringer-Ingelheim y Novo Nordisk.
Sergio Cinza-Sanjurjo declara haber participado como asesor de Almirall, Astra-Zeneca, Bayer, Daiichi-Sankyo, MSD, Novartis, Viatris, y haber participado como ponente en reuniones patrocinadas por y recibir financiación para estudios de investigación de Almirall, Astra-Zeneca, Bayer, Boehringer-Ingelheim, Bristol-Mayer-Squibb, Menarini, Novartis y Pfizer.
Miguel Turégano declara haber participado como ponente de reuniones patrocinadas por Astra-Zeneca, Bayer, Daiichi-Sankyo, Almirall, Novartis, Viatris, Organon y MSD.
Angel Díaz declara haber participado como asesor de Viatris y Menarini, y haber participado como ponente en reuniones patrocinadas por Astra-Zeneca, Daiichi-Sankyo, Almirall, Viatris y Organon
Vicente Pallarés declara haber participado como asesor de Astra-Zeneca, Daiichi-Sankyo, Novartis, Adamed, Viatris y Organon; haber participado como ponente en reuniones patrocinadas por Astra-Zeneca, Boehringer-Ingelheim, Daiichi-Sankyo, Almirall, Novartis, Adamed, Viatris, Organon, MSD, y haber recibido financiación para estudios de Organon.
David Fierro declara haber participado como asesor de Adamed y Bayer, haber participado como ponente en reuniones patrocinadas por Boehringer-Ingelheim, Daiichi-Sankyo, Alter, Almirall, Novartis, Adamed, Viatris y MSD, y haber recibido financiación para estudios de Almirall.