Estudiar la relación entre la presencia de síndrome de hipogonadismo de inicio tardío (HIT) del varón y las alteraciones en la ecogenicidad testicular en una muestra de población rural.
Material y métodosEstudio observacional de cohortes prospectivo en el que se incluyeron varones de entre 45 y 75 años del cupo de Villarta de San Juan (Ciudad Real). A cada paciente, con objeto de conocer la incidencia de HIT, se le administró el test AMSS, se le realizó un análisis de sangre que determinaba la concentración de testosterona y se le realizó una ecografía testicular bilateral.
ResultadosSe incluyeron en el estudio 287 pacientes. En un 9,76% de los mismos se estableció el diagnóstico de síndrome de HIT. Se realizaron 154 ecografías testiculares bilaterales en las que se evaluaron sus patrones de ecogenicidad testicular. En el 72,7% de los casos se pudieron describir alteraciones conforme a los estándares propuestos por la European Academy of Andrology del año 2022. La ecogenicidad testicular evaluada por ultrasonidos demostró una sensibilidad de 72,7%, una especificidad de 78,8%, un valor predictivo negativo de 94,5% y un valor predictivo positivo de 36,4%, para el diagnóstico del HIT.
ConclusionesLa determinación de ecogenicidad testicular en pacientes con sospecha de síndrome de HIT evidenció una especificidad mucho mayor que el test AMSS y un valor predictivo negativo similar. En base a su inocuidad y al tratarse de una exploración relativamente sencilla desde el punto de vista técnico, podría postularse como una herramienta diagnóstica a tener en cuenta en la identificación de este síndrome.
This study aims to investigate the relationship between the presence of late-onset hypogonadism (LOH) syndrome in men and alterations in testicular echogenicity in a rural population sample.
Materials and methodsProspective observational cohort study in which men between 45 and 75 years old from Villarta de San Juan area (Ciudad Real) were included. In order to determine the incidence of HIT, each patient was administered the AMSS test, a blood test to determine the concentration of testosterone, and a bilateral testicular ultrasound was performed.
Results287 patients were included in the study. The diagnosis of LOH syndrome was established in 9.76% of them. 154 bilateral testicular ultrasounds were performed in which their testicular echogenicity patterns were evaluated. In 72.7% of the cases, alterations could be described in accordance with the standards proposed by the European Academy of Andrology of the year 2022. Testicular echogenicity evaluated by ultrasound demonstrated a sensitivity of 72.7%, a specificity of 78.8%, a negative predictive value of 94.5% and a positive predictive value of 36.4%, for the diagnosis of LOH.
ConclusionsThe determination of testicular echogenicity in patients with suspected LOH syndrome showed much greater specificity than the AMSS test and a similar negative predictive value. Based on its innocuousness and the fact that it is a relatively simple examination from a technical point of view, it could be postulated as a diagnostic tool to be taken into account in the identification of this syndrome.
El síndrome de hipogonadismo de inicio tardío (HIT) es el término de elección, relativamente moderno, elegido para caracterizar un cuadro clínico que posee muchas aristas y que ha cobrado una creciente atención en la medicina contemporánea, especialmente en el contexto del envejecimiento de la población masculina1. La International Society of Andrology (ISA) lo define como un síndrome clínico y bioquímico que afecta a varones de edad avanzada caracterizado por la deficiencia de testosterona (T), que se asocia a una constelación de síntomas y que afecta significativamente a la calidad de vida2. A medida que la esperanza de vida continúa aumentando, comprender y abordar adecuadamente el HIT constituye un desafío clínico y terapéutico esencial.
Establecer un dato de prevalencia del HIT no puede de ninguna manera ser categórico ya que los estudios disponibles exhiben una notoria variabilidad. Entre otras razones, porque los umbrales de normalidad analítica y de las técnicas diagnósticas empleadas distan de regirse por la uniformidad deseada. Mayoritariamente los estudios se refieren a población norteamericana y en uno de los más recientes, que incluyó a 1845 varones, la prevalencia estimada del síndrome de HIT fue de 3,1 - 7% casos en varones entre 30-69 años y hasta un 18% en varones mayores de 70 años3. En este sentido y con similar origen de la población, el Massachusetts Male Aging Study (MMAS) en 1994 ya aportó resultados de estimación de la prevalencia del síndrome en un 12,3% de la población y sentaron, en cierto modo, sus bases conceptuales4.
En nuestro ámbito, el estudio de referencia es el European Male Aging Study (EMAS). Se realizó sobre 3369 varones con edades comprendidas entre los 40 y 79 años, cifró la prevalencia en un 7,8%5.
En el EMAS se documentó que el descenso de los niveles de T disminuía en torno a 0,4% cada año en condiciones fisiológicas y en el MMAS4 se objetivó no solo una disminución en la T total (TT) sino mucho mayor en la T libre (TL), concretamente, un 30% menor en hombres de 75% años respecto a los de 40.
Desde el punto de vista clínico, es clave entender que puede existir solapamiento de algunos de los síntomas propios del HIT con el envejecimiento natural. La diferencia entre ambas situaciones se advierte, tal y como estudios recientes evidencian, en la clara mejoría de los pacientes con HIT cuando son tratados con testosterona6.
Con los conocimientos actuales, al HIT se le considera como un síndrome plurihormonal, con potencial implicación de hormonas como la somatotropina, la tiroxina o la melatonina2, los niveles de gonadotropinas. Es por esta circunstancia por la que se acepta que en el HIT confluyen tanto un hipogonadismo primario como uno secundario y con implicación tanto de la función testicular como de la glándula pituitaria7.
El documento básico de consenso para el manejo clínico del HIT en nuestro ámbito se homologa a las pautas seguidas en EE. UU. o en otros países europeos y en él se especifica que un paciente mayor (en general con edad superior 45 años) debe ser considerado como caso cuando presenta clínica compatible evidenciada en test validados, como el test Aging's Male Symptoms Scale (AMSS) y una concentración de testosterona en sangre por debajo de los niveles normales (3,10) conforme a valores de T total normal (TT) <8 nmol/l (231 ng/dl) y de T libre (TL) <180pmol/l (52 pg/ml)2.
La mencionada dificultad para establecer la dimensión epidemiológica del HIT en términos de incidencia y prevalencia, a pesar de disponer de las herramientas diagnósticas ya descritas, se describen en el Documento de Consenso que recoge, por ejemplo, la escasa especificidad y valor predictivo negativo que posee el test AMSS2. Estas circunstancias refuerzan la necesidad de un conocimiento y concienciación mayor frente al HIT y aumentan también la demanda de nuevas herramientas que otorguen certeza al diagnóstico.
Las exploraciones basadas en la utilización de la ecografía, en sus múltiples indicaciones, gozan cada vez de mayor difusión y sus indicaciones son crecientes, una circunstancia que no es ajena a especialidades como por ejemplo la Medicina de Familia y la Urología. Su doble condición de inocuidad y relativa facilidad de uso la hacen idónea para su incorporación a la metodología diagnóstica de muchas entidades clínicas, que debe ser planteada, al menos, como método complementario al diagnóstico.
En el caso concreto de la patología testicular, su indicación está definitivamente establecida en patología tumoral e inflamatoria-infecciosa entre otras, pero existen muy pocas contribuciones que, de forma específica, relacionen eventuales alteraciones ecográficas testiculares con la presencia de síndrome de HIT y alteraciones ecográficas a nivel testicular a excepción de su indicación en el estudio de la infertilidad en el varón8,9.
En 2022 la European Academy of Andrology (EAA) publicó los criterios de referencia tanto para la ecografía escrotal como la prostática10. Así, en el caso de estudio del testículo, define para valorar la ecogenicidad el patrón 0, homogéneo, el patrón 1 ante la presencia de pequeños focos hipoecoicos o finas estrías hipoecoicas, el patrón 2 ante la presencia de estrías hipoecoicas gruesas, y el patrón 3 en el supuesto de objetivar falta de homogeneidad siendo esta difusa y/o con apariencia de «netting» o mapa geográfico.
Por las circunstancias mencionadas, este trabajo plantea como objetivo evaluar la relación entre la presencia de síndrome de hipogonadismo de inicio tardío (HIT) del varón y las alteraciones en la ecogenicidad testicular en el marco de una población de varones evaluados en un estudio diseñado para conocer la incidencia del síndrome de HIT con la metodología tradicional, basada en valoración clínica y analítica habituales para su identificación.
Material y métodosPoblación y diseñoSe trata de un estudio observacional de cohortes prospectivo realizado sobre 287 varones de un área de población rural de Ciudad Real (Villarta de San Juan) que cuenta actualmente con una población total de 2710 habitantes empadronados según la última actualización del Instituto Nacional de Estadística11.
No se estableció un límite en el tamaño de la muestra; todos los pacientes elegibles fueron incluidos en el estudio. Se reclutó a todos los varones de entre 45 y 75 años de edad del área de salud mencionada que cumplían los siguientes criterios de inclusión: estar circunscrito en el área de salud rural objeto de estudio, ser varón con edad comprendida entre los 45 y 75 años y haber obtenido un consentimiento informado. Fueron criterios de exclusión el diagnóstico previo de hipogonadismo, la presencia de enfermedad neoplásica concomitante, la presencia de enfermedad crónica grave de larga evolución y el tratamiento activo con fármacos que alteren las concentraciones de testosterona.
ProcedimientoEste estudio se realizó entre los meses de enero y octubre del año 2023. Confirmados los criterios de exclusión/inclusión y obtenido el consentimiento informado, se pactó una entrevista en persona en una de las consultas del Centro de Salud. En la misma se administró el test AMSS de forma anónima, y se solicitó un análisis de sangre entre las 7:00 y las 11:00 de la mañana, en el cual se determinaron los niveles de testosterona total, SHBG, albúmina y LH. Todos estos datos fueron trasladados a una base de datos en Excel.
Posteriormente, los pacientes fueron citados una semana después para realizarles una ecografía testicular bilateral con el objetivo de determinar su patrón de ecogenicidad conforme a los estándares de la EAA. Se consideró que los patrones 0 y 1 de la EAA son los considerados como sanos o normales y se englobaron en el patrón «A»; los patrones 2 y 3 de la EAA se consideraron patológicos y se englobaron en el patrón «B». Las ecografías fueron llevadas a cabo por el Dr. J.M.G, jefe del Servicio de Urología del Hospital Universitario Nuestra Señora de la Candelaria (Tenerife) y cuyos resultados ratificó el Dr. J.G.S, jefe del Servicio de Radiología del Hospital Mancha Centro (Alcázar de San Juan).
El test AMSS consiste en 17 preguntas que exploran los síntomas relacionados con la deficiencia androgénica y, en caso de estar presentes, cuantifica su intensidad con valores que puntúan de 2 a 5 (1 punto en caso de que no los haya). Por encima de 27 puntos se estima que hay síntomas de hipogonadismo leve, por encima de 37 hipogonadismo moderado, y por encima de 50 se lo considera grave12.
Respecto a la cuantificación de los niveles de testosterona se optó por el uso de las concentraciones de testosterona libre (TL) en sangre, siendo diagnósticas de hipogonadismo bioquímico cuando se sitúan por debajo de 180pmol/l. Para su obtención, se utilizó la fórmula matemática validada y desarrollada por el Departamento de Endocrinología del Hospital Universitario de Gent13,14.
Con todo lo descrito, se consideró a paciente como «caso» cuando su puntuación era superior a 27 en el test AMSS y presentaba concentraciones de TL inferiores a 180pmol/l.
Análisis estadísticoEl análisis estadístico se inició con uno descriptivo de todas las variables incluidas en el estudio. Las variables cuantitativas se describen con su valor medio o mediano, junto con la desviación estándar o rango intercuartílico según la normalidad de la variable, la cual fue medida previamente mediante los test de Kolmogorov-Smirnov. Las variables cualitativas se describieron mediante frecuencias absolutas y relativas.
Posteriormente se realizó un análisis bivariante para comparar las características de los pacientes diagnosticados de HIT respecto a los que no tienen esta patología. Para las variables cuantitativas se utilizó el test t de student o U-Mann Whitney y para las variables cualitativas se utilizó el test de χ2 o el test exacto de Fisher cuando fue necesario.
Para analizar las diferencias entre pacientes con y sin ecografía testicular se usó el test t de Student para comparar edad media, IMC medio, puntuación AMSS, y niveles de testosterona libre. Para la comparación del diagnóstico de síndrome de HIT se usó el test de chi cuadrado.
Todos los cálculos se realizaron mediante el programa estadístico SPSS v18 y se tomó un valor de p<0,05 como estadísticamente significativo.
ResultadosDe los 310 pacientes que cumplían los criterios de inclusión y no presentaban criterios de exclusión, se pudo reclutar un total de 287 pacientes, lo que representa una tasa de respuesta del 92,6%. Por lo tanto, la tasa de abandono fue del 7,4%, con 23 pacientes que no completaron el estudio. Este nivel de abandono se considera aceptable dentro del contexto del estudio y no compromete la validez de los resultados obtenidos.
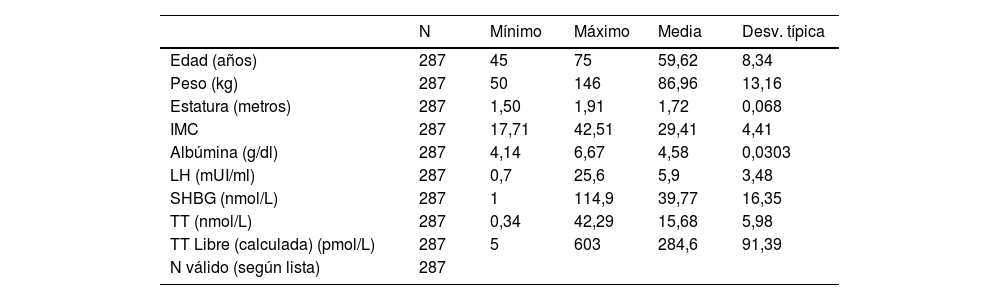
En cuanto a las características poblacionales, la edad media de la población estudiada fue de 59,6 años y una desviación estándar de 8,39. Destaca además un IMC medio de 29,41 (desv. estándar de 13,16) (tabla 1).
Análisis descriptivo del estudio
| N | Mínimo | Máximo | Media | Desv. típica | |
|---|---|---|---|---|---|
| Edad (años) | 287 | 45 | 75 | 59,62 | 8,34 |
| Peso (kg) | 287 | 50 | 146 | 86,96 | 13,16 |
| Estatura (metros) | 287 | 1,50 | 1,91 | 1,72 | 0,068 |
| IMC | 287 | 17,71 | 42,51 | 29,41 | 4,41 |
| Albúmina (g/dl) | 287 | 4,14 | 6,67 | 4,58 | 0,0303 |
| LH (mUI/ml) | 287 | 0,7 | 25,6 | 5,9 | 3,48 |
| SHBG (nmol/L) | 287 | 1 | 114,9 | 39,77 | 16,35 |
| TT (nmol/L) | 287 | 0,34 | 42,29 | 15,68 | 5,98 |
| TT Libre (calculada) (pmol/L) | 287 | 5 | 603 | 284,6 | 91,39 |
| N válido (según lista) | 287 |
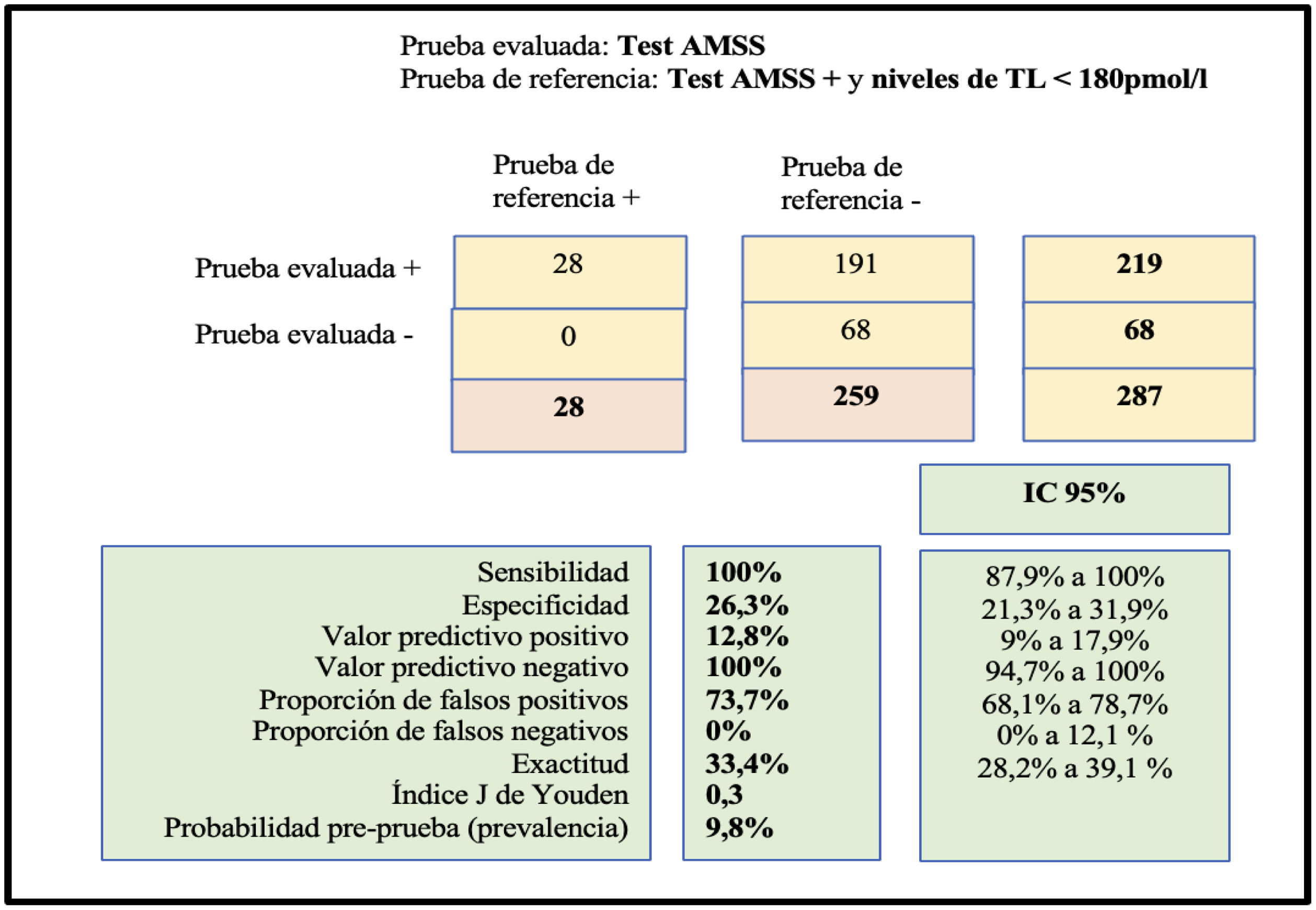
Del total de pacientes estudiados, un 76,4% obtuvieron calificación patológica o superior a 27 en el test AMSS, siendo de nivel moderado o grave un 34%. En nuestro análisis estadístico el test AMSS obtuvo sensibilidad y VPN del 100%. Su especificidad fue de 26,3% y su VPP de 12,8%. Para hallar estos valores predictivos, se utilizó el gold standard para el diagnóstico consistente en test positivo y resultados analíticos en valores patológicos (fig. 1).
A los 287 pacientes se les realizó determinación de testosterona libre calculada, siendo el valor medio de 284,67pmol/l (desv. estándar de 91,39). Se objetivaron niveles inferiores a 180pmol/l en 28 pacientes (9,75%). Todos ellos presentaron puntuación patológica en el test AMSS, por lo que fueron diagnosticados de síndrome de HIT (tabla 2).
Relación entre puntuación en el test AMSS y si presentaban o no niveles de TL < 180pmol/l
| TL<180 pmol/l | |||||
|---|---|---|---|---|---|
| Tabla contingencia | NO | SI | Total | ||
| Puntuación testAMSS | Negativo | Recuento % | 68 | 0 | 68 |
| Con esa condición dentro de su grupo | 26,3% | 0% | 23,7% | ||
| Leve | Recuento % | 115 | 7 | 122 | |
| con esa condición dentro de su grupo | 26,3% | 25% | 42,5% | ||
| Moderado | Recuento % | 68 | 19 | 87 | |
| con esa condición dentro de su grupo | 26,3% | 67,9% | 30,3% | ||
| Severo | Recuento % | 8 | 2 | 10 | |
| con esa condición dentro de su grupo | 3,1% | 7,1% | 3,5% | ||
| Total | Recuento % | 259 | 28 | 287 | |
| con esa condición dentro de su grupo | 100% | 100% | 100% | ||
De los 287 pacientes estudiados, se realizaron un total de 154 ecografías testiculares. Se realizó un análisis de potencia previo al estudio para determinar el tamaño de muestra necesario. Con base en la literatura previa y en consideraciones clínicas, se estimó que realizar 154 ecografías proporcionaría una muestra adecuada para detectar diferencias clínicamente significativas en los parámetros de interés, con una potencia estadística del 80% y un nivel de significación del 5%.
La decisión de detener la recolección de datos en 154 ecografías se basó en la observación de que la variabilidad de los resultados y la estabilidad de las conclusiones alcanzadas no mejoraron significativamente con la inclusión de más casos.
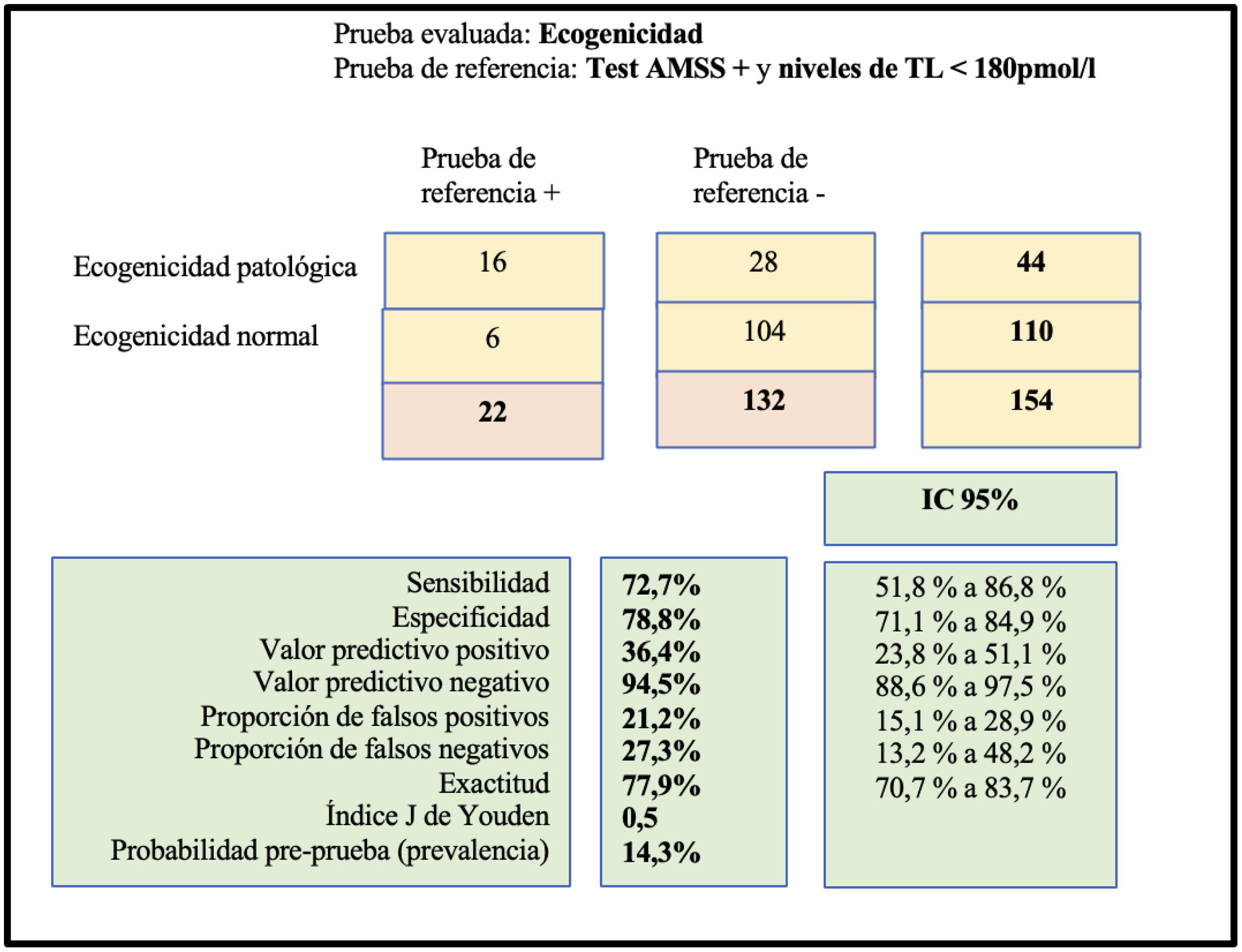
En las ecografías realizadas se determinó la ecogenicidad de ambos testículos y se clasificó según estándares de la EAA. Ciento diez pacientes (71,4%) expresaron patrón A o no patológico. Los patrones patológicos (B y C) fueron hallados en 44 pacientes (28,6%). Dieciséis de los 28 pacientes diagnosticados de síndrome de HIT expresaron un patrón patológico (el 72,7%) hallándose una relación estadísticamente significativa (p <0,05) (tabla 3).
Relación entre los patrones de ecogenicidad y si presentaban o no niveles de TL < 180pmol/l
| TL<180 pmol/l | ||||
|---|---|---|---|---|
| Tabla contingencia | No | Sí | ||
| Ecogenicidad | Normal | Recuento % | 104 | 6 |
| (Tipo A) | con esa condición dentro de su grupo | 78,8% | 27,3% | |
| Alterado | Recuento % | 28 | 16 | |
| (Tipo B o C) | con esa condición dentro de su grupo | 21,2% | 72,7% | |
| Total | Recuento % | 132 | 22 | |
| con esa condición dentro de su grupo | 100% | 100% | ||
En términos de edad media, IMC, puntuación AMSS, niveles de testosterona libre y diagnóstico de HIT no existieron diferencias estadísticamente significativas entre pacientes a los que se les realizó ecografía (n=154) y aquellos a los que no se les realizó (n=133) (tabla 4). El valor de p en todas las comparaciones fue mayor a 0,05.
Comparativa entre pacientes con y sin ecografía testicular
| Características clínicas | Pacientes sin ecografía (n=133) | Pacientes con ecografía (n=154) | p-valor |
|---|---|---|---|
| Edad (años) | 58,5 +- 7,9 | 60,2 +- 8,5 | 65 |
| IMC (kg/m2) | 28,9 +- 4,1 | 29,4 +- 4,3 | 0,45 |
| Puntuacion AMSS | 26,8 +-5,4 | 27,2 +- 5,7 | 0,6 |
| Niveles de testosterona libre media (pmol/l) | 288,0 +- 91,4 | 280,5 +- 89,6 | 0,3 |
| Diagnóstico de HIT (%) | 8,3 | 10,4 | 0,48 |
Se estableció una sensibilidad de 72,7% y una especificidad de 78,8% para las alteraciones en la ecogenicidad. Así mismo se determinó para esta técnica, un valor predictivo negativo de 94,5% y un valor predictivo positivo de 36,4% (fig. 2).
DiscusiónEs innegable que, en el momento actual, la sociedad no solo busca cada vez mayor longevidad, sino que la calidad de estos años sea alta. Por otro lado, también en los últimos años, la población rural demanda mayor atención de las autoridades en líneas generales, siendo particularmente notable la exigencia de una calidad sanitaria similar a la existente en grandes núcleos urbanos.
En línea con lo descrito, se ha producido un aumento de las facilidades sanitarias en los Centros de Salud ubicados en zonas más despobladas. En concreto la ecografía y la formación de los médicos respecto a la misma ha experimentado un crecimiento exponencial en la última década. Así lo acreditan tanto publicaciones internacionales15,16 como nacionales17.
Uniendo estos hechos, nos encontramos ante el escenario ideal para que cuadros como el síndrome de hipogonadismo de inicio tardío vuelvan a primera línea tras haber atravesado una larga época sin avances al respecto. Una evidencia de ello es la dificultad existente en la literatura para encontrar el modelo idóneo de aplicación de las diferentes técnicas de la metodología diagnóstica, siendo particularmente escasas las referencias a la ecografía.
Nuestros resultados estiman una prevalencia del síndrome de HIT diagnosticado por los métodos descritos de un 9,76%, algo menor que la prevalencia comprobada en el Massachusetts Male Aging Study (12,3%)18 y superior a la establecida en el EMAS (7,8%)5.
Es un claro ejemplo de la ausencia de trabajos que relacionen ecografía y HIT el hecho de que el documento básico de consenso2 otorga un escaso protagonismo a esta técnica diagnóstica, haciendo alguna referencia al volumen testicular apoyándose en el estudio de Mahmoud et al.19. Sin embargo, tal y como se describe en estudios posteriores20 la falta de consenso en cuanto a cuál debe ser el volumen esperable en un varón sano ha sido una constante, sugiriéndose siempre que sea evaluado en un contexto clínico y mediante ecografía.
Existen algunos estudios de ecogenicidad que pueden ser válidos como referencia, donde la mayoría intentan establecer correlación entre infertilidad y hallazgos patológicos testiculares. Destaca el llevado a cabo en 2012 por Guido Virgili et al.21 donde se realizó un estudio sobre 101 pacientes con problemas de infertilidad donde no se halló relación.
Sin embargo, en el año 2022 la European Academy of Andrology (EAA) arroja luz a este problema, publicando los estándares para la ecografía escrotal10 que han sido referencia en este estudio. En nuestros resultados se obtiene una relación estadísticamente significativa entre poseer alteraciones en la ecogenicidad testicular (patrones B o C) y padecer síndrome de HIT. La potencia estadística del ultrasonido ofrece datos muy alentadores. Fundamentalmente una especificidad alta (78,8%) que supera holgadamente a la del test AMSS (26,3%) y un valor predictivo negativo del 94,5%. A todo lo previo, hay que resaltar lo inocuo de la técnica y su relativa sencillez para ser ejecutada e interpretada.
En este sentido, y a pesar de la discutible potencia estadística del test AMSS, no se han desarrollado en los últimos años otras técnicas alternativas que permitan aflorar un síndrome complejo que sufre una parte no desdeñable de la población adulta. Así lo afirma la Canadian Urological Association en la última actualización de sus guías clínicas22, donde hace hincapié en la baja especificidad de los test autoadministrados disponibles, situándola en torno al 20%, similar al 26,3% que obtuvo el test en nuestro estudio.
Respecto a las determinaciones analíticas, la bioquímica sanguínea para la determinación de las concentraciones de testosterona es imprescindible para el diagnóstico. Así lo definieron la International Society of Andrology (ISA), la International Society for the Study of Aging Male (ISSAM), la European Association of Urology (EAU), la American Society of Andrology (ASA) y la citada EAA en su documento de consenso23. En nuestro estudio, se obtuvieron niveles infranormales de TL en un 9,76% de los pacientes. Porcentaje muy similar al encontrado en el EMAS.
Es importante resaltar las limitaciones que ha tenido este estudio, ya que la población es solo rural y monocéntrica, por lo que podrían ser resultados no extrapolables a otros núcleos poblacionales. Además, se hizo una recogida de datos retrospectiva, a pesar de que la inclusión de pacientes fue prospectiva.
Existen múltiples alusiones a la baja especificidad de los test usados en la evaluación clínica por parte de los profesionales, por lo que se hace evidente la necesidad de una alternativa fiable. Los hallazgos de este estudio presentan la ecografía testicular no solo como una herramienta complementaria a los métodos tradicionales para diagnosticar síndrome de hipogonadismo de inicio tardío, sino como una técnica con capacidad por sí sola para el despistaje de casos sospechosos. El crecimiento y la formación que reciben los médicos en esta técnica, unido al cada vez mayor conocimiento del síndrome de HIT abren un horizonte esperanzador para muchos pacientes.
- •
Los varones expresan un declinar fisiológico de la función gonadal con el paso del tiempo.
- •
El síndrome de HIT es un desafío clínico y diagnóstico.
- •
Las técnicas diagnósticas actuales no tienen gran potencia estadística.
- •
El despistaje del síndrome de HIT debe estar presente en los varones adultos.
- •
La ecografía se presenta como una herramienta útil para su diagnóstico.
- •
Se requieren más estudios que refuercen esta hipótesis y cambien el actual paradigma de diagnóstico.
Para la realización de este proyecto se han seguido los Principios de la Declaración de Helsinki promulgada por la Asociación Médica Mundial y se ha obtenido la aprobación del Comité de Ética de Investigación con medicamentos (CEIm) de la Gerencia de Atención Integrada de Alcázar de San Juan. Todos los pacientes han firmado un consentimiento informado previo a la inclusión del estudio.
El presente estudio se adhiere rigurosamente a los principios éticos establecidos por la Ley Orgánica de Protección de Datos Personales y garantía de los derechos digitales (LOPDGDD) 5/2018, así como al código de aprobación del Comité de Ética de la Investigación con Medicamentos (CEIm). La recopilación, tratamiento y manejo de los datos personales de los participantes se realizará en estricto cumplimiento con la normativa vigente sobre protección de datos y derechos digitales. Además, se seguirán todas las directrices éticas establecidas por el CEIm para garantizar la integridad y el respeto hacia los participantes involucrados en este estudio.
FinanciaciónEste trabajo de investigación fue llevado a cabo sin el respaldo financiero de ninguna institución, agencia o entidad externa. Todos los costos asociados con la realización de este estudio fueron cubiertos por los autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Doctor Jesús Monllor Gisbert, por su inestimable ayuda y su incansable aliento.