Analizar el porcentaje de retraso diagnóstico (RD) de la infección por el virus de la inmunodeficiencia humana (VIH), su tendencia y factores asociados a partir de los datos procedentes del Sistema de Información de Nuevos Diagnósticos de VIH (SINIVIH) en España.
MétodosEstudio descriptivo sobre las personas diagnosticadas de VIH durante 2003–2007 en las 8 comunidades autónomas (CCAA) actualmente participantes. Se definió como RD la presencia de <200CD4/μl al diagnóstico. Mediante regresión logística se obtuvieron las odds ratio (OR) y su intervalo de confianza al 95% (IC95%).
ResultadosSe notificaron 5.785 nuevos diagnósticos de VIH, de los que 4.798 disponían de cifra de CD4 al diagnóstico. De estos, el 37,3% cumplieron la definición de retraso. Un 19% adicional tenía entre 200–350 CD4. El porcentaje de RD era menor en mujeres que en hombres (32,9% frente a 38,6%), y mayor en heterosexuales (42,4%) y usuarios de drogas inyectadas (UDI) (40,1%) que en los hombres que mantienen relaciones sexuales con hombres (HSH) (26,7%). Ajustando por CCAA y año de diagnóstico la probabilidad de RD en españoles es mayor en hombre (OR=1,49; IC95%:1,21–1,85); en: 30–39 años (OR=2,08; IC95%:1,63–2,67), 40–49 años (OR=3,98; IC95%:3,07–5,16) y >49 años (OR=6,77; IC95%:5,10–9,00) frente a 20–29 años; y en heterosexuales (OR=1,75; IC95%:1,43–2,15) y UDI (OR=1,75; IC95%:1,38–2,22) comparados con los HSH. El RD disminuyó de 2003 a 2007. En extranjeros se encontraron los mismos factores, pero con distinta magnitud: la asociación con el sexo masculino, UDI o heterosexuales es más fuerte, mientras que con la edad es más débil.
ConclusionesEl RD afecta a casi 4 de cada 10 nuevos diagnósticos de VIH, y los varones, los mayores de 30 años, UDI e infectados por contacto heterosexual están más afectados. Estas variables se asocian a RD en españoles y en extranjeros, pero entre estos últimos la asociación es aún más fuerte. Es necesario aumentar la autopercepción de las conductas de riesgo e implantar el SINIVIH en todo el país para mejorar y ampliar la información sobre RD.
To analyse the prevalence of delayed diagnosis (DD) of human immunodeficiency virus (HIV) infection, the trends over time and its determining factors from the Newly Diagnosed HIV-infected individuals Information System (SINIVIH) data, in process of being implemented in Spain.
MethodsCross-sectional study of newly diagnosed HIV-infected individuals between 2003 and 2007 in the 8 currently participating Spanish autonomous regions (AR). DD was defined as a CD4 count <200cells/μL at diagnosis. Adjusted odds ratios with 95% confidence interval were calculated using logistic regression (OR; 95%CI).
ResultsAmong the 5785 newly diagnosed HIV cases reported, 4798 had a CD4 cell count at diagnosis. Of these, 37.3% met the DD definition. An additional 19% had between 200 and 350cells/μL. The proportion of DD was lower for women than for men (32.9% versus 38.6%). According to exposure category, it was higher in heterosexuals (42.4%) and injecting drug users (IDUs) (40.1%) than in men who have sex with men (MSM) (26.7%). In the Spanish patient group, in multivariate logistic regression analyses, adjusting for AR and year of diagnosis, men were more likely to have a DD (OR=1.49; 95%CI:1.21–1.85). Compared to younger patients (20–29 years), LD was more frequent in older: 30–39 years (OR=2.08; 95% CI:1.63–2.67), 40–49 years (OR=3.98; 95% CI:3.07–5.16) and >49 years (OR=6.77; 95% CI:5.10–9.00); and compared to MSM, was more frequent in heterosexuals (OR=1.75; 95% CI:1.43–2.15) and IDUs (OR=1.75; 95% CI:1.38–2.22). DD decreased from 2003 to 2007 (OR=1.38; 95% CI:1.08–1.76). The same associated factors were found in immigrants, but with different magnitude: stronger association with men, heterosexuals and IDUs, and weaker association with older age.
ConclusionsDD affects almost four in every ten newly diagnosed HIV-infected individuals, and is significantly more common among men, age group over 30 years, IDUs and heterosexuals. These are associated factors both in Spanish and immigrants, but in the last group the association is stronger. Strategies to increase the perception of risk among these groups are needed, as well as the implementation of the SINIVIH in the whole country to improve and to extend the information on DD.
La aparición del tratamiento antirretroviral de gran actividad (TARGA) cambió la historia natural de la infección por el virus de la inmunodeficiencia humana (VIH), modificando drásticamente la supervivencia y calidad de vida de las personas infectadas1. En un país como España, en el que el acceso a TARGA es gratuito y universal cuando se precisa2, el retraso del diagnóstico de la infección por el VIH supone una pérdida de oportunidad tanto desde el punto de vista individual como desde una perspectiva de salud pública. En el primer caso, el inicio tardío del tratamiento repercutirá negativamente en el grado de recuperación inmunológica alcanzado por el individuo3, así como en su mortalidad4. En el segundo, el riesgo de transmitir el virus será mayor cuanto más tiempo permanezca sin conocer su infección, al no adoptar comportamientos de menor riesgo, y mantener, sin tratamiento, una carga viral posiblemente elevada5,6. Por ello, la reducción del tiempo que pasa entre la infección y el diagnóstico del VIH es una prioridad de todos los programas de prevención del VIH/sida7,8, incluido el español9.
Existen diversos estudios sobre el retraso diagnóstico (RD) y su tendencia en los países industrializados10–14, aunque no siempre las definiciones utilizadas han sido las mismas15 por lo que es difícil comparar los resultados. En España se han publicado varios realizados en cohortes hospitalarias16–20. Aunque su valor es indudable, quienes aceptan formar parte de una cohorte suelen seleccionarse de una u otra forma, lo que puede limitar la validez externa de los resultados21. Por ello, paneles de expertos europeos han establecido que la vigilancia del VIH ha de descansar en sistemas de notificación con cobertura poblacional22,23. En nuestro país, se han publicado datos sobre RD de base poblacional en 2004 en el País Vasco24 y en Cataluña en 200525. Asimismo, en 2006 se publicó un estudio de este tipo cuya cobertura incluyó Canarias, La Rioja, Navarra, el País Vasco y la ciudad autónoma de Ceuta, es decir, un 11,5% del total de población26.
En este artículo se analiza la prevalencia de RD del VIH, su tendencia y los factores a él asociados, durante el periodo 2003–2007, a partir de los datos procedentes del Sistema de Información de Nuevos Diagnósticos de VIH (SINIVIH), en proceso de implantación en España, que actualmente cubre las siguientes comunidades autónomas (CCAA): Baleares, Canarias, Cataluña, Extremadura, Navarra, País Vasco, La Rioja, y la ciudad autónoma de Ceuta. El total de población incluida es de 14.157.108 personas, lo que supone un 32% del total de la población española.
MétodosSe ha incluido como «nuevo diagnóstico de VIH» todo aquel realizado en una persona no diagnosticada con anterioridad, y que cumplía los criterios analíticos establecidos en la definición implantada para comunicar las enfermedades transmisibles, con objeto de vigilancia epidemiológica, en todo el ámbito de la Unión Europea27.
A efectos del estudio, se definió como retraso diagnóstico todo caso que presentaba una cifra de linfocitos CD4 inferior a 200células/μl en el momento del diagnóstico de VIH. Se eligió este criterio porque señala un grado importante de inmunodepresión, con el consiguiente riesgo de desarrollar infecciones oportunistas28, y por ser uno de los más utilizados en la literatura15,29. No obstante, también se ha analizado el grupo de personas que presentaban entre 200–350 CD4 al diagnóstico, dado que estos pacientes también pueden ser subsidiarios de tratamiento antirretroviral.
Se incluyeron en el estudio todos los nuevos diagnósticos de VIH notificados a los sistemas de información de las CCAA de Baleares, Canarias, Cataluña, Extremadura, Navarra, País Vasco, La Rioja, y la ciudad autónoma de Ceuta durante el periodo 2003–2007. Aunque algunas de estas comunidades disponen de datos desde hace más de una década, solo a partir de 2003 se dispone de información en las 8 CCAA. Todas las CCAA han publicado, o están en proceso de publicar, decretos regulando la notificación de los nuevos diagnósticos de VIH. En 7 de ellas la declaración de los médicos se completa con búsqueda activa por parte del personal de vigilancia a partir de otras fuentes, incluidos los laboratorios correspondientes en 6. En conjunto, las CCAA participantes representan un 32% del total de población española y notifican un 34% del total de casos de sida.
La información contenida en las hojas de notificación incluye las siguientes variables: CCAA de notificación y fecha de esta, edad, sexo, año de diagnóstico, categoría de exposición al virus, país de origen y cifra de linfocitos CD4. La búsqueda y eliminación de duplicados se realizó en las CCAA y posteriormente los datos se enviaron al Centro Nacional de Epidemiología para su agregación y análisis conjunto.
Se ha realizado un análisis descriptivo según variables de persona, lugar y tiempo. Se utilizó la prueba de chi-cuadrado o pruebas exactas para la comparación de variables cualitativas y la t de Student o tests no paramétricos para las variables cuantitativas. Para evaluar la asociación entre 2 variables se usó la OR y su intervalo de confianza al 95% (IC 95%) y para el análisis multivariante de los factores asociados a retraso diagnóstico se ajustó un modelo de regresión logística. Para el análisis estadístico se utilizó el programa STATA (versión 10)30.
ResultadosEn total, durante el período de estudio se notificaron 5.785 nuevos diagnósticos de VIH (499 en Baleares, 644 en Canarias, 3.355 en Cataluña, 143 en Extremadura, 166 en Navarra, 807 en el País Vasco, 160 en La Rioja y 11 en Ceuta), lo que supone una tasa media del periodo de 86,14 nuevos diagnósticos por millón de habitantes. Del global de notificados, 987 (17,1%), no disponían de una cifra de CD4 al diagnóstico. El porcentaje de registros sin datos de CD4 disminuyó a lo largo del período de forma significativa, desde un 25,8% en 2003 a un 15,3% en 2007 (p<0,001).
No se apreciaron diferencias entre los pacientes que tenían y no tenían información sobre CD4, excepto en el porcentaje que supone la transmisión a través de la inyección intravenosa de drogas, que era mayor en el grupo sin información sobre CD4 (18,4% frente a 12,9, p<0,001).
De los 4.798 nuevos diagnósticos de VIH con información sobre CD4 al diagnóstico que constituyen la población de estudio, el 75,8% eran varones. La mediana de edad al diagnóstico fue de 35 años (RIC: 29–43), siendo significativamente menor en las mujeres que en los hombres (33 frente a 36 años). Respecto a la zona geográfica de origen, se observa un incremento en el porcentaje que suponen las personas con origen fuera de España, pasando de representar el 27,8% al inicio del período, a sumar el 36% en el año 2007 (tabla 1).
Características de los nuevos diagnósticos de VIH con información de CD4 al diagnóstico, según año de diagnóstico
| Características | Año de diagnóstico de VIH | |||||
| 2003 | 2004 | 2005 | 2006 | 2007 | Total | |
| n=959 (100%) | n=991 (100%) | n=947 (100%) | n=995 (100%) | n=906 (100%) | n=4.798 (100%) | |
| Sexo | ||||||
| Mujer | 238 (24,8) | 256 (25,8) | 232 (24,5) | 223 (22,4) | 214 (23,6) | 1.163 (24,2) |
| Hombre | 721 (75,2) | 735 (74,2) | 715 (75,5) | 772 (77,6) | 692 (76,4) | 3.635 (75,8) |
| Edad al diagnóstico de VIH (años)* | ||||||
| Todos | 35 (29–42) | 35 (29–42) | 36 (29–43) | 36 (29–43) | 36 (29–43) | 35 (29–43) |
| Mujer | 33 (27–40) | 33 (27–40) | 34 (27–41) | 32 (26–41) | 33 (26–42) | 33 (27–41) |
| Hombre | 36 (30–43) | 36 (30–42) | 37 (30–44) | 37 (30–44) | 36 (30–44) | 36 (30–44) |
| Modo de transmisión | ||||||
| HSH | 251 (26,2) | 300 (30,3) | 329 (34,7) | 363 (36,5) | 391 (43,2) | 1.634 (34,1) |
| UDIs | 166 (17,3) | 162 (16,4) | 118 (12,5) | 105 (10,6) | 70 (7,7) | 621 (12,9) |
| Hetero | 482 (50,3) | 465 (46,9) | 434 (45,8) | 460 (46,2) | 362 (40,0) | 2.203 (45,9) |
| Madre-hijo | 3 (0,3) | 3 (0,3) | 1 (0,1) | 2 (0,2) | 0 (0,0) | 9 (0,2) |
| Transfusión/hemoder | 0 (0,0) | 0 (0,0) | 1 (0,1) | 0 (0,0) | 0 (0,0) | 1 (0,0) |
| Desconocido/N.C | 57 (5,9) | 61 (6,2) | 64 (6,8) | 65 (6,5) | 83 (9,2) | 330 (6,9) |
| Zona geográfica de origen | ||||||
| España | 692 (72,2) | 646 (65,2) | 605 (63,9) | 605 (60,8) | 581 (64,1) | 3.129 (65,2) |
| Europa Occidental | 39 (4,1) | 50 (5,1) | 38 (4,0) | 42 (4,2) | 38 (4,2) | 207 (4,3) |
| Europa del Este | 19 (2,0) | 14 (1,4) | 18 (1,9) | 20 (2,0) | 20 (2,2) | 91 (1,9) |
| Latinoamérica | 93 (9,7) | 124 (12,5) | 143 (15,1) | 169 (17,0) | 167 (18,4) | 696 (14,5) |
| África Subsahariana | 88 (9,2) | 132 (13,3) | 107 (11,3) | 134 (13,5) | 80 (8,8) | 541 (11,3) |
| África del Norte | 22 (2,3) | 15 (1,5) | 22 (2,3) | 20 (2,0) | 13 (1,4) | 92 (1,9) |
| Otros/n.c | 6 (0,6) | 10 (1,0) | 14 (1,5) | 5 (0,5) | 7 (0,8) | 42 (0,9) |
| Linfocitos CD4 al diagnóstico | ||||||
| <200células/μl | 409 (42,7) | 368 (37,1) | 351 (37,1) | 357 (35,9) | 303 (33,4) | 1.788 (37,3) |
| 200–350células/μl | 165 (17,2) | 204 (20,6) | 175 (18,5) | 206 (20,7) | 161 (17,8) | 911 (19,0) |
| >350células/μl | 385 (40,2) | 419 (42,3) | 421 (44,5) | 432 (43,4) | 442 (48,8) | 2.099 (43,8) |
HSH: hombre que tienen relaciones sexuales con hombres; UDI: usuarios de drogas inyectadas; hetero: relaciones heterosexuales.
En conjunto, y para todo el período de estudio, 1.788 (37,3%) personas tenían una cifra de linfocitos CD4 por debajo de 200células/μl en el momento del diagnóstico, y un 19% adicional tenía entre 200–350células/μl. El porcentaje de RD era menor para las mujeres que para los hombres (32,9% frente a 38,6%), y según el modo de transmisión, mayor en heterosexuales (42,4%) y UDI (40,1%) que en HSH (26,7%). Según el origen, el retraso fue algo mayor en las personas de origen africano, tanto subsahariano (41,4%) como norteafricano (41,3%), que en las de origen español (37,6%). En cambio, fue algo inferior en los europeos del este (29,7%), europeos occidentales (34,8%) y latinoamericanos (34,1%) (tabla 2b).
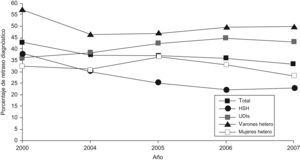
En cuanto a la tendencia, a lo largo del periodo de estudio, el porcentaje de retraso diagnóstico varía desde el 42,7% en 2003 hasta el 33,4% en 2007. Según el modo de transmisión, la tendencia descendente se observa en el colectivo HSH, que baja del 37,8% en 2003 al 23% en 2007. En cambio, la proporción permanece constante tanto en UDI como en heterosexuales (fig. 1).
En el análisis multivariante se puso de manifiesto la existencia de interacciones estadísticamente significativas entre origen del paciente (español/extranjero) y modo de transmisión y edad. Por ello, se ajustaron modelos separados de regresión logística, para los españoles y para los originarios de otros países. En los españoles la probabilidad de presentar RD aumenta en los varones (OR=1,49; IC95%:1,21–1,85), a partir de los 30 años (30–39 años frente a 20–29 años (OR=2,08; IC95%:1,63–2,67); 40–49 años frente a 20–29 años (OR=3,98; IC95%:3,07–5,16); mayores de 49 años frente 20–29 años (OR=6,77; IC95%:5,10–9,00) y, en comparación con los HSH, entre los UDI (OR=1,75; IC95%:1,38–2,22) y heterosexuales (OR=1,75; IC95%:1,43–2,15). Según el año de diagnóstico, el RD disminuyó casi un 40% desde 2003 hasta 2007 (OR=1,38; IC95%:1,08–1,76) (tabla 2a). En cuanto a los extranjeros, se encontraron los mismos factores asociados a RD que entre los españoles, pero la magnitud de las asociaciones con las distintas variables es diferente: así por ejemplo la asociación de RD con el sexo masculino o las categorías de transmisión UDI o heterosexuales es más fuerte en extranjeros, mientras que la asociación con la edad es más débil (tabla 2b).
Porcentaje de retraso diagnóstico (cifra de linfocitos CD4<200células/μl al diagnóstico de VIH) y análisis multivariante de los factores asociados en personas de origen español. Período 2003–2007. España, datos de 8 comunidades autónomas
| Características | Diagnósticos de VIH n | Retraso diagnóstico (%) | Análisis multivarante* | ||
| OR ajustado | IC 95% | p | |||
| Sexo | |||||
| Mujer | 632 | 33,5 | 1,00 | ||
| Hombre | 2.497 | 38,7 | 1,49 | 1,21–1,85 | 0,000 |
| Edad (años) | |||||
| 0–19 | 43 | 14,0 | 0,58 | 0,20–1,72 | 0,332 |
| 20–29 | 617 | 17,0 | 1,00 | ||
| 30–39 | 1.156 | 31,8 | 2,08 | 1,63–2,67 | 0,000 |
| 40–49 | 776 | 48,2 | 3,98 | 3,07–5,16 | 0,000 |
| >49 | 527 | 61,3 | 6,77 | 5,10–9,00 | 0,000 |
| Modo de transmisión | |||||
| HSH | 1.158 | 27,7 | 1,00 | ||
| UDIs | 517 | 40,0 | 1,75 | 1,38–2,22 | 0,000 |
| Hetero | 1.226 | 43,6 | 1,75 | 1,43–2,15 | 0,000 |
| Desconocido/N.C | 221 | 51,1 | 1,95 | 1,41–2,72 | 0,000 |
| Año de diagnóstico | |||||
| 2007 | 581 | 34,4 | 1,00 | ||
| 2006 | 605 | 37,0 | 1,06 | 0,82–1,37 | 0,675 |
| 2005 | 605 | 36,4 | 1,04 | 0,80–1,34 | 0,770 |
| 2004 | 646 | 37,2 | 1,15 | 0,90–1,49 | 0,266 |
| 2003 | 692 | 42,5 | 1,38 | 1,08–1,76 | 0,011 |
| Total | 3.129 | 37,6 | |||
HSH: hombre que tienen relaciones sexuales con hombres; UDI: usuarios de drogas inyectadas; hetero: relaciones heterosexuales.
Porcentaje de retraso diagnóstico (cifra de linfocitos CD4<200células/μl al diagnóstico de VIH) y análisis multivariante de los factores asociados en personas de origen extranjero. Período 2003–2007. España, datos de 8 comunidades autónomas
| Características | Diagnósticos de VIH n | Retraso diagnóstico (%) | Análisis multivarante* | ||
| OR ajustado | IC 95% | p | |||
| Sexo | |||||
| Mujer | 531 | 32,2 | 1,00 | ||
| Hombre | 1.138 | 38,6 | 1,78 | 1,38–2,31 | 0,000 |
| Edad (años) | |||||
| 0–19 | 27 | 22,2 | 0,72 | 0,25–2,04 | 0,546 |
| 20–29 | 557 | 27,1 | 1,00 | ||
| 30–39 | 706 | 40,1 | 1,73 | 1,34–2,23 | 0,000 |
| 40–49 | 284 | 42,6 | 1,76 | 1,28–2,43 | 0,001 |
| >49 | 95 | 51,6 | 2,41 | 1,51–3,88 | 0,000 |
| Modo de transmisión | |||||
| HSH | 476 | 24,4 | 1,00 | ||
| UDIs | 104 | 40,4 | 2,67 | 1,62–4,43 | 0,000 |
| Hetero | 977 | 40,7 | 2,95 | 2,16–4,05 | 0,000 |
| Desconocido/N.C | 109 | 47,7 | 3,17 | 1,93–5,24 | 0,000 |
| Año de diagnóstico | |||||
| 2007 | 325 | 31,7 | 1,00 | ||
| 2006 | 390 | 34,1 | 1,03 | 0,75–1,44 | 0,829 |
| 2005 | 342 | 38,3 | 1,27 | 0,91–1,78 | 0,162 |
| 2004 | 345 | 37,1 | 1,16 | 0,83–1,64 | 0,375 |
| 2003 | 267 | 43,1 | 1,50 | 1,05–2,14 | 0,025 |
| Zona de origen | |||||
| Europa Occidental | 207 | 34,8 | 1,00 | ||
| Europa del Este | 91 | 29,7 | 0,83 | 0,47–1,49 | 0,549 |
| Latinoamérica | 696 | 34,1 | 1,26 | 0,88–1,82 | 0,209 |
| Africa Subsahariana | 541 | 41,4 | 1,07 | 0,72–1,59 | 0,725 |
| Africa del Norte | 92 | 41,3 | 0,92 | 0,53–1,60 | 0,774 |
| Otros/n.c | 42 | 28,6 | 0,57 | 0,27–1,25 | 0,161 |
| Total | 1.669 | 36,5 | |||
HSH: hombre que tienen relaciones sexuales con hombres; UDI: usuarios de drogas inyectadas; hetero: relaciones heterosexuales.
En este estudio se presentan datos sobre RD de la infección por VIH, en una muestra que cubre el 32% del total de población española durante el periodo 2003–2007. Hasta la fecha este es el estudio de base poblacional más grande realizado en España sobre este tema, por lo que sus resultados son de gran interés para formular la política sanitaria en nuestro país. Un porcentaje ligeramente superior al 37% de las personas diagnosticadas de VIH por primera vez entre 2003–2007 presentaban un recuento de CD4 inferior a 200células/μl al diagnóstico. Si a esta cifra se une el 19% que presentaba entre 200–350células/μl al ser diagnosticado, nos encontramos con que más del 55% de las personas nuevamente diagnosticadas de VIH entre 2003–2007 en las CCAA participantes eran susceptibles de recibir tratamiento.
En comparación con otros estudios españoles, esta cifra es superior al 18% hallado en la cohorte VACH19 y similar al 35,6% de CoRis18, aunque en ambos casos la definición de RD incluyó, además del criterio inmunológico usado aquí, el diagnóstico simultáneo de VIH y sida; por el contrario, es inferior a las encontradas, utilizando la misma definición, en el estudio de Castilla et al (39,7% de RD) y en la cohorte PISCIS (43% de RD), pero en ambos casos el periodo de estudio es anterior al nuestro20,26. En comparación con otros países, nuestra cifra de RD es similar al 39% encontrado en Italia31 (estudio en el que también se incluye como RD el diagnóstico simultáneo de sida), mayor que el 31% encontrado en el Reino Unido29, con una definición similar, y menor que el 49% y el 58% encontrados respectivamente los Estados Unidos32 y Hong Kong33 también usando la misma definición.
La relación del RD con el sexo masculino, la edad y la transmisión heterosexual o entre UDI se observa tanto en españoles como en extranjeros, aunque con magnitudes diferentes, y también se ha hallado en otros estudios en nuestro país y fuera de él. El mayor RD hallado en los hombres se explica en los países industrializados por la implantación generalizada del screening prenatal para el VIH desde hace ya tiempo. Datos procedentes del Reino Unido muestran que, incluso ajustando por edad, la mediana de CD4 al diagnóstico de VIH en mujeres embarazadas es significativamente mayor que en mujeres diagnosticadas en otras unidades, y también es mayor que en hombres heterosexuales29. El hecho de que, en nuestro estudio, los hombres extranjeros sufran mayor retraso frente a las mujeres extranjeras que los españoles frente a las españolas, apoyaría esta interpretación puesto que, en España, las mujeres procedentes de otros países tienen un mayor número de hijos que las españolas34.
La asociación del RD con la edad es también ya conocida13,18,19,26,31–33,35,36. Varias son las explicaciones que se han dado para este hallazgo. La más utilizada argumenta que hay una menor percepción del riesgo y frecuentación de la prueba conforme aumenta la edad26,36. Otra posible explicación se relaciona con la historia natural de la enfermedad, que evolucionaría, clínica e inmunológicamente, de forma más rápida en los pacientes de mayor edad36. Es posible que ambas explicaciones sean válidas. Pero también podría ser que, al menos parte de las diferencias, sean un artefacto. Se puede argumentar que inevitablemente el RD será menor en los jóvenes: al existir una correlación entre edad y duración de la infección, los jóvenes, como grupo, han vivido menos años tras la infección, y por tanto han tenido menos posibilidad de desarrollar RD que los mayores10,36. El hecho de que el efecto de la edad en los extranjeros sea menor que en los españoles en este estudio apoyaría esta explicación, puesto que en los países de prevalencia más alta las personas probablemente se infectan antes, y por ello las diferencias entre las cohortes de nacimiento tienden a diluirse.
El RD se asocia a adquisición del VIH por contacto heterosexual, un hallazgo común en otros estudios, españoles y de otros países desarrollados18,19,33,35. La explicación más lógica de este hecho es la falta de percepción del riesgo entre sanitarios y pacientes. Existe evidencia de que, entre las personas con nuevo diagnóstico de VIH, aunque la conciencia de tener prácticas de riesgo es alta, la autopercepción del riesgo de estar infectado antes de hacerse la prueba es mucho menor37. De esta forma, la existencia de un acceso razonable al sistema sanitario no sería suficiente para la disminución de la fracción de RD.
Aunque hay que resaltar que los inmigrantes en España son un grupo muy diverso, tanto en cuanto a su procedencia como en cuanto a su patrón epidemiológico respecto de la infección por VIH, una parte relevante de ellos proviene de países donde los heterosexuales están muy afectados por la infección; por ello sorprende que la asociación entre vía de transmisión heterosexual y RD sea aún más fuerte entre ellos. Es posible que, en su caso, amén de la percepción del riesgo, también tengan un papel importante factores como el estigma, las barreras lingüísticas o de acceso al sistema sanitario, o bien es posible que los inmigrantes heterosexuales tengan peor acceso a la información sobre VIH. Un resultado llamativo es la mayor probabilidad de RD entre UDI puesto que en España tanto ellos como los sanitarios son muy conscientes de su riesgo. La explicación a este hecho podría ser doble. Es posible que, como se ha visto en otros países13,38 los UDI tarden más tiempo que otros pacientes en iniciar su seguimiento médico tras ser diagnosticados, por lo que más que de RD habría que hablar de un retraso en el inicio del seguimiento. Otra explicación alternativa para el mayor RD hallado en UDI es que se trate de un grupo «especial» de usuarios, infectado hace ya tiempo, que emerge ahora, y cuya percepción del riesgo es menor por parte de ellos y de los sanitarios.
Este estudio presenta algunas limitaciones. En primer lugar, el número de registros sin información sobre CD4 no es desdeñable, y además los UDI están sobre- representados en el grupo sin información. Podría ser que los pacientes sin información tuvieran mayor probabilidad de tener RD, en cuyo caso se habría subestimado el RD para los UDI en nuestro trabajo. No obstante, hay que resaltar que el porcentaje sin información disminuye a lo largo del periodo, y que la cumplimentación de esta variable (83%) es una de las mejores en los sistemas de vigilancia de Europa39. Otra limitación es que no se ha evaluado formalmente la existencia o no de subnotificación, aunque en las 2 comunidades donde sí se ha hecho la cobertura del sistema de vigilancia fue superior al 95% en ambos casos40. Por lo demás, es obvio que, para no subestimar la incidencia de nuevos diagnósticos de VIH, es esencial que la cobertura de los sistemas de vigilancia epidemiológica sea buena; sin embargo, a efectos de estimación de RD la posible sub-notificación no necesariamente introduciría un sesgo, puesto que no parece probable que los notificadores sean más proclives a declarar un nuevo diagnóstico en función de su mayor o menor RD. Finalmente hay que señalar que, en sentido estricto, los resultados solo son extrapolables a la población de estudio. Esperamos que la consolidación progresiva del SINIVIH en España nos permita en unos años poder presentar datos para todo el país.
En conclusión, este estudio pone de relieve que el RD de la infección por VIH afecta a casi 4 de cada 10 nuevos diagnósticos de VIH y que no se distribuye aleatoriamente: los varones, los mayores de 30 años, los UDI y las personas que se infectaron por contacto heterosexual son más susceptibles de sufrir RD. Esto se aprecia tanto en españoles como en extranjeros, pero entre estos últimos el efecto es aún mayor, lo que sugiriere que la mayor vulnerabilidad social de los inmigrantes acentúa aún más la desigualdad en estos grupos.
En vista de estos datos habría que considerar una serie de medidas de salud pública: a) realizar acciones para aumentar la percepción del riesgo entre quienes tienen conductas de riesgo, en particular los hombres, los heterosexuales y las personas de más edad; b) «normalizar» la prueba del VIH en el ámbito sanitario, de forma que se prescriba siempre que haya conductas de riesgo; c) ofertar la prueba a todo el que consulte por infecciones de transmisión sexual, tuberculosis, buscando contracepción, y en los programas de atención a usuarios de drogas; d) mejorar la accesibilidad y aceptabilidad de la prueba del VIH para las personas con mayores dificultades sociales, en particular los inmigrantes y las poblaciones más estigmatizadas; e) evaluar si los UDI tienen problemas de RD o de acceso al seguimiento; f) implantar el SINIVIH en todo el país para mejorar y ampliar la información sobre RD.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.