La disfagia sarcopénica, definida como la disfagia causada por la sarcopenia, es un trastorno de la deglución de gran interés para la comunidad médica. El objetivo de nuestro trabajo fue evaluar la prevalencia y los factores asociados con disfagia sarcopénica en adultos mayores institucionalizados.
Material y métodosEstudio observacional, analítico, transversal, realizado en un hogar geriátrico entre septiembre y diciembre del 2017, con 100 participantes. Se valoró la presencia de disfagia mediante el método de exploración clínica volumen-viscosidad y se siguió el algoritmo diagnóstico para disfagia sarcopénica. Se evaluó fuerza de agarre, velocidad de la marcha, perímetro de pantorrilla, evaluación nutricional (Mini Nutritional Assessment), índice de Barthel, evaluación cognitiva (Mini-Mental State Examination) e índice de comorbilidad de Charlson. Se realizaron análisis bivariados y multivariados de regresión logística.
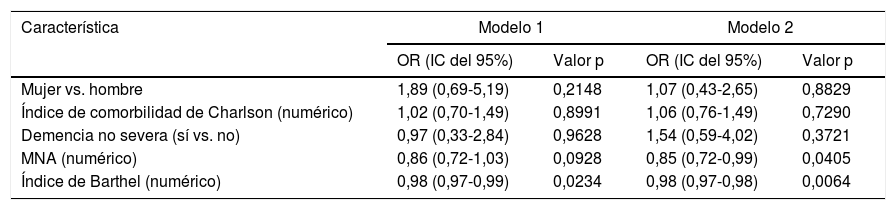
ResultadosLa mediana de edad fue de 84 años y el 55% eran mujeres. El 48% presentó dependencia funcional, el 49% tenía cribado positivo para desnutrición y el 64% tuvo algún grado de disfagia. La prevalencia de disfagia sarcopénica fue del 45% y los principales factores relacionados con menos disfagia sarcopénica fueron un buen estado nutricional (OR = 0,85, IC del 95%, 0,72-0,99) y un mejor estado funcional (OR = 0,98, IC del 95%, 0,97-0,98).
ConclusiónLa disfagia sarcopénica tiene una alta prevalencia en adultos mayores institucionalizados y las variables asociadas fueron la dependencia funcional y un pobre estado nutricional.
Sarcopenic dysphagia, defined as dysphagia caused by sarcopenia, is a swallowing disorder of great interest to the medical community. The objective of our study was to evaluate the prevalence and factors associated with sarcopenic dysphagia in institutionalised older adults.
Material and methodsAn observational, analytical, cross-sectional study was conducted in a nursing home between September and December 2017, with 100 participants. The presence of dysphagia was assessed using the volume-viscosity clinical examination method, and the diagnostic algorithm for sarcopenic dysphagia was followed. The participants’ grip strength, gait speed, calf circumference, nutritional assessment (Mini Nutritional Assessment), Barthel Index, cognitive assessment (Mini-Mental State Examination) and Charlson Comorbidity Index were evaluated. Bivariate and multivariate logistic regression analyses were performed.
ResultsThe median age was 84 years, and 55% were women; 48% had functional dependence, 49% had positive screening for malnutrition and 64% had some degree of dysphagia. The prevalence of sarcopenic dysphagia was 45%, and the main factors related to less sarcopenic dysphagia were a good nutritional status (OR 0.85, 95% CI, 0.72-0.99) and a better functional performance status (OR 0.98, 95% CI 0.97-0.98).
ConclusionSarcopenic dysphagia has a high prevalence in institutionalised older adults; and functional dependence and poor nutritional status were associated with sarcopenic dysphagia.
La disfagia orofaríngea es definida como un trastorno de la motilidad gastrointestinal que provoca dificultad o imposibilidad para desplazar el bolo alimentario con seguridad de la boca al estómago1. Un factor asociado con la disfagia es la sarcopenia, definida según el consenso europeo del año 2018 en función de la fuerza muscular (sarcopenia probable) y para confirmar su diagnóstico existe un algoritmo establecido que involucra además la evaluación de la cantidad o calidad muscular (sarcopenia confirmada) y el rendimiento físico (sarcopenia severa)2.
Los trastornos de la deglución son un problema emergente y se han convertido en uno de los retos más importantes de la geriatría. La prevalencia de disfagia en los adultos mayores (AM) es alta3, afecta a alrededor del 27% de los AM que viven en comunidad4, llegando hasta el 47,4% en los AM ingresados en una Unidad Geriátrica de Agudos según un estudio realizado por Carrión et al.3 y aumenta hasta el 51% en los AM institucionalizados según un estudio realizado por Lin et al.5 en una unidad de larga estancia en Taiwán.
La disfagia genera gran impacto en la salud y causa complicaciones nutricionales y respiratorias asociadas con hospitalización, readmisiones hospitalarias, institucionalización, mala calidad de vida y mortalidad3-6. Sin embargo, por el desconocimiento de esta condición en muchas ocasiones no es diagnosticada ni tratada y solo una minoría de los AM reciben un diagnóstico y tratamiento adecuado7,8.
Tanto la disfagia como la sarcopenia han sido incluidos en la Clasificación Internacional de Enfermedades (CIE-10) como enfermedades independientes (R 13 y M 62,84 respectivamente)9 y en los años recientes se ha reportado la relación entre estas 2condiciones10-12. Recientemente, Zhao et al.13, en un metaanálisis, documentaron que el riesgo de disfagia es mayor en pacientes con sarcopenia comparados con quienes no tienen sarcopenia (odds ratio [OR] = 4,06, intervalo de confianza (IC) del 95%, 2,27-7,29).
Es así como surge el concepto de disfagia sarcopénica en el año 2012, descrito por primera vez por Kuroda y Kuroda14, quienes, en su estudio realizado en Saint Francis Hospital, en Japón, establecieron una correlación entre la circunferencia del brazo (como indicador de desnutrición) y la función deglutoria. Se define como la disfagia que es causada por sarcopenia que afecta a todos los músculos del cuerpo incluidos los músculos relacionados con la deglución. En el año 2014, los mismos autores plantean los criterios diagnósticos y son Mori et al.15, en el año 2017, publican el algoritmo diagnóstico que incluye la medición de sarcopenia y la valoración de la función deglutoria. En él se establece que se deben excluir los casos donde se sospeche que la disfagia es secundaria a otra etiología y se descarta el diagnóstico si la sarcopenia no está presente15.
La disfagia sarcopénica se ha convertido en un tema de gran interés para la comunidad médica y científica en los últimos años. Hay casos reportados de disfagia sarcopénica después de eventos agudos como cirugía de cáncer pulmonar16 o glosectomía17. Su diagnóstico es importante ya que su presencia aumenta el riesgo de complicaciones relacionadas, como neumonía por aspiración, deshidratación y desnutrición18. La neumonía por aspiración incluso puede ser catalogada como consecuencia de la disfagia sarcopénica, implicando deterioro en la calidad de vida y aumento de costos en salud19. En la población de los AM institucionalizados encontramos habitualmente mayor dependencia, sarcopenia, morbilidad y presencia de enfermedades neurológicas y degenerativas que podrían causar disfagia8. A pesar de esto, en la literatura no existen estudios que evalúen la prevalencia y factores asociados con disfagia sarcopénica en esta población.
Lo descrito con anterioridad motivó el objetivo de este estudio, que fue establecer la prevalencia y los factores asociados con disfagia sarcopénica en una población de AM institucionalizados.
Material y métodosPoblación y diseñoEstudio observacional, analítico, transversal, realizado en un hogar geriátrico entre septiembre y diciembre del 2017. Para la muestra se consideró un total de N=250 historias clínicas de residentes del hogar geriátrico, se estimaron según la literatura una prevalencia de P (50%), margen de error d (7,5%) y un nivel de confianza del 95%, para un tamaño estimado de n=101 participantes. Para calcular el tamaño de la muestra se empleó el programa Estadístico EpiInfo versión 6 (Centers for Disease Control and Prevention, Atlanta, Georgia, EE. UU.).
El estudio de Mori et al.15 incluyó a pacientes de 65 años o más que podían seguir las órdenes, por lo que en nuestro estudio se eligió a 100 participantes por medio de muestreo aleatorio simple, quienes debían tener ≥ 65 años, tuvieran la capacidad de seguir órdenes y fueran capaces de completar la valoración funcional y de función deglutoria. En nuestro estudio no incluimos en la muestra inicial a participantes con diagnóstico de demencia severa ya que en estos participantes no era posible garantizar una valoración completa por medio del algoritmo por la imposibilidad para seguir órdenes.
Después de obtener el consentimiento informado, se procedió a diligenciar el cuestionario por los integrantes del equipo interdisciplinario del hogar geriátrico conformado por médicos residentes de geriatría y medicina familiar, fonoaudiología, fisioterapia, nutrición, enfermería y psicología. El protocolo del estudio fue aprobado por el comité de ética del Hospital Geriátrico Ancianato San Miguel en Cali, Colombia.
Variables de estudioDesenlaceDisfagia sarcopénica en los AM institucionalizados.
Diagnóstico de disfagia sarcopénicaLa presencia de disfagia y sarcopenia son criterios de diagnóstico necesarios para la disfagia sarcopénica, pero no son criterios suficientes. La sarcopenia puede ser causada por condiciones como la edad, la inactividad, la desnutrición y enfermedades que incluyen inflamación aguda y crónica, además enfermedades neuromusculares, por lo cual si están presentes se debe establecer que la sarcopenia es la principal causa de la disfagia y no las otras etiologías presentes. En la tabla 1 se describen los criterios diagnósticos de disfagia sarcopénica15.
Criterios diagnósticos de consenso para la disfagia sarcopénica
| 1) Presencia de disfagia |
| 2) Presencia de sarcopenia de cuerpo entero (pérdida generalizada de masa y fuerza del músculo esquelético) |
| 3) Los resultados de las pruebas de imagen (tomografía computarizada, resonancia magnética, ecografía) son compatibles con una pérdida de masa muscular para la deglución |
| 4) Se excluyen las causas de la disfagia excepto la sarcopenia |
| 5) Se considera que la principal causa de disfagia es la sarcopenia (si existen otras causas de disfagia como accidente cerebrovascular, lesión cerebral, enfermedades neuromusculares, cáncer de cabeza y cuello, y enfermedades del tejido conectivo. |
| Diagnóstico definitivo: 1, 2, 3, 4 |
| Diagnóstico probable: 1, 2, 4 |
| Diagnóstico posible: 1, 2, 5 |
Fuente Mori et al.15.
En el estudio de Mori et al.15 los autores plantean un algoritmo abreviado cuando no es posible tener un instrumento para medir la fuerza de la lengua, lo que sucede con frecuencia. Este evalúa la presencia de sarcopenia y disfagia. Así los pacientes con sarcopenia, alteración de la función deglutoria y sin una enfermedad causal evidente de disfagia pueden diagnosticarse como posible disfagia sarcopénica sin medir la presión de la lengua.
Los autores evaluaron sarcopenia según los criterios establecidos por el Asian Working Group for Sarcopenia (AWGS), teniendo en cuenta la fuerza de agarre y velocidad de la marcha15. En nuestro estudio se adaptaron estos criterios y se incluyó además la medición del perímetro de pantorrilla, el cual se encuentra validado en el conceso de la AWGS2 y fue utilizado en el estudio de Mori et al. en casos donde no se tenían disponibles estudios más avanzados para valoración de la composición corporal como la absorciometría de rayos X de energía dual (DXA) o la bioimpedancia eléctrica (BIA).
La valoración de la función deglutoria se realizó mediante el método de exploración clínica volumen-viscosidad. Esta prueba fue realizada por una fonoaudióloga entrenada en trabajar con AM. Esta prueba valora la eficacia (capacidad del paciente de ingerir la totalidad de las calorías y el agua que necesita para estar bien nutrido e hidratado) y la seguridad (el riesgo de complicaciones respiratorias) de la deglución. Utiliza 3viscosidades y 3volúmenes diferentes. Obtiene información sobre la viscosidad y el volumen más seguro para cada paciente. Tiene una sensibilidad diagnóstica del 88,1% para las alteraciones de la seguridad y del 89,8% para las alteraciones de la eficacia deglutoria20. El objetivo es identificar signos clínicos de una eficacia disminuida, como el sellado labial deteriorado, los residuos orales o faríngeos y la deglución fraccionada (múltiples degluciones por bolo) y signos clínicos de una seguridad deteriorada durante la deglución, como cambios en la calidad de la voz (incluida la voz húmeda), tos o disminución de la saturación de oxígeno en un 3%, medido con pulsioxímetro para detectar aspiraciones silenciosas21. Este procedimiento requiere que el paciente esté alerta, tolere la sedestación y obedezca órdenes. Fue diseñado para proteger a los pacientes de la aspiración, comenzando con la viscosidad néctar y aumentando los volúmenes de 5ml a 10ml y 20ml en una progresión de dificultad creciente. Cuando los pacientes completaron la serie de néctar sin síntomas de aspiración (tos o caída de la saturación de oxígeno 3%), se evaluó una serie de viscosidad líquida, también con volúmenes de dificultad creciente (5ml a 20ml) y, finalmente, una serie de viscosidad pudín (5ml a 20ml) fue evaluado de la misma manera. Uno o más signos de alteración de seguridad o eficacia indicaron que el paciente presentaba disfagia22. Establecimos una clasificación del grado de disfagia según el número de alteraciones en la seguridad y la eficacia encontradas durante la prueba:
- 1.
Disfagia leve: 1 o 2 signos de eficacia y seguridad alterados.
- 2.
Disfagia moderada: entre 3 a 4 signos de eficacia y seguridad alterados.
- 3.
Disfagia severa: entre 5 a 6 signos de eficacia y seguridad alterados.
Mori et al., como punto final de su algoritmo abreviado, excluyeron a los pacientes que tenían una enfermedad que era la causa obvia de la disfagia; sin embargo, los participantes que tenían enfermedades en quienes se considerara que la edad, la capacidad funcional, la nutrición o la sarcopenia fuera la causa, no fueron excluidos15.
CovariablesSe recogió información de datos sociodemográficos y variables biológicas, mentales y funcionales. Se incluyeron en los análisis la edad, el sexo y las variables conocidas que pudieran afectar el desenlace. Para la valoración del estado funcional se utilizó el índice de Barthel (IB) que evalúa 10 actividades básicas de la vida diaria asignando un valor predeterminado para la autonomía/independencia23. La puntuación varía de 0 a 100, siendo 0 la máxima dependencia y 100 la independencia total. El IB se usó como variable categórica (< 60 o dependiente vs. ≥ 60 o independiente).
El estado cognitivo se evaluó con la escala del examen mínimo mental (Mini-Mental State Examination)24. Los participantes se agruparon, según el puntaje, como normal (≥ 24), leve (19 a 23), moderado (14 a 18) y severo (< 14). Los pacientes con puntuación menor a 14 fueron excluidos del estudio.
Para la comorbilidad se empleó el índice de Charlson, que se analizó como variable categórica. Para esta última se determinó el punto de corte de la mediana del índice en esta población y se estableció con y sin comorbilidad 0-4 y> 4, respectivamente25.
Para evaluar la velocidad de la marcha, la distancia tomada fue de 3 m y el tiempo se midió con un cronómetro digital. Se realizaron 2pruebas y se tomó el mejor valor.
La fuerza de agarre se midió utilizando un dinamómetro de mano (Jamar Hydraulic Hand Dynamometer®, Patterson Medical Ltd., Warrenville, Illinois, EE. UU.). A todos los pacientes se les realizó la prueba en bipedestación con los miembros superiores en aducción. Se realizó la prueba 2veces y se tomó el mejor valor obtenido. Se estableció como punto de corte los valores según el algoritmo utilizado por Mori et al.15, 26 kg para hombres y 18 kg para mujeres.
El perímetro de la pantorrilla se evaluó en posición sentada con ambos pies firmes sobre el suelo formando con este un ángulo de 90°, la medida se realizó en el punto más ancho de la pantorrilla, y se tomaron mediciones adicionales por encima y por debajo para asegurarse que la primera medida era la mayor. Se estableció como punto de corte 31cm según la definición del consenso europeo de sarcopenia2.
Para evaluar el estado nutricional se empleó el cribado del Mini Nutritional Assessment (MNA). Esta es una herramienta que permite valorar el estado nutricional e identificar pacientes con riesgo o signos de desnutrición. Categoriza el estado nutricional según la puntuación: entre 0-7 puntos malnutrición, entre 8 a 11 puntos riesgo de malnutrición y entre 12 y 14 estado nutricional normal26.
Análisis estadísticoSe realizó análisis exploratorio y descriptivo. Se estimaron proporciones (%) para las variables categóricas. Para las variables continuas se emplearon medianas con rangos intercuartiles (RIC). Para el análisis bivariado entre las variables independientes con la variable de 3 categorías (disfagia sarcopénica, disfagia no sarcopénica y otro), se emplearon la prueba de la chi al cuadrado o la prueba de Fisher según el cas; para las variables categóricas y el análisis de varianza no paramétrica (prueba de Kruskal-Wallis) para las variables cuantitativas.
Se realizaron 2modelos multivariados de regresión logística para determinar la asociación entre disfagia con las variables que tuvieron significación estadística en el análisis bivariado así:
- –
Modelo 1: variable dependiente disfagia sarcopénica dicotómica – (1=disfagia sarcopénica vs. 0=disfagia no sarcopénica o no disfagia)
- –
Modelo 2: variable dependiente disfagia sarcopénica ordinal (1=no disfagia; 2=disfagia no sarcopénica; 3=disfagia sarcopénica).
Así se obtuvieron las OR con su respectivo IC del 95%. Todos los análisis se hicieron en el programa estadístico SAS versión 9.4 para Windows (SAS Institute, Inc., Cary, NC, EE. UU.); el nivel de significación estadística seleccionado fue p<0,05, para la prueba de 2colas.
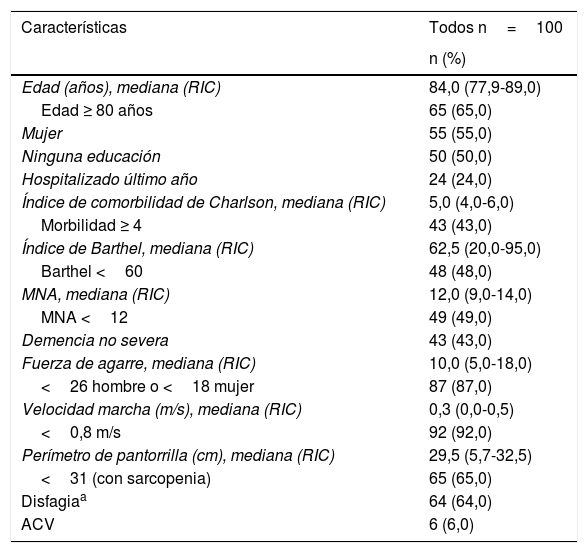
ResultadosLas características generales de la población se muestran en la tabla 2. La mediana de edad fue de 84 años con RIC de 77,9 a 89 años. Los AM ≥ 80 años correspondieron al 65% de la población y el 55% fueron mujeres. La mediana del índice de comorbilidad de Charlson fue de 5 puntos con RIC de 4 a 6 puntos. Con respecto al IB, la mediana fue 62,5 puntos con RIC de 20 a 95 puntos. El 48% presentó dependencia funcional. Con respecto al estado nutricional, la mediana del MNA fue de 12 puntos con RIC de 9 a 14 puntos. El 49% tenía puntuación menor de 12. Evaluando la función cognitiva, el 43% presentaba demencia en cualquier grado excluidos los AM con demencia severa.
Características generales de la población
| Características | Todos n=100 |
|---|---|
| n (%) | |
| Edad (años), mediana (RIC) | 84,0 (77,9-89,0) |
| Edad ≥ 80 años | 65 (65,0) |
| Mujer | 55 (55,0) |
| Ninguna educación | 50 (50,0) |
| Hospitalizado último año | 24 (24,0) |
| Índice de comorbilidad de Charlson, mediana (RIC) | 5,0 (4,0-6,0) |
| Morbilidad ≥ 4 | 43 (43,0) |
| Índice de Barthel, mediana (RIC) | 62,5 (20,0-95,0) |
| Barthel <60 | 48 (48,0) |
| MNA, mediana (RIC) | 12,0 (9,0-14,0) |
| MNA <12 | 49 (49,0) |
| Demencia no severa | 43 (43,0) |
| Fuerza de agarre, mediana (RIC) | 10,0 (5,0-18,0) |
| <26 hombre o <18 mujer | 87 (87,0) |
| Velocidad marcha (m/s), mediana (RIC) | 0,3 (0,0-0,5) |
| <0,8 m/s | 92 (92,0) |
| Perímetro de pantorrilla (cm), mediana (RIC) | 29,5 (5,7-32,5) |
| <31 (con sarcopenia) | 65 (65,0) |
| Disfagiaa | 64 (64,0) |
| ACV | 6 (6,0) |
ACV=historia de accidente cerebrovascular; RIC: rango intercuartil.
Se documentó en fuerza de agarre una mediana de 10kg con RIC de 5 a 18kg y fuerza de agarre disminuida en el 87% de los AM. Con relación a la velocidad de la marcha la mediana fue 0,3 m/s, con RIC de 0 a 0,5 m/s, y el 92% de los AM presentó velocidad de la marcha disminuida. La mediana del perímetro de pantorrilla fue de 29,5cm con RIC de 25,7 a 32,5cm, y el 65% de los AM presentaron un perímetro<31cm.
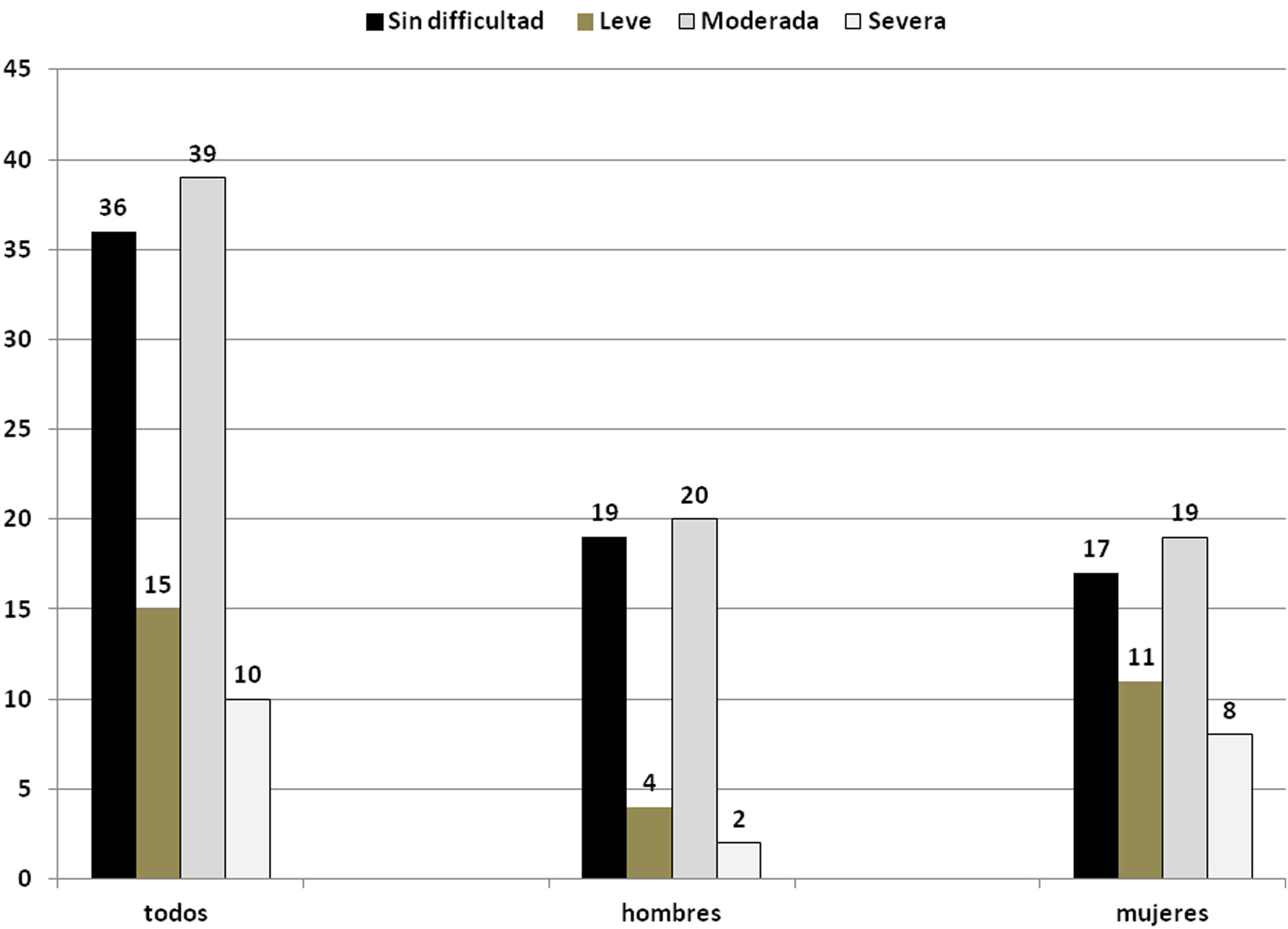
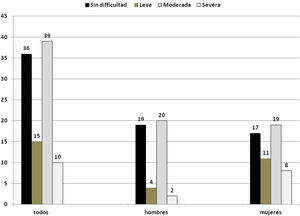
En cuanto a la valoración de la función deglutoria, el 64% tuvo algún grado de disfagia; de estos, el 15% fue clasificada como disfagia leve, el 39% disfagia moderada y el 10% disfagia severa. Sin dificultad se consideró como no disfagia (fig. 1) Por sexo, no hubo diferencia significativa en las categorías (prueba de Fisher p=0,12).
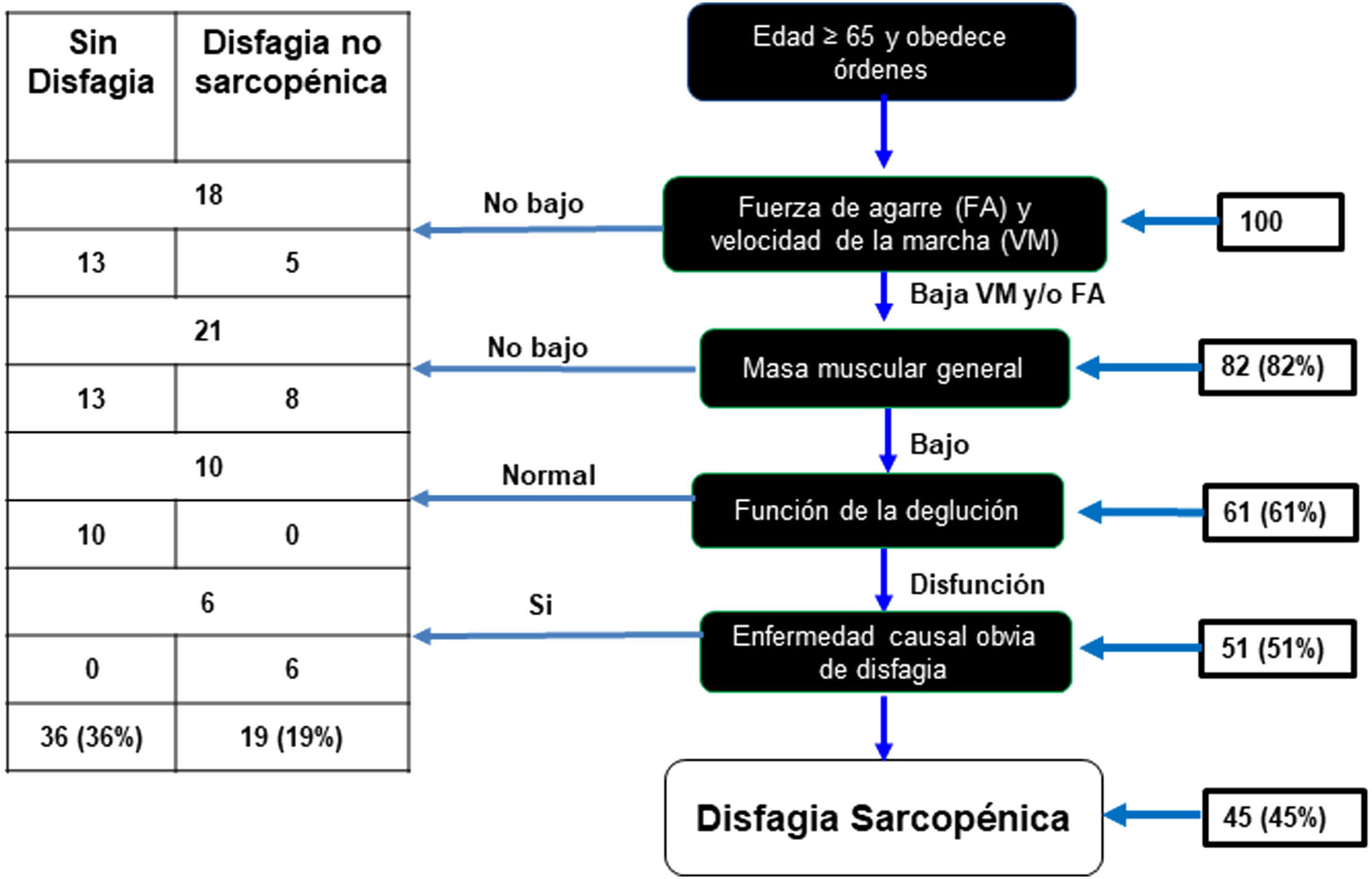
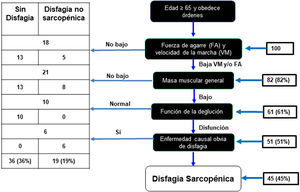
De la muestra de 100 AM, 82 presentaron baja fuerza de agarre y velocidad de la marcha. De estos, 61 AM tuvieron baja masa muscular evaluada con perímetro de pantorrilla, de los cuales al realizar la prueba de volumen viscosidad para valorar la función deglutoria, 51 presentaron disfagia en cualquier grado, y de estos se excluyó a 6 porque al realizar el análisis de cada caso se consideró que presentaban otra causa de disfagia (antecedentes de ACV). Como resultado hubo una prevalencia de disfagia sarcopenia del 45% (fig. 2). También se encontró que el 36% no presentó disfagia y el 19% presentó disfagia no sarcopénica.
Algoritmo diagnóstico para disfagia sarcopénica.
Modificado de Mori et al.15.
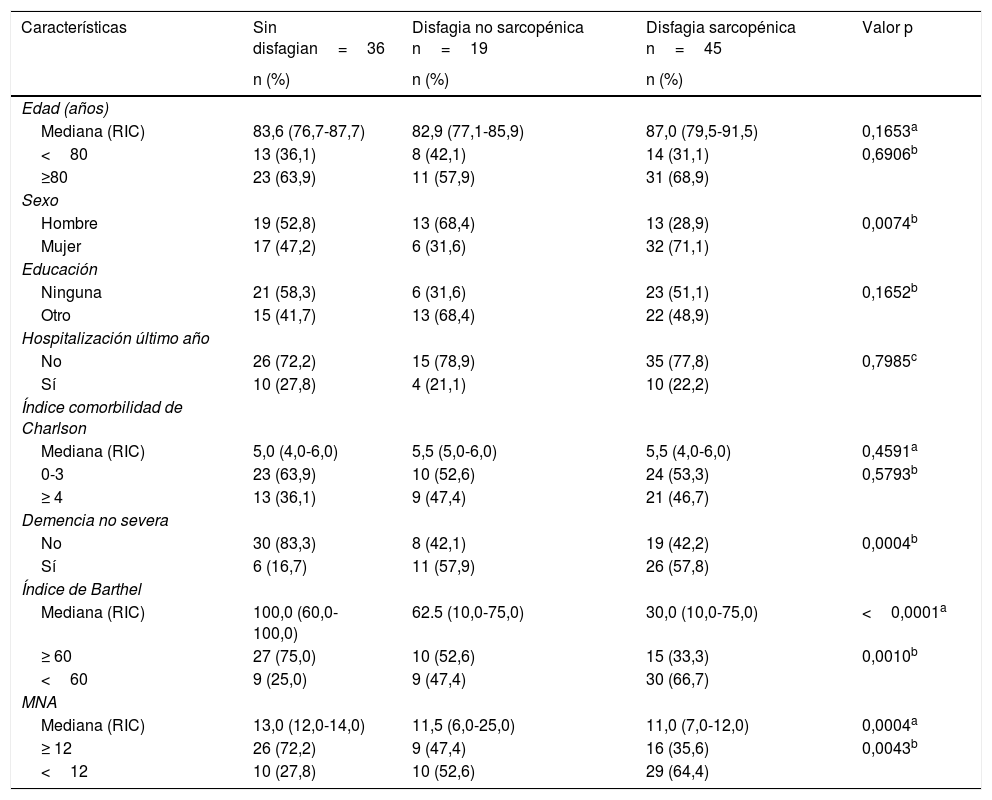
En los análisis bivariados, los pacientes con disfagia sarcopénica se caracterizaron por ser mujeres, presentar demencia no severa, mayor discapacidad física evaluada por el IB y tener riesgo de malnutrición (tabla 3).
Análisis bivariado según la presencia de disfagia sarcopénica
| Características | Sin disfagian=36 | Disfagia no sarcopénica n=19 | Disfagia sarcopénica n=45 | Valor p |
|---|---|---|---|---|
| n (%) | n (%) | n (%) | ||
| Edad (años) | ||||
| Mediana (RIC) | 83,6 (76,7-87,7) | 82,9 (77,1-85,9) | 87,0 (79,5-91,5) | 0,1653a |
| <80 | 13 (36,1) | 8 (42,1) | 14 (31,1) | 0,6906b |
| ≥80 | 23 (63,9) | 11 (57,9) | 31 (68,9) | |
| Sexo | ||||
| Hombre | 19 (52,8) | 13 (68,4) | 13 (28,9) | 0,0074b |
| Mujer | 17 (47,2) | 6 (31,6) | 32 (71,1) | |
| Educación | ||||
| Ninguna | 21 (58,3) | 6 (31,6) | 23 (51,1) | 0,1652b |
| Otro | 15 (41,7) | 13 (68,4) | 22 (48,9) | |
| Hospitalización último año | ||||
| No | 26 (72,2) | 15 (78,9) | 35 (77,8) | 0,7985c |
| Sí | 10 (27,8) | 4 (21,1) | 10 (22,2) | |
| Índice comorbilidad de Charlson | ||||
| Mediana (RIC) | 5,0 (4,0-6,0) | 5,5 (5,0-6,0) | 5,5 (4,0-6,0) | 0,4591a |
| 0-3 | 23 (63,9) | 10 (52,6) | 24 (53,3) | 0,5793b |
| ≥ 4 | 13 (36,1) | 9 (47,4) | 21 (46,7) | |
| Demencia no severa | ||||
| No | 30 (83,3) | 8 (42,1) | 19 (42,2) | 0,0004b |
| Sí | 6 (16,7) | 11 (57,9) | 26 (57,8) | |
| Índice de Barthel | ||||
| Mediana (RIC) | 100,0 (60,0-100,0) | 62.5 (10,0-75,0) | 30,0 (10,0-75,0) | <0,0001a |
| ≥ 60 | 27 (75,0) | 10 (52,6) | 15 (33,3) | 0,0010b |
| <60 | 9 (25,0) | 9 (47,4) | 30 (66,7) | |
| MNA | ||||
| Mediana (RIC) | 13,0 (12,0-14,0) | 11,5 (6,0-25,0) | 11,0 (7,0-12,0) | 0,0004a |
| ≥ 12 | 26 (72,2) | 9 (47,4) | 16 (35,6) | 0,0043b |
| <12 | 10 (27,8) | 10 (52,6) | 29 (64,4) |
Valores de p buscando diferencias en cada variable a través de las 3 categorías (otros, disfagia no sarcopénica y disfagia sarcopénica), obtenidos por las pruebas de ANOVA no paramétrica (Kruskall-Wallis), chi al cuadrado y prueba exacta de Fisher.
MNA: Mini Nutritional Assessment; RIC: rango intercuartil.
En los análisis multivariados, se realizaron análisis de regresión logística ajustada con las variables que tuvieron un valor p<0,15 en análisis bivariados y agregamos comorbilidad, la cual es una condición importante de acuerdo con la evidencia existente1, y con el objetivo de determinar la asociación de variables independientes con la variable dependiente (disfagia sarcopénica). Se evaluaron 2modelos de regresión logística multivariada (tabla 4). Según el cual por cada punto en el IB se disminuye en 2% la oportunidad de presentar disfagia sarcopénica (OR 0,98 [IC del 95%, 0,97-0,98]). Con respecto al estado nutricional, por cada punto en el MNA la oportunidad de presentar disfagia sarcopénica se disminuye en un 15% (OR = 0,85 [IC del 95%, 0,72-0,99]).
Regresión logística multivariada, asociación entre disfagia sarcopénica con otras variables (n=100)
| Característica | Modelo 1 | Modelo 2 | ||
|---|---|---|---|---|
| OR (IC del 95%) | Valor p | OR (IC del 95%) | Valor p | |
| Mujer vs. hombre | 1,89 (0,69-5,19) | 0,2148 | 1,07 (0,43-2,65) | 0,8829 |
| Índice de comorbilidad de Charlson (numérico) | 1,02 (0,70-1,49) | 0,8991 | 1,06 (0,76-1,49) | 0,7290 |
| Demencia no severa (sí vs. no) | 0,97 (0,33-2,84) | 0,9628 | 1,54 (0,59-4,02) | 0,3721 |
| MNA (numérico) | 0,86 (0,72-1,03) | 0,0928 | 0,85 (0,72-0,99) | 0,0405 |
| Índice de Barthel (numérico) | 0,98 (0,97-0,99) | 0,0234 | 0,98 (0,97-0,98) | 0,0064 |
Modelo 1: variable dependiente disfagia sarcopénica dicotómica (1=disfagia sarcopénica vs. 0=disfagia no sarcopénica o no disfagia); modelo 2: variable dependiente disfagia sarcopénica ordinal (1=no disfagia; 2=disfagia no sarcopénica; 3=disfagia sarcopénica).
MNA: Mini Nutritional Assessment; IC: intervalo de confianza; OR: odds ratio.
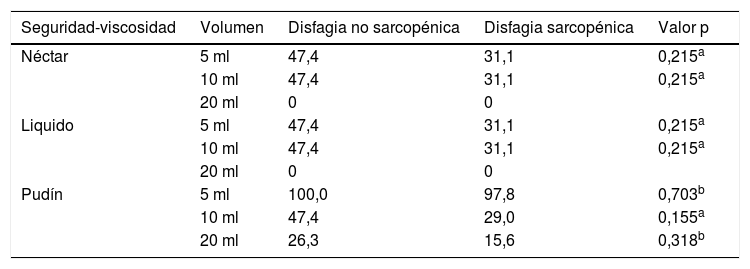
Adicionalmente, se analizó el tipo de textura o viscosidad tolerada (néctar, liquido, pudin) y no hubo diferencia significativa entre la disfagia no sarcopénica vs. la sarcopénica (tabla 5) ni en seguridad ni en eficacia. Tampoco hubo diferencia (p=0,926) en la severidad de la disfagia entre la disfagia no sarcopénica (leve=26,3%; moderada=57,9% y severa=15,8%) vs. la sarcopénica (leve=22,2%; moderada=62,2% y severa=15,6%).
Porcentajes (%) de los adultos mayores sin alteración de la deglución en pruebas de seguridad o eficacia según condición de disfagia sarcopénica y no sarcopénica
| Seguridad-viscosidad | Volumen | Disfagia no sarcopénica | Disfagia sarcopénica | Valor p |
|---|---|---|---|---|
| Néctar | 5 ml | 47,4 | 31,1 | 0,215a |
| 10 ml | 47,4 | 31,1 | 0,215a | |
| 20 ml | 0 | 0 | ||
| Liquido | 5 ml | 47,4 | 31,1 | 0,215a |
| 10 ml | 47,4 | 31,1 | 0,215a | |
| 20 ml | 0 | 0 | ||
| Pudín | 5 ml | 100,0 | 97,8 | 0,703b |
| 10 ml | 47,4 | 29,0 | 0,155a | |
| 20 ml | 26,3 | 15,6 | 0,318b |
Realizamos un estudio aplicando un algoritmo diagnóstico abreviado, previamente validado en una población de AM institucionalizados. La fortaleza del algoritmo utilizado es que confiere la capacidad de diagnosticar posible disfagia sarcopénica sin evaluar la masa muscular de los músculos de la deglución o fuerza de la lengua, medición que no es fácil realizar en la práctica clínica habitual ya que se requiere un instrumento especializado. Encontramos 2resultados relevantes. Primero se documentó una prevalencia de disfagia sarcopénica del 45% en la población de AM institucionalizado y segundo, las variables que se asociaron de forma significativa con disfagia sarcopénica fueron el estado funcional y el estado nutricional.
La prevalencia y el pronóstico de disfagia sarcopénica aún no han sido claramente documentados. En nuestro estudio, la prevalencia encontrada fue del 45% en una población de AM institucionalizados, similar al estudio original de Mori et al.15, quienes documentaron una prevalencia del 41,8% en una población de pacientes ingresados en hospitales de cuidado agudo, hogares de larga estancia y de rehabilitación.
El análisis de la regresión logística multivariada en el modelo 2 mostró que los principales factores asociados con disfagia sarcopénica fueron el estado nutricional evaluado por el MNA y el estado funcional evaluado por IB. Estos resultados son similares al estudio de Maeda y Akagi27, donde también documentaron asociación con malnutrición, demencia y el estado funcional, en una población de 95 AM hospitalizados en una unidad de agudos. Existe evidencia en la literatura de que la malnutrición contribuye a la etiología tanto de la disfagia sarcopénica como de la sarcopenia28.
Encontramos que, en la muestra total, el 36% no tenía disfagia y el 19% tenía disfagia no sarcopénica, es decir, de otra etiología. Fueron 6 pacientes que tenían antecedente de ACV, en quienes al hacer la revisión de cada caso se determinó que este era la causa de la disfagia. También encontramos que el 68,9% de los AM con disfagia sarcopénica fueron mayores de 80 años, lo que tiene plausibilidad biológica dado que a mayor edad aumenta la probabilidad de sarcopenia2. También encontramos mayor frecuencia de disfagia sarcopénica en mujeres, siendo esta del 71% con significación estadística (p=0,0074). Estos hallazgos son concordantes con el estudio de Maeda y Akagi27, donde el 67% de los pacientes AM hospitalizados con disfagia sarcopénica fueron mujeres.
En los análisis bivariados, hubo una frecuencia del 57,9% de disfagia no sarcopénica y del 57,8% de disfagia sarcopénica en los pacientes AM con demencia no severa, hallazgo similar al estudio de Altman et al.29, que reportan una prevalencia del 60% de disfagia en pacientes con demencia. En estas personas las mediciones de la fuerza muscular y la función física son difíciles, sin embargo, el diagnóstico de disfagia sarcopénica en este contexto es importante, porque la demencia se asocia con sarcopenia30,31 y es ampliamente conocida la relación existente entre la demencia y la disfagia32.
El conocimiento y la detección de la disfagia sarcopénica es relevante, ya que el no diagnosticar esta condición aumenta el riesgo de complicaciones y eventos adversos en salud18. Parece ser más severa que otros tipos de disfagia y existe evidencia de que el tratamiento enfocado al soporte nutricional y el entrenamiento de resistencia de los músculos de la deglución está relacionado con buenos resultados. Maeda y Akagi33 describieron el caso de una mujer de 80 años, quien se recuperó de la condición de disfagia sarcopénica con un agresivo manejo nutricional y terapia física, logrando aumento de peso corporal y mejoría de la función deglutoria; incluso a los 6 meses de la intervención mantuvo la mejoría de la función deglutoria evaluada por videofluoroscopia. Wakabayashi y Sakuma28 sugieren una estrategia llamada nutrición de rehabilitación para pacientes sarcopénicos en quienes se proporciona suplementación nutricional de acuerdo con la carga de ejercicio, la actividad diaria y el estado nutricional. No obstante, se necesitan más investigaciones para mejorar el entendimiento de la disfagia sarcopénica y su tratamiento.
Por otro lado, encontramos que la prevalencia de tener algún grado de disfagia entre los AM institucionalizados fue del 64%, concordante con la literatura. En un estudio realizado por Lin et al.5 en Taiwán, que incluyó a 1.221 AM institucionalizados, la prevalencia general de disfagia fue del 51%. En otro estudio realizado por Ferrero López et al. en 5 instituciones geriátricas en España, que incluyó a 422 AM, documentan una prevalencia de disfagia del 65%8.
Además, encontramos que en los AM institucionalizados la afectación de la fuerza muscular es prevalente. Así, 9de cada 10AM tienen fuerza de agarre o la velocidad de la marcha disminuidas según consenso de la EWGSOP8, datos similares a lo documentado en nuestro estudio, en donde la fuerza de agarre promedio fue de 10 kg (5,0 – 18,0 kg) y estaba disminuida en el 87% de los AM (tabla 2).
La masa muscular baja se ha establecido como posible factor de riesgo para disfagia. A su vez, hay estudios donde el índice de masa corporal ha sido determinado como el mayor factor predictor de disfagia34. En nuestro trabajo la prevalencia de sarcopenia fue más alta (61%) en contraste con lo reportado en la literatura, como en el metaanálisis publicado recientemente y realizado por Shen et al., donde la prevalencia fue del 41% en AM institucionalizados35.
Dentro de las fortalezas del estudio se tiene que la valoración de la deglución se realizó mediante el método de exploración clínica volumen-viscosidad realizado por una fonoaudióloga entrenada y experta en atender población de AM, lo cual les confiere validez interna a los resultados. Además, es un estudio pionero sobre este tema a nivel nacional al tener como población objetivo AM institucionalizados, en quienes se conoce que la disfagia tiene alta prevalencia y, por ende, su diagnóstico y abordaje temprano genera un impacto significativo en salud.
Nuestro estudio presenta como limitación que no se realizó medición objetiva de fuerza de la lengua, que requiere un instrumento especializado. A pesar de ello, empleamos el algoritmo diagnóstico abreviado planteado y validado por Mori et al., el cual ofrece la ventaja de ser aplicable en la práctica diaria sin la necesidad de utilizar la variable fuerza de la lengua para el diagnóstico. Por otro lado, no se incluyó a pacientes con demencia severa, lo cual puede ser un sesgo de selección en nuestro estudio.
En conclusión, la disfagia sarcopénica tiene alta prevalencia en los AM institucionalizados, y las variables independientemente asociadas fueron la dependencia funcional y el estado nutricional pobre.
Tras los resultados obtenidos en nuestro trabajo, nos planteamos la posibilidad de realizar en un futuro un estudio de cohorte, multicéntrico, que evalúe desenlaces adversos como mortalidad, neumonía, deterioro nutricional y funcional.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.