Las lesiones profundas del pie diabético constituyen un importante problema terapéutico. El objetivo de este estudio es presentar la experiencia resultante de la utilización del sistema de cierre asistido al vacío (VAC) en el tratamiento del pie diabético avanzado y complicado.
Material y métodosSe realizó un estudio prospectivo de 5 casos de pie diabético avanzado tratados mediante VAC. Del total, a 3 pacientes se los diagnosticó de insuficiencia renal, entre ellos uno que recibió tratamiento inmunosupresor debido a un trasplante renal. En 4 de los casos se habían realizado intervenciones quirúrgicas locales sin éxito. Conforme a la clasificación de Wagner, las lesiones se catalogaron como de grado 3 o 4. En todos los casos se realizó un desbridamiento extenso, que en 4 de los pacientes dio lugar a amputaciones menores abiertas a la altura del metatarso, mientras que en uno se tradujo en una resección de la articulación metatarsofalángica. En el mismo acto, en cada uno de los pacientes se colocó VAC. La mediana de seguimiento posprocedimiento fue de 9 meses.
ResultadosSe consiguió salvar la extremidad en todos los casos. La mediana de cambios de VAC fue de 16 durante un período mediano de 8 semanas. La mitad de los cambios se realizó de modo ambulatorio. No ocurrieron complicaciones mayores. En ningún caso se produjeron signos clínicos de la infección. En uno de los pacientes, antes de comenzar el tratamiento con VAC, se llevó a cabo una angioplastia de arteria ilíaca y femoral superficial. Se necesitaron otros procedimientos adicionales: 2 revascularizaciones distales y 2 amputaciones parciales del antepié, después de que se iniciara el tratamiento con VAC.
ConclusionesEl sistema VAC parece ser muy eficaz en el tratamiento del pie diabético avanzado.
Deep diabetic foot lesions pose an enormous therapeutic problem. The purpose of this study was to present the experience of the use of vacuum assisted closure (VAC) in the treatment of advanced and complicated diabetic foot lesions.
Material and methodsFive cases of advanced diabetic foot that were treated with VAC were prospectively studied. Three patients were diagnosed with renal failure, including one with renal transplant, who were receiving immunosuppression therapy. Four patients had undergone local foot surgery. The foot lesions were classified as grade 3 or 4 according to the Wagner classification. In all patients extensive debridement was performed that resulted in open minor amputations in four cases and resection of the metatarsophalangeal joint in one case. The VAC was applied during the same procedure. The median follow-up period of the patients was 9 months.
ResultsFoot salvage was achieved in all cases. The median number of changes of VAC was 16 within median period of 8 weeks. Half of the changes were performed as an outpatient procedure. There were no major complications or clinical signs of infection observed. In one case before treatment with VAC began, angioplasty of the iliac artery and superficial femoral artery was performed. Other interventions carried out after the treatment was started were, two distal revascularizations and two partial transmetatarsal amputations.
ConclusionsVAC appears to be very useful in the treatment of advanced diabetic foot lesions.
El pie diabético sigue siendo la causa más importante de las amputaciones no traumáticas de las extremidades inferiores1,2. Aunque se ha demostrado que una profilaxis adecuada es capaz de prevenir hasta un 85% de las amputaciones en este grupo de pacientes, con cierta frecuencia se producen casos que presentan úlceras o necrosis avanzadas con amenaza inmediata de pérdida del miembro. Estos casos casi siempre necesitan un tratamiento complejo en el que un extenso desbridamiento quirúrgico representa el procedimiento más importante y resulta en grandes defectos de tejidos del pie afectado, que habitualmente se traducen en una cicatrización difícil y tórpida.
El sistema de cierre asistido al vacío (VAC) utiliza una succión subatmosférica continua o intermitente sobre la herida quirúrgica realizada mediante una esponja de poliuretano sellada con un plástico adherente transparente. Este sistema se introdujo en la práctica clínica hace 10 años. Se ha indicado que el tratamiento mediante apósitos de presión negativa puede acelerar la cicatrización de heridas en el pie diabético3–5. El mecanismo de acción de este sistema es multifactorial y consiste en una evacuación del exceso de líquido y una reducción del edema de los tejidos adyacentes y, por lo tanto, mejora la perfusión microvascular y disminuye la colonización bacteriana, protegiendo al mismo tiempo la herida de la contaminación externa6. El objetivo de este trabajo es relatar nuestra experiencia en el tratamiento del pie diabético avanzado y complicado con utilización de VAC.
Pacientes y métodoSe realizó un estudio prospectivo de 5 casos de pie diabético avanzado tratados mediante sistema de VAC entre agosto de 2007 y septiembre de 2008 en la Clínica Universitaria de Navarra. La edad media de los pacientes se situó en 65,2 años. Uno de los pacientes presentaba diabetes tipo 1. Los demás presentaban diabetes tipo 2 en tratamiento mediante antidiabéticos orales. Tres pacientes se diagnosticaron de insuficiencia renal, entre ellos uno que permanecía en programa regular de hemodiálisis y otro en tratamiento inmunosupresor como consecuencia de un trasplante renal. Todos presentaban lesiones profundas, 3 lesiones de grado 3 y 2 lesiones de grado 4, según la clasificación de Wagner7. Conforme a la clasificación de la Universidad de Texas, todos se catalogaron como grado 3. Uno de los casos se consideró en estadio A (sin infección ni isquemia), otro en estadio B (con infección sin isquemia), 2 más en estadio C (isquemia sin infección) y uno en estadio D (infección e isquemia)8.
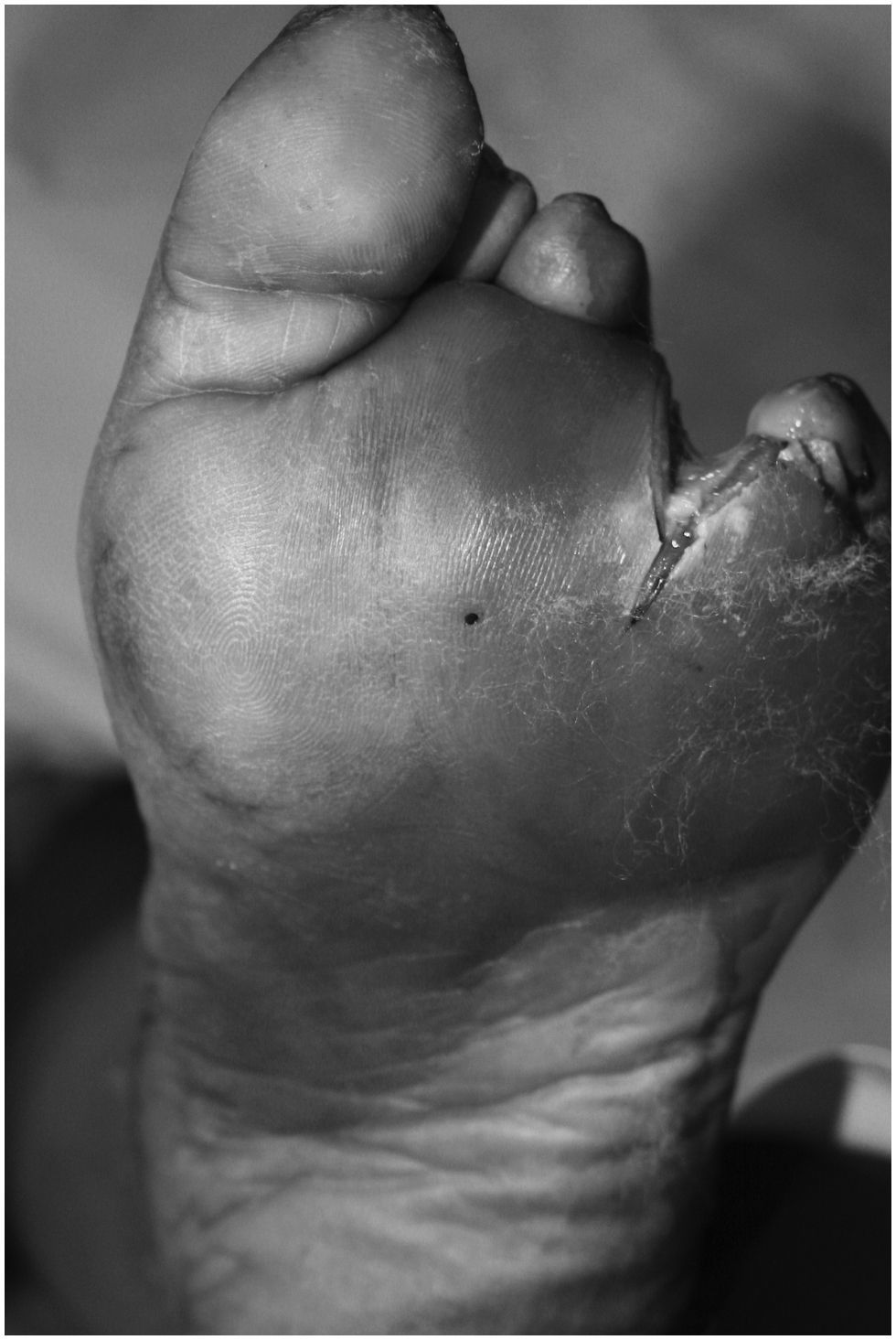
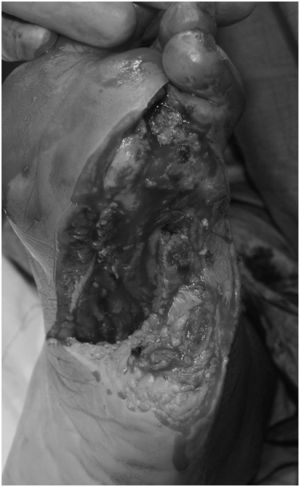
Los signos y síntomas requeridos para diagnosticar la infección eran supuración, mal olor o signos como eritema, tumefacción, calor o sensibilidad a la presión en la zona de la úlcera (fig. 1). A todos se los había tratado previamente. En 2 pacientes se había realizado una amputación del dedo del pie afectado; en otro paciente se había realizado la amputación del antepié y una angioplastia de la arteria tibial posterior; un cuarto paciente había recibido tratamiento conservador pese a presentar necrosis parcial del antepié, y la última paciente manifestaba una úlcera tras la amputación parcial del antepié.
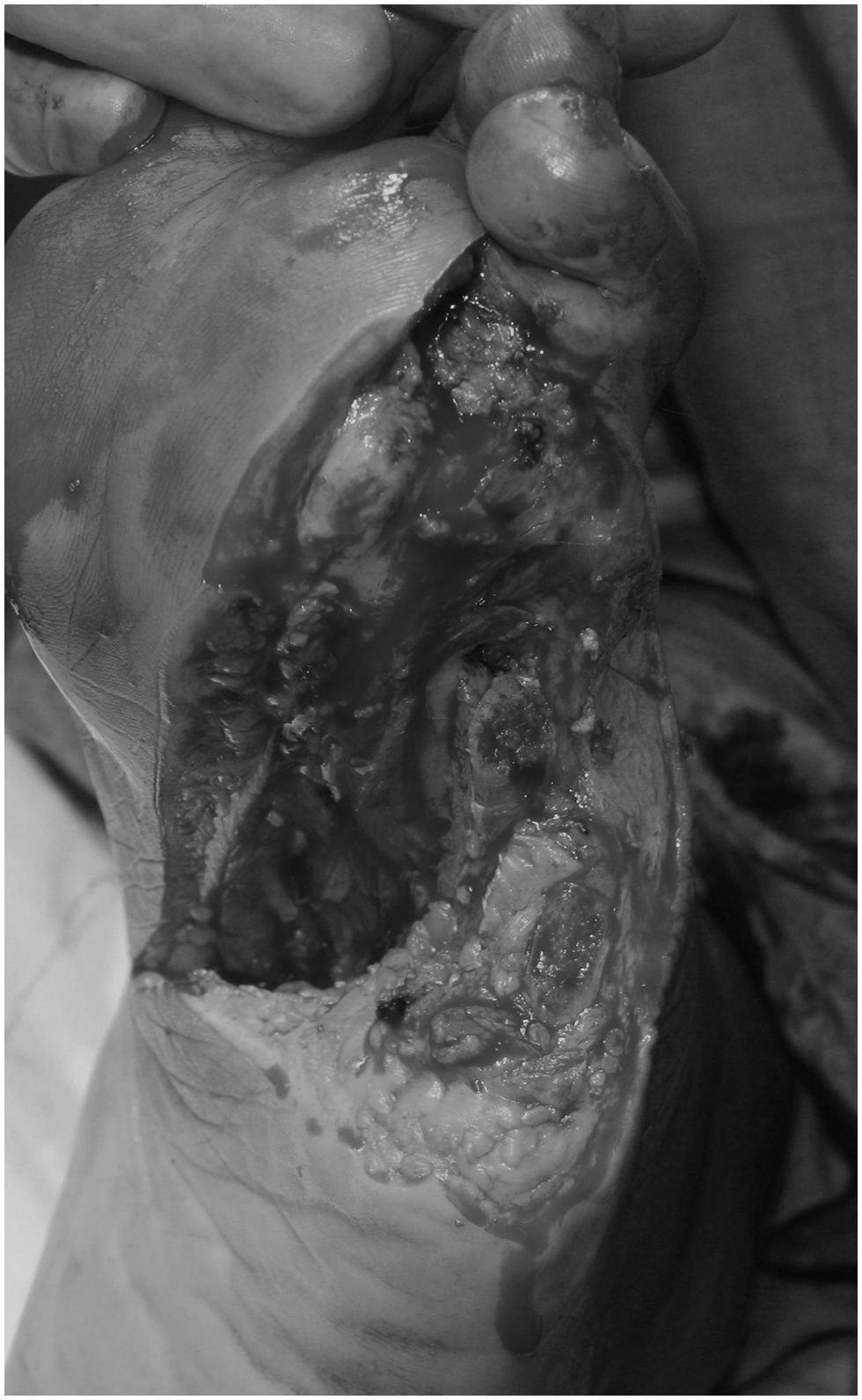
A todos los pacientes se les informó de la técnica que se les iba a realizar y firmaron un documento en el que certificaban el consentimiento informado. En todos los casos se practicó un desbridamiento quirúrgico radical, consistente en la resección de todo el tejido desvitalizado e infectado, que incluía la amputación digital y, también, la amputación parcial del antepié en los casos necesarios (fig. 2). En 4 pacientes se realizaron amputaciones menores abiertas a la altura del metatarso y en un caso se practicó un desbridamiento radical de la úlcera mal perforante junto con la resección de la articulación metatarsofalángica.
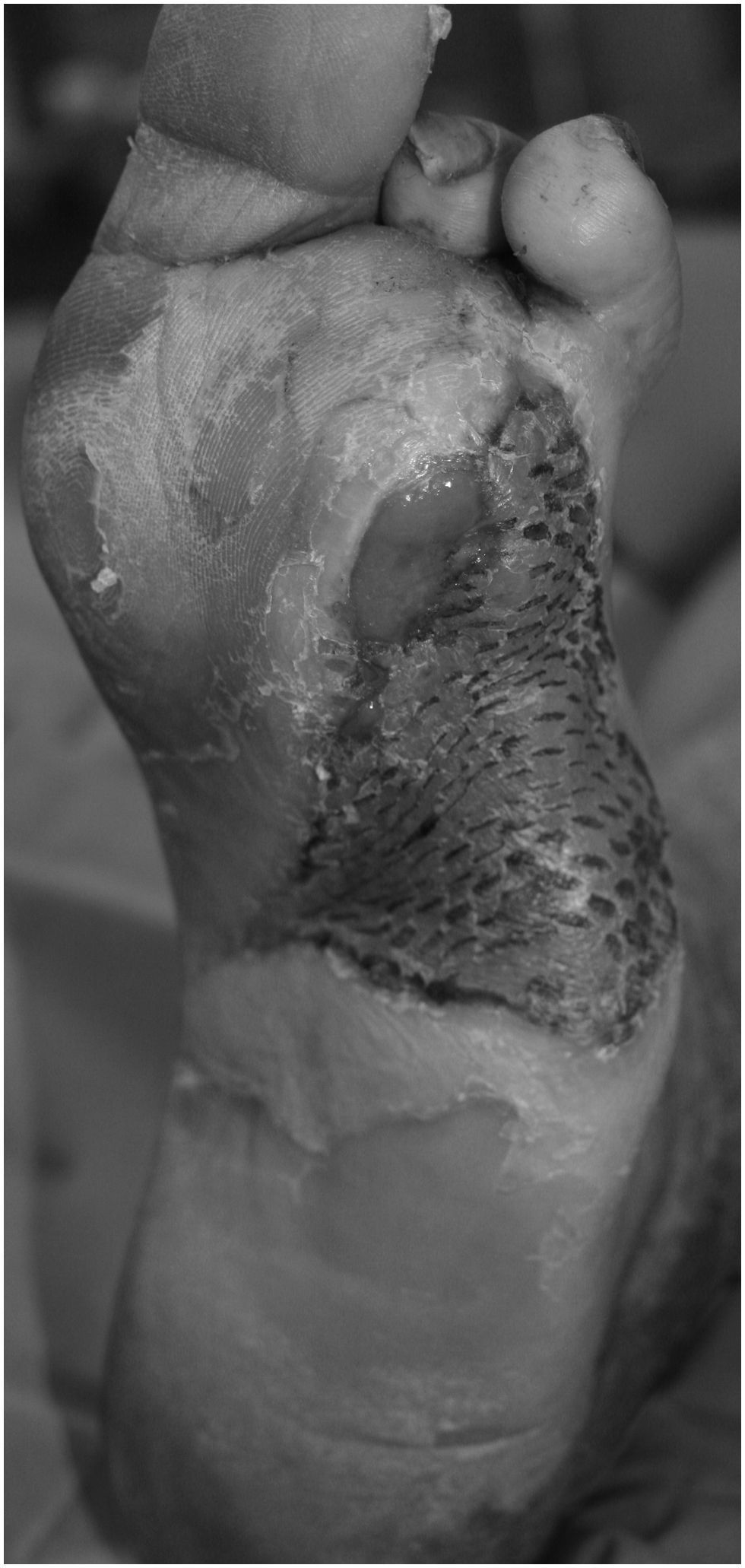
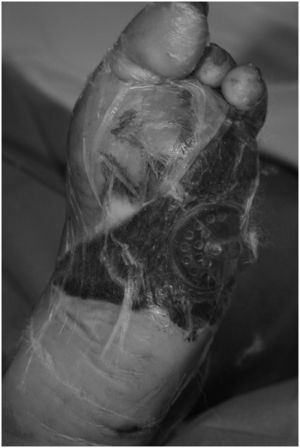
En todos los casos, durante el mismo acto se colocó un sistema de VAC, empezando con aspiración de modo continuo durante las primeras 6–12h y cambiando, a continuación, al modo intermitente (fig. 3). Los cambios de VAC se realizaron en quirófano utilizando una técnica aséptica cada 3–4 días o en intervalos más cortos si surgían indicaciones. Cada día se inspeccionaba el pie buscando síntomas de inflamación de tejidos adyacentes a la herida. El tratamiento con VAC se continuó hasta que la úlcera se rellenó totalmente con tejido de granulación y se decidió implantar injerto de piel de espesor parcial, seguir con apósitos convencionales o realizar una amputación menor cerrada. Durante el desbridamiento inicial en cada caso se tomó una muestra para su cultivo. Durante el período de hospitalización todos los pacientes recibieron tratamiento antimicrobiano.
Como salvación de extremidad se consideró, conforme a criterios publicados, la preservación de aquella parte del pie que permitía bipedestación y deambulación sin prótesis9. La mediana de duración del seguimiento de los pacientes fue de 9 meses y osciló entre 4 y 13 meses.
ResultadosNo hubo fallecimiento. En todos los casos se consiguió salvar la extremidad. El número mediano de cambios del VAC fue 16 (rango: 2–19) durante un período mediano de 8 semanas. La mitad de los procedimientos se realizó de modo ambulatorio. La estancia hospitalaria relacionada con el tratamiento con VAC osciló entre 2 y 23 días. La mediana se situó en 21 días.
En un paciente que presentaba necrosis parcial de antepié y dolor en reposo, 3 días antes de que se realizara desbridamiento radical y empezara tratamiento con VAC se practicó una angioplastia de la arteria ilíaca y superficial femoral que eliminó el dolor en reposo. En 3 pacientes se realizaron otros procedimientos después de que se iniciara el tratamiento con VAC. En 2 casos que, a pesar de ausencia de dolor en reposo, presentaban tórpida evolución del tejido de granulación, se necesitaron procedimientos de revascularización. Las revascularizaciones realizadas fueron, en un caso, angioplastia de arteria tibial anterior 4 días después y, en otro caso, angioplastia poplítea y derivación popliteopedia 13 y 29 días después de que se empezara el tratamiento con VAC, respectivamente. En este último paciente ya se había realizado angioplastia de arteria ilíaca y superficial femoral.
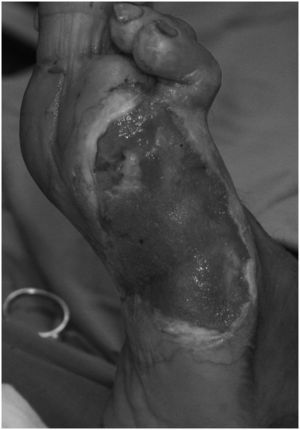
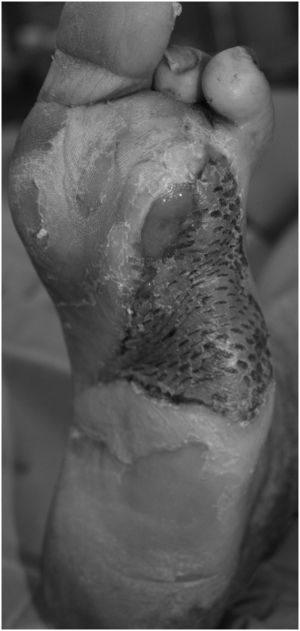
En un paciente, tras un desbridamiento de úlcera perforante infectada que incluyó resección de la articulación metatarsofalángica, se llevaron a cabo sólo 2 cambios de VAC durante 6 días, ya que se procedió a amputar el antepié debido a una extensa afectación de tejidos profundos. Tras la amputación, el antepié cicatrizó 3 semanas después y no presentó complicaciones. En ese mismo momento, el paciente pudo volver a caminar sin necesidad de usar prótesis. En otro paciente con amputación abierta de parte medial del antepié se realizó, después de 29 días de tratamiento con VAC, una amputación cerrada de la parte residual, lateral del antepié. Se continuó el tratamiento con VAC de la herida de la parte medial. La amputación de la parte lateral cicatrizó en 21 días. La herida situada en la parte medial fue tratada 10 días más con VAC y después con Betadine® gel hasta que la cicatrización completa se produjo 7 meses después del comienzo del tratamiento. En otro paciente se practicó, después de 56 días de tratamiento con VAC, un injerto de piel de espesor parcial para acelerar la cicatrización definitiva (figs. 4 y 5).
Otros 2 pacientes no necesitaron procedimientos adicionales y sus heridas cicatrizaron completamente 3 y 4 meses después del tratamiento, que incluyó 66 y 31 días de tratamiento con VAC cada uno.
En 4 casos se identificaron microorganismos patógenos. Los gérmenes aislados fueron Staphylococcus aureus, Staphylococcus epidermidis, Bacteroides fragilis, Klebsiella pneumoniae y Serratia marcescens.
No se observaron complicaciones mayores. Las complicaciones relacionadas con la técnica fueron pérdida de hermetismo de apósito o bloqueo del sistema de aspiración por coágulos de sangre. Esta última complicación ocurrió en 2 pacientes que estaban con doble antiagregación debido a una revascularización anterior. En ningún caso se produjo edema, eritema, dolor o supuración. Ningún paciente rechazó ni quiso abandonar el tratamiento con VAC hasta que se lo indicara el médico.
DiscusiónEste estudio ha comprobado que el tratamiento con sistema de VAC de heridas extensas tras desbridamiento de lesiones profundas en el pie diabético, tanto isquémico como infectado, es seguro y eficaz, incluso en pacientes con insuficiencia renal e inmunosupresión. Además, se ha demostrado que este tratamiento se puede realizar de modo ambulatorio sin provocar complicaciones.
En ningún caso se observó progresión de la necrosis ni reinfección, algo que suele producirse frecuentemente con el tratamiento convencional. La mayoría de los estudios publicados sobre utilización del VAC en el tratamiento del pie diabético tratan úlceras menos profundas que las de nuestros pacientes4,5. En un estudio multicéntrico publicado recientemente se seleccionaron sólo pacientes con úlceras de grado 2 y 3 (según clasificación de Wagner), es decir, menos avanzadas que las de nuestros pacientes10. Además, se excluyeron pacientes con osteomielitis, isquemia o inmunosupresión. Por la profundidad de las lesiones y la extensión del desbridamiento, nuestras observaciones coinciden más con los resultados del estudio de Armstrong y Lavery. En él se asignó, de forma aleatorizada, a los 162 pacientes diabéticos con heridas tras amputaciones abiertas al grupo de tratamiento con VAC o al con curas convencionales11. Ese estudio mostró una mayor tasa de cicatrización y una evolución más rápida del tejido de granulación en el grupo tratado con VAC respecto a los pacientes en quienes se realizaron curas convencionales. No obstante, en ese estudio tampoco se incluyeron pacientes con pie diabético isquémico. También se excluyeron pacientes con tratamiento inmunosupresor.
La determinación de suficiente perfusión sanguínea en el pie diabético es difícil. Dada la calcificación de la capa media de las arterias, el índice tobillo-brazo no siempre es fiable. El edema presente en casos de infección profunda puede influir en los resultados de tensión transcutánea de oxígeno. Es cierto que en el caso de una úlcera profunda en el pie diabético sin pulso se debe llevar a cabo una revascularización de extremidad. Sin embargo, la patogénesis del pie diabético es polifactorial y pueden presentarse casos de infecciones profundas con lesiones arteriales infrapoplíteas de no muy clara importancia clínica. Lógicamente, la valoración del desarrollo del tejido de granulación puede aclarar esta incertidumbre. No obstante, en el caso de amputaciones abiertas en el pie diabético isquémico, la demora de la revascularización suele empeorar el estado local y puede provocar la pérdida de la extremidad. Contribuyen a esta situación factores como deshidratación y reinfección de la herida. El sistema VAC mantiene el medio húmedo y protege frente a posibles infecciones extrínsecas. Además, disminuye el edema, lo que optimiza la circulación de la sangre en el nivel de microcirculación. Nosotros hemos observado que, en caso de isquemia, el tratamiento con VAC permitió una adecuada valoración del desarrollo del tejido de granulación, y en 2 casos de evolución lenta permitió proceder a técnicas de revascularización más arriesgadas, como una angioplastia infrapoplítea o una derivación popliteopedia, que resultó eficaz en la aceleración de la cicatrización y en la conservación de la extremidad. Por lo tanto, especialmente en caso de pie diabético isquémico, el tratamiento con VAC se puede considerar un tratamiento seguro, que permite una adecuada valoración de la irrigación en casos dudosos, pero ciertamente no es el único tratamiento.
También el tratamiento con VAC, como hemos visto en uno de los casos, puede ayudar a controlar el estado inflamatorio y la infección, permite valorar la afectación de tejidos del pie y realizar la amputación definitiva cerrada de antepié, un tratamiento que hace posible una rápida deambulación independiente y sin prótesis.
Anteriormente, a la mayoría de nuestros pacientes se los había tratado quirúrgicamente sin éxito. Creemos que una de las causas más importantes del fracaso de cicatrización de las úlceras en diabéticos, además de la isquemia, es el desbridamiento insuficiente. Hay que destacar que es imprescindible en cado caso de lesiones profundas del pie diabético eliminar todo el tejido desvitalizado e infectado antes de empezar el tratamiento local, tratamiento con VAC incluido. El afán por conservar el máximo posible de tejidos de pie o el miedo al desbridamiento radical pueden afectar este principio fundamental de tratamiento del pie diabético. La comparación de los resultados de los 2 estudios ya citados parece apoyar este concepto. La tasa de cicatrización de las úlceras diabéticas, 16 semanas después del desbridamiento, fue menor (43%) que la tasa de cicatrización de heridas tras amputaciones abiertas (56%)10,11.
El VAC no es un apósito hemostático. Por eso, antes de colocarlo es importante asegurar la hemostasia, especialmente en pacientes con medicación antiplaquetaria. En caso contrario, se pueden producir coágulos de sangre que atasquen la esponja o el tubo de drenaje. Esto último es lo que les ocurrió a 2 pacientes. Asimismo, la falta de hemostasia en el momento de la colocación de apósito de VAC puede, a menudo, impedir su aplicación adecuada. Si la superficie de la piel que rodea a la herida no está seca, el plástico adherente no se pegará bien a la superficie de la piel, lo que puede provocar una pérdida de hermeticidad del apósito y la exposición de la piel sana alrededor de la herida a la presión negativa, que puede ocasionar su maceración.
No es necesario emplear tratamiento con VAC hasta la cicatrización completa de la herida. En nuestro estudio el tiempo mediano de utilización de VAC fue de 8 semanas, lo que coincide con el trabajo de Clare et al, que relataron un tiempo medio de tratamiento con VAC de 8,2 semanas12. Una vez que se observa cómo la herida está rellena con tejido de granulación o se aprecia irrigación satisfactoria, se puede proceder al injerto de piel de espesor parcial o amputación cerrada.
Todos los cambios de apósito de VAC realizados a los pacientes de nuestro estudio se practicaron en quirófano, ya que así se asegura una técnica estéril. Además, el quirófano permite realizar desbridamiento y facilita la obtención de hemostasia si éstos fueran necesarios. No obstante, pensamos que es posible, en la mayoría de los casos, realizarlos en la sala de curas.
Uno de los hechos importantes es que el tratamiento con VAC disminuye la frecuencia de cambios de los apósitos. En nuestros pacientes los cambios se realizaron cada 3 o 4 días, mientras que con las curas convencionales se reemplazan entre 2 y 3 veces al día. Esto, en el caso de que se haga fuera del quirófano, puede suponer una reducción de costes, tal y como demuestra un estudio de Apelqvist et al13. Según este estudio, el gasto medio de cicatrización fue de $25,954 en los pacientes tratados con VAC y de $38,806 en los pacientes tratados con curas convencionales.
Otro dato interesante que se desprende de nuestro estudio es la satisfacción de los pacientes. A pesar de que los pacientes tenían que llevar un aparato de aspiración y acudir al centro hospitalario para que se les realizaran los cambios de apósito en quirófano, ninguno quiso abandonar el tratamiento.
ConclusiónEl tratamiento con sistema VAC parece ser muy útil como tratamiento adyuvante del pie diabético avanzado; sin embargo, no exime de la necesidad de realizar desbridamiento radical y revascularización si estuvieran indicados.
A Marta Chavarri y Mónica Ruiz de la Cuesta por la ayuda en la redacción de este manuscrito.