La terapia de presión negativa (TPN) para el tratamiento de las heridas es ampliamente conocida en la práctica quirúrgica. Las indicaciones iniciales de la TPN fueron las heridas crónicas, sobre todo úlceras de pie diabético, vasculares y por decúbito, y las heridas infectadas traumáticas. En la actualidad, el uso se ha diversificado ampliamente. Aunque en el campo de la cirugía de pared abdominal se ha utilizado principalmente en el manejo de las complicaciones de la herida quirúrgica tras la reparación herniaria, otras indicaciones han sido añadidas tras adquirir la experiencia durante años en el manejo de la TPN.
Por ello, el objetivo de este artículo es analizar y revisar las principales indicaciones de la TPN en la cirugía de pared abdominal, así como las ventajas que se obtienen con su aplicación.
Negative pressure wound therapy (NPWT) is widely known in surgical practice. The initial indications for NPWT were chronic wounds, especially diabetic foot, vascular and decubitus ulcers, and infected traumatic wounds. Nowadays, the use has been widely increased. Although in the field of abdominal wall surgery, it has mainly been used in the treatment of surgical wound complications after hernia repair, other indications have been added after years of experience in the management of NPWT.
Therefore, the aim of this article is to analyze and review the main indications of NPWT in abdominal wall surgery, as well as the advantages obtained with its application.
La terapia de presión negativa (TPN) para el tratamiento de las heridas es ampliamente conocida en la práctica quirúrgica, y fue dada a conocer en su forma actual en 1997 por los doctores Argenta y Morykwas1.
El sistema básico se compone de una esponja porosa, usualmente de poliuretano, que rellena la cavidad de la herida a tratar, junto a un vendaje oclusivo de plástico adhesivo y un tubo que conecta con la esponja y transmite la succión generada por un dispositivo electrónico2. Todos los dispositivos que existen en la actualidad parten de este diseño original, aunque algunos incluyen algunas mejoras como la instilación de líquidos en la herida o cambios en el material para su aplicación en diferentes situaciones2,3.
Las indicaciones iniciales de la TPN fueron las heridas crónicas, sobre todo úlceras de pie diabético, vasculares y por decúbito, y las heridas infectadas traumáticas. En la actualidad, el uso se ha diversificado ampliamente. Aunque en el campo de la cirugía de pared abdominal se ha utilizado principalmente en el manejo de las complicaciones de la herida quirúrgica (CHQ) tras la reparación herniaria, otras indicaciones han sido añadidas tras adquirir la experiencia durante años en el manejo de la TPN.
Por ello, el objetivo de este artículo es analizar y revisar las principales indicaciones de la TPN en la cirugía de pared abdominal, así como las ventajas que se obtienen con su aplicación.
Mecanismo de acción de la terapia de presión negativaLos efectos terapéuticos que consigue la TPN con su aplicación son la macrodeformación de los bordes de la herida, la microdeformación de la interfase esponja-herida, la eliminación del exudado y el mantenimiento de un ambiente húmedo y estable para la correcta cicatrización de la herida2. A esto se le suman efectos microscópicos como la proliferación celular, la angiogénesis y la formación del tejido de granulación3.
La macrodeformación es la capacidad que tiene la aplicación del vacío de contraer los bordes de la herida, disminuyendo su área, dependiendo de la elasticidad del tejido donde se coloca la esponja2. Factores que modifican la macrodeformación son el nivel de succión, volumen y tipo de esponja4–6. La microdeformación está relacionada con los poros de la esponja (normalmente de 400 a 600μm); la presión del vacío es transmitida a las células de la herida, pierden su forma esférica, promoviendo la división y proliferación7. Este efecto es lo que principalmente induce la proliferación celular y la angiogénesis3. Importante destacar que las esponjas de poro abierto, como usan la mayoría de sistemas, transmiten de manera efectiva el vacío y se contraen hasta un 80% a 125mmHg; es por ello importante adaptar y cortar la esponja para que encaje perfectamente en la herida cuando procedemos a su recambio8–10. También la succión ayuda a disminuir el edema del tejido, mejora la perfusión tisular6, extrae el exceso de líquido sobre la herida, ayudando a un ambiente idóneo para la cicatrización.
Indicaciones de la terapia de presión negativa en cirugía de pared abdominalLas indicaciones principales de la TPN en la cirugía de pared abdominal son:
- –
Cierre temporal de la cavidad abdominal debido a complicaciones derivadas de la reparación herniaria: apoyo del cierre de la herida quirúrgica por segunda intención o cierre diferido, y el manejo del abdomen abierto con tracción fascial.
- –
En el contexto de una infección crónica protésica (ICM), con el objetivo de intentar salvar la malla quirúrgica.
- –
Profilaxis de la CHQ tras una reparación herniaria o TPN incisional.
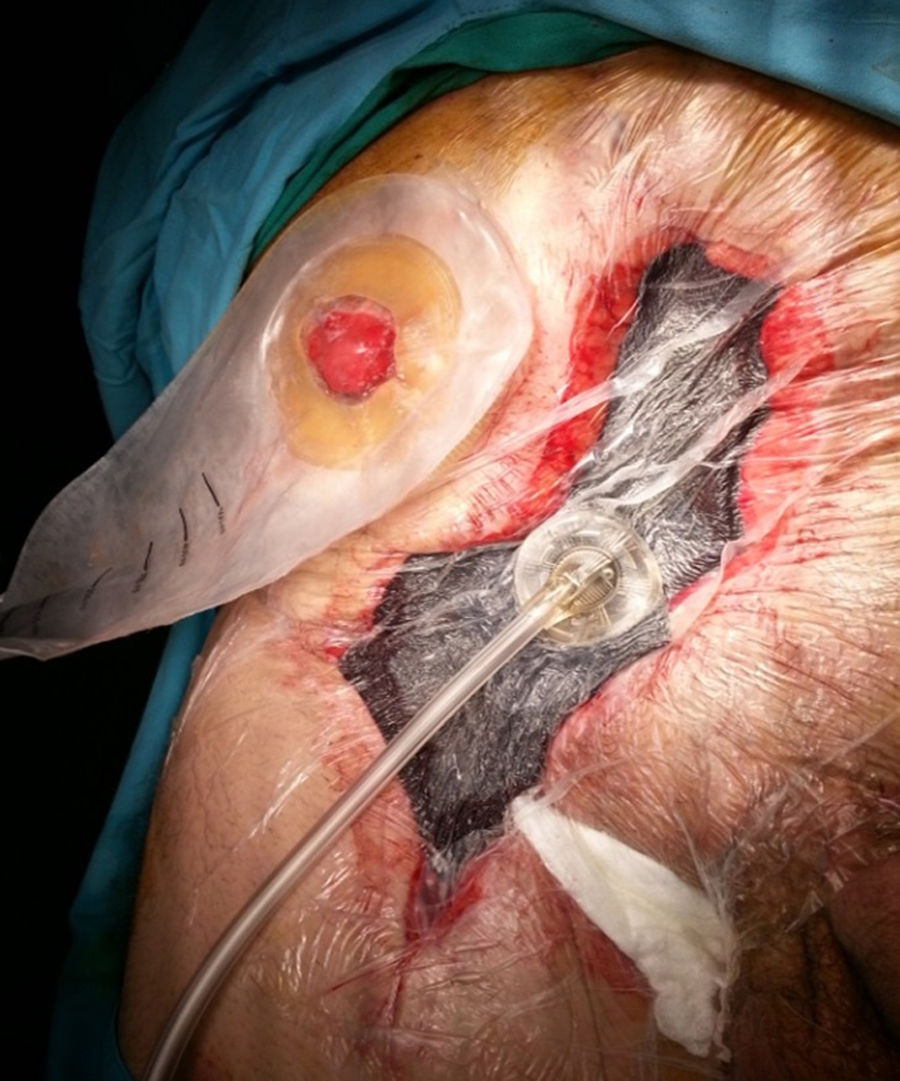
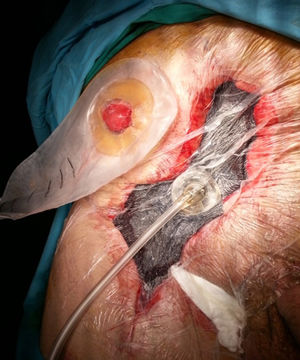
Es la aplicación más frecuentemente utilizada en el contexto de cirugía de pared abdominal (fig. 1). El dispositivo es útil en casos de CHQ, principalmente en situaciones de infección (IHQ), dehiscencia o necrosis de sus bordes. Existen factores asociados a la aparición de CHQ, dependientes del paciente (edad, diabetes, inmunodepresión, obesidad, broncopatía, etc.), y otros relacionados con la técnica quirúrgica, como la reparación abierta frente a la laparoscópica, la disección amplia del tejido, la reparación de pared abdominal compleja, especialmente la separación de componentes anterior (SAC) o paniculectomías, etc.11. La TPN también se puede combinar con la aplicación de injertos cutáneos con el fin de disminuir el tiempo de cicatrización de la herida quirúrgica2.
Aunque la técnica de recambio en la TPN es bien conocida por la comunidad científica, conviene recordar que los cambios se deben realizar cada 2 a 3 días, sobre todo en heridas que tengan gran cantidad de exudado o contaminación. Si la herida tiene poca secreción y ya se han controlado los detritus o esfacelos, y solo se está esperando la granulación de los bordes, podría espaciarse los cambios hasta un máximo de 4 a 5 días. Finalmente, la aponeurosis anterior, el tejido celular subcutáneo y el músculo son las estructuras donde mejor granula la herida; en este sentido, se debe tener en cuenta este factor de la TPN, porque en casos de su utilización sobre la fascia posterior del recto o sobre el peritoneo (p.ej., cuando existe un saco herniario) la granulación es mínima o mucho más lenta12.
Manejo del abdomen abierto con terapia de presión negativaEl sistema de TPN clásicamente tiene su principal uso en los abdómenes traumáticos. Junto al control de daños, el edema visceral y el control de la sepsis, los cierres temporales de la cavidad abdominal con este dispositivo, han demostrado manejar mejor los fluidos, mantener bajos niveles de fistulización intestinal y permitir cierres fasciales completos y más rápidos de la cavidad abdominal13–15.
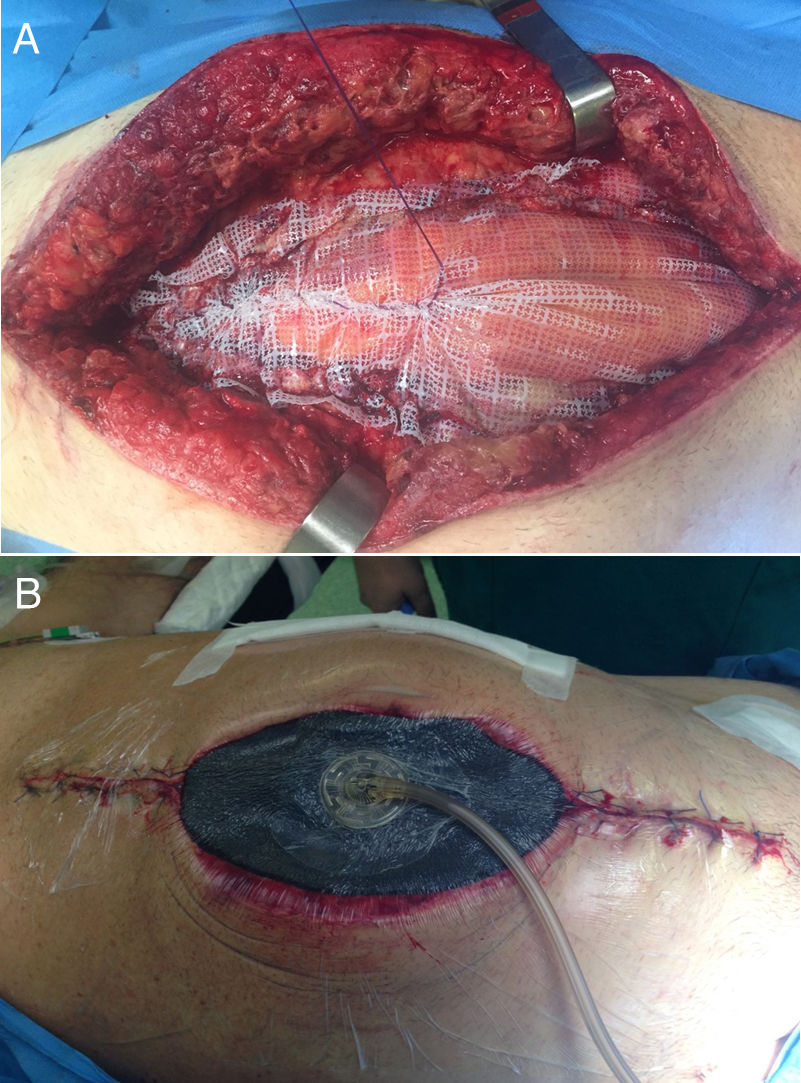
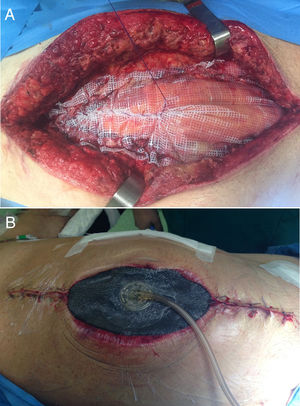
En el campo de la cirugía de pared abdominal, esta aplicación en estas situaciones se realiza junto al uso de la tracción fascial (o técnica de Leppäniemi), especialmente en casos de evisceración tras laparotomía o en casos donde no se puede realizar un cierre fascial primario ni tampoco el puenteo con la prótesis16 (fig. 2).
En 2007 se publican los primeros trabajos acerca del cierre mediado con tracción facial en pacientes con abdomen abierto16,17. Esta novedosa técnica en ese momento se justificó debido a los altos porcentajes de «hernias ventrales planeadas» ocasionadas por la cirugía de control de daños en el manejo del trauma abdominal18. Así, una vez colocado el apósito que separará las vísceras de la malla y de la esponja, se pasa a fijar la prótesis a los bordes de la fascia. La malla, normalmente de polipropileno (PPL), aunque en ocasiones pueden utilizarse una malla compuesta, se ajusta al tamaño del defecto y es fijada con un monofilamento no absorbible o de reabsorción lenta. Por último, sobre la prótesis se colocan las esponjas del dispositivo de la forma convencional16.
La tracción facial en este contexto ha demostrado, mayor porcentaje de cierre fascial completo y menor incidencia de hernia incisional residual, reduciendo el índice de complicaciones y de la temida fistula enteroatmosférica, aunque en este caso, alguna serie ha mostrado un aumento en su incidencia19,20.
Manejo conservador en la infección crónica de la prótesisLa ICM es una complicación potencialmente devastadora en la reparación herniaria; su incidencia oscila entre el 0,7 y el 25,6%, dependiendo de varios factores, como la comorbilidad del paciente, la técnica quirúrgica o el tipo de prótesis utilizada21. Si hay que retirar una malla infectada, el paciente se enfrenta a los inconvenientes de la reaparición de la hernia y a la morbilidad relacionada con procedimientos quirúrgicos adicionales, con el riesgo de enterotomías, hemorragia o fístulas intestinales relacionadas con el proceso de retirada de la malla. Además, este procedimiento puede dejar una herida abierta compleja, con una debilidad o defecto subyacente de pared abdominal, que puede ser un problema clínico mayor que la hernia original22.
El tipo de prótesis infectada influye en la dificultad de solución del problema clínico. Así, una malla de PPL de poro grande en posición extraperitoneal puede gestionarse de forma rutinaria sin necesidad de explantación, mientras que las mallas de multifilamento, microporosas y compuestas (por ejemplo, de politetrafluoroetileno expandido o PTFE) requieren su retirada en casi todos los casos22,23. Las mallas parcialmente absorbibles parecen ser más ventajosas en el éxito del manejo conservador de la ICM en comparación con las no absorbibles23. Por último, el hallazgo de Staphylococcus aureus resistente a meticilina (SARM) en el cultivo de exudado obtenido en el lecho de la infección, también presenta un factor predictivo de necesidad de exéresis de prótesis24.
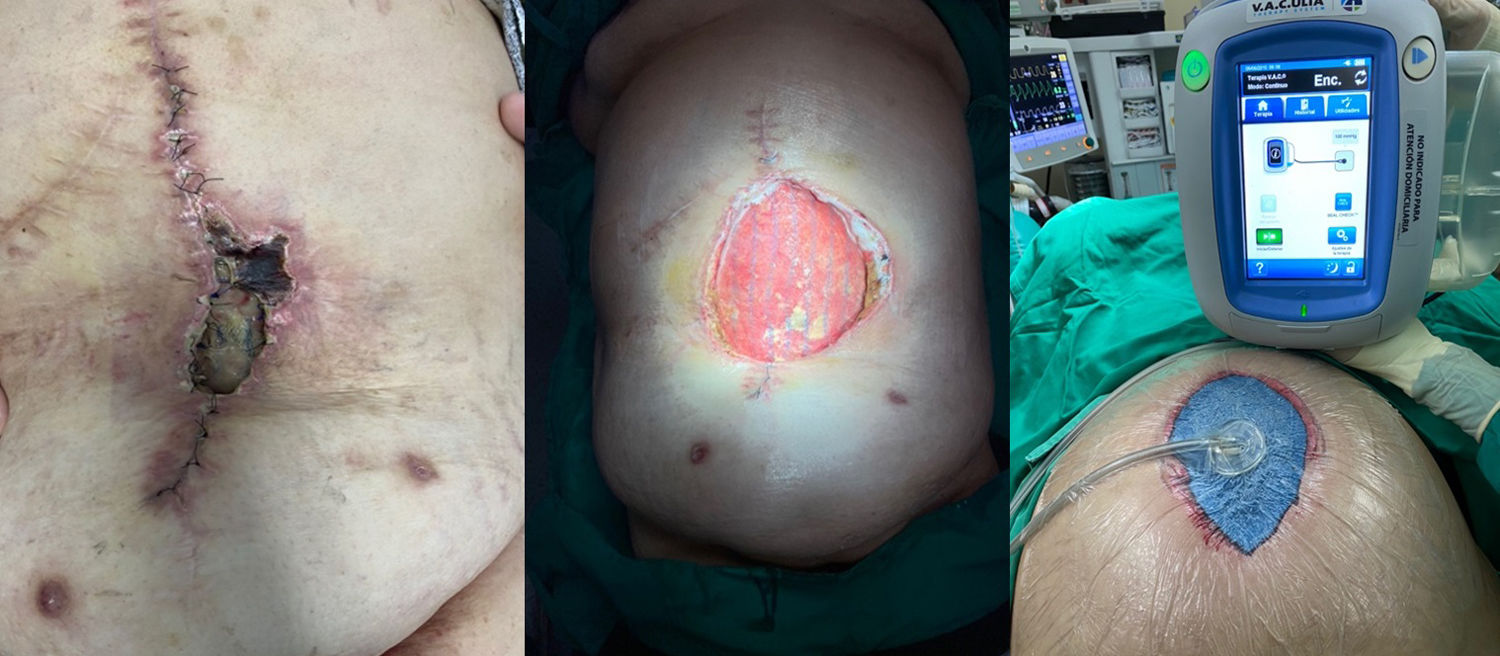
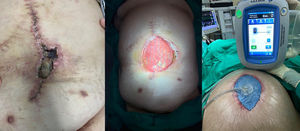
El manejo de la ICM en cada paciente debe ser individualizado, intentando en la mayoría de los casos el rescate de la malla tras supervisión estrecha y antes de condenar al paciente a la morbilidad asociada a su extirpación. Este tratamiento conservador puede lograrse mediante varios métodos, con tasas de éxito variables. Una estrategia aceptada incluye la aplicación de la TPN, especialmente cuando se produce una IHQ tras la reparación herniaria, y que puede desembocar en una ICM a posteriori25 (fig. 3). La TPN contribuye al crecimiento de tejido de granulación a través de la malla, lo que la puede proteger de la presencia bacteriana en la herida quirúrgica26. Así, un tamaño de poro amplio de prótesis (2-5mm) permite una mejor incorporación y migración tanto de leucocitos como de macrófagos de los tejidos subyacentes en comparación con el tamaño de poro de las mallas de peso elevado.
Varios autores han demostrado buenos resultados con el uso de la TPN en el rescate de mallas infectadas. Greenberg27 evaluó el tratamiento de mallas compuestas infectadas en 11 pacientes, encontrando que en 4 casos fue necesaria su retirada completa, aunque ninguno de ellos desarrolló una recidiva de la hernia. Stremitzer et al.28 utilizaron la TPN en pacientes con malla expuesta infectada, logrando salvar 17 de las 31 mallas infectadas (55%) con esta terapia; a pesar de ello, solo un 20% de mallas PPL y un 23% de mallas compuestas infectadas pudieron salvarse. Los autores sugirieron que debería aplicarse un tratamiento conservador en los casos de infección de prótesis absorbibles, mientras que las mallas no absorbibles deben requerir una extracción quirúrgica temprana.
Baharestani y Gabriel29 revisaron a 21 pacientes con una malla expuesta infectada; en 18 de ellos se consiguió cerrar la herida con éxito, pero 13 de los pacientes necesitaron una retirada total o parcial de la malla. Los autores concluyeron que el factor más importante para el éxito del tratamiento de las mallas biológicas o sintéticas infectadas es el desbridamiento adecuado con el inicio temprano de la TPN.
Berrevoet et al.30 informaron de 63 pacientes tratados con TPN debido a una complicación infecciosa tras la reparación de hernias a nivel retromuscular e intraperitoneal. La tasa de ICM fue del 8,7%, pero todas las mallas retromusculares se salvaron, obteniendo un éxito global del 95% con esta terapia. Similares resultados obtuvieron Boettge et al.23 y Nobaek et al.31, en series de 48 y 30 pacientes tratados por ICM tras reparaciones supraaponeuróticas y retromusculares, respectivamente, con un éxito de tratamiento conservador del 92 y 84%.
Las ventajas de la TPN se han combinado con el efecto tópico de soluciones antisépticas añadidas al dispositivo con instilación. García Ruano et al.32 informaron resultados positivos con dicho dispositivo en 45 pacientes, siendo necesaria la retirada parcial de la malla únicamente en un paciente (8,3%).
Como posibles inconvenientes del manejo conservador de la ICM con la TPN, se han mencionado la posibilidad de desarrollo de fístulas intestinales como una de las complicaciones más graves asociadas a la terapia29. Sin embargo, con el uso de diferentes gradientes de presión y los tipos de esponja adecuadas para regular la agresividad del tratamiento local, esta complicación puede minimizarse. Por otra parte, otros grupos informan de los altos costes asociados a la TPN prolongada para obtener un resultado positivo. Sin embargo, si se comparan con los posibles costes asociados a los días de hospitalización adicionales y a la intervención quirúrgica compleja para retirar la malla, podría argumentarse que la solución aparentemente más rentable es el tratamiento conservador30. También es importante destacar que el restablecimiento de la integridad de la fascia muscular de la pared abdominal puede ser incompleto con este tratamiento, lo que podría explicar la incidencia ligeramente mayor de hernia incisional en los grupos que se sometieron a este tratamiento para salvar la malla infectada33.
Terapia de presión negativa incisional de uso profiláctico en cirugía de pared abdominalLos pacientes que se someten a una reparación de pared abdominal compleja corren un alto riesgo de sufrir una serie de complicaciones en la herida33. En estos procedimientos, la incidencia de SSI, hematomas, seromas o dehiscencia de la herida representan cifras que oscilan entre el 15 y el 46%28. En general, las CHQ suponen una amenaza sustancial para la salud de los pacientes y pueden dar lugar a intervenciones costosas o invasivas, lo que hace necesario el uso de prácticas de prevención adecuadas.
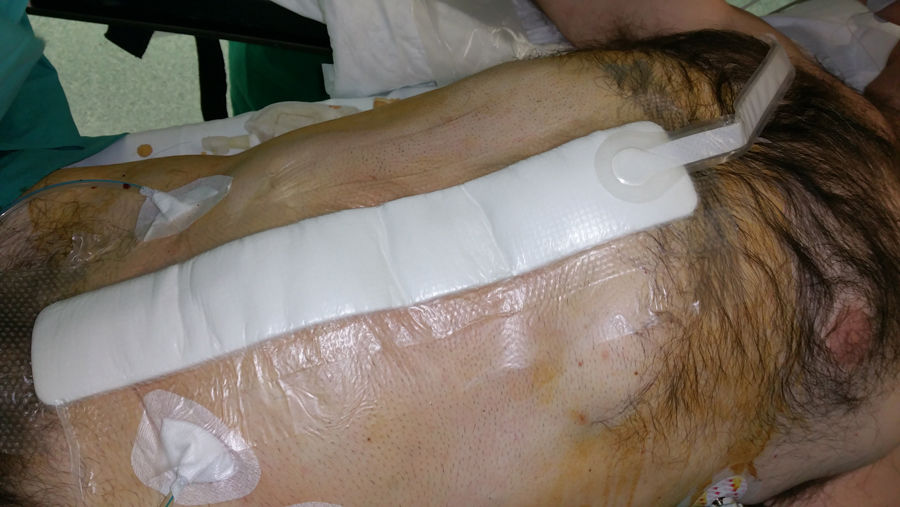
Desde 2010, se viene proponiendo la aplicación de TPN a las incisiones quirúrgicas cerradas como medio para reducir las CHQ, especialmente la IHQ2. Esta barrera física asociada a las ventajas del vacío sobre la herida, puede promover un entorno favorable para la curación. La descarga mecánica de la tensión en el lugar de la herida también puede facilitar la aposición de los bordes de la herida, por lo que puede ser de especial importancia en las amplias incisiones abdominales asociadas a la reconstrucción de pared abdominal compleja.
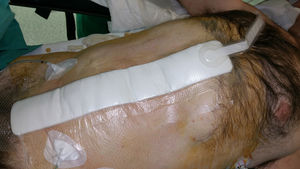
La TPN incisional ha sido el centro de nuevas investigaciones con el objeto de prevenir las complicaciones postoperatorias inmediatas en incisiones quirúrgicas cerradas (fig. 4). Aunque la bibliografía está repleta de datos sobre el uso de la TPN incisional, pocos estudios, la mayoría descriptivos retrospectivos, se han centrado en su aplicación profiláctica después de una reparación protésica herniaria de pared abdominal (tabla 1).
Estudios publicados sobre la terapia de presión negativa incisional profiláctica en cirugía de pared abdominal
| Autor | Tipo de estudio | Apósito(presión mmHg/días) | Casos TPN | Casos apósito convencional | Reparación herniaria realizada | Malla usada | Conclusiones |
|---|---|---|---|---|---|---|---|
| Conde-Green et al. (2013) | R | ADAPTIC® (J&J) y VAC® (KCI)-125/5d | 23 | 33 | ACS | -Refuerzo con Strattice™ | -Reducción del índice global de CSQ con apósito TPN (22 vs. 63,6%; p=0,020) y dehiscencia herida (9 vs. 39%; p=0.014)-No dif. significativas en IHQ, seroma, tasa recidiva herniaria |
| Pauli et al.(2013) | R | ADAPTIC® (J&J) y VAC® (KCI)-75/7d | 49 | 70 | -Retrorrectal-TAR (2 últimos años) | -Sintética (PPL)-Biológica si campo contaminado | -No dif. significativas en tasa de IHQ (25,8 vs. 20,4%; p=0,50) |
| Olona et al.(2014) | R | PREVENA™ (KCI)-125/7d | 5 | 37 | Chevrel | sintética (PPL) | -TPN reduce días de débito de drenaje (4 vs. 7 días)-No dif. significativas en IHQ, hematoma o seroma |
| Gassman et al. (2014) | R | ADAPTIC® (J&J) y VAC® (KCI)-125/7d | 29 | 32 | -ACS 57%-IPOM 43% | -Sintética-Strattice™ (intraperitoneal) | -Reducción IHQ con TPN (17,2 vs. 53,1%; p=0.01)-No dif. significativas en hematoma, seroma, necrosis herida, retirada malla o recidiva herniaria |
| Soares et al.(2014) | R | VAC® (KCI)-125/3d | 115 | 84 | ACS | -Sintética (PPL)-Biológica si cierre fascial no posible | -NPT reduce IHQ (8,7 vs 32,1%; p<0,01)-No dif. significativas en seroma, dehiscencia herida t recidiva herniaria |
| deVries et al. (2017) | R | PREVENA™ o VAC® (KCI)-100/5-10d | 32 | 34 | -ACS 91%-Retrorrectal 9% | -PPL retrorrectal-Strattice™ si fistula enterocutánea | -NPT reduce IHQ |
| Diaconu et al. (2018) | R | PREVENA™ (KCI)-125/5d | 62 | 42 | -Onlay 69%(ACS 50%)-Inlay 14%-Underlay 14% | -No malla-Biológica-Sintética (PPL) | -Reducción global de CSQ (47 vs. 69%; p=0,025)-No dif. significativas en IHQ, dehiscencia herida, necrosis, seroma, hematoma y recidiva herniaria |
| Hopkins et al. (2020) | R | PREVENA™ (KCI)-125/5-7d | 34 | 51 | -TAR 29%-ACS 14%-Retrorrectal 57% | -Progrip® extraperitoneal-BIO-A® intraperitoneal-Vicryl® intraperitoneal | -TPN reduce IHQ profunda-No dif. significativas en seroma o dehiscencia herida |
| Licari et al.(2020) | R | PREVENA™ (KCI)-125/7d | 70 | 110 | -IPOM 59,5%-Rives 40,5% | sintética | -TPN reduce índice global de CSQ, especialmente IHQ, estancia postoperatoria y costes totales |
| Bueno-Lledó et al.(2020) | RCT | PICO® (SN)-80/7d | 72 | 74 | -Rives 63%-ACS 18,7%-TAR 18,3% | Sintética (PPL o PVDF)BIO-A® (en TAR) | -TPN reduce índice global de CSQ e IHQ (0 vs. 8%;p<0,002)-No dif. significativas en dehiscencia herida, seroma, hematoma y estancia hospitalaria |
ACS: separación anterior componentes; CSQ: complicación sitio quirúrgico; dif.: diferencias; IHQ: infección herida quirúrgica; IPOM: intraperitoneal onlay mesh; J&J: Johnson and Johnson; PPL: polipropileno; PVDF: polyvinylidene difluoride; R: retrospectivo; RCT: ensayo clínico; SN: Smith and Nephew; TAR: tranversus abdominis release; TPN: terapia de presión negativa.
Conde-Green et al.34 estudiaron a 56 pacientes sometidos a SAC, en 23 de los cuales fueron aplicados profilácticamente apósitos de TPN incisional, y otros 33 recibieron apósitos convencionales. Sus resultados sugieren que la TNP incisional tras la reparación de pared abdominal compleja podría mejorar significativamente las tasas de CHQ y de dehiscencia de la piel, relacionados frecuentemente con este abordaje. Otros autores35–37 llegan a la misma conclusión, con una menor incidencia de IHQ a los 30 días y con un análisis costo-efectivo que justificaría su uso rutinario en poblaciones de alto riesgo. Mismos resultados demostraron Gassman et al.38 y Soareset al.39, especialmente en la tasa global de IHQ y en la tasa de recidiva herniaria, aunque observaron que tras un seguimiento de 90 días, las complicaciones más graves de la herida que requirieron reintervención, se produjeron después de 4 semanas de la reconstrucción. Estos hallazgos sugieren que la TPN incisional puede mejorar la incidencia de IHQ a corto plazo, pero no traducirse en mejores resultados a largo plazo.
Diaconu et al.40 sugirieron que el uso de la TPN incisional en la reparación de pared asociada a paniculectomía, disminuye las CHQ no infecciosas y su consecuente reintervención, en una población de pacientes con alto riesgo de las mismas. Por último, Olona et al.41, aplican el beneficio de la instilación al dispositivo de TPN incisional, previniendo las complicaciones postoperatorias locales, y obteniendo una estancia hospitalaria más corta.
Aunque la TPN profiláctica reduce la morbilidad de la herida en algunas poblaciones quirúrgicas, no parece ofrecer esta ventaja en la reconstrucción de pared en campos contaminados42. Un metaanálisis reciente43 demostró que la TPN incisional ahorra costes cuando se utiliza en pacientes de alto riesgo; el estudio concluye que en 829 pacientes sometidos a reconstrucción de pared compleja (260 con apósito de TPN y 569 con apósitos estándar), esta terapia supuso un ahorro de costes estimado de 1.542 dólares y podría ser una opción rentable, más cuando la tasa estimada de IHQ en esta población de riesgo puede ser superior al 16%.
Por último, Bueno-Lledó et al.44 aportan el único ensayo clínico al respecto, concluyendo que el uso del apósito profiláctico de TPN incisional tras reparaciones de SAC, transversus abdominis release (TAR) y Rives-Stoppa, redujo significativamente la incidencia global de CHQ y de IHQ a los 30 días del postoperatorio. Sin embargo, no se observaron diferencias significativas en cuanto a seroma, hematoma, dehiscencia de la herida o duración de la estancia hospitalaria entre los grupos.
En algunos casos, el manejo profiláctico de la TPN incisional podría ocasionar como beneficio añadido, una reducción teórica de la recidiva herniaria45; pero la mayoría de los estudios revisados concluyen que esta terapia no influye sustancialmente en la aparición o no de la misma. Así, algunos pacientes que experimentaron una IHQ y posterior ICM, requirieron la exéresis completa de la malla para su solución, lo que pudo motivar una mayor posibilidad de desarrollar una recurrencia de su hernia original45. Esta hipótesis requiere de estudios futuros para aclarar las diferencias a este respecto entre los grupos de pacientes con TPN incisional y aquellos con apósito convencional.
Como conclusiones finales, hay que destacar el papel de la TPN en el campo de la cirugía de pared abdominal. Como hemos visto, esta terapia constituye un apoyo en el cierre temporal de la cavidad abdominal tras complicaciones derivadas de la reparación herniaria, especialmente en casos de la necesidad del cierre de la herida quirúrgica por segunda intención, o en el manejo del abdomen abierto con tracción fascial. Finalmente, debemos subrayar el apoyo que esta terapia aporta al cirujano general en complicaciones tan relevantes como la ICM, con la posibilidad de intentar salvar la malla quirúrgica, y en la profilaxis de la CHQ tras una reparación de pared abdominal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.