La insuficiencia cardiaca aguda (ICA) es un síndrome geriátrico de alta prevalencia que origina uno de los motivos más frecuentes de visita a urgencias y de ingreso hospitalario, asociándose a una alta morbimortalidad e impacto funcional agudo. En los últimos años ha surgido cada vez más información sobre la importancia del manejo inicial de la ICA de cara a los resultados a corto plazo y su posible influencia en la historia natural de la enfermedad. El objetivo del presente trabajo es recoger una serie de recomendaciones prácticas que deberían considerarse a la hora de la atención inicial del paciente anciano con ICA en los servicios de urgencias hospitalarios y revisar las estrategias de intervención más interesantes que están en marcha en la actualidad.
Acute heart failure is a high prevalence geriatric syndrome that has become one of the most frequent causes of visits to emergency departments, as well as hospital admission, and is associated with high morbidity, mortality and functional impairment. There has been an increasing amount of information published in recent years on the initial management of acute heart failure and the results of the short-term outcomes, as well as the natural history of the disease. The objective of this study is to provide several recommendations that should be taken into account in the initial management of the elderly patient with acute heart failure in the emergency departments, and to review the most interesting currently on-going clinical trials.
La insuficiencia cardiaca aguda (ICA) se define como la aparición o modificación repentina de los síntomas o signos secundarios a una anormalidad cardiaca estructural o funcional que requiere de atención médica inmediata debido al potencial riesgo vital1. La ICA es uno de los motivos más frecuentes de atención urgente y la principal causa de ingreso hospitalario en la población anciana1-4. Se considera un síndrome geriátrico asociado a una alta morbimortalidad (reingreso a los 60-90días, 30%; mortalidad intrahospitalaria, 2-7%; mortalidad a los 60-90días, 5-14%, y mortalidad a los 4años, 50%) y a un importante impacto funcional agudo4-7.
En los últimos años ha surgido cada vez más información sobre la trascendencia de la correcta atención inicial de la ICA, ya que podría influir en el pronóstico a corto plazo y por tanto modificar la historia natural de la enfermedad. Por otro lado, se conoce bien que, dada la mayor probabilidad de presentación atípica de enfermedades, de comorbilidad y de polifarmacia en el paciente anciano, la atención urgente en dicho grupo etario se asocia a una evaluación clínica más compleja, mayor consumo de recursos y un riesgo incrementado de presentar eventos adversos en comparación con los adultos más jóvenes8,9. Teniendo todo lo anterior en cuenta, y a pesar de los escasos estudios sobre la atención inicial de la ICA que incluyen pacientes ancianos, el objetivo del presente trabajo es el recoger una serie de recomendaciones prácticas que deberían considerarse a la hora del manejo inmediato del paciente anciano con ICA en los servicios de urgencias hospitalarios (SUH).
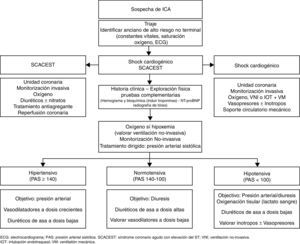
Primer mensaje: detectar de forma inmediata al anciano de alto riesgo vitalEn primer lugar, y coincidiendo con el primer contacto con el paciente, bien sea en el ámbito extrahospitalario u hospitalario, se debe realizar una primera valoración clínica de forma inmediata con el fin de identificar al paciente de alto riesgo vital que pueda requerir procedimientos invasivos urgentes (reperfusión coronaria, intubación orotraqueal y ventilación mecánica, fármacos vasoactivos, marcapasos o cardioversión cardiaca) y potencial traslado a una unidad coronaria. Para ello, es clave detectar si el paciente presenta síntomas o signos de fallo respiratorio inminente o hipoperfusión sistémica (frío-húmedo), elevación del segmento ST o una arritmia de riesgo vital en el electrocardiograma6. De forma paralela a este proceso, se deben aunar elementos clínicos, funcionales y neuropsiquiátricos, así como de la voluntad del paciente, que pudieran limitar el esfuerzo terapéutico.
La mayoría de los SUH poseen sistemas de triaje estructurado que permiten clasificar en diferentes niveles de gravedad —generalmente 5— y priorizar el orden de asistencia en el SUH10. La situación clínica de necesidad de valoración inmediata, anteriormente descrita, es poco frecuente (<1% de los casos atendidos en los SUH españoles) y suele ser clasificada por dichos sistemas de triaje como nivel1 (Sistema Español de Triaje) o Rojo (Sistema de Triaje de Manchester)6. El resto de los casos, la mayoría niveles2-4 (Naranja-Amarillo-Verde), son clasificados en diferentes niveles de gravedad y se les asigna un tiempo de espera estimado de atención en el SUH. En este sentido, hay que considerar que los ancianos tienden a ser clasificados con niveles de gravedad menores a los que les corresponden, especialmente en los niveles2-3 (Naranja-Amarillo), debido a la mayor frecuencia de quejas inespecíficas o dificultades en la comunicación, y por tanto existe mayor probabilidad de demorar la atención en dicho grupo de edad11. De hecho, algunos autores proponen realizar una triaje multidisciplinar, incorporando un médico al equipo del triaje, que permitiría estratificar a los ancianos con niveles de gravedad2-3 en función de la complejidad, asegurando así un tiempo de atención y una ubicación adecuada a la llegada del paciente a urgencias12.
Segundo mensaje: realizar el diagnóstico correcto de la insuficiencia cardiaca agudaEn segundo lugar, se debe asegurar el diagnóstico precoz certero de la ICA en los ancianos atendidos por disnea en los SUH, ya que el retraso o el error en el diagnóstico del síndrome en urgencias se ha asociado a una demora en la prescripción del tratamiento y peores resultados globales a corto plazo13,14. El diagnóstico de sospecha de ICA se basa en la presencia de síntomas y signos clínicos, electrocardiográficos y radiológicos compatibles. La sospecha de ICA no es fácil, ya que los síntomas y signos clínicos, del electrocardiograma y la radiografía de tórax tienen una limitada sensibilidad y certeza diagnóstica15. Esta complejidad es aún mayor según avanza la edad del paciente, ya que existe mayor probabilidad de detectar signos menos específicos (p.ej., edemas) y reproductibles (p.ej., presión venosa yugular elevada) y menor probabilidad de signos típicos (p.ej., disnea paroxística nocturna) y específicos (p.ej., tercer tono)16. Además, el envejecimiento se asocia a la presencia de ciertos cambios fisiológicos y comorbilidades que dificultan la anamnesis (p.ej., deterioro cognitivo), la interpretación clínica (p.ej., enfermedad pulmonar crónica) y favorecen la presencia de manifestaciones atípicas (p.ej., deterioro funcional, cuadro confusional, síncope o caídas de repetición)7.
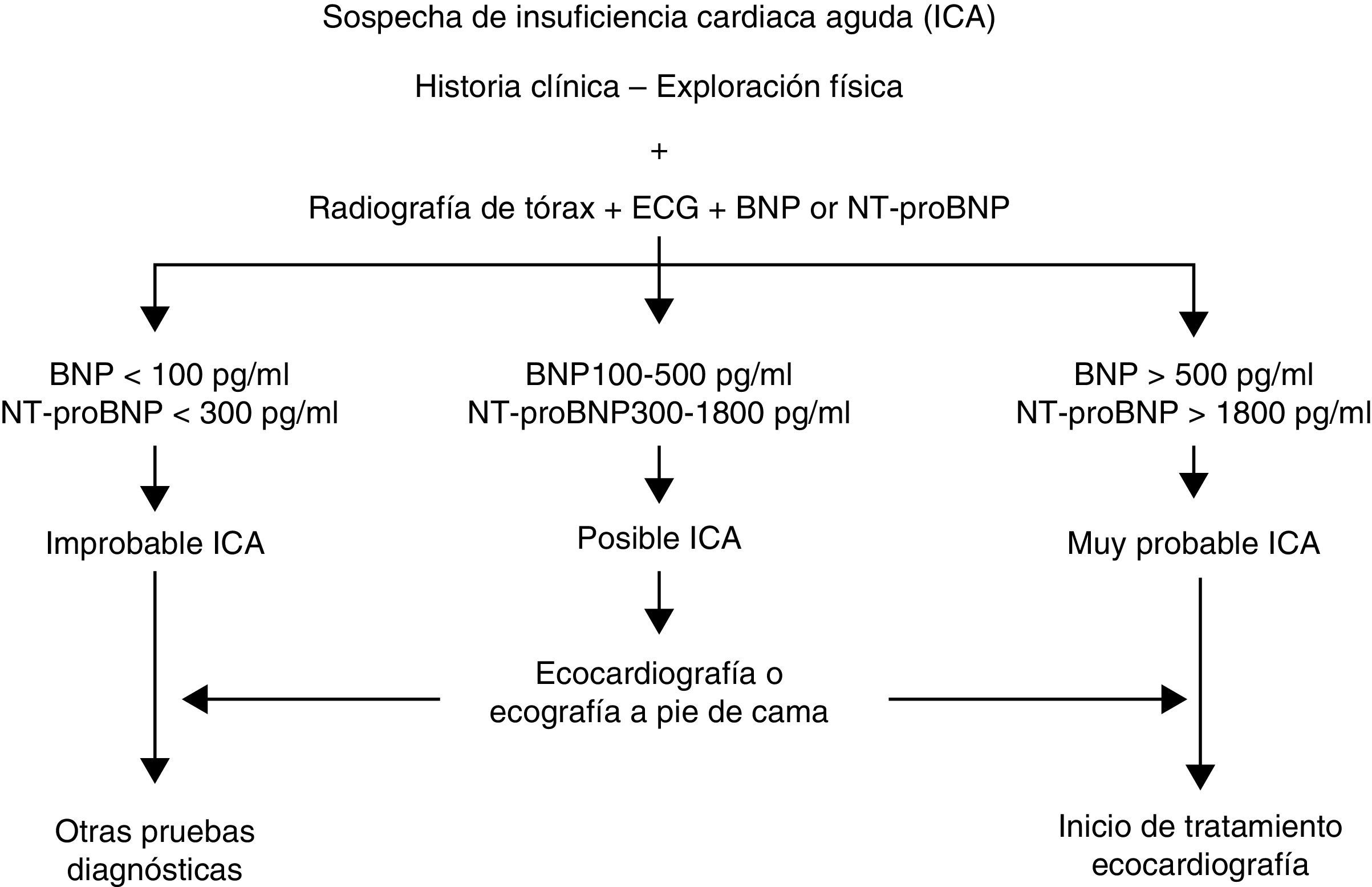
La introducción de los péptidos natriuréticos tipoB (BNP y NT-proBNP) y de la ecografía a pie de cama ha mejorado el rendimiento diagnóstico de la ICA, siendo en la actualidad herramientas de gran utilidad a la hora del diagnóstico precoz en los SUH16. Los péptidos natriuréticos tipoB son biomarcadores de estrés del miocito, que son liberados por el miocardio ventricular en respuesta al estrés de la pared y tienen una función cardioprotectora17. Dichos biomarcadores han demostrado utilidad a la hora de identificar la disnea originada por insuficiencia cardiaca y se correlacionan con la gravedad del episodio17. Por tanto, los péptidos natriuréticos tipoB se deberían solicitar siempre en aquellos pacientes ancianos atendidos por disnea en urgencias, y como mínimo en aquellos casos donde existan dudas sobre el origen cardiaco de la disnea6. En general, se considera que un BNP<100pg/ml y NT-proBNP<300pg/ml descarta casi con toda probabilidad el diagnóstico de ICA. Por el contrario, en relación con el diagnóstico, se han descrito diferentes puntos de corte de NT-proBNP en función del grupo de edad, estableciéndose el punto de corte en 1.800pg/ml para los pacientes de 75años o más18. Es importante considerar que se han reflejado otras circunstancias, como la función renal, el estado nutricional o ciertas condiciones agudas, como la fibrilación auricular, el tromboembolismo pulmonar, la sepsis, la anemia, la cardiopatía isquémica o las miocardiopatías, que pueden incrementar el valor de dichos péptidos19.
La ecografía a pie de cama, realizada por el médico responsable de la atención, permite mejorar la capacidad diagnóstica en el momento de la atención inicial y poder modificar actitudes terapéuticas basadas en la función del ventrículo izquierdo20. Esta técnica permite cuantificar las líneasB pulmonares o artefactos de reverberación verticales, que se correlacionan con el grado de edema pulmonar, el grado de colapso de la vena cava, la fracción de eyección del ventrículo izquierdo de manera cualitativa, el derrame pericárdico, la dilatación del ventrículo derecho, la regurgitación mitral aproximada, el grosor miocárdico y el tamaño de la aurícula izquierda21. Se ha publicado que se desconoce la función ventricular en más de la mitad de los pacientes atendidos por ICA en los SUH españoles, siendo casi dos tercios de estos pacientes geriátricos22. Algunos autores han propuesto introducirla en el algoritmo diagnóstico de la ICA, especialmente en aquellos casos donde los péptidos natriuréticos ofrecen incertidumbre diagnóstica y donde es complejo el diagnóstico diferencial con la patología pulmonar20,23,24. Dicha práctica no debe sustituir nunca la realización de una ecocardiografía reglada, que debería practicarse lo antes posible, y solo de forma urgente en casos de shock o inestabilidad hemodinámica, ya que nos ayuda a confirmar el diagnóstico de ICA, conocer la posible etiología cardiaca y valorar el grado de disfunción sistólica y/o diastólica del ventrículo izquierdo6 (fig. 1).
Tercer mensaje: identificar los factores precipitantes de la insuficiencia cardiaca agudaEn tercer lugar, una vez hecho el diagnóstico de ICA en urgencias («poner nombre»), es fundamental identificar el factor precipitante («poner apellidos»), ya que el pronóstico a corto plazo podría estar modificado por la tipología del mismo25. Las infecciones son la causa más frecuente de descompensación en la población de mayor edad, siendo además frecuente la coexistencia de varios desencadenantes asociados22,26. La identificación de los factores precipitantes del episodio de la ICA en urgencias es casi aún más complejo que el diagnóstico del propio síndrome. Los datos de los registros publicados procedentes de los SUH muestran que este solo se identifica en la mitad de las ocasiones25.
Los biomarcadores pueden ser de gran ayuda a la hora del diagnóstico de los precipitantes de la descompensación de la insuficiencia cardiaca. La troponina es un marcador de necrosis miocárdica y se reconoce como el biomarcador más sensible y específico del síndrome coronario agudo sin elevación del ST (valor predictivo negativo de infarto mayor del 95 al 99% en función de si la troponina es sensible o ultrasensible, respectivamente). La elevación ocurre en las primeras horas de los síntomas y se mantiene típicamente elevada durante varios días. Es importante saber que una discreta elevación aislada y mantenida de troponina en la fase aguda del episodio no debería asumirse como un infarto de miocardio27. La procalcitonina es un biomarcador de inflamación sistémica grave de origen bacteriano. Se puede detectar en el suero a las 2-3h tras un estímulo infeccioso con un pico máximo entre las 6-12h y una semivida de 24-30h. En condiciones fisiológicas, la calcitonina se expresa en las células neuroendocrinas que se encuentran principalmente en las célulasC del tiroides y en el pulmón. En individuos sanos, a excepción de los primeros días de vida, las concentraciones séricas de procalcitonina en suero son inferiores a 0,1ng/ml o incluso indetectables. Los resultados del estudio BACH mostraron que los pacientes atendidos por ICA cuyo valor de la procalcitonina fue >0,21ng/ml se asociaron a un mejor pronóstico a 90días si habían recibido antibiótico frente a los que no28.
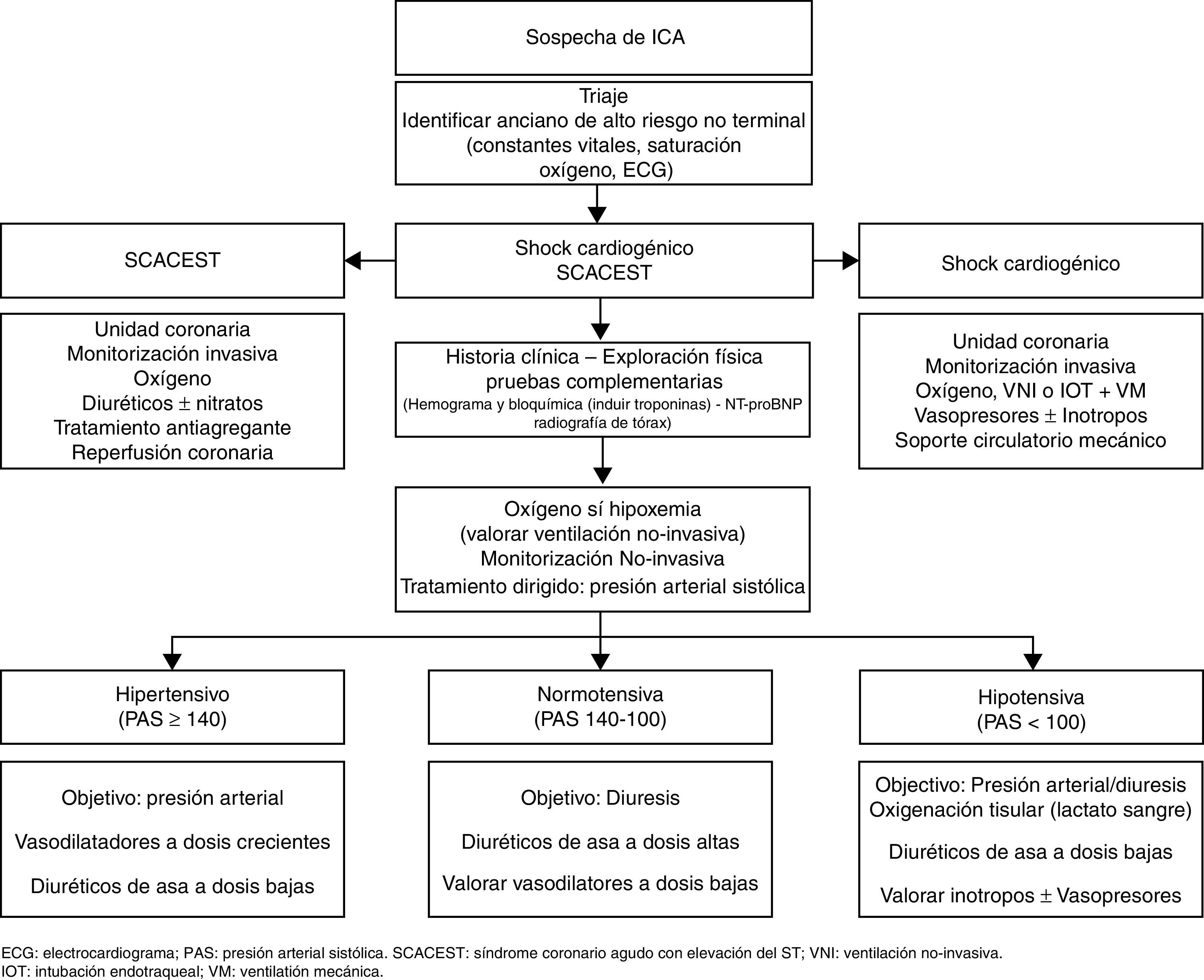
Cuarto mensaje: prescribir el tratamiento inicial dirigido por escenariosEn cuarto lugar, hay que prescribir el tratamiento inicial de la ICA dirigido por escenarios, ya que el correcto manejo inmediato condiciona los resultados clínicos durante la estancia hospitalaria13,29. Desde un punto de vista práctico, y exceptuando al paciente crítico —que, como ya se comentó con anterioridad, necesita soporte ventilatorio y/o hemodinámico o un tratamiento específico del factor precipitante, como es en el caso del síndrome coronario con elevación del ST o la arritmia que amenaza la vida—, se resume en tratar la hipoxemia con oxigenoterapia, valorar el tratamiento con ventilación mecánica no invasiva, administrar un bolo de diurético intravenoso y realizar un tratamiento por escenarios dirigido por las cifras de presión arterial sistólica a la llegada a urgencias6,29.
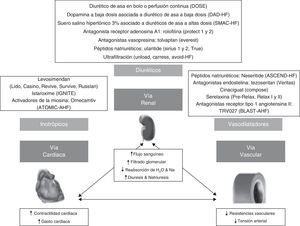
El tratamiento por escenarios surge para intentar realizar un tratamiento dirigido en función del mecanismo fisiopatológico fundamental, es decir, un fallo de bomba o una alteración de las resistencias vasculares sistémicas. Así, en aquellos pacientes con una alteración principal de las resistencias vasculares, y por tanto con necesidad de dosis altas de vasodilatadores, tendrán una presentación clínica brusca, con cifras de presión arterial sistólica elevadas, con alteración de la función diastólica y con síntomas predominantes de congestión pulmonar (escenario ICA hipertensiva o edema agudo de pulmón). Por el contrario, en los pacientes con fallo de bomba —y por tanto con necesidad de dosis altas de diuréticos— la presentación clínica será progresiva, con cifras de presión arterial en rango de la normalidad, con disfunción sistólica y con síntomas predominantes de congestión sistémica (escenario ICA normotensiva)6,7,29. La ICA hipotensiva puede ser indicativa de un fracaso de bomba (shock cardiogénico) y se asocia a una importante morbimortalidad intrahospitalaria. En este escenario es fundamental descartar la etiología isquémica y ver si existen signos de hipoperfusión sistémica. La hiperlactacidemia (niveles de lactato en sangre >2mmol/l) puede ser de gran utilidad para estratificar el riesgo en dicha situación clínica30. Los pacientes con shock cardiogénico pueden beneficiarse de una monitorización invasiva, un tratamiento farmacológico con inotrópicos y vasopresores, soporte circulatorio mecánico e incluso una revascularización precoz en caso de infarto agudo de miocardio asociado6,31,32 (fig. 2). La ICA exclusiva del ventrículo derecho es una entidad nosológica propia que requiere una monitorización estrecha y un tratamiento dirigido a la etiología. En la fase aguda, se debe asegurar la precarga, optimizando la relación administración de volumen frente a diuréticos y evitando fármacos vasodilatadores, así como disminuir la poscarga e incrementar la contractilidad del ventrículo derecho administrando fármacos inodilatadores e inotrópicos cuando sea necesario.
Quinto mensaje: tratar la hipoxemiaEn quinto lugar, hay que tratar la hipoxemia con oxigenoterapia con el objetivo de mantener una saturación de oxígeno alrededor del 95%, pudiendo ser algo menor en caso de enfermedad pulmonar obstructiva crónica concomitante. Las situaciones de hiperoxia disminuyen el flujo coronario y aumentan las resistencias vasculares.
La ventilación no invasiva ha demostrado mejorar de forma precoz parámetros clínicos y gasométricos y la necesidad de intubación sin haber aumentado las complicaciones en los pacientes con edema agudo de pulmón independientemente de la edad, así como reducir la mortalidad en dicho escenario clínico33-37. Desde un punto de vista práctico, se recomienda valorar de forma inicial la ventilación mecánica no invasiva en los pacientes con dificultad respiratoria secundaria a edema agudo de pulmón. Por su fácil manejo, se prefiere iniciar la oxigenación con la modalidad de presión positiva continua en la vía aérea (CPAP), y la modalidad ventilación con presión positiva intermitente (NIPPV) estaría indicada cuando se asocia hipercapnia, disnea grave o fallo de la CPAP. Como regla general, la necesidad de intubación y ventilación mecánica contraindica la ventilación mecánica no invasiva, aunque en ciertos pacientes ancianos en los que existe una verdadera duda en el momento sobre el criterio de medidas agresivas, puede ser una buena alternativa de tratamiento no farmacológico inicial6.
Sexto mensaje: optimizar la relación entre diuréticos y agentes vasodilatadoresLa relación entre diuréticos y vasodilatadores, como se comentó con anterioridad, está condicionada por el factor precipitante y el mecanismo fisiopatológico principal cardiogénico o vascular7. Para ello, nos podemos ayudar de las cifras de presión arterial sistólica, la función ventricular previa y los síntomas congestivos pulmonares y sistémicos. En este sentido, en caso de existir una alteración inicial, fundamentalmente de las resistencias vasculares, donde destaque la congestión pulmonar, será prioritario el uso de dosis altas de vasodilatadores, y en caso de prescribir diuréticos de asa intravenosos, se realizará por lo general a dosis bajas y en función del estado de congestión. Por otro lado, si fuera un fallo de bomba, donde predomine la congestión sistémica, será fundamental el uso de diuréticos de asa intravenosos, cuya dosificación dependerá del grado de resistencia a diuréticos, y en caso de prescribir vasodilatadores, se hará por lo general a dosis bajas y en función de la cifras de presión arterial sistólica6.
Los diuréticos de asa por vía intravenosa han mostrado mejorar la disnea y los síntomas de congestión. Las guías clínicas actuales recomiendan el uso de diuréticos de asa por vía intravenosa lo más precozmente posible hasta la mejoría de los síntomas38. No existen claras evidencias sobre la dosis óptima (dosis alta frente dosis baja) ni el régimen de administración del tratamiento (bolo frente a perfusión). Un estudio sobre la eficacia y la seguridad de los diuréticos de asa, en función de la dosis y la forma de administración, mostró que dosis altas se asocian con una mayor mejoría de los síntomas y los signos, pero con un riesgo incrementado de empeoramiento transitorio de la función renal39. Se sabe que los diuréticos de asa a dosis altas (2,5 veces la dosis oral previa) deben contemplarse en pacientes con tratamiento crónico con diuréticos, y que la necesidad de la administración de dosis muy altas (>160mg/día de furosemida o equivalente) se asocia a peores resultados a corto plazo39-41. Por otro lado, existen cada vez más datos que apuntan a la mayor eficacia y seguridad de los diuréticos de asa en perfusión en comparación con la administración en bolo, siendo más recomendable la administración de estos últimos, en términos de eficacia, para aquellos pacientes con diuréticos de asa a dosis altas de forma ambulatoria (>120mg/día de furosemida o equivalente)42-44. Todo esto, teniendo en cuenta que los diuréticos a altas dosis son la principal causa de empeoramiento de la función renal durante la hospitalización, debe ser considerado a la hora de prevenir el desarrollo de un síndrome cardiorrenal, sobre todo en un segmento de población como el anciano con un riesgo incrementado del mismo, al ser más frecuente la presencia de comorbilidad y deterioro progresivo de la función renal45.
La nitroglicerina intravenosa ha demostrado propiedades hemodinámicas positivas, reducir la tasa de procedimientos y disminuir las necesidades de furosemida, lo cual reduciría la probabilidad de efectos secundarios relacionados con los diuréticos, especialmente en un grupo tan vulnerable como los ancianos46,47. De forma general, el tratamiento vasodilatador con la nitroglicerina es principalmente útil en el escenario de ICA hipertensiva y edema agudo de pulmón, es decir, donde existe una alteración de las resistencias vasculares48. Se recomienda iniciar a partir de cifras de 110mmHg de presión arterial sistólica, y se va titulando la dosis en función del grado de hipertensión arterial sistólica. Está contraindicada en caso de estenosis aórtica e insuficiencia mitral significativa, por lo que debe tenerse cuidado a la hora de su prescripción, dada la prevalencia de enfermedad valvular en los ancianos6,31.
Séptimo mensaje: prescribir el tratamiento farmacológico tras la estabilización clínicaEn séptimo lugar, y tras conseguir la estabilización clínica, hay que prescribir el tratamiento recomendado por las guías clínicas basado en la evidencia. En este punto, es necesario hacer una reflexión sobre la falta de evidencia de los tratamientos de la ICA en los ancianos, ya que en los ensayos clínicos existe poca representación de pacientes muy ancianos y/o con alto grado de comorbilidad, y la infrautilización de los tratamientos que han demostrado disminuir la mortalidad en función de la edad7,49. Todo ello debe ser tenido en cuenta a la hora de la prescripción del tratamiento, pero en ningún momento debe servir de justificación para recibir un trato distinto y de peor calidad que los pacientes más jóvenes50.
En referencia al tratamiento recomendado a los pacientes con insuficiencia cardiaca con disfunción sistólica, se debería empezar un tratamiento con un inhibidor de la enzima convertidora de angiotensina (IECA) o un antagonista del receptor de la aldosterona (ARA) y un bloqueador del receptor beta1-adrenérgico (BB) lo antes posible tras el diagnóstico, siempre que lo permitan la función renal, los niveles de potasio, la presión arterial y la frecuencia cardiaca6,31. La retirada del tratamiento crónico con IECA (o ARA) o BB durante la fase aguda no está siempre justificada y puede conllevar implicaciones en el pronóstico a largo plazo51. Se ha documentado que casi el 70% de los pacientes que recibían BB de forma crónica se les suspendió en la fase aguda del episodio a pesar de las evidencias y las recomendaciones actuales de poder ser continuados en los pacientes con estabilidad hemodinámica sin efectos secundarios o contraindicaciones relacionadas con los mismos6,52,53.
Octavo mensaje: manejar la comorbilidadEn octavo lugar, hay que manejar la comorbilidad asociada, tratando las posibles descompensaciones y conciliando el tratamiento crónico de las patologías asociadas, ya que puede tener implicaciones en el curso evolutivo de la insuficiencia cardiaca.
La hiperglucemia al ingreso de la ICA parece que podría asociarse a un peor pronóstico a 30días indistintamente de conocer o no el antecedente previo de diabetes mellitus54. En este sentido, y en espera de resultados concluyentes procedentes de ensayos clínicos, se deberían adoptar las recomendaciones del manejo de la hiperglucemia en el paciente hospitalizado. De forma resumida se indica control de la glucemia, suspender los antidiabéticos orales y un régimen de insulinización para mantener cifras de glucemia de 140-180mg/dl.
La fibrilación auricular es una arritmia frecuente durante la atención del episodio agudo, y su presencia dificulta la interpretación de los biomarcadores diagnósticos (BNP y NT-proBNP) de la ICA7,55. En lo que respecta al manejo agudo —exceptuando los pocos casos donde la fibrilación auricular se inicia de manera súbita desencadenando la ICA—, se recomienda tratar la hipoxemia, la sobrecarga de volumen y valorar la profilaxis de tromboembolia arterial. Como mensaje general, no apresurarse en instaurar un tratamiento específico para control de la frecuencia ventricular, ya que en la mayoría de los casos se trata de una respuesta adaptativa y mejorará con el tratamiento específico de la ICA. En caso de necesidad de control de la frecuencia ventricular (objetivo en fases iniciales de la frecuencia ventricular en reposo <110-120lpm), valorar el uso de digoxina, BB cardioselectivos a dosis bajas, diltiazem en caso de función ventricular conservada y amiodarona6,56,57.
La presencia de EPOC se ha relacionado con un menor uso de la medicación que mejora el pronóstico de la insuficiencia cardiaca, y muy especialmente de los BB58. En la actualidad, las guías clínicas afirman claramente que su presencia no es una contraindicación absoluta para su prescripción31. En fase aguda, y basándonos en estudios observacionales, se podría hacer uso de los BB cardioselectivos a dosis bajas, disminuyendo la dosis transitoriamente cuando sea necesario, y utilizar preferentemente agentes anticolinérgicos como tratamiento broncodilatador cuando sea necesario, ya que algunos estudios han mostrado un incremento de la mortalidad intrahospitalaria con el uso de agonistas de los receptores beta2-adrenérgicos debido a su efecto cronotrópico e inotrópico positivo e incremento del gasto cardiaco31,58,59.
La anemia también es común en los ancianos con ICA, pero no disponemos de suficiente evidencia sobre el papel pronóstico a corto plazo ni recomendaciones específicas de manejo, por lo que se aconseja seguir las directrices generales sobre transfundir lentamente componentes sanguíneos en caso de valor de Hb<9g/dl6,7.
Respecto a la conciliación del tratamiento crónico, se recomienda conciliar los IECA (o ARA) y BB, nitratos, antagonistas del calcio, antiarrítmicos, broncodilatadores y antidiabéticos orales e insulinas en las primeras 4h desde la llegada a urgencias60. Se deben evitar los calcioantagonistas no dihidropiridínicos, antiarrítmicos de la clasei y iii, antiinflamatorios no esteroideos e inhibidores de las Cox-2 y ciertos antidiabéticos orales6,31. Además, se debería apuntar que los ancianos son especialmente susceptibles a las reacciones adversas a medicamentos debido a una mayor probabilidad de polifarmacia y la existencia de otros condicionantes, tales como las modificaciones farmacocinéticas y farmacodinámicas debidas al envejecimiento, las enfermedades asociadas, la automedicación y, a veces, los complejos regímenes terapéuticos. Entre los fármacos más frecuentemente descritos están los antitrombóticos, los antidiabéticos, los diuréticos, los BB, los antagonistas del calcio y los fármacos con estrecho rango terapéutico, como la digoxina61-63.
Noveno mensaje: tomar la decisión de ingresoEn noveno lugar, la toma de decisión de ingreso y del nivel asistencial más adecuado debería ser individualizada y basarse en el juicio clínico teniendo en cuenta las necesidades médicas, funcionales, cognitivas y sociales específicas de cada paciente. Las recomendaciones actuales de las guías clínicas se basan en aspectos empíricos. Se conoce que según avanza la edad de los pacientes con ICA aumenta el grado de comorbilidad y de marcadores fragilidad, como la demencia, la incontinencia, el déficit sensorial y la dependencia funcional basal grave, sobre todo en la población de 85años o más7. Por tanto, en la población anciana, además de otros factores de mal pronóstico descritos en la población adulta, hay que tener en consideración el grado de comorbilidad y de dependencia funcional basal (índice de Barthel<60)64-67. En lo que respecta a los biomarcadores, los niveles de troponina y péptidos natriuréticos tipoB (NT-proBNP) también se asocian con la mortalidad a 30días68,69.
Se han descrito numerosas escalas de estratificación del riesgo a corto plazo que nos pueden ser de ayuda en dicho toma de decisiones70-77. Respecto a la validez externa, y por tanto a la aplicabilidad de dichas escalas, es fundamental considerar el lugar de procedencia de la cohorte incluida, así como la definición de la variable resultado. La escala Heart Failure Risk Scoring System procedente del estudio EFFECT ha sido uno de los modelos más difundidos y aplicables a la población anciana hospitalizada, ya que incluye datos del episodio agudo, pero también de la edad y de la comorbilidad, prediciendo la mortalidad a los 30días71. Además, mostró que podría ser aplicable en los pacientes ancianos atendidos por ICA en SUH españoles, y que su capacidad predictiva mejoraría al incluir la dependencia funcional basal severa cuantificada mediante un índice de Barthel menor de 6078. Se ha publicado recientemente la Emergency Heart Failure Mortality Risk Grade (EHMRG), procedente de un registro de 12.591 pacientes atendidos en 86SUH canadienses, que da la posibilidad de incluir biomarcadores como la troponina y los péptidos natriuréticos tipoB, y predice el riesgo de muerte a los 7días desde la atención en urgencias76. Los mismos autores aportan una aproximación a la práctica clínica, en función de la categoría de la EHMRG, recomendando ingresar al paciente con riesgo alto y dar de alta al de riesgo bajo. En aquellos de riesgo intermedio o con dudas en el riesgo bajo, se indica ingresar en unidades alternativas vinculadas a los SUH79 y reevaluar la necesidad de ingreso en función de la respuesta al tratamiento, la evolución de los biomarcadores de congestión y daño miocárdico y la posibilidad de seguimiento precoz ambulatorio, especialmente en el anciano frágil80,81.
Décimo mensaje: indicar las recomendaciones al alta de urgenciasEn décimo y último lugar, una vez tomada la decisión de alta a domicilio directamente desde urgencias, deben indicarse las recomendaciones al alta, así como comprobar que se han cumplido los estándares mínimos de calidad durante la atención urgente. A la hora de valorar el alta al domicilio, el paciente debe haber mejorado tanto de los síntomas y signos como de los biomarcadores de congestión, y alcanzado ciertos objetivos, como la identificación y el tratamiento de las razones de la descompensación, el cumplimiento de la transición de los diuréticos de vía intravenosa a vía oral, el establecimiento de un plan de tratamiento farmacológico y no farmacológico modificador de la enfermedad, la programación de una estrategia de recuperación funcional si fuera necesario, la educación del paciente y la familia, y la programación de la visita de seguimiento a los 7-10días con el fin de mejorar el pronóstico a largo plazo y la readmisión precoz6,74,82. Las principales variables descritas relacionadas con el éxito del tratamiento tras el alta son el cumplimiento de las recomendaciones del tratamiento modificador de la enfermedad, la adherencia al tratamiento, las restricciones dietéticas, la realización de ejercicio y el seguimiento ambulatorio83,84. Desde un punto de vista de calidad asistencial, debería figurar en el informe al alta de urgencias las cifras de presión arterial y de frecuencia cardiaca en reposo, la valoración de los síntomas y la actividad, el impacto cognitivo y/o funcional, la función del ventrículo izquierdo, el valor del péptido natriurético tipoB al alta, la prescripción de un IECA (o ARA) y un BB en caso de ICA con disfunción sistólica y el plan de continuidad de cuidados al alta, así como la evaluación del grado de adherencia terapéutica, la educación del paciente y el haber descartado la necesidad de un dispositivo6.
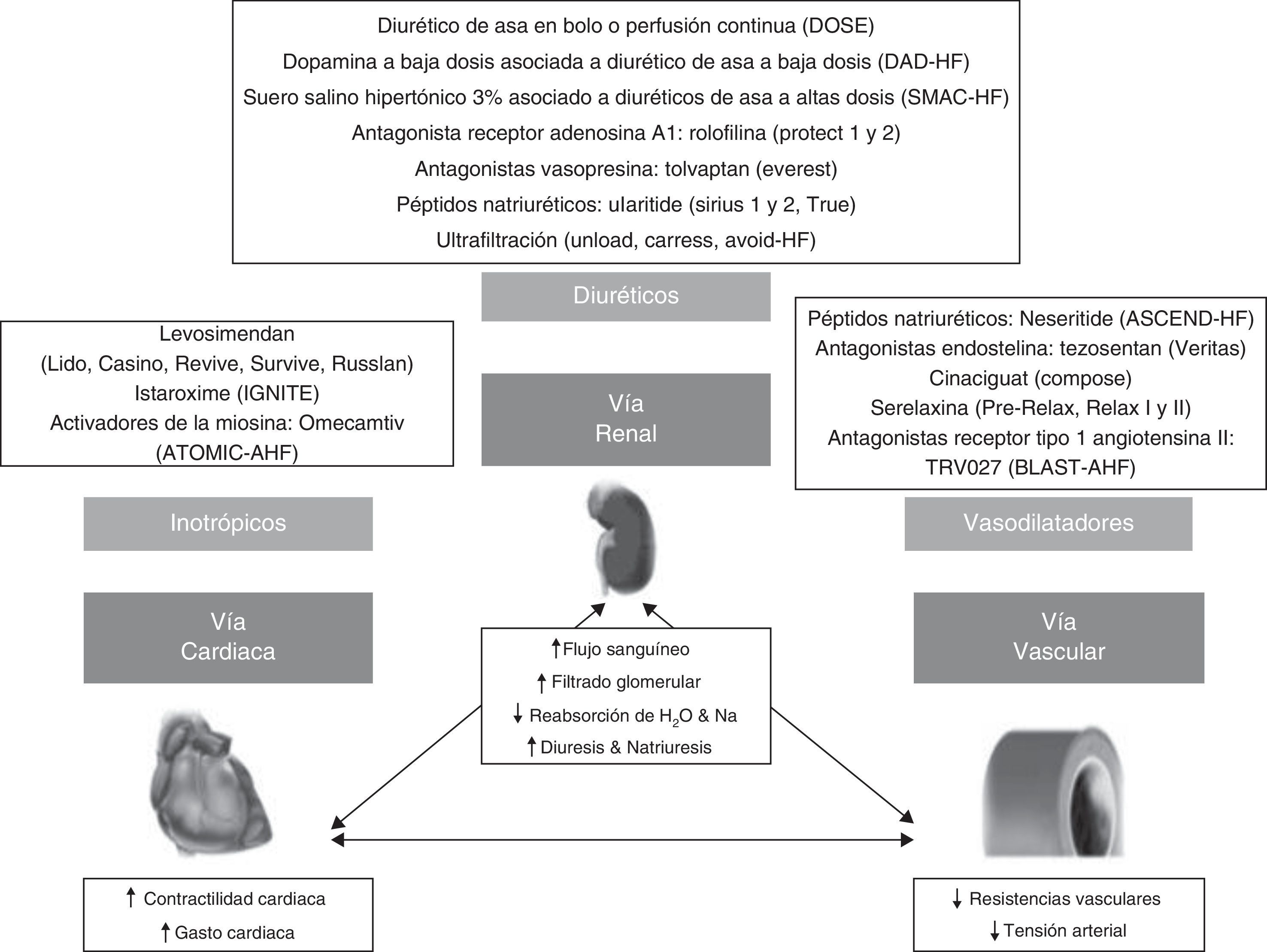
Perspectivas de futuroLa ICA, a diferencia de la insuficiencia cardiaca crónica, continúa siendo un síndrome con un pronóstico a corto plazo inaceptable, siendo por tanto necesario el desarrollo de nuevas estrategias85. Hasta la fecha se han llevado a cabo numerosos ensayos clínicos de nuevos tratamientos en fase aguda con resultados desalentadores86-92 (fig. 3). Esto se ha puesto en relación con el diseño de los estudios, al valorar la ICA como un síndrome homogéneo sin considerar los diferentes escenarios basados en aspectos fisiopatológicos u otras variables no estimadas que puedan influir en el pronóstico (p.ej., el factor precipitante, el tiempo de administración del tratamiento, el empeoramiento de la insuficiencia cardiaca, los biomarcadores, la impedanciometría, la comorbilidad, la fragilidad, etc.) ni definir variables de eficacia de mayor relevancia que la disnea, como pueden ser la morbimortalidad, el consumo de recursos hospitalarios u otros aspectos funcionales y de calidad de vida7,64,93,94.
En la actualidad se están desarrollando prometedores ensayos clínicos en la ICA que intentan subsanar algunas de las principales limitaciones presentadas en estudios previos. Dichos ensayos clínicos incluyen pacientes geriátricos normo o hipertensivos (excluyen el edema agudo de pulmón hipertensivo) atendidos en urgencias sea cual sea su función cardiaca, excluyendo una gran variedad de factores precipitantes y comorbilidades. Desde el punto de vista de intervención, se considera clave el momento de inicio del tratamiento, ocurriendo en las primeras horas desde la llegada a urgencias. Los criterios de eficacia principal incluyen la mortalidad y definen otros objetivos exploratorios, como el análisis de biomarcadores o el consumo de recursos hospitalarios. Además, se recogen otros aspectos que pueden influir en el curso evolutivo, como el empeoramiento de la insuficiencia cardiaca o el grado de disfunción del ventrículo izquierdo.
La serelaxina en una molécula recombinante de la relaxina-2 humana, hormona presente durante la gestación, que incrementa la vasodilatación arterial, el gasto cardiaco y el filtrado glomerular, reduce la inflamación, los fenómenos de lesión y fibrosis tisular, y estimula la angiogénesis favoreciendo la reparación tisular95. El ensayo clínico faseiii RELAX-AHF comparó serelaxina (30μg/kg al día) en perfusión continua durante 48h iniciado en las primeras 16h desde la llegada al hospital frente a placebo añadido al tratamiento estándar en 1.161 pacientes atendidos por ICA con normo o hipertensos (PAS>125mmHg) e insuficiencia renal leve-moderada (MDRD 30-75ml/min/1,73m2), independientemente de la función ventricular. Se demostró que la serelaxina produce una mejoría de la percepción de la disnea y del estado general, disminuyendo el empeoramiento de la insuficiencia cardiaca, el tiempo de hospitalización y —lo más importante— la mortalidad global y de origen cardiovascular a los 180días96. También se ha demostrado, en el grupo de serelaxina, que existe una mejoría más rápida de los marcadores de congestión y de daño de órgano a nivel cardiaco, renal y hepático97. Los efectos secundarios fueron poco comunes, siendo el más frecuente la hipotensión arterial. En relación con el paciente geriátrico, los resultados son muy prometedores, ya que se ha visto que el tratamiento con serelaxina podría ser más beneficioso en términos de mortalidad en ciertos subgrupos de pacientes, especialmente en mujeres de 75años o más con fibrilación auricular, con insuficiencia renal moderada, función del ventrículo izquierdo conservada y elevación de biomarcadores de daño miocárdico98. En la actualidad está en marcha el estudio RELAX-II, que incluye 6.375 pacientes con ICA descompensada y donde existe la posibilidad de iniciar el tratamiento en las 16 primeras horas tras la valoración inicial por un médico de urgencias, para confirmar los datos expuestos, y cuya variable de eficacia principal es reducir la muerte cardiovascular en pacientes con ICA en los primeros 180días.
El ularitide es una forma sintética de la urodilatina, péptido natriurético de origen renal que fisiológicamente favorece la natriuresis y la vasodilatación venosa y arterial. El estudio SIRIUSII, con 221 pacientes, demostró que el ularitide añadido al tratamiento estándar tiene efectos hemodinámicos, clínicos y neurohormonales favorables, sin producir un empeoramiento la función renal en las primeras 72h, y redujo la mortalidad a los 30días y la estancia hospitalaria86. En la actualidad el estudio TRUE, en fase de selección, evalúa el efecto de la perfusión continua de ularitide (15ng/kg/min) durante 48h frente placebo en pacientes de 18 a 85años con ICA descompensada donde existe la posibilidad de iniciar el tratamiento en las 12 primeras horas tras la valoración inicial por un médico de urgencias y cuya medida de eficacia es la variable compuesta clínica hasta el alta y resultados adversos a 180días.
En relación con la estratificación del riesgo, los modelos actuales tienen una capacidad moderada de predecir el riesgo de episodios adversos a corto plazo99. Es necesario desarrollar nuevos modelos que incluyan el universo de pacientes geriátricos atendidos en los SUH y que incluyan otros aspectos, como la respuesta al tratamiento inicial mediante biomarcadores seriados (biomonitorización) o dispositivos (bioimpedanciometría), nuevos biomarcadores (ST2, MR-proADM, copeptina, proteínaC reactiva) y variables funcionales, cognitivas y sociales (fragilidad), y que sean más efectivos a la hora de la toma de decisión de alta-ingreso y la elección del nivel asistencial más adecuado7,94,100. Además, se deben aportar cuáles son los mejores modelos de atención para los ancianos dados de alta directamente desde urgencias con el fin de evitar resultados adversos de forma precoz. En este sentido, se están desarrollando varios ensayos clínicos, como el Early Care After Discharge of HF Patients (ECAD-HF), que compara la atención habitual con la consulta precoz y monitorización de biomarcadores durante las primeras 4semanas tras el alta; el REducing 30-day ADMIssions in posT-discharge Subjects (READMIT) (READMIT-HF), que intenta demostrar la eficacia de la monitorización con un dispositivo de impedanciometría (AVIVO™ PiiXPatch Monitor System) a los 30días tras el alta, o el Trial of Rehabilitation Therapy in Older Acute Heart Failure Patients (REHAB-HF), que estudia la intervención de rehabilitación durante las 12 primeras semanas tras el alta del hospital.
ConclusiónEn definitiva, y en espera de los resultados de nuevos ensayos clínicos actualmente en marcha de prometedoras intervenciones de fase aguda en la ICA que incluyen población anciana, tenemos en nuestras manos sencillas estrategias que podemos llevar a cabo y que mejorarían la calidad asistencial y posiblemente los resultados a corto plazo de los ancianos atendidos por un episodio de ICA en los SUH.
FinanciaciónDr. Pere Llorens y Dr. F. Javier Martín Sánchez han recibido becas PI11/01021 y PI10/01918 del Instituto de Salud Carlos III procedentes de fondos del Ministerio de Sanidad, Servicios Sociales e Igualdad (MSSSI) y Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesDr. Pere Llorens y Dr. F. Javier Martín Sánchez han recibido ayudas para la investigación de Novartis, Abbott, Otsuka, Cardiorentis y Orion Pharma. El resto de los autores declaran no tener ningún conflicto de intereses.